Introduzione:
La LUF Syndrome (Luteinized Unrupted Follicle Syndrome) o cisti teco-luteinica é una patologia clinica nella quale la rottura della paretedel follicolo preovulatorio ed il rilascio dell’ovocita (ovulazione) non avvengono ma le cellule della granulosa subiscono un normale processo di luteinizzazione (1,11). La LUF-S rientra tra le patologie dell’ovulazione evidenziate dalle tecniche di fecondazione in vitro, con relativa iperstimolazione ovarica (COH) (tab. 1).
Fisiologia dello scoppio follicolare: Diverse ipotesi sono state formulate per spiegare il meccanismo di rottura del follicolo di Graaf; attualmente sono tre le ipotesi più accreditate (tab.2):
- Una prima ipotesi affermava che la rottura del follicolo era dovuta ad aumento della pressione
 colloidosmotica intrafollicolare; in un primo momento si pensò che ciò fosse conseguenza dell’incrementata attività secretoria delle cellule della granulosa oppure conseguenza della depolimerizzazione dei mucopolisaccaridi ad opera della jaluronidasi oppure conseguenza di entrambi questi meccanismi. Ma ulteriori osservazioni esclusero che tali meccanismi si verificassero nel periodo preovulatorio. Fu quindi ipotizzato che le cellule muscolari lisce permettessero lo scoppio del follicolo contraendosi. Infatti i farmaci tocolitici (anestetici locali, calcio antagonisti, inibitori della ciclossigenasi) inibiscono anche lo scoppio del follicolo (10).
colloidosmotica intrafollicolare; in un primo momento si pensò che ciò fosse conseguenza dell’incrementata attività secretoria delle cellule della granulosa oppure conseguenza della depolimerizzazione dei mucopolisaccaridi ad opera della jaluronidasi oppure conseguenza di entrambi questi meccanismi. Ma ulteriori osservazioni esclusero che tali meccanismi si verificassero nel periodo preovulatorio. Fu quindi ipotizzato che le cellule muscolari lisce permettessero lo scoppio del follicolo contraendosi. Infatti i farmaci tocolitici (anestetici locali, calcio antagonisti, inibitori della ciclossigenasi) inibiscono anche lo scoppio del follicolo (10). - Una seconda ipotesi chiama in gioco gli enzimi proteolitici ed in particolare l’attivatore del plasminogeno capace di trasformare il plasminogeno in plasmina, enzima fibrinolitico capace di dissolvere i coaguli di fibrina ma dotato anche di analoghi effetti sulle altre proteine plasmatiche consimili e di indebolire la parete del follicolo in vitro. Alti dosaggi di attivatore del plasminogeno sono presenti in cellule della granulosa prelevate in periodo immediatamente preovulatorio. La produzione dell’attivatore del plasminogeno é stimolata da LH e FSH. I sostenitori di tale teoria portano a loro sostegno il fatto che l’indometacina inibisce l’ovulazione inibendo l’attivatore del plasminogeno (9). Da esperimenti condotti sul coniglio si é avuta la conferma che l’ovulazione può essere inibita dall’indometacina che é un inibitore della PG sintetasi mentre può essere indotta da PGE2α. Le prostaglandine (PG), tranne la PGF2 –α, stimolano la produzione di attivatore del plasminogeno da parte delle cellule della granulosa.
Frequenza: L’incidenza della LUF-s riportata dai vari Autori é estremamente variabile: dal 9% al 55% e ciò é dovuto molto probabilmente alle difficoltà di diagnosi differenziale soprattutto con il corpo luteo cistico. Le cisti teco-luteiniche si possono riscontare sia nelle donne sterili che nelle donne fertili (4,5) sono molto più frequenti (35%) nelle pazienti con endometriosi (25).
LUF-s e variazioni ormonali: le pazienti LUF presentano una crescita follicolare normale ma un surge dell’LH inferiore alla norma. Il quadro ormonale plasmatico della fase luteale risulta simile ai cicli normali ovulatori ma le concentrazioni sieriche di progesterone sono decisamente inferiori alla norma come pure il picco middle-luteale (2). La percentuale di follicoli normalmente scoppiati è significativamente correlata con la concentrazione sierica del progesterone middle-luteale: (46.97 ± 8.95 nmol/1 versus 108.74 ± 12.27 nmol/1; P = 0.02) (15). Le concentrazioni di FSH hanno un decremento più lento rispetto ai cicli normali: 4-5 giorni invece di 1-2 giorni. Probabilmente questa variazione è dovuta alla mancata azione dell’inibina in conseguenza della mancata deiscenza ovarica. La durata della fase luteale è nei limiti della norma (14). La temperatura basale é di tipo bifasico (3); La citologia vaginale ed il quadro istologico dell’endometrio sono di tipo secretivo.
Il pregnancy rate delle pazienti con cicli LUF senza altre patologie associate é simile a quello di donne fertili.
DIAGNOSI
Per la diagnosi di LUF-S ci si avvale della esplorazione delle ovaie per via laparascopica, del dosaggio del 17-beta- estradiolo (E2) e del progesterone (P) nel Fluido Peritoneale (FP) e del monitoraggio follicolare ecografico (MF) della crescita follicolare ( tab. 3).
1. ECOGRAFIA
Attualmente é la metodica più affidabile purché effettuata da un esperto operatore e con apparecchio adeguato. Inoltre l’ecografia ha un alto rapporto beneficio/costo ed ha una buona compliance della paziente. Per il monitoraggio follicolare (MF) attualmente usiamo una scansione addominale al 2°-4° giorno del ciclo per una valutazione complessiva della pelvi e delle ovaie a riposo funzionale e quindi scansioni transvaginali con sonda da 6,5 MHz iniziando dall’8° giorno a giorni alterni dapprima e successivamente tutti i giorni nel periodo immediatamente pre-ovulatorio. Il MF continua fino all’osservazione dell’avvenuto scoppio del follicolo o fino a quando compaiono almeno due dei segni indicatori della luteinizzazione follicolare (tab. 4). I segni ecografici dell’ avvenuta ovulazione (tab. 5) più noti sono la brusca diminuzione del diametro follicolare, la perdita della regolarità dei margini follicolari e la comparsa di una falda transonica non saccata nello scavo del Douglas (6,7). Accurati studi random su pazienti sottoposte a COH con HMG + HCG hanno riportato percentuali di ovulazione del 69% dei cicli, non determinati nel 24% e non scoppio nel in 7% in controlli USG effettuati 2-3 giorni dopo l’iniezione di HCG o il surge dell’LH (16).
Durante la fase follicolare non ci sono differenze sostanziali nella velocità di crescita fra follicoli LUF e quelli normali; Essa raggiunge i 2.3 mm al giorno nei tre giorni precedenti l’ovulazione ma dopo il picco dell’LH i follicoli LUF mostrano una tipica accelerazione di crescita. Una percentuale del 13% di falsi positivi é stato descritto per tale tecnica. Probabilmente ciò è da riferire a corpi lutei cistici che sono stati diagnosticati per LUF (8,26).
2. DOSAGGIO P e E2 NEL FLUIDO PERITONEALE.
L’ovaio è il maggior produttore di fluido peritoneale (FP). Donne con tube occluse hanno livelli di FP uguali a quelli delle donne con tube pervie. Gli uomini hanno trascurabili quantità di FP. L’incremento rapido del FP in corrispondenza dell’ovulazione é dovuto alla rottura del follicolo di Graaf con conseguente versamento di fluido follicolare in peritoneo. Le pazienti in terapia con contraccettivi orali hanno livelli di FP costantemente bassi. Gli estrogeni fanno aumentare la produzione di FP da parte del mesotelio peritoneale. La concentrazione del progesterone (P) e del 17-beta-estradiolo (E2) nel FP è uguale o di poco inferiore a quella plasmatica tranne che nel periodo immediatamente post-ovulatorio, quando subisce un incremento anche di 5-6 volte. Tale aumento non si osserva in caso di mancata deiscenza del follicolo. La raccolta del FP si effettua durante una laparascopia di controllo o più spesso pungendo il cul de sac di Douglas per via vaginale utilizzando una minitrousse epidurale (Portex Limited System 4) del diametro di 16 G.
3. LAPAROSCOPIA:
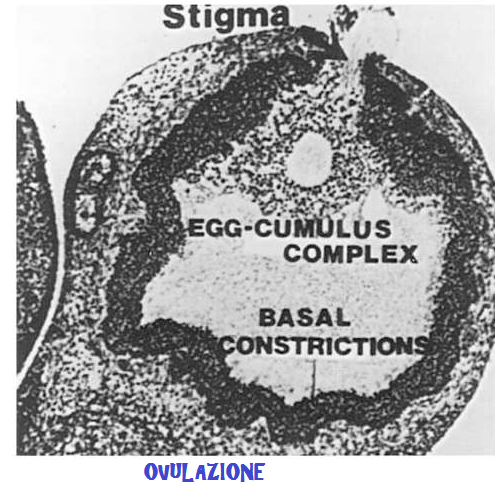
La diagnosi ideale e risolutiva per la LUF-S sarebbe la dimostrazione istologica di un ovocita intrappolato in un follicolo; sono stati effettuati tentativi per recuperare laparascopicamente un intero follicolo ma senza risultato. La mancata visualizzazione dello stigma ovulatorio sulla superficie ovarica entro le 36 ore successive alla presunta ovulazione é un elemento fondamentale per la diagnosi di LUF-S. Purtroppo in molti casi non si riesce a rilevare lo stigma anche quando si é certi dell’avvenuta ovulazione perchè molti stigma vanno incontro a riepitelizzazione rapida. A causa di aderenze addomino-pelviche spesso non é possibile evidenziare del tutto o parzialmente le ovaie. Per lo stesso motivo talvolta non é possibile praticare neppure la laparascopia. In conclusione: data l’esistenza di un alto numero di falsi negativi e di falsi positivi la laparascopia non può ricoprire un ruolo risolutivo nella diagnosi di LUF-S.
ETIOPATOGENESI: Si possono distinguere due probabili cause della luteinizzazione follicolare: quella centrale e quella periferica (tab. 5).
Nell’etiopatogenesi centrale rientrano quei fenomeni di disregolazione ipotalamo-ipofisaria caratterizzati da un’alterata increzione di gonadotropine, iperprolattinemia (18), stress. Lo stress è in grado di aumentare la prolattinemia.
A sostegno di una etiopatogenesi periferica é stato osservato che molte pazienti affette da LUF-S riportano nella storia clinica una malattia infiammatoria pelvica (PID) al punto che é stato proposto il termine di “mechanically unruptured follicle syndrome”. L’incidenza della LUF-S in pazienti con fenomeni aderenziali é molto più alta (71%) rispetto alle pazienti con pelvi normale (33%) (14). Le aderenze periovariche sarebbero responsabili della mancata rottura del follicolo. Anche in assenza di fatti aderenziali, gli stati infiammatori pelvici coinvolgenti le ovaie potrebbero impedire lo scoppio del follicolo pur permettendone la luteinizzazione. Un miglioramento del deficit della fase luteinica si osservava in seguito a antibiotico-terapia. Anche la terapia prolungata con FANS (Indometacina, diclofenac, ketoprofene, ibuprofene) o paracetamolo e tutti gli inibitori delle prostaglandine in genere ma specialmente gli inibitori dell’enzima COX-2 (direttamente interessato nella sintesi delle PG) e gli antistaminici possono indurre una aumentata incidenza di LUF (17,19-24).
Nell’ambito della patologia pelvica associata alla LUF syndrome un discorso a parte merita l’endometriosi. Il rapporto fra LUF e endometriosi é molto controverso: Brosens e Coll. affermano che l’endometriosi é secondaria alla LUF-S perché un basso livello ormonale in cavità peritoneale favorisce l’impianto di cellule endometriali sul mesotelio. Donnez e Thomas affermano che l’incidenza dei cicli LUF è significativamente più alta nelle pazienti con endometriosi (18l); per altri ancora non c’è nessuna connessione. La presenza di ben tre fattori etiologici che implicano aderenze e ostacoli meccanici ci ha spinti a studiare la possibilità terapeutica di un diretto intervento meccanico confortati anche dalle osservazioni del gruppo di Rochester effettuate durante cicli di PMA. Nel corso di induzione di crescita follicolare multipla il ciclo non deve essere abbandonato se si presentano follicoli LUF perché il pregnancy rate é simile a quello degli altri cicli anche se i criteri di classificazione degli ovociti indicano ovociti di cattiva qualità.
TERAPIA DELLA LUF SYNDROME:
Le principali possibilità finora sperimentate nella terapia della LUF-S sono:
1) Citrato di clomifene: risultati molto controversi; Molti AA ritengono addirittura il Clomifene possibile causa di LUF specialmente in pazienti che ovulano spontaneamente (20).
2) Gonadotropine: buoni risultati nel 65% delle pazienti con LUF(15).
3) Adesiolisi in caso di aderenze pelvi-peritoneali.
4) Aspirazione di follicolo ill-timed leading: Il follicolo dominante viene aspirato se di diametro >6 mm rispetto a tutti gli altri follicoli. Secondo Barash e altri ciò sarebbe sufficiente per evitare un precoce picco di LH permettendo a tutti gli altri follicoli di svilupparsi normalmente
5) Scoppio meccanicamente indotto (studio personale).
6) iniezione intraovarica di PGE2 and PGF2α è stata sperimentata com successo negli equini (26)
Bibliografia:
-
Marik J, Hulka J: “Luteinized unruptured follicle syndrome: a subtle cause of infertility”. Fertil Steril1978;29:270-274.
-
Zaidi J, Jurkovic D, Campbell S, Collins W, McGregor A, Tan SL: “Luteinized unruptured follicle: morphology, endocrine function and blood flow changes during the menstrual cycle”. Hum Reprod 1995;10:44-49.
-
Moghissi KS: “Accuracy of basal body temperature for ovulation detection”. Fertil Steril 1976;27:1415-1421.
-
BiH. Qublan, Z. Amarin, M. Nawasreh, F. Diab, S. Malkawi, N. Al-Ahmad and M. Balawneh: “Luteinized unruptured follicle syndrome: incidence and recurrence rate in infertile women with unexplained infertility undergoing intrauterine insemination “. Human Reprod 2006; 21,8: 2110-13.
-
Aksel S: . Thou shall not luteinize nor rupture. Fertil Steril1987;47:762-764.
-
Liukkonen S, Koskimies AI, Tenhunen A, Ylostalo P: “Diagnosis of luteinized unruptured follicle syndrome by ultrasound”. Fertil Steril1984;41:26-30.
-
Queenan JT, O’Brien GD, Bains LM: “Ultrasound scanning of ovaries to detect ovulation in women”. Fertil Steril1980;34:99-105.
-
Vermesh M, Kletzy OA, Davajan V, Jarold R: “Monitoring techniques to predict and detect ovulation”. Fertil Steril1987;47:259-264.
-
Murdoch WJ, Cavender JL: “Effect of indomethacin on the vascular architecture of preovulatory ovine follicle: possible implication in the luteinized unruptured follicle syndrome”. Fertil Steril 1989;51:153-155.
-
Killick S, Elstein M: “Pharmacologic production of luteinized unruptured follicles by prostaglandin synthetase inhibitors”. Fertil Steril1987;47:773-777.
-
Mardesic T.: “Unruptured luteinized follicle syndrome”. Zentralbl Gynakol. 1990; 112(18):1133-41.
-
Hilgers T.W. (2004) The Medical & Surgical Practice of NaProTECHNOLOGY. Pope Paul VI Institute Press, Omaha, NE.
-
Hilgers T.W. (2004) Introduction to the Creighton Model System. [In:] The Medical & Surgical Practice of NaPro-TECHNOLOGY, Pope Paul VI Institute Press, Omaha,NE, pp. 43-248.
-
Hamilton CJ et al: “Follicle growth curves and hormonal patterns in patients with the luteinized unruptured follicle syndrome”. Fertil Steril [1985, 43(4):541-548]
-
T. Coetsier and M. Dhont: “Complete and partial luteinized unruptured follicle syndrome after ovarian stimulation with clomiphene citrate/human menopausal gonadotrophin/human chorionic gonadotrophin”. Human Reprod; 1995;11,3:583-587.
-
J. Check, HG Adelson, C Dietterich and J Stern: “Pelvic sonography can predict ovum release in gonadotrophin-treated patients as determined by pregnancy rate”. Human Reprod; 1989;5,3:34-36
-
G. Smith, R. Roberts, C. Hall and G. Nuki: “reversible ovulatory failure associated with the development of LUF in women with inflammatory arthritis taking non-steroidal anti-inflammatory drugs”. Human Reprod 1995;35;5:458-462.
- Kugu K et al: “Exaggerated prolactine response to thyrotropin-releasing hormone in infertile women with the luteinized unruptured follicle syndrome”. Arch Gynecol Obstetr 1991; 249: 27-31.
- H. Bourne, K. Reynolds, J. Waterstone, E. Okokon, D. Jurkovic, S. Campbell and Dr W P. Collins: “Paracetamol-associated luteinized unruptured follicle syndrome: effect on intrafollicular blood flow”. Ultrasound in Obstetrics & Gyneacology; 2003;1;6:420-425.
- Mikuni M, Pall M, Peterson CM, Peterson CA, Hellberg P, Brannstrom M, et al. The selective prostaglandin endoperoxide synthase-2 inhibitor, NS-398, reduces prostaglandin production and ovulation in vivo and in vitro in the rat. Biol Reprod 1998; 59: 1077–83.
- Killick S, Elstein M. Pharmacologic production of luteinized unruptured follicle syndrome. Fertil Steril 1987; 47: 773–7.
- Pall M, Friden BE, Brannstrom M. Induction of delayed follicular rupture in the human by the selective COX-2 inhibitor rofecoxib: a randomized double-blind study. Hum Reprod 2001; 16: 1323–8.
- Smith G, Roberts R, Hall C. Reversible ovulatory failure associated with the development of luteinized unruptured follicles in women with inflammatory arthritis taking non-steroidal anti-inflammatory drugs. Br J Rheumatol 1996; 35: 458–62.
- Mendonca LL, Khamashta MA, Nelson-Piercy C, Hunt BJ, Hughes GR. Non-steroidal anti-inflammatory drugs as a possible cause for reversible infertility. Rheumatology (Oxford) 2000; 39: 880–2.
- Yasuyki M, Toshiko T, Tasuku H, Naoki T: “Luteinized unruptured follicle in the early stages of endometriosis as a cause of unexplained infertility”. Am J Obst Gynecol;1992; 167,1:271-273
- Parsons, Anna K: “Ultrasound of the Human Corpus Luteum”. Ultrasound Quarterly: 1994;12,3:
- R. Martínez-Boví and J. Cuervo-Arango: *“Intrafollicular treatment with PGE2 and PGF2α inhibits the formation of luteinised unruptured follicles (LUF) and restores normal ovulation in mares treated with flunixin-meglumine”. Equine Veterinary J.









4 commenti
Hello everyone, it’s my first pay a visit at this web page,
and piece of writing is really fruitful in support of me,
keep up posting such content.
Oh my goodness! Impressive article dude! Thank you, However I am going through issues with your
RSS. I don’t understand the reason why I am unable
to join it. Is there anybody else getting identical RSS
problems? Anyone who knows the answer can you kindly respond?
Thanks!!
Have you ever thought about writing an e-book or guest authoring on other sites?
I have a blog based on the same information you discuss and would love to have you
share some stories/information. I know my viewers would appreciate your work.
If you are even remotely interested, feel free to shoot me
an e mail.
I’m very intrigued by the idea of writing an e-book. Who are you? Best regards
dr. Volpicelli