Ultimo aggiornamento 2022-03-15 18:03:15
ANOVULARIETA’ DELLE ADOLESCENTI
L’anovulazione indica che l’ovaio non è in grado di garantire l’ovulazione cioè la ciclica liberazione di un ovocita nella cavità peritoneale da parte dell’ovaio, coordinata e seguita dal classico pathway ormonale.
La presenza di cicli anovulatori è fisiologica nei primi tre anni dopo il menarca. La frequenza ovulatoria deve registrare un progressivo incremento durante i primi 5 anni dopo il menarca: un basso trend ovulatorio oltre il 3° anno ginecologico é un elemento diagnostico negativo, specialmente se si associa al persistere di irregolarità mestruali (oligomenorrea e polimenorrea) (1-3).
| Tab. 1 – FREQUENZA DEI CICLI OVULATORI NEI PRIMI ANNI GINECOLOGICI |
|
| Anni Ginecologici | Percentuale % |
| 1° | 15% |
| 2° | 34% |
| 3° | 41% |
| 4° | 58% |
| 5° | 70% |
| 6° | 75% |
| 7° | 79% |
| 8° | 90% |
Fisiologia della maturazione ovulatoria adolescenziale: La maturazione della capacità ovulatoria nell’adolescenza è un processo complesso e vulnerabile, essenzialmente condizionato da 2 momenti funzionali:
1° progressivo innalzamento del livello di attività dell’ipotalamo, dell’ipofisi e delle gonadi, con relativo aumento della relativa secrezione ormonale;
2° graduale innalzamento e maturazione dei meccanismi di feed-back positivo, da cui deriva il surge di LH in risposta a stimolazione estrogenica adeguata (4).
Fisiopatologia ed eziologia dell’anovulazione adolescenziale: si identificano con quelle della policistosi ovarica. Sotto l’aspetto funzionale i cicli anovulatori dell’adolescente sono caratterizzati dalla tendenza ad un aumento dei livelli di LH già in fase follicolare precoce nel 20% dei casi, e sino al 35% dei casi in fase premestruale, con aumenti corrispondenti di androgeni di derivazione prevalentemente ovarica come testosterone e androstendione. Queste percentuali raggiungono anche il 70% nei casi con amenorrea, che è comunque tra le manifestazioni meno comuni di irregolarità del ciclo (5).
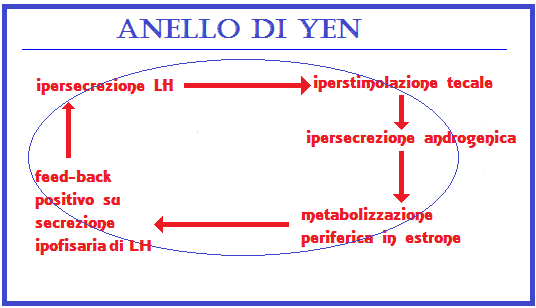
Ma l’aumentata secrezione di LH è primitiva o secondaria all’iperandrogenismo o ad altre patologie metaboliche o dell’asse ipotalamo-ipofisi-ovarico? Nonostante l’enorme quantità di studi in proposito, non è stata ancora formulata un’ipotesi univoca. L’unico dato costante resta l’elevata concentrazione di LH in una serie di patologie fra di loro collegate in un cerchio che le racchiude e collega tutte (anello di Yen) (1-5)
Le ipotesi eziologiche maggiormente accreditate sono:
1. “Top-down school”: disregolazione ipotalamo-ipofisaria primitiva o secondaria (stress, dieta, eccessivo esercizio fisico, danza, neoplasie) con aumentata secrezione di LH, iperstimolazione teca ovarica, aumentata secrezione di androgeni ovarici (androstenedione, testosterone e relativi metaboliti) (6-10).
2. “Bottom-up school”: a causa dell’obesità, c’è un’aumentata conversione, a livello adiposo, degli androgeni in estrone (E1), estrogeno dotato di scarsa attività estrogenica ma capace di “feed-back” negativo su ipofisi e ipotalamo capace di far diminuire la secrezione di FSH ma non di LH con alterato rapporto FSH/LH a favore di quest’ultimo (11).
3. “Androgen school”: secondo gli AA. di questa ipotesi, l’iperandrogenismo ovarico o surrenalico è il primum movens dell’iperproduzione di LH. Gli androgeni vengono metabolizzati a livello adiposo in E1 (12).
A livello ovarico possono essere presenti uno o più dei seguenti fattori distorsivi:
- deficit di 3-β-HSD (olodeidrogenasi), enzima preposto alla trasformazione del DHEA in Androstenedione (A) nella teca ovarica.
- deficit di 17-α-HSD (17-α-idrossi-deidrogenasi) detta anche chetoreduttasi, che converte l’A in T nella teca e l’E1 in E2 nella granulosa.
- deficit di aromatasi che converte il T in E2: la drammatica riduzione dell’estradiolo compromette i meccanismi di feed-back; inoltre gli AA antagonizzano l’azione delle gonadotropine sulla maturazione follicolare; i follicoli vanno in atresia e i follicoli atresici producono ancora maggiori quantità di AA. (4).
- amplificazione della 5-α-reduttasi nella granulosa che converte l’Androstenedione (A) in 5-α-Androstenedione. Il 5-α-A inibisce a livello recettoriale l’azione dell’aromatasi per cui viene inibita la conversione del testosterone in E2 nelle cellule della granulosa.
- Aumento dell’attività enzimatica del citocromo P450c17α: L’iperfosforilazione della serina nella molecola dell’enzima stimola significativamente l’attività steroidogenetica sia a livello ovarico sia a livello surrenalico causando un aumento della produzione di androgeni (ed in particolare del 17-OH-P), senza peraltro modificare le quote di ACTH. L’iperattività del citocromo P450c17α sembra essere correlato con l’aumentato numero di follicoli antrali. Infatti nei follicoli antrali il rapporto teca/granulosa è a favore della prima.
- deficit di inibina a cui segue iperproduzione gonadotropinica ed in particolare dei picchi di secrezione dell’LH con alterato rapporto LH/FSH.
- alterazione del fattore EGF (Epidermal Growth Factor) presente nelle cellule della teca ovarica. L’EGF avrebbe un’azione regolatrice in senso prevalentemente inibitorio sull’azione dell’FSH a livello ovarico di sintesi dell’aromatasi.
- Alterazioni IGF I-II e IGF-BP: l’IGF I e II hanno una struttura molecolare molto simile all’insulina, la sua produzione è ubiquitaria ma in modo preponderante dal fegato. Hanno un’emivita do 8-10 ore e non sono soggetti a variazioni circadiane né all’effetto di stress di qualsiasi tipo ma risentono molto dello stato nutrizionale. L’IGF I ha una molteplicità di azioni legata alla crescita e sviluppo di vari organi specialmente cerebrali e nervosi. Nel sangue le IGF sono legate alle globuline spcifiche (IGF-BP, IGF Binding Protein), che ne limitano l’azione ma ne prolungano l’emivita. La IGF-BP 3 lega più del 95% delle IGF circolanti. Un alto dosaggio di IGF-I nel sangue di un bambino è sinonimo di elevato QI, Quoziente Intellettivo (18). Anche le cellule della granulosa ovarica presiedono alla sintesi del IGF I. Le cellule tecali invece condividono con quelle della granulosa la presenza di recettori specifici. L’IGF I promuove la replicazione delle stesse cellule della granulosa ed anche la trasformazione di esse in altri tipi di cellule ovariche. L’IGF-I e II ha un’azione FSH-sinergica. (19). Un’alta concentrazione di IGF-BP3 può inibire il normale meccanismo steroidogenetico per blocco delle IGF (13-15).
- Idrossilasi e liasi iperattivi con conseguente iperproduzione di androstendione e Testosterone. Questa iperattività enzimatica è stimolata da LH e Insulina.
- Aumentata sintesi della AMH, MIS (Anti-Müllerian Hormone, Müllerian-inhibiting substance) a livello delle cellule della granulosa. Questa citochina inibisce l’aromatasi che trasforma gli androgeni in estrogeni.
- Iperattività P450c17: alla iperattività del citocromo P450c17 della zona reticolare consegue una iperproduzione di androgeni surrenalici.
- CAH e NCAH (LOCAH): l’iperplasia surrenalica congenita (Congenital Adrenal Hyperplasia) classica e quella non classica (NCAH) o tardiva Late-Onset Adrenal Hyperplasia (LOCAH) sono caratterizzate da deficit di 11- e 21-idrossilasi e conseguente diminuita o assente produzione di aldosterone e cortisolo e iperproduzione di androgeni.
4. “Insulin school”: insulino-resistenza, iperinsulinemia, obesità, aumentata conversione degli androgeni in E1 a livello adiposo. Inoltre l’insulina sembra avere un ruolo cofattoriale nella etiopatogenesi surrenalica dell’iperandrogenismo per la sua sinergia con l’ACTH. L’insulina agisce direttamente sulle cellule della teca ovarica attivando il citocromo P450c17α e deprimendo la sintesi epatica di SHBG (sex hormone–binding globulin) per cui aumenta il livello sierico degli androgeni free prontamente disponibili e quindi dotati di maggiore attività biologica rispetto agli androgeni legati alle globuline plasmatiche (23). L’insulina sembrebbe agire anche a livello ipotalamico modificando la secrezione pulsatile di LH e favorendo così l’ipersecrezione ovarica di androgeni (16-20).
E’ possibile una predisposizione genetica all’iperinsulinismo: dovuta probabilmente ad una variazione della regione VNTR5’’ del gene responsabile della secrezione dell’insulina sul cromosoma 19 (Waterworth e coll., 1997) (21,22).
5. “Iperpubertà”: esagerata risposta ipofisaria a normale stimolo di Gn-RH ipotalamico con ipersecrezione di LH per predisposizione genetica ereditaria (“phenotype to genotype”) da madri affette dalla stessa patologia (21).
6. Anomalie del meccanismo di feed-back (ANFB) degli estrogeni
7. Fattori prenatali:
- · Madri obese (23-26)
- · gravidanza protratta (Cresswell e Coll. 1997)

- · macrosomia fetale
- Neonato SGA: i neonati con basso peso alla nascita (Small for Gestazional Age) cui segue un rapido aumento di peso durante l’infanzia [LBW (Low Birth Weight)-early-life sequence] possono facilmente sviluppare FSH resistenza, ipersecrezione di FSH (7.9 mUI/ml delle SGA vs. 3.5 delle AGA), anovularietà nel 40% delle adolescenti nate SGA vs. 4% delle adolescenti nate AGA (22,23), insulino-resistenza, diabete di tipo 2, PCOS (23-32), FSH resistenza (46), elevati valori di FSH (47) e diminuita secrezione di beta-inibina (48).
- Leptina: nei bambini LBW (Low Birth Weight) con accelerata crescita (catch-up growth) post-natale si evidenziano alterazioni della secrezione della leptina che normalmente dovrebbe essere positivamente correlata con il BMI e le concentrazioni sieriche di LH ed estrogeni. La sua diminuita secrezione permette un eccesso di accumulo di percentuale grassa nell’organismo del bambino e dell’adolescente (33-34,38), Infatti la funzione della leptina è quella di contenere il BMI e la percentuale di massa grassa stimolando la termogenesi adattativa e deprimendo il neuropetide Y (PY) che è il più potente stimolatore della sensazione della fame. Ma in questi soggetti capita di osservare obesità pur in presenza di elevatissimi livelli sierici di leptina, e si deduce che in questi soggetti il deficit sia rappresentato da una leptino-resistenza. Esistono forti evidenze che associano l’obesità alla leptino-resistenza, sia a livello del SNC che periferico (muscolare), e che la leptino-resistenza possa determinare l’insorgenza della insulino-resistenza e di conseguenza al diabete tipo 2 Inoltre non è da escludere l’esistenza di differenze interindividuali nella risposta della leptina all’introito calorico.
- esposizione fetale in utero ad eccessi di androgeni sierici materni
Diagnostica: Sono molti i rilievi clinici che debbono essere tenuti presenti quali segnali di un incompleto processo di maturazione o di una iniziale anomalia (tab. 2).
| Tab. 0-2 SEGNALI DI EVOLUZIONE PATOLOGICA DELL’ANOVULARIETA’ |
| Tappe puberali anomali |
| Ipertricosi |
| Acne |
| Seborrea |
| Alopecia |
| Obesità |
| Iperinsulinemia |
| Iperglicemia |
| Basso trend ovulatorio oltre il 3° anno ginecologico |
| Ovaie ingrandite oltre il 3° anno ginecologico |
| Ovaie policistiche oltre il 3° anno ginecologico |
| LH elevato |
| LH/FSH elevato |
| DHEA elevato |
| DHEA-S elevato |
Sintomatologia: Il significato patologico di ciascun rilievo si modifica in relazione all’età in cui compare o è presente: ipertricosi, acne, seborrea ed alopecia sono sempre elementi clinici che debbono suggerire attenzione. La presenza di sovrappeso o di obesità devono indurre alla ricerca di eventuali insulino-resistenza, iperinsulinemia e iperglicemia, condizioni funzionali profondamente radicate nel pathway della PCOS (7).
Tappe puberali anomali, dopo il 3° anno ginecologico richiedono un’approfondita indagine genetica, dosaggi ormonali di base e sotto stimolo, USG dell’apparato genitale e valutazione dei genitali esterni.
Dosaggi ormonali: bassi livelli di FSH (rilevati nella fase follicolare precoce del ciclo) non sono anormali durante i primi anni ginecologici e non sono infrequenti livelli elevati di LH, testosterone e androstendione. Il periodico rilievo di questi parametri clinici permette la constatazione della loro frequente reversibilità o del loro persistere, che può divenire francamente patologico dopo il 3°-4° anno ginecologico, specie in presenza di una condizione di persistente anovulatorietà e di aumento delle ovaie (11). Anche se livelli elevati di DHEA e DHEAS non hanno un preciso significato nell’adolescenza e le relazioni fra le ghiandole surrenali ed il sistema riproduttivo sono poco conosciute, elevati livelli di questi androgeni deboli possono rappresentare un rischio per l’integrità del sistema riproduttivo.
USG: La struttura multifollicolare é un elemento ecografico di per sé privo di implicazioni patologiche avanzate, ma la contemporanea osservazione di iperecogenicità stromale e di un volume ovarico >3 cm3 dopo il 3° anno ginecologico suggerisce la possibilità di una patologia incipiente (39). La struttura multifollicolare è rilevabile ecograficamente nel 35,7% delle adolescenti con cicli regolari, interessa sino al 57,9% di quelle con episodi anovulatori e l’84,6% in caso di amenorrea. Classicamente tali caratteristiche ecografiche e funzionali si riscontrano nella PCOS in cui l’anovulatorietà si presenta nell’80% dei casi ed è quasi sempre associata con LH elevato, iperandrogenismo, alterazioni del ciclo (80%) (40-43). Il parametro ecografico utilizzato come marker della PCOS è l’area stromale in rapporto all’area totale (S/A) dell’ovaio (44). Il volume dell’utero e delle ovaie presentano nelle adolescenti nate SGA una riduzione del 20% rispetto alle adolescenti nate AGA (45,48).
TERAPIA:
Fondamentalmente si possono adottare tre strategie per il trattamento dell’anovulatorietà adolescenziale:
- la modulazione della secrezione pulsatile di gonadotropine;
- la guida diretta della maturazione follicolare;
- la soppressione temporanea delle connessioni endocrine riproduttive.
Per questi obiettivi vengono utilizzati quattro tipi di farmaci con differenti meccanismi d’azione: progesterone o progestinici. farmaci dopaminomimetici, ormone follicolostimolante (FSH), associazioni di estrogeni e progestinici.
- Progesterone e progestinici. Il razionale dell’uso del progesterone nell’anovulatorietà adolescenziale deriva dagli studi di fisiologia della pubertà. Nei primi anni successivi al menarca, quantità anche minime di progesterone prodotto dai follicoli luteinizzati sono in grado di mettere in azione lo sviluppo della funzione ciclica. Ciò causa i primi cambiamenti di frequenza delle pulsazioni gonadotropiniche nell’ambito del ciclo mestruale, portando progressivamente alla sincronizzazione riproduttiva tipica dell’adulto. La somministrazione di progesterone in adolescenti anovulatorie riproduce questi stessi cambiamenti: essa modifica la pulsatilità delle gonadotropine, rallentando la frequenza del rilascio di LH, e riduce i livelli di androgeni circolanti che sono caratteristicamente aumentati nei cicli anovulatori. A causa di un assorbimento incompleto del progesterone per via orale, é più conveniente una terapia con progestinici, quali il medrossiprogesterone acetato o il diidrogesterone, somministrati in dosi da 5 a 10 mg per 10 giorni al mese per almeno 6 cicli. Con questo dosaggio e questa durata, il trattamento non presenta effetti collaterali o rischi significativi. E’una terapia flessibile, particolarmente adatta all’anovulatorietà adolescenziale anche nei primi anni ginecologici (1).
- Farmaci dopaminomimetici. Sia l’anovulatorietà adolescenziale con alti livelli di LH, sia la sindrome dell’ovaio policistico potrebbero dipendere da una riduzione del tasso dopaminergico centrale. Questo postulato é confermato dall’osservazione che la somministrazione di dopamina in entrambi i casi riduce i livelli medi di LH e la frequenza e l’ampiezza delle pulsazioni. La somministrazione di bromocriptina, alla dose di 2,5 mg al giorno per 4-6 mesi, sembra in grado di ridurre i livelli di LH e permette che l’ovulazione abbia luogo in una certa percentuale di casi. Mancano però, a proposito dell’efficacia di questa terapia, dati conclusivi e probanti.
- Ormone follicolostimolante. La somministrazione di FSH puro può promuovere la maturazione follicolare in vari tipi di ragazze con cicli anovulatori con diversi background endocrini e differenti rapporti FSH/LH. Ciò conferma il ruolo preminente dell’FSH nello sviluppo del ciclo riproduttivo normale. Nell’anovularietà delle adolescenti, l’FSH é generalmente più basso del normale e manca del fisiologico aumento premestruale. Perciò il razionale di una terapia con FSH puro nell’anovulatorietà adolescenziale consiste nella riproduzione artificale di questo aumento e nella normalizzazione dei rapporti FSH/LH e androgeni/estrogeni, mediante la promozione dell’attività aromatasica correlata all’FSH. A tale scopo, l’FSH viene somministrato in dosi di 75 UI al giorno per via intramuscolare per 3 giorni al mese (primi 3 giorni del ciclo) per 6 mesi. Secondo la nostra esperienza, questo farmaco non ha effetti collaaterali ed é, a questo dosaggio, privo di qualsivoglia rischio (2).
- Estroprogestinici. Sopprimere la secrezione gonadotropinica delle adolescenti con combinazione di estrogeni e progestinici potrebbe sembrare paradossale se lo scopo della somministrazione é diverso da quello anticoncezionale. D’altronde le adolescenti con cicli anovulatori, con alti livelli di LH, ovaie di volume notevolmente aumentato e segni clinici di iperandrogenismo possono trarre vantaggio dalla soppressione della funzione riproduttiva che interrompe un circolo vizioso che può condurre alla sindrome dell’ovaio policistico. Le preparazione estroprogestiniche più adatte sono quelle con una spiccata azione antiandrogenica:
- la combinazione etinilestradiolo (20 µg) + desogestrel (150 µg) esplica la sua azione antiandrogenica aumentando la concentrazione plasmatica della sex hormone-binding globulin (SHBG);
- la combinazione etinilestradiolo (35 µg) + ciproterone acetato (2 mg) ha un’azione antiandrogenica più forte e più specifica, esplicata attraverso la
- riduzione della secrezione dell’FSH,
- blocco dei recettori per gli androgeni
- inibizione dell’attività 5 alfa-reduttasica.
La terapia con questi dosaggi per 12-18 mesi è generalmente sicura, con effetti collaterali minori quali nausea, una modesta mastodinia e aumento di peso.
Scelta della terapia: Utilizzando gli strumenti terapeutici appena descritti, la strategia di trattamento che mira all’accelerazione o alla correzione della maturazione puberale dipende dai seguenti dati:
- il pattern endocrino ed ovarico;
- l’età ginecologica;
- i sintomi clinici, quali ipertricosi, acne e ipermenorrea.
In effetti le adolescenti con irregolarità mestruali e cicli anovulatori possono possono essere divise in due gruppi: il primo è composto da adolescenti con livelli alti di LH e di androgeni e con ovaie di volume aumentato; il secondo raggruppa le adolescenti con livelli normali di LH e di androgeni e con volume ovarico normale.
Adolescenti con cicli anovulatori con livelli alti di LH e androgeni e ovaie di volume aumentato. Queste ragazze hanno una prognosi incerta per quanto riguarda la capacità riproduttiva. Sebbene sia possibile una maturazione spontanea della ovulatorietà con una normalizzazione della secrezione episodica e circadiana di LH e del volume ovarico normale con l’avanzare dell’età ginecologica. Tali soggetti costituiscono dunque un gruppo ad alto rischio, poichè percorrono un cammino maturativo pericoloso, ai limiti della patologia. Nei primi anni che fanno seguito al menarca e in soggetti con volume ovarico modicamente aumentato (11-15 cm3) il primo passo terapeutico é la modulazione della secrezione aumentata di LH con progestinici o con dopamino-agonisti. Il diidrogesterone (5-10 mg/die per 10 giorni) viene somministrato per 6 mesi, seguito da 6 mesi di pausa. Durante la terapia sono presenti normali mestruazioni indotte, che evitano l’iperplasia endometriale. Dopo la sospensione della terapia la frequenza ovulatoria aumenta del 20-30%. Il trattamento con bromocriptina viene effettuato per 6 mesi, seguito da 6 mesi senza terapia. Durante la terapia, i cicli diventano più regolari e risultano ovulatori in circa il 50% delle p/ti: questo risultato persiste nel tempo in percentuali variabili (3).
In caso di anovularietà persistente dopo la terapia suddetta, il successivo passo terapeutico è la guida diretta della maturazione follicolare con dosi basse di FSH puro (r-FSH 75 UI/die nei primi 3 giorni del ciclo). Prima di iniziare la terapia, si dovrebbe praticare un esame ultrasonografico delle ovaie per escludere la presenza di cisti funzionali. Secondo la nostra esperienza, durante 6 mesi di trattamento, il 50% delle p/ti mostra ritmo mestruale ed ovulazione regolari. I risultati persistono in circa il 30% dei casi. Nell’anovulatorietà persistente, può essere opportuna una combinazione dell’azione di guida follicolare dell’FSH con l’effetto LH-modulante della bromocriptina. I due farmaci vengono somministrati secondo le stesse modalità sopra descritte per almeno 6 mesi. Il tasso di successo di questa associazione farmacologica sembra particolarmente buono (4).
Nei casi di adolescenti con ovaie multifollicolari di volume aumentato (> 15 cm3) e con segni di iperandrogenismo, di p/ti con cisti follicolari occasionali o con spiccata ipermenorrea, la terapia più adatta è la soppressione delle connessioni riproduttive con un composti estroprogestinici, anche nell’età ginecologica più precoce (6).
Per i casi più lievi di iperandrogenismo, l’associazione etinil-estradiolo-desogestrel, con i suoi deboli effetti antiadrogenici, è la più adatta. Questa terapia si dovrebbe protrarre per 12-18 mesi, con monitoraggio semestrale del volume ovarico e dell’evoluzione dell’ipertricosi. Nei soggetti con irsutismo evolutivo, si può prescrivere una preparazione fortemente antiandrogenica con ciproterone acetato. La terapia sopressiva è efficace nel ridurre il volume ovarico ed il numero di follicoli e nel controllare l’iperandrogenismo clinico. Inoltre, la frequenza dell’ovulazione aumenta fino al 40% dopo la sospensione della terapia (5,12).
Adolescenti con cicli anovulatori e con livelli normali di LH e di androgeni e volume ovarico normale. Questo gruppo di ragazze costituisce la condizione di anovulatorietà adolescenziale più fisiologica e con la prognosi migliore. La maggior parte di queste giovani donne giunge ad ovulare spontaneamente entro il 3° anno dopo il menarca. Fino a questo momento, non sono necessarie terapie di sorta, a parte i casi con ipermenorrea, a causa del rischio potenziale di anemia. Oltre agli agenti fibrinolitici, come l’acido tranexamico e l’acido aminocaproico (0,5-1/die), è consigliabile un trattamento ormonale con basse dosi di medrossiprogesterone (MAP) per almeno 6 mesi. Questo trattamento consente un controllo endometriale soddisfacente nella maggior parte dei casi. La persistenza dell’anovulatorietà nonostante quadri endocrini e gonadici normali è meno comune dopo il 3° anno ginecologico. Oltre questa età si deve considerare la necessità di aiutare lo sviluppo del potenziale ovulatorio. Un ciclo iniziale di terapia progestinica, possibilmente seguita da 6 mesi di trattamento con FSH, è di solito efficace nel promuovere il sistema ovulatorio. Si può raggiungere una percentuale di ovulatorietà pari a circa il 40-50% durante il trattamento con FSH, con un 30% di cicli ovulatori anche dopo la sospensione della terapia.
Si potrebbe anche utilizzare il clomifene per indurre l’ovulazione (50 ,g/die dal 3° al 7° giorno del ciclo per 6 mesi. Oviamente tale terapia è di seconda scelta ed è adottata solo per diminuire il costo economico della terapia.
Bibliografia:
- S. Venturoli, E. Porcu, R. Fabbri, R. Paradisi, L. F. Orsini, C. Flamigni. Ovaries and menstrual cycles in adolescence. Gynecol. Obstet. Invest. 17: pag.219-222, 1984.
- S. Venturoli, E. Porcu, S. Macrelli, C. Cavallari, C. Flamigni. L’Ovaire pubertaire . Contracept Fert Sex, 1994; 22: pag.469-474.
- E. Porcu. Puberal root of polycistic ovary sindrome. Gynecological Endocrinoology 10; 4: pag.14-16, 1996
- Sloboda DM, Hickey M and Hart R: ”Reproduction in females: the role of the early life environment”. Human reproduction Update; 2011;17,2:210-227.
- S.K. Blank, C.R. McCartney, and J.C. Marshall: “The origins and sequelae of abnormal neuroendocrine function in polycystic ovary syndrome”. Hum. Reprod. Update (July/August 2006) 12(4): 351-361
- S. Venturoli, E. Porcu, R. Fabbri, O. Magrini, R. Paradisi, G. Pallotti, L. Gammi, C. Flamigni. Postmenarchal evolution of endocrine pattern and ovarian aspects in adolescents with menstrual irregularities. Fertility and Sterility, vol. 48, n. 1: pag.1, 1987.
- S. Venturoli, E. Porcu, R. Fabbri, R. Paradisi, L. Gammi,M. Passarini, L. F. Orsini, C. Flamigni. Ovarian multifollicularity, hight LH androgen plasma levels and anovulation are frequent and strongly linked in adolescent irregular cycles. Acta Endocrinol. (Kbh) 111: pag.368-372, 1986.
- S. Venturoli, E. Porcu, R. Fabbri, R. Paradisi, L. Gammi, M. Passarini, L. F. Orsini, C. Flamigni. Ovarian multifollicolarity, high LH and androgen plasma levels and anovulation are frequent and strongly linked in adolescent irregular cycles. Critica e riconoscimento internazionale. Obstet. Gynecol. Survey, vol. 41: pag.704, 1986.
- E. Porcu, S. Venturoli, O. Magrini, R. Bolzani, D. Gabbi, R. Paradisi, R. Fabbri, C. Flamigni. Circadian variation of luteinizing hormone can have two different profiles in adolescent anovulation. The Journal of Clinical Endocrinology and Metabolism, Vol. 65: pag.488, 1987.
- S. Venturoli, E. Porcu, L. Gammi, O. Magrini, R. Fabbri, R. Paradisi, C. Flamigni. Different gonadotropin pulsatile fashion in anovulatory cycles of young girls indicate different maturational pathways in adolescence. Journal of Clinical Endocrinology and Metabolism, Vol. 65: pag.785, 1987.
- R. Paradisi, S. Venturoli, R. Pasquali, M. Capelli, E. Porcu, R. Fabbri, C. Flamigni. Effects of obesity on gonadotropin secretion in patients with polycystic ovarian disease. J. Endocrinol. Invest. 9: pag.139-144, 1986.
- Ehrmann DA, Barnes R, Rosenfield RL: “Polycystic ovary syndrome as a form of functional ovarian hyperandrogenism due to dysregulation of androgen secretion”.Endocrin Rev 1995;16:322-353
- Adashi E. Y Insulin-like growth factors as intraovarian regulators of granulosa cell growth and function. Endocr Rev 1985; 6:400-20.
- Yoshimura Y. : “Insulin-like growth factors and ovarian physiology”. J Obstet Gynaecol Res. 1998 Oct;24(5):305-23
- Adashi EY, Resnick CE, D’Ercole AJ, Svoboda ME, Van Wyk JJ. Insulin-like growth factors as intraovarian regulators of granulose cell growth and function. Endocrinol Rev. 1985;6:400–420.
- Poretsky et al. The insulin-related ovarian regulatory system in health and desease. Endocr Rev 1999;20:535-82
- Nestler JE, Powers LP, Matt DW, Steingold KA, Plymate SR, Rittmaster RS, et al. A direct effect of hyperinsulinemia on serum sex hormone–binding globulin levels , Barnes R, Rosenfield RL: “Polycystic ovary syndrome in obese women with the polycystic ovary syndrome. J Clin Endocrinol Metab. 1991;72:83–89.
- Nestler JE, Powers LP, Matt DW, Steingold KA, Plymate SR, Rittmaster RS, et al. A direct effect of hyperinsulinemia on serum sex hormone–binding globulin levels , Barnes R, Rosenfield RL: “Polycystic ovary syndrome in obese women with the polycystic ovary syndrome. J Clin Endocrinol Metab. 1991;72:83–89
- Nestler JE. Role of hyperinsulinemia in the pathogenesis of the polycystic ovary syndrome, and its clinical implications. Semin Reprod Endocrinol 1997;15(2):111-22
- Nestler JE, Powers LP, Matt DW, Steingold KA, Plymate SR, Rittmaster RS, et al. A direct effect of hyperinsulinemia on serum sex hormone–binding globulin levels , Barnes R, Rosenfield RL: “Polycystic ovary syndrome in obese women with the polycystic ovary syndrome. J Clin Endocrinol Metab. 1991;72:83–89
- Evanthia Diamanti-Kandarakis and Christina Piperi: “Genetics of polycystic ovary syndrome: searching for the way out of the labyrinth”. Hum. Reprod. Update (November/December 2005) 11(6): 631-643
- Vu-Hong TA, Durand E, Deghmoun S, Boutin P, Meyre D, Chevenne D, Czernichow P, Froguel P, Levy-Marchal C: “The INS VNTR locus does not associate with smallness for gestational age (SGA) but interacts with SGA to increase insulin resistance in young adults”. J Clin Endocrinol Metab 2006;91:2437–2440
- Ibáñez L, Potau N, Ferrer A, Rodriguez-Hierro F, Marcos MV, de Zegher F: ” Reduced ovulation rate in adolescent girls born small for gestational age”. J Clin Endocrinol Metab 2002;87:3391–3393
- Ibáñez L, Valls C, Cols M, Ferrer A, Marcos MV, De Zegher F: “Hypersecretion of FSH in infant boys and girls born small for gestational age”. J Clin Endocrinol Metab. 2002 May;87(5):1986-8.
- S A Paschou, D Ioannidis, E Vassilatou, M Mizamtsidi, M Panagou, D Lilis, I Tzavara, A Vryonidou: “Birth weight and polycystic ovary syndrome in adult life: is there a causal link” ? Human Reproduction (Impact Factor: 4.59). 08/2010; 25(8):2124-31.
- Melo AS et al: “High prevalence of polycystic ovary syndrome in women born small for gestational age”. Human Reprod 2010, vol. 25, no8, pp. 2124-2131 [8 page(s) (article)] (1 p.1/4)
- Paul Saenger, Paul Czernichow, Ieuan Hughes, and Edward O. Reiter: “Small for Gestational Age: Short Stature and Beyond”. Endocrine Reviews 28(2):219 –251 Printed in U.S.A.
- Paul Saenger, Paul Czernichow, Ieuan Hughes, and Edward O. Reiter: “Small for Gestational Age: Short Stature and Beyond”. Endocrine Reviews;2013;28,2
- Jaquet D, Gaboriau A, Czernichow P, Levy-Marchal C: “Insulin resistance early in adulthood in subjects born with intrauterine growth retardation”. J Clin Endocrinol Metab 2000;85:1401–1406
- Beringue F, Blondeau B, Castellotti MC, Breant B, Czernichow P, Polak M: “Endocrine pancreas development in growth-retarded human fetuses”. Diabetes 2002; 51:385–391
- Jaquet D, Deghmoun S, Chevenne D, Collin D, Czernichow P, Lévy-Marchal C: “Dynamic change in adiposity from fetal to postnatal life is involved in the metabolic syndrome associated with reduced fetal growth”. Diabetologia 2005; 48:849–855 CrossRef,
- Barker DJ, Hales CN, Fall CH, Osmond C, Phipps K, Clark PM: “Type 2 (non-insulin-dependent) diabetes mellitus, hypertension and hyperlipidaemia (syndrome X): relation to reduced fetal growth”. Diabetologia 1993; 36:62–67
- Jaquet D, Léger J, Levy-Marchal C, Oury JF, Czernichow P: “Ontogeny of leptin in human fetuses and newborns: effect of intrauterine growth retardation on serum leptin concentrations”. J Clin Endocrinol Metab 1998;83:1243–1246
- Jaquet D, Léger J, Tabone MD, Czernichow P, Levy-Marchal C High serum leptin concentrations during catch-up growth of children born with intrauterine growth retardation. J Clin Endocrinol Metab 1999;84:1949–1953
- Moschos S, Chan JL, Mantzoros S: “Leptin and reproduction: a review”. Fertil Steril 2002;77,3:433-444.
- Mann DR, Johnson AOK, Gimpel T, Castracane VD: “Change in circulating leptin, leptin receptor, and gonadal hormones from infancy until advanced age in human”. J Clin Endocrinol Metabolism; 2000;13:7171-7182.
- Frisch RE, Revelle R: “Heigth and weight at menarche and an hypotesis of menarche”. Arch. Dis Child; 1971;46:695-701.
- Jaquet D, Gaboriau A, Czernichow P, Levy-Marchal C Relatively low serum leptin levels in adults born with intra-uterine growth retardation. Int J Obes Relat Metab Disord 2001;25:491–495
- RS Ratani , HL Cohen , E Fiore . Ratani RS , Cohen HL , Fiore E .: “Pediatric gynecologic ultrasound”. Ultrasound Q. 2004 Sep;20(3):127-39.
- S. Venturoli, R. Paradisi, E. Saviotti, S. Bernabè, E. Porcu, R. Fabbri, C. Flamigni. Ultrasound study of ovarian morfology in women with polycystic ovary syndrome before and during treatment with oestrogen/progestogen preparation. Arch. Gynecol. 234: pag.87-93, 1983.
- S. Venturoli, R. Paradisi, E. Saviotti, E. Porcu, R. Fabbri, L. F. Orsini, L. Bovicelli, C. Flamigni. Ultrasound study of ovarian and uterine morphology in women with polycystic ovary syndrome before, during and after treatment with cyproterone acetate and ethinyloestradiol. Arch. Gynecol. 237: pag.1-10, 1985.
- Venturoli S, Porcu E, Fabbri R, Pluchinotta V, Ruggeri S, Macrelli S, Paradisi R, Flamigni C. Longitudinal change of sonographic ovarian aspects and endocrine parameters in irregular cycles of adolescence. Pediatric Research, 38, 6: pag.974-980, 1995.
- Dramusic V, Goh VH, Rajan U, Wong YC, Ratnam SS. Clinical, endocrinologic, and ultrasonographic features of polycystic ovary syndrome in Singaporean adolescents. J Pediatr Adolesc Gynecol. 1997 Aug;10(3):125-32.
- Li Sun, Qingzhao Fu: “Three-dimensional transrectal ultrasonography in adolescent patients with polycystic ovarian syndrome”. Int J Gynec & Obst 2007;98,1:34-38
- Ibáñez L, Potau N, Enriquez G, de Zegher F.Reduced uterine and ovarian size in adolescent girls born small for gestational age. Pediatr Res. 2000 May;47(5):575-7.
-
Ibáñez L, Potau N, de Zegher F. Ovarian hyporesponsiveness to follicle stimulating hormone in adolescent girls born small for gestational age. J Clin Endocrinol Metab. 2000 Jul;85(7):2624-6.
-
Ibáñez L, Valls C, Cols M, Ferrer A, Marcos MV, De Zegher F. Hypersecretion of FSH in infant boys and girls born small for gestational age. J Clin Endocrinol Metab. 2002 May;87(5):1986-8.
-
Ibáñez L1, de Zegher F .Puberty and prenatal growth. Mol Cell Endocrinol. 2006 Jul 25;254-255:22-5. Epub 2006 Jun 6.
- Scognamiglio G, Giannotti F, Liguori G, Tortora A, Faticato A, Volpicelli T, Civitillo R.M., Tolino A. : “Terapia dell’anovularietà adolescenziale con FSH puro”. Giornale It. di Ost e Ginecol 1999;21;6:268-272
- Venturoli S, Paradisi R, Bagnoli A, Colombo FM, Ravaioli B, Vianello F, Mancini F, Gualerzi B, Porcu E, Seracchioli R. Low-Dose Flutamide (125mg/Day) as Maintenance Therapy in the Treatment of Hirsutism. Horm Res. 2001;56 (1 2):25-31
- Lourdes Ibáñez and Francis de Zegher: “Low-dose flutamide-metformin therapy for hyperinsulinemic hyperandrogenism in non-obese adolescents and women” Hum. Reprod. Update(May/June 2006) 12(3): 243-252
- Welt CK et al.: “Recombinant Human Leptin in Women with Hypothalamic Amenorrhea”. N Engl J Med 2004; 351:987-997.
- Farroqi IS, Jebb SA, Langmack G, Lawrence E, Cheetman CH, Prentice AM: “Effects of recombinant leptin therapy in a child with congenital leptin deficiecy”. N Engl J Med 1999;341:879-884.