Ultimo aggiornamento 2021-05-06 17:41:31
Le vaginiti batteriche sono reazioni infiammatorie della vagina in seguito a colonizzazione da parte di germi patogeni o virulentazione della flora saprofitica vaginale. La vaginosi batterica invece viene definita la sempli ce infezione batterica senza segni di flogosi (prurito, bruciore, iperemia della mucosa, aumento dei leucociti).
ce infezione batterica senza segni di flogosi (prurito, bruciore, iperemia della mucosa, aumento dei leucociti).
Fisiologicamente la vagina ha un pH 3.8-4.5, una flora saprofitica propria e produce secrezioni filanti, di colore chiaro, non irritanti e inodori.
In funzione dell’agente eziologico che le determina le vaginiti possono essere distinte in:
- micotiche (20%), rappresentate nella quasi totalità dei casi dalle candidosi,
- da tricomoniasi vaginalis (15%),
- batteriche (45%),
- virali (5%)
- aspecifiche (15%): non sostenute da alcun germe noto.
Flora vaginale o flora batterica vaginale: si definisce flora vaginale l’insieme di microorganismi, in maggior parte di origine batterica, che colonizzano la cavità vaginale come avviene per la maggior parte dei tessuti di rivestimento del corpo umano del corpo umano: cavità oro-faringea, mucosa intestinale, cute, etc.
Si tratta di una popolazione di batteri che vivono in simbiosi tra loro e costituiscono una forma di difesa verso le aggressioni da parte dei patogeni.
Il lattobacillus acidophilus o bacillo di Doderlein presente in vagina in concentrazioni di 1-10 milioni, occupa il ruolo principale nella protezione della nicchia vaginale mediante diversi meccanismi:
- produzione di acido lattico ottenuto dalla metabolizzazione del glicogeno e conseguente
- acidificazione (pH 3,8-4,5) dell’ambiente vaginale,
- produzione di H2O2 dalla combinazione degli idrogenioni dell’acido lattico con l’acqua,
- produzione di biosurfattanti che creano una barriera protettiva sulle pareti cellulari impedendo l’adesione dei batteri,
- co-aggregazione con i batteri esogeni impedendo in tal modo a questi ultimi di aderire alla mucosa vaginale. L. acidophilus, L. gasseri e L. jensenii si legano a Candida albicans, E. coli e Gardnerella vaginalis
- competizione con i batteri per il sito di adesione cellulare sia occupando direttamente il recettore cellulare che mediante la produzione di biosurfattanti (1).
Oltre ai lattobacilli, la flora batterica vaginale è costituita in minor misura anche da altri microrganismi, che, pur essendo potenzialmente patogeni, non sono in grado di espletare la loro azione lesiva perché vengono mantenuti in numero limitato dai lattobacilli e dal sistema immunitario.
Quelli aerobi sono: Staphyloccus epidermidis (60%), Corynebacterium (60%), Streptococcus 59%), Gadnerella vaginalis (43%), Enterococcus (27%), Enterobatteriaceae (15%), Mycoplasma hominis (14%), Yeast (7.2%), Candida (7%), Staphilococcus aureus (5%), Escherichia coli (4%), Klebsiella pneumonie (2%), neisseria, proteus mirabilis, Pseudomonas aeruginosa, Enterobacter.
Quelli anaerobi sono rappresentati da: Peptococcus spp. (o stafilococco anaerobio) (80%), Peptostreptococcus spp. (o streptococco anaerobio) (28%), Eubacterium (36%), Bacteroides spp (43%), Bacteroides fragilis (14%), B. melaninogenicus (30%), Bacteroides oralis (18%), Bacterides disiens (15%), Bacteroides bivius (40%), B. asacharolyticus(5%), Fusobacterium (23%), Veillonella (29%), Propionibacterium (14 %), Bifidobacterium (15%), Clostridium (18%), Ureaplasma spp (54%), Sarcina (2%), Mobiluncus, Actinomices, Clostridium, Prevotella, Micoplasmi, Trichomonas.
I lattobacilli costituiscono da soli il 90-98% della flora batterica vaginale mentre streptococchi, stafilococchi, enterococchi, enterobatteri, gardnerella, candida e mycoplasma sono presenti in una percentuale del 2-10% circa. Pneumococchi, meningococco ed hemophilus influenzae sono piuttosto rari.
Il pH normale della vagina, per un regolare sviluppo del b. di Doderlein, deve essere decisamente acido: 3,8-4,5. La candida si sviuppa bene in ambiente leggermente acido (pH 4.5-5) mentre il gonococco, lo streptococco e lo stafilococco proliferano in pH 6-8 decisamente basico; il trichomonas beneficia di un pH 5-6.
Eziologia delle vaginiti: le vaginiti sono causate da colonizzazione di batteri provenienti dall’esterno o da organi limitrofi (cute e retto) o per virulentazione della normale flora vaginale. L’alterazione della flora saprofitica può avvenire per cause locali (vaginite primaria) o secondaria ad infezioni di organi limitrofi (vaginite secondaria). In tutti i casi comunque intervengono fattori nocivi locali o sistemici capaci di depotenziare le difese locali espresse dalla nicchia vaginale. L’alterazione dell’equilibrio locale è seguito da una rapida moltiplicazione degli agenti infettivi.
Le principali noxae capaci di depotenziare le difese locali sono individuabili in:
- depressione del sistema immunitario,
- antibioticoterapia,
- terapia radiante,
- assunzione di corticosteroidi,
- citostatici,
- stress psico-fisico severo,
- grave denutrizione,
- diabete scompensato,
- irrigazioni vaginali esasperate,
- IUD,
- spermicidi.
Durante il flusso mestruale la flora vaginale subisce un cambiamento dovuto al passaggio delle desquamazioni mestruale con aumento del pH vaginale e iperproliferazione di gonococchi, streptococchi e stafilococchi.
L’uso di tamponi vaginali se effettuato correttamente sembra non influenzare significativamente il bilancio batterico.
Vaginosi batterica (VB): può definirsi una infezione batterica vaginale che si manifesta con leucoxantorrea maleodorante senza prurito o bruciore. In genere è dovuta a Gardnerella e a batteri gram negativi.
Frequenza: la vaginosi batterica rappresenta probabilmente l’infezione vaginale oggi più diffusa (20-40%) tra le donne in età fertile; è rara sia nelle ragazze prepuberi che nelle donne dopo la menopausa.
Il sintomo più comune è rappresentato da un caratteristico odore di pesce marcio (“fish odour”) e leucoxantorrea lattiginosa bianco-grigiastra. Il cattivo odore è provocato da amine come la cadaverina e la putrescina, prodotte dal metabolismo batterico. A differenza di quanto capita nelle vaginiti, non sono presenti i segni della flogosi (prurito, bruciore, iperemia della mucosa, aumentata presenza di leucociti).
Etiologia: sostenuta da batteri in prevalenza gram – (ma anche gram +) tra cui spicca la Gardnerella vaginalis (precedentemente indicata come Haemofilus vaginalis da Gardner che per primo descrisse la patologia e in seguito ribattezzata Corynebacterium vaginalis e attualmente Gardnerella in onore di Gardner). Attualmente, pur restando caratteristica e preponderante la presenza di Gardnerella, si ritiene che l’etiologia della vaginosi batterica possa ricondursi anche all’azione di altri batteri soprattutto anaerobi, micoplasmi, ureoplasmi, clamidia, pseudomonas, E. Coli, Neisseria, stafilococchi e streptococchi gram -. Fra le altre concause vanno segnalate un’igiene intima scorretta (anche un uso eccessivo di lavande!), l’uso di antibiotici, IUD, pluriparità ed una predisposizione genetica (la popolazione di colore è statisticamente più colpita).
Diagnostica di laboratorio:
- Pap-test: permette la visualizzazione dei batteri e delle caratteristiche
 cellule epiteliali vaginali ricoperte di batteri denominate “clue cells”, cellule spie. Occorre ricordare che la sola evidenza della Gardnerella vaginalis e/o di altri batteri nell’esame batteriologico del secreto vaginale non autorizza la diagnosi di vaginosi, in quanto la presenza dei batteri è fisiologica entro certi limiti, come già detto.
cellule epiteliali vaginali ricoperte di batteri denominate “clue cells”, cellule spie. Occorre ricordare che la sola evidenza della Gardnerella vaginalis e/o di altri batteri nell’esame batteriologico del secreto vaginale non autorizza la diagnosi di vaginosi, in quanto la presenza dei batteri è fisiologica entro certi limiti, come già detto. - Il pH vaginale normalmente acido (4,5) diventa basico (7).
All’ispezione vaginale si riscontrano fini secrezioni omogenee bianco-grigiastre, adese alle pareti vaginali ed al vestibolo.
Epidemiologia: la VB si trasmette attraverso i rapporti sessuali, per contaminazione esterna o per colonizzazione batterica da organi limitrofi (retto, cute perineale).
Complicanze: La vaginosi batterica -come tutte le le vaginiti- può apparire inizialmente come un problema banale ed essere di conseguenza ignorato o comunque 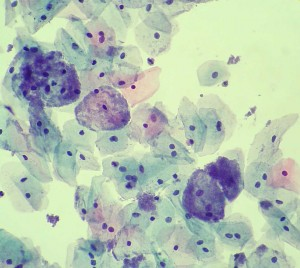 sottovalutato. Se non opportunamente trattata, aumenteranno i rischi di sviluppare cerviciti, displasie cervicali, endometrite, annessiti o una vera e propria malattia infiammatoria pelvica (PID). Il rischio di trasmissione dell’Aids donna-uomo è tre volte più alto in caso di vaginosi batterica. In gravidanza poi la Vaginosi Batterica è spesso associata ad aborti, amnionite, rottura precoce delle membrane (PROM) , parto prematuro ed endometrite post-partum.
sottovalutato. Se non opportunamente trattata, aumenteranno i rischi di sviluppare cerviciti, displasie cervicali, endometrite, annessiti o una vera e propria malattia infiammatoria pelvica (PID). Il rischio di trasmissione dell’Aids donna-uomo è tre volte più alto in caso di vaginosi batterica. In gravidanza poi la Vaginosi Batterica è spesso associata ad aborti, amnionite, rottura precoce delle membrane (PROM) , parto prematuro ed endometrite post-partum.
Terapia: le pazienti asintomatiche non necessitano di terapia. Il ricorso agli antibiotici potrebbe peggiorare il già alterato equilibrio vaginale, mentre è più utile far ricorso a prodotti che ripristinino la normale flora saprofitica vaginale. Le linee guida raccomandano l’impiego della terapia antibiotica solo nelle donne gravide, nelle pazienti sintomatiche ed in quelle che devono essere sottoposte ad intervento chirurgico.
§ Il metronidazolo (Flagyl cpr 250 mg, Zidoval gel, Meclon ovuli; Meclon 5 flaconcini P): la terapia sistemica prevede la somministrazione di una dose unica di 2 gr oppure 500 mg/die per 5 giorni con risultato di guarigione del 90% ed eradicazione dell’infezione nel 75-80%. dei casi. Ma solo il 15-20% dei ceppi di G. vaginalis è sensibile al metronidazolo. Questo significa che il metronidazolo agisce soprattutto sulla flora anaerobica concomitante e che la vaginosi da G. vaginalis è in verità una vaginosi da G. vaginalis-anaerobi. Il metronidazolo risparmia i lattobacilli; non è efficace sugli aerobi.
§. La Clindamicina (Dalacin C cpr 150 mg, Veclam cpr 250 mg, 500 mg) in dose di 300 mg x 2/die per 7 giorni per os. Distrugge anche la flora lattobacillare fisiologica inoltre può avere gravi effetti collaterali (colite pseudomembranosa).
§. Ampicillina (Amplital cps 500 mg, 1 gr, fl im 500 mg, 1 gr), eritromicina (Eritrocina cpr 600 mg) e amoxicillina (Neotetranase cpr 1 gr; Velamox cpr 1 gr; Zimox cpr 1 gr) hanno una buona efficacia e il vantaggio di poter essere somministrate pure in gravidanza, ma come la clindamicina distruggono anche i lattobacilli vaginali sovvertendo l’eumicrobismo vaginale. Ciò spiega l’elevata percentuale di successo della terapia e l’altrettanto elevata percentuale di recidive. Infatti il dismicrobismo vaginale sembra essere il primum movens etiologico della vaginosi (29).
§ Clorexidina (Euclorina® bustine, Euclorina® fazzoletti disinfettanti, Fisian® soluzione in bustine monodose, Clorexidina salviettine, Micoschiuma® soluzione ginecologica -clorexidina + ac. borico + aloe vera-) agente antibatterico di sintesi, utilizzato per disinfettare cute e mucose. Molto efficace contro i batteri gram positivi, la clorexidina si rivela piuttosto attiva anche verso i gram negativi; inoltre, pare moderatamente attiva contro funghi e virus incapsulati. Potente battericida, agisce alterando la struttura proteica della membrana cellulare batterica: aumentandone esageratamente la permeabilità,
§ Lattobacilli acidofili e Vitamina C somministrati per os e per via vaginale: allo scopo di ripristinare la popolazione lattobacillare e l’acidità del pH vaginale. Prodotti commerciali di prebiotici e probiotici: Doderflora® cpr vaginali a lento rilascio, Puraflor bustine (probiotici + lattoferrina + zinco), Microspor cpr vaginali (lattobacillo acidofilo + ac. Lattico); Lactoflorene Gyn capsule vaginali; Acidif CV compresse vaginali (lattobacillo acidofilo + acido lattico + soia); Vitagyn C ovuli e crema vaginale con applicatori (Vit C + maltodestrine + Au); Ginoxil flac P (ac. Lattico, olio di ricino, alcool benzilico); Lactonorm tavolette vaginali (lattobacilli di Döderlein); Normogin candelette vaginali (lattobacilli di Döderlein); Dicoflor elle, cps.
§ Lattoferrina: svolge un’azione antibatterica legandosi alla membrana esterna dei batteri gram – e legando il ferro; togliendo il ferro ai batteri, questi ultimi senza ferro non riescono a replicarsi. Batteri come Escherichia Coli tuttavia possiedono chelanti del ferro che permettono al microrganismo di procurarselo anche in presenza di lattoferrina. Prodotti commerciali contenenti lattoferrina: elleffe 100 plus cpr (lattoferrina + ac. folico + iodio + vitamina C); Puraflor bustine.
§ zinco: proprietà antibatteriche: Puraflor bustine (probiotici + lattoferrina + zinco), Wilzin cps 25 mg
§ lisozima: enzima in grado di distruggere le pareti dei batteri.
§ La kanamicina (Keimicina® ovuli vaginali) è stata riproposta recentemente per la terapia delle vaginosi possedendo una buona azione battericida su gardnerella e enterobacteriacaee.
§ Clorexidine (Neoxene® ovuli)
E’ utile associare antinfiammatori tipo FANS (Ibuprofene-isobutanolammonio, Gineflor® flac P) specialmente in caso di sopravvenuta flogosi. Mediante l’impiego della microscopia elettronica a scansione si è potuto infatti evidenziare che l’Ibuprofene-isobutanolammonio riduce l’adesività (-50% circa ) della Gardnerella vaginalis alle cellule della mucosa vaginale che risultano meno colonizzate da questo batterio.
La prevenzione della Vaginosi Batterica – e delle infezioni vaginali in generale – passa comunque anche attraverso alcune basilari norme igieniche e di comportamento quotidiano.
- Evitare detergenti intimi a PH non acido o ad attività anti-lattobacillare, le irrigazioni, gli spray igienizzanti, i saponi e i talchi profumati. Le irrigazioni infatti alterano la naturale flora saprofita presente in vagina; talchi profumati e spray possono invece produrre irritazioni della mucosa vaginale.
- Bisognerebbe inoltre evitare di indossare biancheria intima sintetica così come jeans e pantaloni troppo
 stretti, tali da trattenere umidità e calore, creando condizioni favorevoli allo sviluppo di microrganismi dannosi.
stretti, tali da trattenere umidità e calore, creando condizioni favorevoli allo sviluppo di microrganismi dannosi.
Quando infine si asciugano e puliscono le parti intime, bisognerebbe sempre eseguire un movimento che dall’avanti procede all’indietro e non viceversa. Questo per evitare il facile e rischioso trasporto di batteri dal retto alla vagina e prevenire quindi la vaginosi.
- Utilizzare fermenti lattici e vitamina C per via vaginale e per os
- Polybactum® 3 ovuli o cps vaginali (Policarbofil + lauril glucoside): 1 ovulo ogni 3 giorni
profilattici: l’uso costante di profilattici offre una protezione del 90% contro le infezioni sessualmente trasmesse.
Vaginite da Streptococcus Agalactiae o β-hemolyticus gruppo B (SBEGB): lo SBEGB è un diplococco gram positivo, catalasi negativo e caratterizzato da antigeni proteici di gruppo B sulla sua parete cellulare. Appartiene alla comune flora saprofitaria vaginale. Infatti si rileva nel 30% dei tamponi vaginali ed in questi casi lo Streptococco agalactiae è presente anche nel tampone rettale. Poiché in condizioni normali non causa sintomi alla donna e non è pericoloso salvo in presenza di immunodepressione o altre gravi malattie, non deve essere trattato con antibiotici, non solo perché è del tutto inutile, ma anche perché molto spesso il trattamento non lo elimina, se non temporaneamente. Ripetuti cicli di antibiotici, effettuati nel vano tentativo di eliminare il germe che sembra ripresentarsi continuamente (ma che in realtà non viene mai eliminato del tutto), sono dannosi, e non di rado causano sovrainfezioni da Candida o alterazioni della flora batterica vaginale.
L’importanza dell’infezione genitale da Streptococco agalactiae aumenta notevolmente in caso di gravidanza e in concomitanza del parto, perché l’infezione può trasmettersi al neonato (circa nel 40% dei casi), ma solo durante il parto (ed esclusi i parti cesarei). Il neonato risulta particolarmente suscettibile alle infezioni da S. agalactiae, dal momento che il suo sistema immunitario non è ancora completamente efficiente. Quindi è molto importante effettuare il tampone vaginale e rettale e urinocultura alla 37a settimana per poter praticare antibiotico-profilassi, nei giorni immediatamente precedenti il parto o durante il travaglio, con ripetute somministrazioni di penicillina. La terapia antibiotica durante il parto non ha lo scopo di eliminare lo Streptococco, ma semplicemente di fare da “scudo” di protezione per il nascituro. Si riduce così il rischio di malattia del neonato, portandola a circa un caso su 3.000 (13,14).
Alcuni ginecologi prescrivono il tampone anche più precocemente, verso la 26° settimana, nell’eventualità di un parto prematuro, ma questa prassi non è raccomandata dalle linee guida internazionali, perché un parto prematuro è imprevedibile e un’infezione non rilevata alla 26a settimana può insorgere magari alla 30a w. Ovviamente non ha nessun senso fare il tampone all’inizio della gravidanza.
In condizioni ad esso favorevoli, lo streptococco beta emolitico di gruppo B si trasforma da commensale ad opportunista patogeno, scatenando nell’ospite una serie d’infezioni anche gravi.
Le vaginiti da streptococco agalactiae si presentano con  arrossamento intenso della mucosa vaginale e del vestibolo vulvare e secrezioni sieropurulente con bruciore e prurito. Lo streptococco hemolyticus è il principale responsabile delle farigo-tonsilliti acute, alitosi, osteomieliti, polmoniti nel neonato infettato durante il passaggio attraverso il canale del parto. Per fortuna solo 3 bambini su 1.000 nati da donne portatrici sane sviluppano segni di malattia.
arrossamento intenso della mucosa vaginale e del vestibolo vulvare e secrezioni sieropurulente con bruciore e prurito. Lo streptococco hemolyticus è il principale responsabile delle farigo-tonsilliti acute, alitosi, osteomieliti, polmoniti nel neonato infettato durante il passaggio attraverso il canale del parto. Per fortuna solo 3 bambini su 1.000 nati da donne portatrici sane sviluppano segni di malattia.
In gravidanza l’Streptococco Beta Emolitico di gruppo B (SBEGB) può provocare setticemia, febbre pueperale, amnioniti, polmonite fetale, meningite fetale, mortalità fetale. Per questo la presenza in vagina della gravida dello streptococco Agalactiae, dovrebbe essere sempre ricercata, di routine, mediante tampone vaginale e rettale anche in assenza di sospetto clinico.
Fattori di rischio: sono stati individuati alcuni importanti fattori di rischio che predispongono una paziente alle infezioni da streptococco beta emolitico di gruppo B:
- Neonati pretermine (< 37 settimane)
- Neonati IUGR
- Rottura delle membrane da oltre 18 ore
- Urinocultura positiva per S. agalactiae
- Iperpiressia durante il travaglio di parto (> 38°C)
- Cervicite e vaginite nella gestante con conseguente corioamnionite (processo infettivo a carico della cavità amniotica)
- Precedente figlio positivo per lo streptococco beta emolitico di tipo B
Diagnostica: per identificare lo Streptococco Beta Emolitico di gruppo B (SBEGB) si può ricorrere al CAMP test. Questo test è utilizzato per identificare glistreptococchi di Gruppo B, in base alla formazione di una sostanza (fattore CAMP) che rende più evidente la zona di emolisi prodotta dalla β-emolisina dello stafilococco aureus. Questo test è spesso utilizzato anche per identificare la listeria spp. CAMP è l’acronimo di “Christie Atkins Munch-Petersen”, i nomi dei tre ricercatori che per primi hanno osservato il fenomeno.
Terapia: si deve trattare la gravida, anche se asintomatica, con penicilline semisintetiche (Zimox, Velamox) + aminoglicoside o penicilline associate con inibitori della lattamasi (Unasyn, Tazocin, Tazobac, Clavulin, Augmentin, Neo-Duplamox) nei 3 giorni precedenti il parto oppure Penicillina + aminoglicoside per via endovenosa prima del parto.
Neisseria Gonorrheae o bacillo di Neisser, dal nome del microbiologo Neisser che la isolò per primo nel 1894, è un diplococco gram negativo di forma circolare (perciò detto gonococco), dotato di fimbrie. Per frequenza e importanza è al secondo posto, dopo  le infezioni da treponema pallidum, per la trasmissione delle malattie sessualmente trasmesse.
le infezioni da treponema pallidum, per la trasmissione delle malattie sessualmente trasmesse.
Nelle infezioni da NG nel 50% dei casi non si manifesta alcun sintomo, nel 50% i sintomi, dopo 1-30 giorni dal contagio, tipicamente sono dolori pelvici, disuria e vulvovaginite acuta con leucorrea nettamente purulenta giallo-verdastra (termine popolare: scolo).
Se non trattata l’infezione da Neisseria gonorrhoeae è responsabile di cerviciti muco-purulente che possono estendersi a tuba, ovaio e peritoneo (PID, Malattia Infiammatoria pelvica) che a sua volta può causare sterilità. La diagnosi, oltre che dall’esame clinico si ricava dalla cultura delle secrezioni vaginale e dalla ricerca degli anticorpi specifici.
Epidemiologia: La gonorrea (letteralmente flusso di seme) si trasmette per contagio durante i rapporti  sessuali con qualsiasi forma di contatto non protetto, dal coito alla fellatio, dai rapporti anali al cunnilingus e, più raramente, col bacio o tramite contatto indiretto (uso promiscuo di biancheria o servizi igienici, ecc.). Può trasmettersi dalla madre al bambino durante il parto e provocare artrite settica, congiuntiviti e ulcere alle cornee anche molto gravi che possono portare fino alla cecità. Per questo durante la gravidanza viene prescritta una terapia antibiotica. Inoltre per limitare ulteriormente i rischi di infezioni agli occhi, in Italia a tutti i neonati entro un’ora dalla nascita si somministrano gocce di collirio antibiotico.Più raramente il contagio può avvenire già durante la gravidanza o nel postpartum; durante la fase gestazionale l’infezione aumenta il rischio di aborto e parto pre-termine.
sessuali con qualsiasi forma di contatto non protetto, dal coito alla fellatio, dai rapporti anali al cunnilingus e, più raramente, col bacio o tramite contatto indiretto (uso promiscuo di biancheria o servizi igienici, ecc.). Può trasmettersi dalla madre al bambino durante il parto e provocare artrite settica, congiuntiviti e ulcere alle cornee anche molto gravi che possono portare fino alla cecità. Per questo durante la gravidanza viene prescritta una terapia antibiotica. Inoltre per limitare ulteriormente i rischi di infezioni agli occhi, in Italia a tutti i neonati entro un’ora dalla nascita si somministrano gocce di collirio antibiotico.Più raramente il contagio può avvenire già durante la gravidanza o nel postpartum; durante la fase gestazionale l’infezione aumenta il rischio di aborto e parto pre-termine.
La terapia della gonorrea si avvale di penicilline depot (1.200.000 UI/w per 4 settimane), penicilline + inibitori di betalattamasi (Unasyn® fl 1 gr) o cefalosporine di 4a generazione (ceftriaxone -Cefixoral® cpr 400 mg- Rocefin® fl 1 gr-), associando Doxicillina (Minocin® cps 100 mg) 100 mg al dì per 7 giorni, ottiene ottimi risultati (15-23). Chinolonici e macrolidi promettono una terapia di successo ma sono frequenti i casi antibiotico-resistenza a questi farmaci. Recentemente in Giappone, Hawai e Nuova Zelanda sono stati segnalati casi di gonococco resistente anche alle cefalosporine di quarta generazione. Questo supergonococco è stato identificato con la sigla superbattere A8806.
Meno frequenti sono le vaginiti da stafilococchi perché gli stafilococchi patogeni non fanno parte della normale flora vaginale mentre sono stanziali nelle prime vie respiratorie e sulla cute dove possono provocare infezioni a carico della cute e dei suoi annessi (follicoliti, acne pustolosa, foruncoli, idrosadeniti). Queste infezioni cutanee restano circoscritte nella maggior parte dei casi, ma talora, specie le stafilococcie della faccia, possono essere il punto di partenza d’infezioni generalizzate a tipo setticemico di notevole gravità (25-26).
Sotto il termine generico Staphylococcus attualmente si riuniscono tutti i cocchi non disposti a catena ma in ammassi e che si presentano al microscopico ottico come elementi rotondeggianti, immobili, del diametro di micron 0,7-1,2, disposti in ammassi o grappoli (σταϕυλή = grappolo). Quasi tutti gli stafilococchi sono aerobi gram positivi ma esistono anche S. anaerobi e gram negativi.
Lo Staphylococcus pyogenes è la varietà maggiormente rappresentata nelle vaginiti della specie e si distingue in due varietà: S. albus ed aureus caratterizzate dalla capacità di produrre o meno un pigmento giallo, quando sono coltivati su terreni particolarmente ricchi come terreni all’uovo, al siero, al latte.
È stata recentemente descritta un’altra specie patogena che produce pigmento rosso-violaceo quando è coltivata in presenza di sali di ferro (Staphylococcus violagabriellae).
Lo Stafilococco saprophyticus, Stafilococco lactis, Stafilococco roseus invece sono specie saprofitarie e non patogene.
Le vaginiti da stafilococchi sono caratterizzate da leucorrea purulenta giallo-verdastra. Il Cefepima (Maxipime® 500 mg, 1 gr), la Novobiocina (Albamycin® o Cathomycin® o Streptonivicin®) e i chinolonici risultano particolarmente attive contro lo Stafilococco Pyogenes (27-28). La novobiocina è un antibiotico che impedisce la replicazione del DNA batterico mediante inibizione dell’enzima DNA-girasi. I chinoloni sono un’altra classe di antibiotici che agiscono sempre sulla replicazione del DNA. L’associazione di Cefepima o Novobiocina con i chinoloni potenzia l’effetto terapeutico e non presenta resistenza crociata (29).
Pseudomonas aeruginosa: Il nome Pseudomonas significa falsa-unità, (dal  greco pseudo falso e μονος singolo), così battezzato, senza motivo, da alcuni microbiologi c all’inizio del XX° secolo. Prima era detto Bacillus pyocyaneus in riferimento al particolare colore blu del pus che si forma nelle ferite infettate, dovuto alla presenza del pigmento piocianina. E’ un batterio gram negativo, a forma di bastoncello, mobile perchè provvisto di un unico flagello. Possiede una spessa capsula che ne favorisce l’adesione all’epitelio uro-vaginale e lo rende resistente a molti antibiotici. A ciò si aggiunge il fatto che lo P. è un potente inibitore di beta-lattamasi per cui occorre utilizzare come terapia un’associazione di ciprofloxacina (Ciproxin®) più cefalosporine di IVa generazione (Maxime®), monobattami (Aztreonam®, Primbactam®) o betalattamine in associazione con inibitori della lattamasi
greco pseudo falso e μονος singolo), così battezzato, senza motivo, da alcuni microbiologi c all’inizio del XX° secolo. Prima era detto Bacillus pyocyaneus in riferimento al particolare colore blu del pus che si forma nelle ferite infettate, dovuto alla presenza del pigmento piocianina. E’ un batterio gram negativo, a forma di bastoncello, mobile perchè provvisto di un unico flagello. Possiede una spessa capsula che ne favorisce l’adesione all’epitelio uro-vaginale e lo rende resistente a molti antibiotici. A ciò si aggiunge il fatto che lo P. è un potente inibitore di beta-lattamasi per cui occorre utilizzare come terapia un’associazione di ciprofloxacina (Ciproxin®) più cefalosporine di IVa generazione (Maxime®), monobattami (Aztreonam®, Primbactam®) o betalattamine in associazione con inibitori della lattamasi  (Unasyn®, Tazocin®, Tazobac®, Clavulin®). La trasmissione in ambiente ospedaliero ed in persone immunodepresse, sottoposte a cateterismo vescicale, cateteri venosi, drenaggi chirurgici e intubazione tracheale è molto frequente.
(Unasyn®, Tazocin®, Tazobac®, Clavulin®). La trasmissione in ambiente ospedaliero ed in persone immunodepresse, sottoposte a cateterismo vescicale, cateteri venosi, drenaggi chirurgici e intubazione tracheale è molto frequente.
E’ un patogeno opportunista, che si può occasionalmente ritrovare nelle regioni cutanee ascellari, inguinali ed anogenitali di soggetti sani. Numerosi sono i fattori di virulenza che ne determinano la patogenicità:
L’Escherichia coli, mentre è spesso responsabile di infezioni urinarie, può provocare piuttosto raramente infiammazioni vaginali, essendo un ospite quasi abituale della vagina; lo stesso dicasi per lo Pseudomonas ed il Proteus. Il rischio maggiore è però quello che si sviluppi, ad opera di questi microrganismi, una infezione ascendente e cioè una malattia infiammatoria pelvica acuta. In caso di vaginite da E. Coli si manifesterà una leucorrea di colore verdastro maleodorante e flogosi del vestibolo vulvare.
Vaginiti da Germi anaerobi: sono ospiti abituali della flora vaginale e sovente sono responsabili di vaginite nelle bambine in età premenarcale. Di solito si tratta di anaerobi non sporigeni gram-negativi (Bacteroides) e cocchi anaerobi gram-positivi e cioè streptococchi e stafilococchi anaerobi. Esistono però dubbi che gli anaerobi possano provocare una infezione primaria della vagina e si pensa che più frequentemente si possano associare con altri germi vaginali patogeni per esempio con la Gardnerella. Il rischio di infezione ascendente è quello di maggior rilievo clinico per cui è opportuno che questi patogeni vengono ricercati. Per identificare questi germi anaerobi occorre però utilizzare mezzi speciali sia al momento del prelievo del trasporto in laboratorio, sia per le colture che debbono essere eseguite in anaerobiosi.
Vaginite da mycoplasmi:
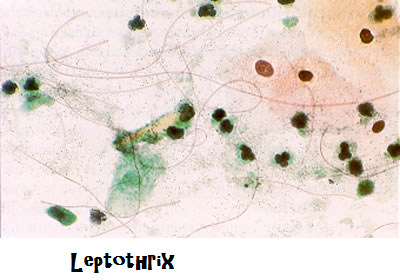
Vaginite da Leptothrix: batterio sottile, filamentoso con guaina che si trova quasi sempre in ambiente acquatico associato con altri agenti patogeni vaginali quali la Candida albicans e il Trichomonas. Taluni affermano che può provocare forme lievi di vaginiti caratterizzate da diffuso arrossamento ed aree bianco-pallide quasi puntiformi sulla mucosa vaginale (24).
Vaginite enfisematosa: è una forma molto rara (meno di 200 casi nella letteratura mondiale), caratterizzata dalla presenza sulla mucosa della vagina e della portio uterina di cavità cistiche (da pochi mm a 2 cm) ripiene di gas. La paziente, per lo più, non ha sintomi e l’alterazione viene scoperta in occasione di un normale controllo ginecologico. Talora si associa una infezione da Trichomonas o da Gardnerella per cui si hanno le perdite caratteristiche di queste infiammazioni. L’origine della lesione è incerta e molto discussa.
Vaginiti ulcerose: Nelle vaginiti ulcerose alcune sono sostenute dal bacillo di Ducrey, dal suo scopritore August Ducrey, è un bacillo Gram negativo che causa l’ulcera venerea. Ma altre gravi ulcere si riscontrano nel corso di malattie infettive generali (tifo, scarlattina, vaiolo, ecc.) con la formazione di pseudomembrane aderenti che poi si ulcerano.
Prevenzione delle vaginiti:
-
detergere correttamente le zone intime. Sia un’igiene personale scadente, sia una detersione ossessiva, contribuiscono ad alterare la microflora locale. Si consiglia l’utilizzo di un prodotto a pH fisiologico (4-4,5), mentre vanno limitati deodoranti intimi e lavande interne.
-
Evitare di indossare biancheria intima sintetica, come jeans e pantaloni troppo stretti, poiché trattengono umidità e calore creando condizioni favorevoli allo sviluppo di agenti patogeni. Analogo discorso per i salvaslip, che durante il flusso mestruale dovrebbero essere cambiati frequentemente. Il continuo sfregamento dell’indumento contro i genitali può inoltre causare irritazioni locali. Meglio quindi scegliere il cotone, che rispetto alle fibre sintetiche garantisce una miglior traspirazione.
-
Utilizzare sempre il condom nei rapporti sessuali occasionali; se si sospetta un’infezione (segnalata da sintomi come prurito e perdite maleodoranti) è importante il riposo sessuale fino alla diagnosi medica e, qualora questa sia positiva, sino al termine dell’eventuale terapia antibiotica. Estendere sempre la cura al proprio partner, anche se privo di sintomi.
-
Evitare l’utilizzo comune di asciugamani e biancheria intima, a casa, in albergo, o in qualsiasi altra condizione.
-
Evitare di stare a lungo con il costume da bagno umido.
-
Seguire una dieta sana ed equilibrata (ridurre, in particolare, il consumo di dolci e zuccheri semplici).
-
Per tutte, poi, c’è un’arma in più, di origine italiana ma conosciuta e usata soprattutto all’estero: la fibroina di seta. E’ una seta al 100% privata della sericina, che è la componente che potrebbe creare allergie, e trattata con un antimicrobico permanente non-migrante a base di ammonio quaternario, che protegge dalla contaminazione batterica e fungina. Questa sostanza antibatterica si lega permanentemente alla seta e non viene ceduta mai alla pelle. In tal modo il tessuto si dimostra efficace:– nel favorire il giusto equilibrio idrolipidico della pelle, svolgendo un’azione emolliente e lenitiva;– nel prevenire la colonizzazione della pelle da parte di batteri e funghi patogeni, senza alterare la naturale flora cutanea;– nel migliorare molti sintomi cutanei, tra cui prurito, secchezza e bruciore, senza alcun rischio di tossicità, né immediata né ritardata.Questo tessuto, dotato di un’attività terapeutica formidabile, è stato classificato come dispositivo medico di classe A e incluso nelle linee guida europee per la cura della dermatite atopica nei bambini. Regno Unito, Svizzera, Svezia, Austria e Olanda lo rimborsano attraverso i rispettivi servizi sanitari o tramite le assicurazioni private.
Studi preliminari indicano che la biancheria intima (Dermasilk) realizzata con questo tessuto riduce significativamente i disturbi da Candida albicans (vulviti e vaginiti) e, appunto, il lichen sclerosus. La fibroina di seta migliora anche le ragadi in allattamento, e cura rapidamente l’intertrigine del solco sottomammario o delle pieghe inguinali, tipica degli anziani e delle persone obese, in quanto riduce significativamente le infezioni cutanee da Staphilococcus aureus e simili. Infine, riduce le superinfezioni batteriche che sono una pesante complicanza delle ustioni.
Antibiotico-terapia dovrebbe essere il più possibile mirata eseguendo un tampone vaginale con antibiogramma, ricerca di anticorpi specifici o facendo riferimento alla sintomatologia ed alle caratteristiche delle perdite vaginali. Se non si conosce esattamente il germe causa dell’infezione è opportuno utilizzare un’associazione di antibiotici attivi su gonococco, chlamydia ed anaeorobi (cefalosporine + doxiciclina).
- Cefalosporine di IIa generazione (Cefoxitina), IIIa generazione (Cefixima, Cefotaxima, Ceftriaxone) e IVa generazione (Cefepime): appartengono alla famiglia delle betalattamine, antibiotici battericidi ad ampio spettro che agiscono con meccanismo d’azione simile alle penicilline, bloccando cioè la sintesi della parete batterica nelle fasi di repòicazione dei batteri. La cefotaxima (Zariviz® fl) e la cefixima (Unixime® Cefixoral® cps 400 mg) sono i farmaci di prima scelta nella terapia dello streptococco. Il ceftriaxone (Rocefin®, Fidato®) è la cefalosporina di questo gruppo dotata di più lunga emivita. Il Cefepima (Maxipime® 500 mg, 1 gr) risulta particolarmente attivo contro lo Stafilococco aureo.
- Doxiciclina (Bassado®, Minocin® cpr 100 mg): 100-200 mg/die per 15-20 gg; attiva su chlamydia e micoplasmi. La Doxiciclina è una tetraciclina semisintetica di seconda generazione, ad assorbimento intestinale completo, con durata d’azione di 15 ore, escreta per via renale. Esplica azione batteriostatica penetrando nel citoplasma batterico e bloccando la subunità ribosomiale batterica 30S. Assumere le compresse almeno un’ora prima di coricarsi, in posizione eretta e con abbondante acqua per il rischio di irritazioni esofagee e intestinali. Per terapia a lungo termine è opportuno associare fermenti lattici e antimicotici.
- Amoxicillina (Zimox® cpr 1 gr) anche in associazione con ac. clavulanico (Neo-Duplamox®, Augmentin®, Clavulin®): una compressa ogni 12 ore per 15-20 gg. L’amoxicillina è una penicillina semisintetica battericida che agisce, come tutte le betalattamine, bloccando la sintesi del peptidoglicano, principale componente della parete batterica, a cui segue la lisi dello stesso batterio. E’ una penicillina ad ampio spettro attiva su germi gram positivi e gram negativi fra cui gonococco, stafilococco, E. Coli. L’amoxicillina è suscettibile alla degradazione da parte delle beta-lattamasi prodotte dai batteri e pertanto viene associata con ac. clavulanico che inattiva alcuni enzimi betalattamici, prevenendo di conseguenza l’inattivazione dell’amoxicillina. L’acido clavulanico da solo non esercita un effetto antibatterico clinicamente utile. L’assorbimento intestinale sia di amoxicillina che di ac. clavulanico è ottimizzato se il farmaco è somministrato ad inizio del pasto.
- Gentamicina (i.m. 160 mg ogni 12 ore per 7 giorni) e doxiciclina (per os 500 mg ogni 6 ore per 7 giorni): per le infezioni da gram negativi e gonococco;
- Metronidazolo (Deflamon® fl 500 mg/100 ml, Flagyl® cpr 250 mg) 250 mg ogni 6 ore per 7 giorni; particolarmente attivo sui germi anaerobi ed in particolare sul Bacteroides Fragilis, sulla Gardnerella vaginalis (vaginosi batterica) e sui protozoi (Trichomonas vaginalis) (2-4). Si può assumere sia in compresse (due volte al giorno per sette giorni o in dose singola) sia in gel da applicare in vagina una volta al giorno per cinque giorni. La terapia per via orale per la durata di sette giorni si è rivelata il metodo più efficace per le donne in gravidanza o durante il periodo dell’allattamento.
- Claritromicina (Veclam® cpr) e Azitromicina (Zitromax® cpr) cpr 500 mg per os ogni 12 ore per 7 giorni): in caso di infezioni da Chlamydia.
- Lincomicina (Lincocin fl 600 mg): 600 mg x 2 i.m. in caso di infezioni da flora anaerobica resistente ad altri farmaci. Antibiotico naturale di estrazione, possiede attività batteriostatica simile ai macrolidi.
- Chinolonici: la ciprofloxacina e la norfloxacina sono i prodotti più recenti, sono dotati di azione batteriostatica inizialmente e poi battericida inibendo la sintesi del DNA batterico. Lo spettro d’azione si volge essenzialmente contro i batteri gram negativi (enterobatteri, brucelle, neisserie). Ottimi disinfettanti urinari.
Bibliografia:
- Boris S, Barbes C.: “Role palyed by lactobacilli in controlling the population of vaginal pathogens microbes and infection”. 2000;2:543-546.
- Hager, WD. (Sep 1992). Metronidazole.. Obstet Gynecol Clin North Am 19 (3): 497-510.
- Boris S, Barbes C.: “Role palyed by lactobacilli in controlling the population of vaginal pathogens microbes and infection”. 2000;2:543-546.
- ^ Schwebke, JR.. Metronidazole: utilization in the obstetric and gynecologic patient.. Sex Transm Dis 22 (6): 370-6.
- ^ Freeman, CD. (Nov 1997). Metronidazole. A therapeutic review and update.. Drugs 54 (5): 679-708.
- Hilton E. et al.: Ann. Intern. Med. 116:353-357, 1992.
- Reid R. and Lorinez A.T.: Human papillomavirus tests. Bail. Clin. Obstet. Gynecol. 1995, 965-103
- Trofatter K.F.: Diagnosis of human paillomavirus genital tract infection. Am. J. Med. 1997, 102: 21-27.
- Poljak M., Brencic A., Seme K., Vince A., MarinI.: Comparative evaluation of first-and second-generation digene hybrid kapture assays for detection of human papillomaviruses associated with high or intermediate risk for cervical cancer. J. Clin. Microbiol., Mar 1999, 796-797.
- Cope J.U. et al.: Comparision of the hybrid capture tube test and PCR for detection of human paillomavirus in cervical specimen. J. Clin. Microb. Vol. 35, n. 9, Sept. ’97, 2262-2265.
- D’Avenia G et Zanchi M.: “Due casi di psoriasi vulvare trattati con a-tocoferolo acetato gel per uso topico”. Riv. Di Ostet Ginecol Pratica e Medic Perinatale 2002,XVII,4:2-5.
- Artuso A: “Kanamicina e vaginosi batterica: un nuovo farmaco”. Riv. Di Ostet Ginecol Pratica e Medic Perinatale 2002,XVII,4:12-13.
- Istituto Superiore di Sanità – Rapporti ISTISAN 07/28. Infezioni da streptococco di gruppo B. A cura di Lucilla Baldassarri.
- Centers for Disease Control and Prevention. Prevention of Perinatal Group B Streptococcal Disease – Revised Guidelines from CDC, 2010. Morbidity and Mortality Weekly Report. November 19, 2010 Vol. 59.
- Eckert LO, Lentz GM. Infections of the lower genital tract:vulva, vagina, cervix, toxic shock syndrome, endometritis, and salpingitis. In: Lentz GM, Lobo RA, Gershenson DM, Katz VL, eds. Comprehensive Gynecology. 6th ed. Philadelphia, Pa: Mosby Elsevier; 2012:chap 23.
- Merritt DF. Vulvovaginitis. In: Kliegman RM, Behrman RE, Jenson HB, Stanton BF, eds. Nelson Textbook of Pediatrics. 19th ed. Philadelphia, Pa: Saunders Elsevier; 2011:chap 543.
- McCormack WM. Vulvovaginitis and cervicitis. In: Mandell GL, Bennett JE, Dolin R, eds. Principles and Practice of Infectious Diseases. 7th ed. Philadelphia, Pa: Elsevier Churchill Livingstone; 2009:chap 107.
- CDC. Syphilis testing algorithms using treponemal tests for initial screening–four laboratories, New York City, 2005–2006. MMWR 2008;57:872–5.
- Tapsall J, Read P, Carmody C, et al. Two cases of failed ceftriaxone treatment in pharyngeal gonorrhoea verified by molecular microbiological methods. J Med Microbiol 2009;58(Pt 5):683–7.
- Moran JS, Levine WC. Drugs of choice for the treatment of uncomplicated gonococcal infections. Clin Infect Dis 1995;20 Suppl 1:S47–S65.
- Newman LM, Moran JS, Workowski KA. Update on the management of gonorrhea in adults in the United States. Clin Infect Dis 2007;44 Suppl 3:S84–101.
- Pandori M, Barry PM, Wu A, et al. Mosaic penicillin-binding protein 2 in Neisseria gonorrhoeae isolates collected in 2008 in San Francisco, California. Antimicrob Agents Chemother 2009;53:4032–4.
- Ison CA, Mouton JW, Jones K, et al. Which cephalosporin for gonorrhoea? Sex Transm Infect 2004;80:386–8.
- Nelson, Yarrow M., Leonard W. Lion, William C. Ghiorse, and Michael L. Shuler. 1999. “Production of biogenic Mn oxides by Leptothrix discophoraSS-1 in a chemically defined growth medium and evaluation of their Pb absorption characteristics.” Applied and Environmental Microbiology, vol. 65, no. 1. American Society for Microbiology. (175-180)
- C. Shaw, J. M. Stitt, S. T. Cowan, Staphylococci and their classification, in Journal General Microbiology, V (1951), pp. 1010-1023;
- G. J. Hucker, in Bergey’s manual of determinative bacteriology, 6ª ed., a cura di R. S. Breed, E. G. D. Murray e A. P. Hitchens, Londra 1948;
- P. Oeding, Antigenic properties of Staphylococcus aureus, in Bacteriological Review, XXIV (1960), pp. 374-396;
- R. E. O. Williams e J. E. Rippon, Bacteriophage typing of Staphylococcus aureus, in Journal of Hygiene, L (1952), pp. 320-353.
- Ginecologia clinica. Nicola Vaglio. PICCIN, 1983
- Gerbert S, Vial Y, Hohlfeld P. Witkin S: “Detection of Ureaplasma urealyticum in Second-Trimester Amniotic Fluid by Polymerase Chain Reaction Correlates with Subsequent Preterm Labor and Delivery”. J Infectious Diseases;2003;187,3:518-521
- Samantha J. Dando, Ilias Nitsos, Graeme R. Polglase, John P. Newnham, lan H. Jobe, and Christine L. Knox: “Ureaplasma parvum Undergoes Selection In Utero Resulting in Genetically Diverse Isolates Colonizing the Chorioamnion of Fetal Sheep”. Biol. Reprod. (2014) 90 (2): 27
- Gerber S, Vial Y, Hohlfeld P, Witkin SS. Detection of Ureaplasma urealyticum in second-trimester amniotic fluid by polymerase chain reaction correlates with subsequent preterm labor and delivery. J Infect Dis 2003; 187:518–521
- Perni SC, Vardhana S, Korneeva I, Tuttle SL, Paraskevas LR, Chasen ST, Kalish RB, Witkin SS. Mycoplasma hominis and Ureaplasma urealyticum in midtrimester amniotic fluid: association with amniotic fluid cytokine levels and pregnancy outcome. Am J Obstet Gynecol 2004; 191: 1382–1386.
- Yoon BH, Chang JW, Romero R. Isolation of Ureaplasma urealyticum from the amniotic cavity and adverse outcome in preterm labor. Obstet Gynecol 1998; 92:77–82.
- Knox CL, Cave DG, Farrell DJ, Eastment HT, Timms P. The role of Ureaplasma urealyticum in adverse pregnancy outcome. Aust N Z J Obstet Gynaecol 1997; 37:45–51.
- Frew L, Stock SJ. Antimicrobial peptides and pregnancy. Reproduction 2011; 141:725–735.
- Cassell GH, Davis RO, Waites KB, Brown MB, Marriott PA, Stagno S, Davis JK. Isolation of Mycoplasma hominis and Ureaplasma urealyticum from amniotic fluid at 16–20 weeks of gestation: potential effect on outcome of pregnancy. Sex Transm Dis 1983; 10:294–302.
- Bush, R.M. and Everett, K.D.E. (2001). Molecular Evolution of the Chlamydiaceae. . Int. J. Syst. Evol. Microbiol. 51: 203 – 220.
- Donati M et al., Chlamydia trachomatis serovar distribution and other concurrent sexually transmitted infections in heterosexual men with urethritis in Italy in Eur J Clin Microbiol Infect Dis. 2009; 28(5): 523-6.
- Ida Kangas, Berit Andersen, Frede Olesen, Jens K Møller, and Lars Østergaard, Psychosocial impact of Chlamydia trachomatis testing in general practice in Br J Gen Pract., vol. 56, 2006, pp. 587–593.
- Picollo R, Brion N, Gualano V, Millérioux L, Marchetti M, Rosignoli MT, Dionisio P, Pharmacokinetics and tolerability of prulifloxacin after single oral administration in Arzneimittelforschung, vol. 53, nº 3, 2003, pp. 201–5
- Prats G, Rossi V, Salvatori E, Mirelis B, Prulifloxacin: a new antibacterial fluoroquinolone in Expert Rev Anti Infect Ther, vol. 4, nº 1, febbraio 2006, pp. 27–41,
- Giannarini G, Tascini C, Selli C, Prulifloxacin: clinical studies of a broad-spectrum quinolone agent in Future Microbiol, vol. 4, nº 1, febbraio 2009, pp. 13–24,
- Giberti C, Gallo F, Rosignoli MT, Ruggieri A, Barattè S, Picollo R, Dionisio P, Penetration of orally administered prulifloxacin into human prostate tissue in Clin Drug Investig, vol. 29, nº 1, 2009, pp. 27–34
- Carmignani G, De Rose AF, Olivieri L, Salvatori E, Rosignoli MT, Dionisio P, Prulifloxacin versus ciprofloxacin in the treatment of adults with complicated urinary tract infections in Urol. Int., vol. 74, nº 4, 2005, pp. 326–31,
- ^ Grassi C, Salvatori E, Rosignoli MT, Dionisio P, Randomized, double-blind study of prulifloxacin versus ciprofloxacin in patients with acute exacerbations of chronic bronchitis in Respiration, vol. 69, nº 3, 2002, pp. 217–22,
- Cazzola M, Salvatori E, Dionisio P, Allegra L, Prulifloxacin: a new fluoroquinolone for the treatment of acute exacerbation of chronic bronchitis in Pulm Pharmacol Ther, 19 Suppl 1, 2006, pp. 30–7,
- Blasi F, Aliberti S, Tarsia P, Santus P, Centanni S, Allegra L, Prulifloxacin: a brief review of its potential in the treatment of acute exacerbation of chronic bronchitis in Int J Chron Obstruct Pulmon Dis, vol. 2, nº 1, 2007, pp. 27–31,
- Gallelli L, Gallelli A, Vero G, Roccia F, Pelaia G, De Sarro G, Maselli R, Acute renal failure probably induced by prulifloxacin in an elderly woman : a first case report in Clin Drug Investig, vol. 26, nº 1, 2006, pp. 49–53,
- Rosignoli MT, Di Loreto G, Dionisio P, Effects of prulifloxacin on cardiac repolarization in healthy subjects: a randomized, crossover, double-blind versus placebo, moxifloxacin-controlled study in Clin Drug Investig, vol. 30, nº 1, 2010, pp. 5–14
- Malik M, Does the prulifloxacin ECG study prove cardiac safety of the drug? in Clin Drug Investig, vol. 30, nº 1, 2010, pp. 1–3
- Deppermann KM, Lode H, Fluoroquinolones: interaction profile during enteral absorption in Drugs, 45 Suppl 3, 1993, pp. 65–72,
- Polk RE, Drug-drug interactions with ciprofloxacin and other fluoroquinolones in Am. J. Med., vol. 87, 5A, novembre 1989, pp. 76S–81S,
- Clobetasol dipropionate 0.05% versus testosterone propionate 2% topical application for severe vulvar lichen sclerosus. AJOG; 1988,178:1:80-84









16 commenti
Great blog here! Also your site loads up very fast! What
web host are you using? Can I get your affiliate link to your host?
I wish my website loaded up as fast as yours lol
Saved as a favorite, I like your web site!
When I originally left a comment I seem to have clicked on the -Notify me when new comments are added-
checkbox and from now on every time a comment is added I receive four emails with the exact same comment.
There has to be an easy method you can remove me from that service?
Thanks a lot!
It’s in point of fact a nice and useful piece of info.
I’m satisfied that you simply shared this useful information with us.
Please keep us informed like this. Thanks for sharing.
I have been browsing online more than 3 hours as of late, yet I by no means discovered any fascinating
article like yours. It is lovely worth sufficient for me.
Personally, if all site owners and bloggers made excellent content
material as you did, the internet will probably be a lot more useful than ever before.
Woah! I’m really enjoying the template/theme of this site.
It’s simple, yet effective. A lot of times it’s tough to get that “perfect balance”
between usability and visual appearance. I must say you have done a very good job with this.
Also, the blog loads super fast for me on Internet explorer.
Superb Blog!
Terrific post however I was wondering if you could write a litte more
on this topic? I’d be very thankful if you could elaborate a little bit further.
Kudos!
I visited several sites except the audio quality for audio songs current at this website
is in fact wonderful.
Nice post. I was checking continuously this blog and I am impressed!
Extremely helpful information specifically the final section 🙂 I take care of such
info a lot. I used to be seeking this particular
info for a long time. Thank you and best of luck.
I all the time emailed this weblog post page to all my friends, since if like
to read it after that my friends will too.
Why not use those coupons for purchasing your favorite healthy products.
Including snacks or perhaps only one part of food, because at the end of the week whenever you review your food diary, you could be shocked
at simply how much food you consumed. Drink Water– The only liquid you ought to drink
is water.
I’m not sure where you’re getting your information, but great topic.
I needs to spend some time learning much more or understanding more.
Thanks for fantastic info I was looking for this info for my mission.
I’m amazed, I have to admit. Seldom do I encounter a blog that’s both educative and interesting, and without
a doubt, you have hit the nail on the head. The issue is an issue that not enough folks are speaking
intelligently about. I’m very happy I found this in my
hunt for something concerning this.
I am really inspired together with your writing
talents as well as with the structure in your weblog.
Is that this a paid topic or did you customize it yourself?
Anyway stay up the excellent quality writing, it is uncommon to see a great blog like this one today..
Hurrah, that’s what I was exploring for,
what a information! existing here at this webpage, thanks admin of this web page.
When you find yourself in need of cash an emergency foundation and you
no matter if your credit track record has a few significant blips ;
you can now get the loan amount, since the student loans in case you
have bad credit are generally designed for a person