Ultimo aggiornamento 22/09/2023
La gonade femminile, come la maschile ha una duplice attività: gametogenetica e steroidogenetica. L’ovaio produce tutte e tre le classi di steroidi sessuali: estrogeni, progestinici e androgeni ma in differenti percentuali rispetto al testicolo a causa della diversità di enzimi critici. L’ovaio inoltre si differenzia dal corticosurrene perchè manca sia della 21-idrossilasi che della 11-β-idrossilasi e pertanto non può produrre glicocorticoidi e mineralcorticoidi (1,2).
Il colesterolo è l’elemento base da cui inizia la steroidogenesi. Il colesterolo presente in circolo come LDL è trasformato in colesterolo libero tramite l’azione di una esterasi a sua volta stimolata dall’ACTH. Il colesterolo libero viene trasportato all’interno dei mitocondri con l’aiuto di una fosfoproteina mitocondriale stimolata da LH, ACTH e Angiotensina II: StAR (Steroidogenic Acute Regulatory protein. All’interno del mitocondrio il citocromo P450scc catalizza l’idrossilazione del colesterolo con formazione di OH-colesterolo e l’azione della desmolasi con clivaggio della catena laterale convertendo l’OH-colesterolo in pregnenolone. Dal pregnenolone si formeranno tutti gli ormoni steroidei attraverso una serie di reazioni che nelle cellule follicolari o luteali avvengono sulla membrana mitocondriale interna.
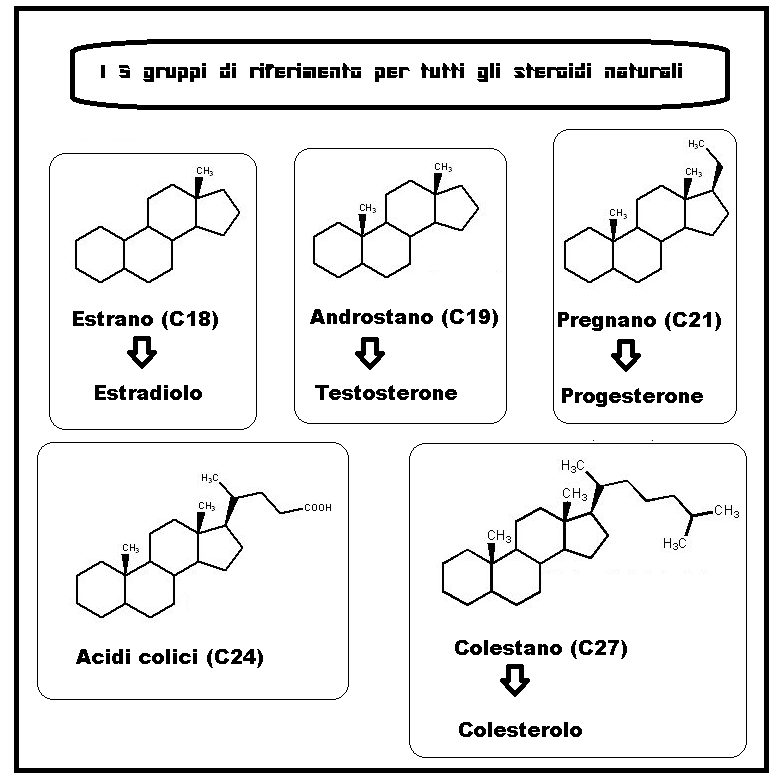
Tutte le molecole steroidee possiedono una struttura base, detta ciclopentanoperidrofenantrene, costituita da tre anelli a 6 atomi di carbonio e uno a 5 atomi.
Gli ormoni steroidei si dividono in 3 gruppi principali, a seconda del numero di atomi di carbonio che possiedono (C21; C19; C18):
1) Pregnano (C21) struttura base dei corticoidi e dei progestinici a 21 atomi di carbonio ;
2) Steroidi a 19 atomi di carbonio (C19) che comprende gli androgeni, che condividono il nucleo di androstano;
3) Steroidi a 18 atomi di carbonio (C18) che comprende gli estrogeni, basati sul nucleo di estrano.
L’ovaio può sintetizzare il colesterolo ex-novo da precursori a 2 atomi di carbonio, oppure può utilizzare come substrato il colesterolo LDL circolante. Gli enzimi steroidogenici fanno parte del gruppo delle ossidasi con citocromo P450.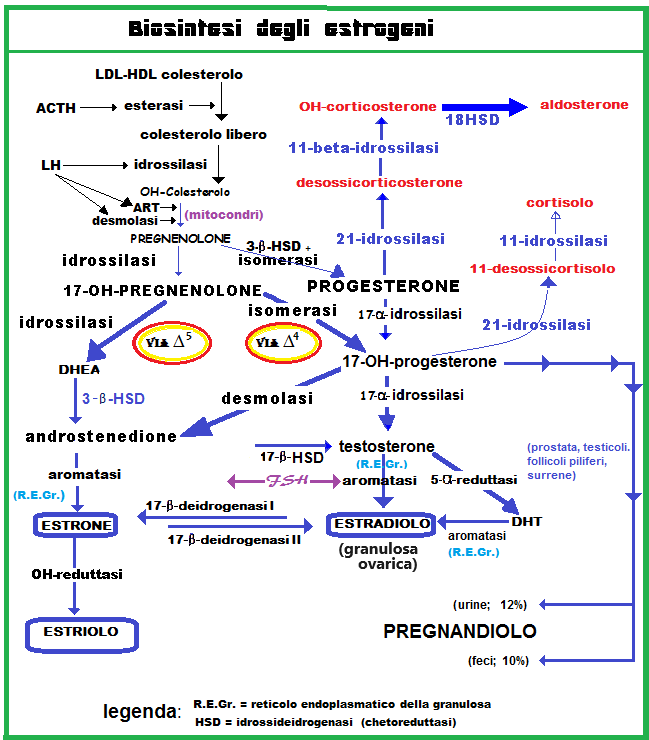
La prima tappa della biosintesi steroidea è la trasformazione del colesterolo in pregnenolone. La biosintesi steroidea prosegue secondo 2 vie: quella dei Δ5-3β-idrossisteroidi, che porta alla formazione di 17-idrossipregnenolone, deidroepiandrosterone (DHEA) e quindi degli estrogeni e quella dei Δ4-3-chetosteroidi, con formazione di progesterone, 17-idrossiprogesterone, T, DHT, Estradiolo. Attraverso la via dei Δ5-3-β-idrossisteroidi il pregnenolone viene convertito a 17-idrossipregnolone, che la P450c desmolasi trasforma in DHEA. Quest’ultimo viene convertito in androstenedione dalla 3-idrossi-steroido-deidrogenasi. L’androstenedione ed il testosterone, suo derivato per azione della 17β-idrossi-steroido-deidrogenasi, sono rapidamente trasformati nei corrispondenti estrogeni C18 estrone ed estradiolo, mediante reazioni microsomiali di aromatizzazione. L’aromatizzazione è mediata dall’aromatasi P450, situata nel reticolo endoplasmatico delle cellule della granulosa. Nella via dei Δ4-3β-chetosteroidi, il pregnenolone viene direttamente trasformato in progesterone, tramite una 3-idrossisteroidodeidrogenasi e una 5-4-5 isomerasi. Quest’ultimo, idrossilato a 17-idrossiprogesterone, costituisce il precursore della serie degli androgeni C19 androstenedione e testosterone.
Le cellule steroidogeniche ovariche possiedono gli enzimi necessari per la produzione di progesterone, androgeni ed estrogeni. Nel follicolo ovarico non luteinizzato (fase follicolare) e nello stroma prevale la via biosintetica dei 5-3-β-idrossisteroidi, che porta alla produzione di androgeni ed estrogeni, mentre la via dei 4-3-chetosteroidi predomina nel tessuto luteinico con conseguente aumentata secrezione di progesterone. La steroidogenesi ovarica si modifica qualitativamente e quantitativamente durante le fasi del ciclo.
Gli estrogeni circolanti sono principalmente di origine ovarica, e derivano in misura minore dalla conversione degli androgeni surrenalici nel tessuto adiposo.
L’estradiolo (17-β-estradiolo, E2) è l’ormone sessuale tipicamente femminile presente però anche nel 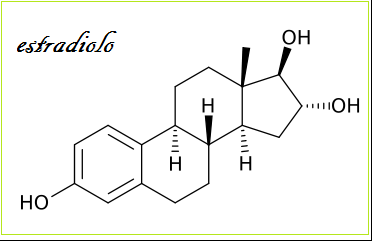 maschio. E’ il più potente fra gli estrogeni ed ha un importante ruolo nella funzionalità sessuale e gametogenetica, in misura minore influisce su molti altri organi.
maschio. E’ il più potente fra gli estrogeni ed ha un importante ruolo nella funzionalità sessuale e gametogenetica, in misura minore influisce su molti altri organi.
E’ secreto dall’ovaio, immesso in circolo è veicolato dalla SHBG (75%), dall’albumina (10%) e solo in minima quantità (15%) libero. Agisce a livello mitocondriale dopo essere penetrato nelle cellule legato al suo recettore specifico.
L’estrone (E1) è sintetizzato nel reticolo endotelio delle cellule della granulosa per metabolizzazione dell’androstenedione sotto lo stimolo dell’enzima aromatasi o per azione della 17-ß-deidrogenasi I dal 17-ß-estradiolo. Viene catabolizzato in estriolo (E3) per azione della OH-reduttasi.
L’estriolo (E3) è il prodotto finale del catabolismo degli estrogeni e come tale è escreto per via renale. I suoi livelli sierici sono elevati in gravidanza e in correlazione con l’età gestazionale.
L’estetrolo (E4) è prodotto esclusivamente dal fegato fetale per metabolizzazione di estradiolo ed estriolo sotto lo stimolo di 15α- e 16α-idrossilasi. Attraverso la placenta l’E4 passa dal circolo fetale nel sangue materno dove è dosabile già dalla nona settimana di gestazione per raggiungere il massimo picco nel 3° trimestre. La sua funzione sembra essere quella di fattore di protezione endoteliale per il feto soprattutto in fase di travaglio e parto. L’estetrolo non subisce alcun metabolismo da parte degli enzimi CYP P450, viene coniugato tramite glucuronidazione e in misura minore solfatazione e quindi escreto per via renale.
Etinil-estradiolo: estrogeno di sintesi, rispetto all’E2 presenta un gruppo etilenico in posizione 17 che consente all’EE di evitare il metabolismo di inattivazione al primo passaggio a livello epatico, contrariamente a ciò che avviene per l’estradiolo.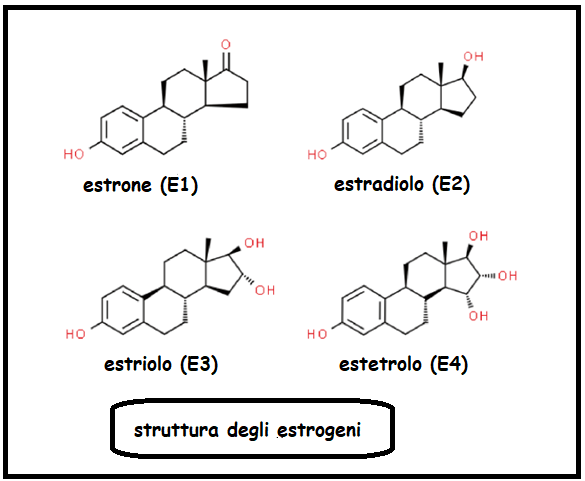
L’azione biologica degli estrogeni, naturalmente, si esercita solo sulle cellule nelle quali vengono espressi recettori specifici. Gli estrogeni sono piccole molecole idrocarburiche apolari e sono molto diversi dagli altri ormoni più grandi, come l’insulina e l’ormone della crescita, che vengono riconosciuti da recettori posti sulla superfice della cellula. Gli estrogeni, invece, passano direttamente all’interno delle cellule e si legano ai recettori che sono nel nucleo formando un dimero. Questo dimero poi si lega ad un gran numero di siti specifici nel DNA, posti strategicamente vicino ai geni che hanno bisogno di essere attivati. Il recettore legato al DNA attiva l’apparato di lettura del DNA ed avvia la produzione di RNA messaggero.
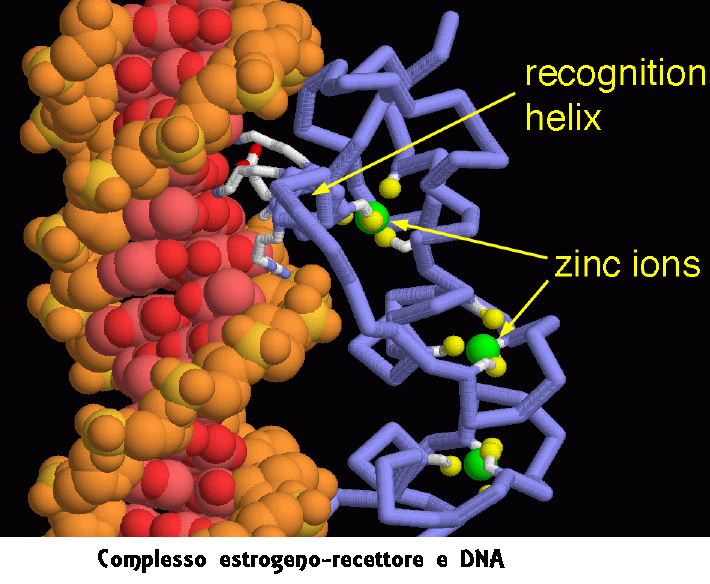
Complesso estrogeni-recettore e DNA – Nella figura qui sotto si vede in dettaglio l’interazione tra il recettore degli estrogeni e il DNA. Il recettore lega il DNA usando due “dita di zinco” (mdm 3-2007). Questi sono piccoli domini costruiti intorno a due ioni zinco. Gli atomi di zolfo di quattro amminoacidi di cisteina (gialli) circondano ognuno degli ioni zinco (verdi), formando legami molto forti che danno al dominio una struttura rigida. Il recettore inserisce un’alfa elica (elica di riconoscimento) nella scanalatura maggiore del DNA. In questa figura, guardiamo proprio lungo l’elica di riconoscimento. Molti amminoacidi su un lato di questa elica (mostrati in grigio chiaro) arrivano a sfiorare e a interagire con i bordi delle basi azotate appaiate (mostrate con sfere rosa e rosse), e in questo modo possono riconoscere una sequenza specifica nel DNA senza bisogno di separare le due catene della doppia elica.
Funzioni degli estrogeni: gli estrogeni sono interessati in numerose funzioni della sfera genitale e del metabolismo osseo e muscolare:
- inducono, in pubertà, la manifestazione dei caratteri sessuali secondari femminili e li sostiene negli anni
- Stimolano la rigenerazione e proliferazione endometriale dopo la desquamazione mestruale.
- stimolano, sia nella pubertà che in gravidanza, la crescita della ghiandola mammaria,
- EE e secrezione lattea – similmente al progesterone, inibisce la secrezione di latte prima del parto inibendo gli enzimi della galattogenesi. La secrezione post-partum di latte è infatti dovuta non solo agli alti livelli di prolattina ma anche al crollo dei valori di estradiolo e quindi alla cessazione di tale inibizione. Gli estrogeni regolano la sua stessa secrezione lattea esercitando un’azione inibente sull’asse ipotalamo-ipofisario con meccanismo di feed-back negativo, ovviamente in caso di elevati livelli sierici di estradiolo.
- azione eutrofica vaginale: La terapia con estradiolo valerato in combinazione con progestinici si è dimostrata particolarmente efficace nel migliorare l’atrofia vaginale, inspessendo l’epitelio vaginale, migliorando la morfologia cellulare e controllando i valori di pH.
- azione anabolizzante: gli EE potenziano la sintesi e secrezione dell’ormone della crescita (GH) e
 contribuisce in tal modo alla crescita corporea post-natale;
contribuisce in tal modo alla crescita corporea post-natale; - azione anti-stress, antinsonnia e antidepressione: la terapia ormonale sostituiva con estradiolo si è rivelata utile nell’alleviare la sintomatologia depressiva legata alla menopausa, riducendo la richiesta di farmaci antidepressivi (7).
- protezione ossea: Il paratormone (PTH) stimola l’osteoclastogenesi in maniera indiretta, agendo cioè sugli osteoblasti. Questi ultimi sotto l’influenza del PTH secernono una citochina, la M-CSF, per la quale i monociti possiedono un recettore specifico, il c-fms. Così stimolati gli osteoblasti secernono una proteina chiamata RANK-L (RANK-ligando), per la quale i monociti possiedono il recettore specifico RANK. La RANK-L interagisce con i monociti, inducendoli a differenziare gli osteoblasti in osteoclasti. Infine gli osteoblasti per mitigare l’azione di RANK-L secernono, con l’aiuto dell’estradiolo, un finto recettore solubile, chiamato osteoprotegerina (OPG), che legandosi a RANKL, ne impedisce l’interazione con il corretto recettore (RANK) presente, come detto, sulla superficie dei monocitii. L’equilibrio fra la produzione di RANKL, M-CSF e OPG stabilisce il livello di osteoclastogenesi fisiologica. La calcitonina invece, secreto dalla tiroide, inibisce l’attività degli osteoclasti agendo direttamente su di essi. La TGF-beta e la BMP (Bone morphogenetic protein). stimolano invece l’osteogenesi. Inoltre l’estradiolo. Infine l’estradiolo aumenta la sintesi epatica di Thyroxine-binding globulin (TBG), inducendo in tal modo un aumento complessivo della concentrazione plasmatica degli ormoni tiroidei ed in particolare della calcitonina. Con l’ovariectomia si osserva un calo precocissimo del trasporto digestivo del calcio senza modificazioni significative dei livelli circolanti del principale metabolita vitaminico: la vitamina D. Ciò fa pensare ad un possibile ruolo diretto degli estrogeni nella modulazione del trasporto del calcio attraverso le pareti intestinali.
- Dominanza estrogenica – Insonnia, ritenzione idrica, nervosismo, cefalea, acne, desiderio di dolci, ansia e stress sono disturbi collegati alla dominanza estrogenica, ovvero alla condizione in cui i livelli di progesterone calano e si crea uno squilibrio progesterone/estrogeni a favore di questi ultimi. La dominanza estrogenica si verifica soprattutto nel periodo antecedente alla menopausa (perimenopausa, 40-45 anni) particolarmente nelle donne obese. Verso i 40-45 anni inizia il fisiologico declino delle ovaie e la loro atrofizzazione perché il numero di follicoli è significativamente ridotto. La secrezione di estrogeni inizia a diminuire e ancor di più quella degli ormoni progestinici sì da creare una dominanza estrogenica. Un altro fattore scatenante della dominanza estrogenica è lo stress. In seguito allo stress si liberano grandi quantità di cortisolo; questo viene prodotto sempre a partire dal pregnenolone, per cui per la sintesi di cortisolo si utilizzeranno più molecole precursori del normale e non ci sarà abbastanza pregnenolone per la sintesi di progesterone con alterazione del rapporto estrogeni/progesterone a favore dei primi. Altre cause di dominanza estrogenica sono l’utilizzo delle pillole anticoncezionali estro-progestiniche, l’esposizione a sostanze chimiche (xeno-estrogeni) che si legano al recettore degli estrogeni, pur trattandosi di sostanze chimiche esterne, come i pesticidi, le diossine, prodotti chimici presenti nei saponi quali i parabeni, ecc.“
- HRT (Hormone Replacement Therapy) – Ripristinare l’equilibrio ormonale presente prima della menopausa può attenuare i sintomi della menopausa stessa (vampate di calore, sudorazione, secchezza vaginale, ansia, irritabilità, depressione), e -se protratto per un tempo sufficientemente lungo – proteggere la donna dall’aumentato rischio osteoporotico.
Inoltre la terapia ormonale in menopausa dimezza il rischio di malattie cardiovascolari come Infarto e ictus cerebrale. Purtroppo solo il 3% delle donne italiane utilizza l’HRT.Estrogeni e cancro – Numerosi studi epidemiologici hanno riportato una diretta correlazione tra HRT e rischio di cancro degli organi riproduttivi femminili: mammella, utero e ovaio. Le donne in postmenopausa e non isterectomizzate, che utilizzano la terapia ormonale sostitutiva (HRT, Hormone Replacement Therapy) a base di soli estrogeni, sono ad aumentato rischio (+ 2-10 volte) di iperplasia endometriale e cancro dell’endometrio. Per minimizzare questo rischio, molte donne che ricorrono a HRT e che non sono state sottoposte ad isterectomia impiegano preparazioni estro-progestinicheo il Tibolone (Livial®). Il progestinico contrasta gli effetti indesiderati degli estrogeni sull’endometrio però produce un
 aumento (+ 0.6-1.5% dopo 5 anni di terapia) del rischio di cancro mammario (1-3).
aumento (+ 0.6-1.5% dopo 5 anni di terapia) del rischio di cancro mammario (1-3).
Anche la terapia con soli estrogeni potrebbe favorire l’insorgenza del ca. mammario, ma solo dopo una terapia prolungata per almeno 10 anni (4).
Secondo altri numerosi studi si dovrebbe ritenere che gli estrogeni non avrebbe un diretto ruolo oncogeno, dal momento che non sono mai stati evidenziati danneggiamenti del DNA correllati alla terapia con estrogeni. Quest ultimi avrebbero un ruolo favorente l’azione di altri oncogeni nell’insorgenza e soprattutto nella progressione e crescita del tumore (5).
Nelle donne isterectomizzate, la terapia ormonale sostitutiva si effettua in genere con soli estrogeni; in questa specifica circostanza l’HRT sembra addirittura esplicare un effetto protettivo nei confronti del cancro mammario (6). Come terapia alternativa per i disturbi della pre-menopausa si possono utilizzare anche rimedi naturali come la Rodiola per lo stress, il Tè verde per il controllo del peso, la Passiflora per l’ansia e i problemi del sonno e la Cimicifuga racemosa o l’Angelica sinensis per i disturbi del ciclo mestruale: Ymea silhoueltte (peperoncino + cimifuga), Ymea pancia piatta (peperoncino + cimifuga + carciofo + tè verde), Ymea vamp control capsule giorno/notte (cimifuga + rodiola + melissa + valeriana + passiflora + vitamina B6). La Cimicifuga, presente nella pillola Giorno, aiuta ad alleviare le vampate di calore, gli sbalzi di umore, l’ansia e l’irritabilità per permetterti di riprendere le tue normali attività quotidiane. La Rodiola è utile in caso di stanchezza fisica e mentale e la Melissa favorisce il rilassamento. Tanto la Valeriana quanto la Passiflora, i cui estratti sono presenti nella pillola Notte, conciliano il sonno e il rilassamento mentre la Cimicifuga contribuisce ad alleviare la sudorazione notturna in modo che tu possa godere di un sonno tranquillo. Infine, la Vitamina B6 contribuisce alla regolazione dell’attività ormonale. Adatto ad un uso prolungato.
Valori sierici di estradiolo: dalla pubertà alla menopausa diminuiscono gradualmente fino ai 50 anni quando si assiste ad un rapido declino.
- Età fertile: 15-350 pg/ml (i livelli sono ampiamente variabile durante il ciclo mestruale)
- Durante le mestruazioni variano da 50 a 100 pg/ml
- Dopo le mestruazioni scende fino a 15 pg/ml,
- Nella fase follicolare ed in corrispondenza del picco di LH può raggiungere e superare i 300 pg/ml,
- Nella fase luteale i livelli iniziano a scendere.
Alcuni nomi di estrogeni in commercio: Climara cerotti, Estraderm cerotti, Estroclim cerotti, Progynova cpr, Femseven cerotti
L’estriolo (E3): è uno dei tre estrogeni naturali prodotti dall’organismo femminile. L’E3 è prodotto solo in parte dall’ovaio; deriva quasi completamente dal metabolismo periferico di estrone ed estradiolo di cui è il metabolita terminale. In gravidanza è prodotto dalla placenta partendo dal DHEA-s a sua volta di derivazione dal fegato fetale. L’estriolo è perciò utilizzato in gravidanza quale parametro di benessere fetale.
L’E3 è il più debole dei tre estrogeni a causa dell’instabilità del legame estriolo-recettore target, la sua azione è di breve durata.
Grazie al suo debole effetto estrogenico, sembra che, la sua azione sia quasi del tutto priva di rischio di sviluppare neoplasie ormone-dipendenti della mammella e dell’endometrio. Tuttavia, ciò non significa che l’estriolo non abbia nessuno dei benefici degli estrogeni più potenti. L’estriolo può ridurre i sintomi della menopausa, come vampate e secchezza vaginale, ma in modo più sicuro rispetto agli altri estrogeni. Questo fa dell’estriolo una scelta ideale per i regimi di sostituzione ormonale (HRT) in menopausa e nella terapia della sclerosi multipla.
Valori sierici normali di E3: Il valore normale dell’E3 varia nel corso della gravidanza (tra parentesi quelli dell’estriolo rilevato nelle urine):
- 20a settimana: 30 mcg/l (4 mg/24 h);
- 24a , 42 mcg/l (6 mg/24 h);
- 28a, 65 mcg/l (9 mg/24h);
- 30a, 75 mcg/l (10 mg/24 h);
- 32a, 123 mcg/l (12 mg/24h);
- 34a, 126 mcg/dl (13 mg/24 h);
- 36a 148 mcg/l (15 mg/24 h);
- 38a: 200 mcg/l; (18 mg/24 h);
- 40a: 230 mcg/l (20 mg/24 h).
Correlazione estrogeni con:
- Estrogeni/recettori steroidei: Gli estrogeni sono in grado di indurre la sintesi dei loro recettori e di quelli per gli androgeni e per i progestinici. Questo processo, detto di reintegrazione, ha luogo nel citoplasma anche se i recettori neosintetizzati raggiungono prontamente il nucleo. L’efficacia biologica di un estrogeno dipenderà dall’affinità per il proprio recettore e dalla concentrazione dello steroide: infatti, qualora l’affinità sia relativamente scarsa e lo steroide venga rapidamente eliminato (come accade nel caso dell’estriolo) l’effetto potrà essere mantenuto se la concentrazione si mantiene elevata nel tempo.
- Estrogeni/prolattina: la prolattina induce un aumento del numero dei recettori estrogenici mentre la bromocriptina ne fa diminuire il numero.
- Estrogeni/Gonadotropine: Gli EE sembrano essere in grado di ridurre l’attività biologica delle gonadotropine circolanti. Tale minore attività sembra collegata ad un aumentato tasso di sializzazione sia dell’LH che dell’FSH. L’FSH e l’LH secreti dall’ipofisi pervengono per via ematica ai recettori specifici di membrana delle cellule follicolari e qui, via c-AMP, stimolano la maturazione morfologica e biochimica dell’apparato follicolo-luteale. I recettori per l’FSH sono posti sulla membrana delle cellule della granulosa e l’effetto dell’FSH è quello di indurre la maturazione dell’ovocita per una ottimale gametogenesi. Inoltre sotto l’effetto sinergico FSH-E2 si ha la progressiva maturazione follicolare fino allo stadio antrale e la comparsa e aumento del numero dei recettori LH in fase follicolare tardiva sulle cellule della granulosa; questa azione spiega la rapida ascesa della secrezione periovulatoria del progesterone. Inoltre è verosimile un controllo peptidergico esercitato dall’ovaio sulla secrezione di FSH mediante l’inibina. Per quanto concerne l’LH, i suoi recettori sono localizzati sulla membrana della teca interna del follicolo, sulle cellule interstiziali, luteali e, in fase follicolare tardiva, sulle cellule della granulosa. L’effetto dell’LH è quello di indurre la steroidogenesi via c-AMP.
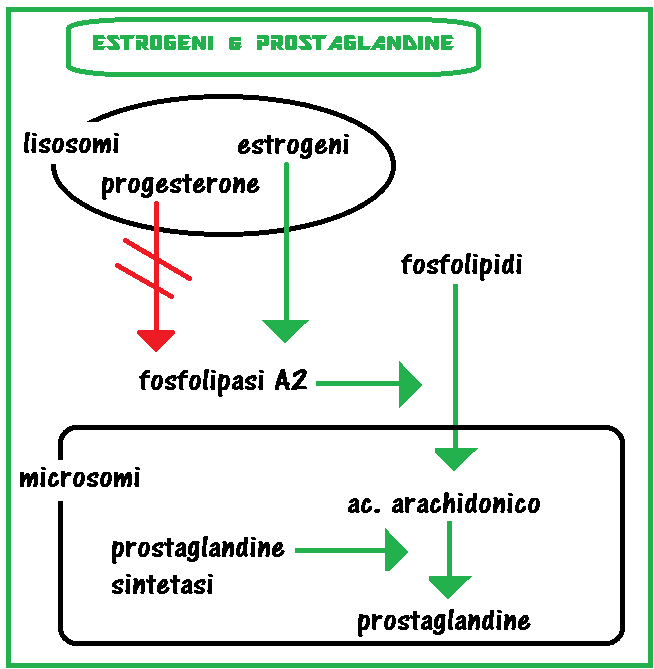
- Rapporti Estrogeni-corpo luteo: Gli EE hanno un’azione luteolitica per cui una loro aumentata concentrazione sierica provoca un aumento correlativo della frequenza degli aborti. E’ verosimile che nell’aumentata incidenza degli aborti intervenga un’aumentata secrezione delle prostaglandine estrogeno-mediata.
- Estrogeni/prostaglandine: gli EE favoriscono la sintesi delle PG mediante attivazione della fosfolipasi A2 che trasforma i fosfolipidi in acido arachidonico.
Nomi commerciali:
- Progynova cpr 2 mg (estradiolo valerato)
- Etinil estradiolo cpr 0.01 mg, 0.05 mg, 0.10 mg, 1 mg
- Sandrena gel cutaneo (estradiolo)
- Colpogyn (estriolo) crema vaginale con applicatori; ovuli
References:
- Doherty JA, Cushing-Haugen KL, Saltzman BS, Voigt LF, Hill DA, Beresford SA, Chen C, Weiss NS: ”Long-term use of postmenopausal estrogen and progestin hormone therapies and the risk of endometrial cancer”. Am J Obstet Gynecol. 2007 Aug;197(2):139.e1-7.
-
M. Diete: Hormone replacement therapy (HRT), breast cancer and tumor pathology. Maturitas 2010;65,3:183-189
- Writing Group for the Women’s Health Initiative Investigators. Risks and benefits of estrogen plus progestin in healthy postmenopausal women. Principal results from the Women’s Health Initiative randomized controlled trial. J Am Med Assoc. 2002;288:321–333.
- Million Women Study Collaborators. Breast cancer and hormone replacement therapy in the Million Women Study. Lancet. 2003;362:419–427
- Vickers, M.R., Martin, J., Meade, T.W. WISDOM study team. The Women’s international study of long-duration oestrogen after menopause (WISDOM): a randomised controlled trial. BMC Women’s Health. 2007;7:2.
- Turgeon, J.L., McDonnell, D.P., Martin, K.A., Wise, P.M. Hormone therapy: physiological complexity belies therapeutic simplicity. Science. 2004;304:1269–1273.
-
Romano-Torres M, Fernández-Guasti A . Estradiol valerate elicits antidepressant-like effects in middle-aged female rats under chronic mild stress. Behav Pharmacol. 2010 Mar;21(2):104-11.