Il ringiovanimento delle ovaie è una procedura che può creare nuovi follicoli nelle ovaie di donne che non sono in grado di concepire a causa della menopausa precoce, senescenza ovarica precoce (POF), età materna avanzata o scarsa riserva ovarica (1-4).
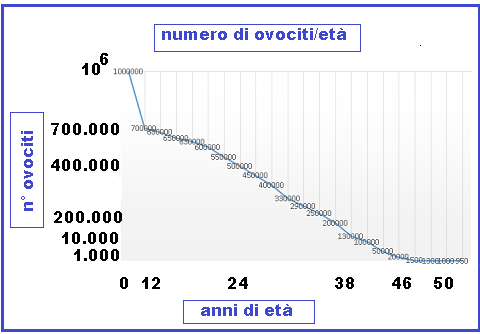
Gli ovociti si formano solo durante la vita fetale e alla 20a settimana di vita intrauterina il pool follicolare è già interamente costituito (1.000.000 circa di follicoli). Da quel momento i follicoli cominciano un processo di inesorabile progressivo esaurimento. Alla nascita molti ovociti sono già andati incontro ad apoptosi e i follicoli primordiali sono presenti in numero di circa 700.000. Questo numero rappresenta la riserva ovarica di ogni donna in epoca prepuberale. Fisiologicamente si assiste poi ad una progressiva riduzione numerica dei follicoli primordiali a causa di fenomeni degenerativi e dei processi ovulatori. Nella donna adulta, il tasso di consumo di follicoli non è costante ma accelera in modo esponenziale con il progredire dell’età. Il patrimonio follicolare a 40 anni è ridotto del 75% ed alla menopausa si registrano <1.000 follicoli/ovaio ed iporesponsivi. Le percentuali di gravidanza con nati vivi anche con tecniche PMA diminuiscono fino a zero dopo i 42 anni e non si hanno gravidanze cliniche dopo i 46 anni. La deplezione follicolare avviene probabilmente a causa di alterazioni delle funzioni immunitarie indotte, in pubertà, da persistenza funzionale del timo e dall’età (5-8).
Molte donne con riserva ovarica ridotta o esaurita, non sono in grado o non vogliono, per ragioni personali, ricorrere all’ovodonazione o adottare un bambino. Per queste categorie di persone la tecnica di neoogenesi è l’unica chance per soddisfare il desiderio di gravidanza.
I primi studi sulla possibilità di ottenere nuovi ovociti dalle cellule epiteliali ovariche sono stati pubblicati nel 2005 (9). I ricercatori hanno ottenuti nuovi follicoli con ovociti prodotti idonei a rendere possibile una gravidanza spontanea. Tuttavia, nel computo di queste gravidanze occorre considerare la possibilità di un concepimento spontaneo coincidente con quel periodo. Infatti possono avvenire concepimenti spontanei anche a 49 anni, ma la probabilità statistica effettiva di un simile evento spontaneo è veramente minima ed è gravata da un’elevata incidenza di malformazioni genetiche fetali a causa dell’età avanzata della gravida.
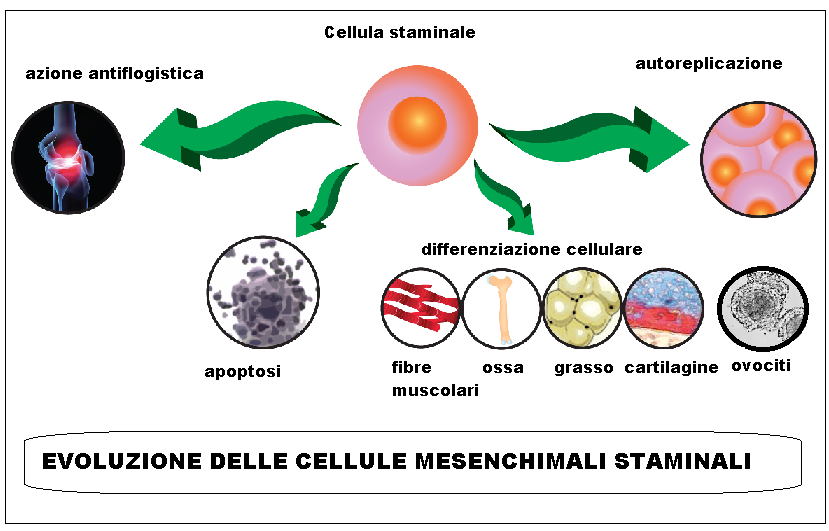
Il rationale della tecnica è sfruttare il potenziale clinico delle cellule staminali pluripotenti presenti nelle gonadi adulte per indurre neoformazione di gonociti sotto lo stimolo locale di fattori di crescita. In vivo i fattori di crescita sono espressi da molte cellule dell’organismo umano ed in particolar modo da piastrine e globuli bianchi, particolarmente in caso di traumi contusivi o lacerazioni, per riparare il danno tissutale. Tra molte altre importanti funzioni biologiche ed immunologiche, i fattori di crescita promuovono neoangiogenesi, tessuto connettivo e nervoso mediante l’attivazione delle cellule staminali normalmente presenti in tutti i tessuti (10-12).
Le cellule staminali possono, sotto lo stimolo biologico appropriato, trasformarsi in qualsiasi tipo di cellula del corpo umano, compresi gli ovociti. La presenza di cellule staminali nelle ovaie e la loro trasformazione in ovociti maturi è stata dimostrata nei topi dai ricercatori di Harvard. Le cellule staminali sono anche state dimostrate essere presenti nell’ovaio umano, quindi è possibile che essi possano essere trasformati in ovociti da fattori di crescita contenuti nei leucociti e nelle piastrine che sono state iniettate nell’ovaio.
Le iniezioni di fattori di crescita, utilizzati per molti tipi di trattamenti medici, sono chiamati PRP (Platelet Rich Plasma) o PDGF (fattori di crescita derivata dalla piastrina).
I fattori di crescita PDGF (Platelet-Derived Growth Factor = Fattori di Crescita Piastrinici) presenti in molte cellule ma in elevata concentrazione nelle piastrine insieme a molti altri fattori di crescita (1-9). Il PDGF è un mitogeno importante per le cellule del tessuto connettivo e per alcuni altri tipi di cellule. Si tratta di una molecola dimerica composta da catene di
polipeptidi A e B, strutturati in modo disolfuro, che si combinano con gli omo- e gli eterodimeri. Le isoforme di PDGF esercitano gli effetti cellulari legando e attivando due recettori strutturati legati alla proteina della tirosina-chinasi, indicando il recettore α e il recettore β. L’attivazione dei recettori PDGF porta alla stimolazione della crescita cellulare, ma anche ai cambiamenti nella forma cellulare e nella motilità; PDGF induce la riorganizzazione del sistema di filamenti attinici e stimola la chemiotassi, cioè un movimento di cellule diretto verso un gradiente di PDGF. In vivo, il PDGF ha un ruolo importante durante lo sviluppo embrionale e durante la guarigione della ferita. Inoltre, l’eccessiva attività di PDGF è stata implicata in diverse condizioni patologiche. La tesi oncogena del simian sarcoma virus (SSV) è legata alla catena B di PDGF e la trasformazione SSV comporta la stimolazione autocrina da una molecola simile a PDGF. Allo stesso modo, la sovrespressione di PDGF può essere coinvolta nella stimolazione di crescita autocrina e paracrina dei tumori umani. La sovraattività di PDGF è stata inoltre implicata in condizioni non maligne caratterizzate da una maggiore proliferazione cellulare, come l’aterosclerosi e le condizioni fibrotiche (10-15).
I geni per l’espressione delle catene A e B del PDGF sono posizionati rispettivamente sui cromosomi 7 e 22.
La sintesi è spesso aumentata in risposta a stimoli esterni, come l’esposizione a bassa tensione di ossigeno, a trombina, al trattamento con glucocorticoidi, invecchiamento dei fibroblasti, traumi, stimolazione con vari fattori di crescita e citochine. L’espressione di PDGF-A aumenta anche nelle cellule muscolari lisce dell’utero umano durante l’ipertrofia fisiologica della gravidanza (16-19).
Come molte altre citochine, il PDGF si lega a α-2-macroglobulina. Questa interazione, che coinvolge PDGF-BB ma non PDGF-AA regola la quantità di PDGF disponibile per l’interazione con i recettori (20-22).
In vivo, il PDGF ha un ruolo importante durante lo sviluppo embrionale e durante la guarigione delle ferite. L’eccessiva attività di PDGF è stata implicata in diverse condizioni patologiche. può essere coinvolta nella stimolazione di crescita autocrina e paracrina dei tumori umani (22-27).
L’utilizzo del concentrato piastrinico (PRP – plasma ricco di piastrine) per uso non trasfusionale, in particolare nella medicina rigenerativa o in dermatologia è una pratica ormai consolidata a livello internazionale. E’ utilizzato da molti anni, con successo, come rigenerante di tessuti danneggiati ad esempio in chirurgia maxillo-facciale e odontostomatologica, in oculistica e nella terapia di ulcere cutanee croniche. L’applicazione per il ringiovanimento ovarico è piuttosto recente (28-34).
La procedura: si prepara il PRP mediante centrifugazione di un prelievo ematico autologo allo scopo di eliminare siero ed eritrociti. Il preparato si inietta nello stroma ovarico con iniezione transvaginale ecoguidata o in corso di laparoscopia in paziente sedata con propofol. Dal momento che il PRP è ricavato da sangue autologo, non ci può essere trasmissione di trasmissioni di alcuna malattia e poiché non ci sono sostanze chimiche sintetiche, la possibilità di una reazione allergica è estremamente improbabile (35-39).
Nelle donne in amenorrea la procedura può essere effettuata in qualsiasi giorno mentre nelle donne mestruate è consigliabile effettuare l’inizione di PRP durante il flusso mestruale o subito dopo.
Per il monitoraggio post-intervento si procede con il dosaggio sierico di AMH (ormone antiMullerian), β-inibina, FSH, LH e Estradiolo a intervalli mensili in donne che non hanno mestruazioni e durante il flusso mestruale nelle
donne mestruate per un periodo di sei mesi. Se i livelli di AMH aumentano, mentre i livelli di FSH, LH e estradiolo diminuiscono, ci sono prove obiettive di ringiovanimento ovarico. È importante ricordare che qualsiasi effetto terapeutico di fattori di crescita può richiedere 3-6 mesi prima di rendersi evidente. Anche se si osserva la rigenerazione ovarica, la gravidanza non può necessariamente verificarsi, in quanto potrebbero esserci altri fattori che potrebbero interferire con il concepimento naturale. AMH <1 ng/ml e Inibina B <45 pg/ml assumono un valore prognostico negativo. A differenza dell’FSH, AMH e Inibina B restano costanti nelle varie fasi del ciclo ovarico e non sono influenzati da patologie o farmaci (40-45).
Conta dei follicoli antrali e calcolo del volume ovarico
E’ un’indagine ecografica transvaginale, molto semplice da eseguire, poco costosa e ripetibile, che rappresenta comunque un ottimo indice per la valutazione della riserva ovarica.
L’indagine deve essere eseguita nei primi giorni del ciclo mestruale (dal 3° al 5° giorno) quando è possibile osservare i piccoli follicoli denominati antrali, in ogni ovaio. Sono follicoli aventi un diametro di circa 2-6 mm.
In condizioni di buona fertilità si osservano in genere >5 follicoli antrali in ogni ovaio e ciascun ovaio ha un volume superiore ai 7 cm3; la presenza di un numero di follicoli inferiore a 5 e di un volume inferiore ai 7 cm3 potrebbe far sospettare una riduzione della riserva ovarica.Per le applicazioni cutanee ora è disponibile la terapia PRP TRANSDERM in elettroporazione. Attraverso una nuovissima apparecchiatura ad alta tecnologia, tra le poche ad essere autorizzate dalla FDA come alternativa elettronica alle iniezioni, è possibile trasferire i Growth Factors senza iniezioni e senza perdere efficacia nella terapia. Tale applicazione ovviamente non è utilizzabile nella PRP (46-53).
Caratteristiche delle pazienti da sottoporre a trattamento con PRP:
1. donne in menopausa o perimenopausa di età <50 anni.
2. Donne aventi una scarsa riserva ovarica, menopausa precoce (POF), bassi livelli di AMH, β-inibina, elevati livelli sierici di FSH.Rischi per la paziente: Il trattamento con PRP non presenta effetti collaterali, cionondimeno una preparazione impropria e non conforme ai requisiti di qualità e sicurezza imposti dalla normativa di riferimento può rappresentare un rischio per il paziente. Un procedimento di lavorazione inadeguato potrebbe esporre al rischio di contaminazione batterica e/o infezioni. Inoltre occorre tener presenti i rischi correlati alla tecniche di approccio chirurgico dell’iniezione intraovarica (54).
Tale terapia può essere eseguita solo in strutture autorizzate all’utilizzo di emoderivati. Il PRP, anche definito gel di piastrine (gdp), in base alla normativa nazionale attualmente vigente può essere preparato solo nei servizi trasfusionali (ST). La preparazione e l’utilizzo del prodotto sono, infatti, disciplinati dalla Legge n. 219/2005 che regola la donazione, la manipolazione e lo stoccaggio del sangue e dei suoi derivati e dal Decreto Legislativo 20 dicembre 2007, n. 261.
References:
- Mathe G. Immunity aging. I. The chronic perduration of the thymus acute involution at puberty? Or the participation of the lymphoid organs and cells in fatal physiologic decline? Biomed Pharmacother. 1997;51:49–57. doi: 10.1016/S0753-3322(97)87726-8.
- Bukovsky A, Presl J. Ovarian function and the immune system. Med Hypotheses. 1979;5:415–36. doi: 10.1016/0306-9877(79)90108-7.
- Bukovsky A, Caudle MR, Svetlikova M, Upadhyaya NB. Origin of germ cells and formation of new primary follicles in adult human ovaries. Reprod Biol Endocrinol. 2004;2:20
- Bukovsky A, Keenan JA, Caudle MR, Wimalasena J, Upadhyaya NB, Van Meter SE. Immunohistochemical studies of the adult human ovary: possible contribution of immune and epithelial factors to folliculogenesis. Am J Reprod Immunol. 1995;33:323–40.
- Bukovsky A, Caudle MR, Svetlikova M, Wimalasena J, Ayala ME, Dominguez R. Oogenesis in adult mammals, including humans: a review. Endocrine. 2005;26:301–16.
- Bukovsky A, Caudle MR. Immunoregulation of follicular renewal, selection, POF, and menopause in vivo, vs. neo-oogenesis in vitro, POF and ovarian infertility treatment, and a clinical trial. Reprod Biol Endocrinol. 2012;10:97. doi: 10.1186/1477-7827-10-97.
- Bukovsky A. How can female germline stem cells contribute to the physiological Neo-oogenesis in mammals and why menopause occurs? Microsc Microanal. 2011;17:498–505
- Bukovsky A. Ovarian stem cell niche and follicular renewal in mammals. Anat Rec (Hoboken) 2011;294:1284–306.
- Oogenesis in cultures derived from adult human ovaries. Bukovsky A, Svetlikova M, Caudle MR
Reprod Biol Endocrinol. 2005 May 5; 3():17.
- Carl-Henrik Heldin, Bengt Westermark Mechanism of Action and In Vivo Role of Platelet-Derived Growth Factor. Physiological Reviews Published 10 January 1999 Vol. 79 no. 4, 1283-1316
- Bukovsky A, Caudle MR. Mammalian neo-Oogenesis from Ovarian Stem Cells in Vivo and in Vitro. In: Schatten H, editor. Cell and Molecular Biology and Imaging of Stem Cells. Hoboken: Wiley; 2014. pp. 67–136.
- Bukovsky A, Virant-Klun I. Adult Stem Cells in the Human Ovary. In: Simon C, Pellicer A, editors. Stem Cells in Reproductive Medicine: Basic Science & Therapeutic Potential. London: Informa Healthcare; 2007. pp. 53–69.
- Conboy IM, Conboy MJ, Wagers AJ, Girma ER, Weissman IL, Rando TA. Rejuvenation of aged progenitor cells by exposure to a young systemic environment. Nature. 2005;433:760–4.
- ABBOUD, H. E. Role of platelet-derived growth factor in renal injury. Annu. Rev. Physiol. 57: 297–309, 1995.
- ABBOUD, H. E., E. POPTIC, AND P. DICORLETO. Production of platelet-derived growth factor-like protein by rat mesangial cells in culture. J. Clin. Invest. 80: 675–683, 1987.
- ABE, J.-I., J.-O. DEGUCHI, T. MATSUMOTO, N. TAKUWA, M. NODA, M. OHNO, M. MAKUUCHI, K. KUROKAWA, AND Y. TAKUWA. Stimulated activation of platelet-derived growth factor receptor in vivo in balloon-injured arteries. A link between angiotensin II and intimal thickening. Circulation 96: 1906–1913, 1997.
- AFINK, G. B., M. NISTE´ R, B. H. G. J. STASSEN, P. H. L. J. JOOSTEN, P. J. H. RADEMAKERS, E. BONGCAM-RUDLOFF, E. J. J. VAN ZOELEN, AND S. MOSSELMAN. Molecular cloning and functional characterization of the human platelet-derived growth factor a receptor gene promoter. Oncogene 10: 1667–1672, 1995.
- ÅHLE´ N, K., AND K. RUBIN. Platelet-derived growth factor-BB stimulates synthesis of the integrin a2-subunit in human diploid fibroblasts. Exp. Cell Res. 215: 347–353, 1994.
- ALEXOPOULOS, E., D. SERON, R. B. HARTLEY, AND J. S. CAMERON. Lupus nephritis: correlation of interstitial cells with glomerular function. Kidney Int. 37: 100–109, 1990.
- ALMAN, B. A., D. A. GREEL, L. K. RUBY, M. J. GOLDBERG, AND H. J. WOLFE. Regulation of proliferation and platelet-derived growth factor expression in palmar fibromatosis (Dupuytren contracture) by mechanical strain. J. Orthop. Res. 14: 722–728, 1996.
- ALMAN, B. A., S. P. NABER, R. M. TEREK, W. A. JIRANEK, M. J. GOLDBERG, AND H. J. WOLFE. Platelet-derived growth factor in fibrous musculoskeletal disorders: a study of pathologic tissue sections and in vitro primary cell cultures. J. Orthop. Res. 13: 67–77, 1995.
- Bukovsky A, Svetlikova M, Caudle MR. Oogenesis in cultures derived from adult human ovaries. Reprod Biol Endocrinol. 2005;3:17
- ALPERS, C. E., C. L. DAVIS, D. BARR, C. L. MARSH, AND K. L. HUDKINS. Identification of platelet-derived growth factor A and B chains in human renal vascular rejection. Am. J. Pathol. 148: 439–451, 1996.
- ALPERS, C. E., R. A. SEIFERT, K. L. HUDKINS, R. J. JOHNSON, AND D. F. BOWEN-POPE. Developmental patterns of PDGF Bchain, PDGF-receptor, and a-actin expression in human glomerulogenesis. Kidney Int. 42: 390–399, 1992.
- ANDERSSON, M., A. O¨ STMAN, G. BA¨ CKSTRO¨ M, U. HELLMAN, C. GEORGE-NASCIMENTO, B. WESTERMARK, AND C.-H. HELDIN. Assignment of interchain disulfide bonds in platelet-derived growth factor (PDGF) and evidence for agonist activity of monomeric PDGF. J. Biol. Chem. 267: 11260–11266, 1992. 1
- ANDERSSON, M., A. O¨ STMAN, J. KREYSING, G. BA¨ CKSTRO¨ M, M. VAN DE POLL, AND C.-H. HELDIN. Involvement of loop 2 of platelet-derived growth factor-AA and -BB in receptor binding. Growth Factors 12: 159–164, 1995.
- ANDERSSON, M., A. O¨ STMAN, B. WESTERMARK, AND C.-H. HELDIN. Characterization of the retention motif in the C-terminal part of the long splice form of platelet-derived growth factor A-chain. J. Biol. Chem. 269: 926–930, 1994.
- ANDREW, J. G., J. A. HOYLAND, A. J. FREEMONT, AND D. R. MARSH. Platelet-derived growth factor expression in normally healing human fractures. Bone 16: 455–460, 1995.
- ANSEL, J. C., J. P. TIESMAN, J. E. OLERUD, J. G. KRUEGER, J. F. KRANE, D. C. TARA, G. D. SHIPLEY, D. GILBERTSON, M. L. USUI, AND C. E. HART. Human keratinocytes are a major source of cutaneous platelet-derived growth factor. J. Clin. Invest. 92: 671– 678, 1993.
- Boyum A. Isolation of mononuclear cells and granulocytes from human blood. Isolation of monuclear cells by one centrifugation, and of granulocytes by combining centrifugation and sedimentation at 1 g. Scand J Clin Lab Invest Suppl. 1968;97:77–89. [
- ANTONIADES, H. N., M. A. BRAVO, R. E. AVILA, T. GALANOPOULOS, J. NEVILLE-GOLDEN, M. MAXWELL, AND M. SELMAN. Platelet-derived growth factor in idiopathic pulmonary fibrosis. J. Clin. Invest. 86: 1055–1064, 1990
- ANTONIADES, H. N., T. GALANOPOULOS, J. NEVILLE-GOLDEN, C. P. KIRITSY, AND S. E. LYNCH. Injury induces in vivo expression of platelet-derived growth factor (PDGF) and PDGF receptor mRNAs in skin epithelial cells and PDGF mRNA in connective tissue fibroblasts. Proc. Natl. Acad. Sci. USA 88: 565–569, 1991.
- ANTONIADES, H. N., C. D. SCHER, AND C. D. STILES. Purification of human platelet-derived growth factor. Proc. Natl. Acad. Sci. USA 76: 1809–1812, 1979.
- ASSOIAN, R. K. Anchorage-dependent cell cycle progression. J. Cell Biol. 136: 1–4, 1997.
- ATALIOTIS, P., AND M. MERCOLA. Distribution and functions of platelet-derived growth factors and their receptors during embryogenesis. Int. Rev. Cytol. 172: 95–127, 1997.
- ATALIOTIS, P., K. SYMES, M. M. CHOU, L. HO, AND M. MERCOLA. PDGF signalling is required for gastrulation of Xenopus laevis. Development 121: 3099–3110, 1995.
- AUBERT, J.-D., P. D. PARE´ , J. C. HOGG, AND S. HAYASHI. Plateletderived growth factor in bronchiolitis obliterans-organizing pneumonia. Am. J. Respir. Crit. Care Med. 155: 676–681, 1997.
- BALLAGI, A. E., A. ISHIZAKI, J.-O. NEHLIN, AND K. FUNA. Isolation and characterization of the mouse PDGF b-receptor promoter. Biochem. Biophys. Res. Commun. 210: 165–173, 1995.
- BANAI, S., Y. WOLF, G. GOLOMB, A. PEARLE, J. WALTENBERGER, I. FISHBEIN, A. SCHNEIDER, A. GAZIT, L. PEREZ, R. HUBER, G. LAZAROVICHI, L. RABINOVICH, A. LEVITZKI, AND S. D. GERTZ. PDGF-receptor tyrosine kinase blocker AG1295 selectively attenuates smooth muscle cell growth in vitro and reduces neointimal formation after balloon angioplasty in swine. Circulation 97: 1960–1969, 1998.
- BAR, R. S., M. BOES, B. A. BOOTH, B. L. DAKE, S. HENLEY, AND M. N. HART. The effects of platelet-derived growth factor in cultured microvessel endothelial cells. Endocrinology 124: 1841–1848, 1989.
- BARLEON, B., F. TOTZKE, C. HERZOG, S. BLANKE, E. KREMMER, G. SIEMEISTER, D. MARME´ , AND G. MARTINY-BARON. Mapping of the sites for ligand binding and receptor dimerization at the extracellular domain of the vascular endothelial growth factor receptor FLT-1. J. Biol. Chem. 272: 10382–10388, 1997.
- BARNHILL, R. L., M. XIAO, D. GRAVES, AND H. N. ANTONIADES. Expression of platelet-derived growth factor (PDGF)-A, PDGF-B and the PDGF-alpha receptor, but not the PDGF-beta receptor, in human malignant melanoma in vivo. Br. J. Dermatol. 135: 898–904, 1996.
- Martin C. Robson, Derek A. Dubay, Xue Wang, Michael G. Franz: Effect of cytokine growth factors on the prevention of acute wound failure. Wound Repair Regeneration 2004;12,1:38-43
- Hesham El-Sharkawy et al: Platelet-Rich Plasma: growth factors and pro- and anti-inflammatory properties. J Periodont 2007;78,4:661-669
- A. K. Gupta and J. L. Carviel. (2017) Meta-analysis of efficacy of platelet-rich plasma therapy for androgenetic alopecia. Journal of Dermatological Treatment 28:1, 55-58.
- F. Mussano, T. Genova, L. Munaron, S. Petrillo, F. Erovigni and S. Carossa. (2016) Cytokine, chemokine, and growth factor profile of platelet-rich plasma. Platelets 27:5, 467-471.
- Lorenzo G. Segabinazzi, Aime M. Friso, Sebastian B. Correal, André M. Crespilho, José Antonio Dell’Aqua, Jordi Miró, Frederico O. Papaand Marco Antonio Alvarenga. (2017) Uterine clinical findings, fertility rate, leucocyte migration, and COX-2 protein levels in the endometrial tissue of susceptible mares treated with platelet-rich plasma before and after AI. Theriogenology 104, 120-126.
- Kostis I. Nikolopoulos, Vasilios Pergialiotis, Despina Perrea and Stergios K. Doumouchtsis. (2016) Restoration of the pubourethral ligament with platelet rich plasma for the treatment of stress urinary incontinence. Medical Hypotheses 90, 29-31.
Online publication date: 1-May-2016. - E.L. Chrysanthopoulou, V. Pergialiotis, D. Perrea, S. Κourkoulis, C. Verikokos and S.K. Doumouchtsis. (2017) Platelet rich plasma as a minimally invasive approach to uterine prolapse. Medical. Hypotheses 104, 97-100.
- Elham A. Masoudi, João Ribas, Gaurav Kaushik, Jeroen Leijten and Ali Khademhosseini. (2016) Platelet-Rich Blood Derivatives for Stem Cell-Based Tissue Engineering and Regeneration. Current Stem Cell Reports 2:1, 33-42.
- Katsimpardi L, Litterman NK, Schein PA, Miller CM, Loffredo FS, Wojtkiewicz GR, et al. Vascular and neurogenic rejuvenation of the aging mouse brain by young systemic factors. Science. 2014;344:630–4. doi: 10.1126/science.1251141.
- Gougeon A. Is neo-oogenesis in the adult ovary, a realistic paradigm? Gynecol Obstet Fertil. 2010;38:398–401. doi: 10.1016/j.gyobfe.2010.04.013
- Antonin Bukovsky Novel methods of treating ovarian infertility in older and POF women, testicular infertility, and other human functional diseases. Reprod Biol Endocrinol. 2015; 13: 10.
- Novel methods of treating ovarian infertility in older and POF women, testicular infertility, and other human functional diseases. Reproductive Biology and Endocrinology 2015; 13()