Ultimo aggiornamento 2022-05-06 13:29:15
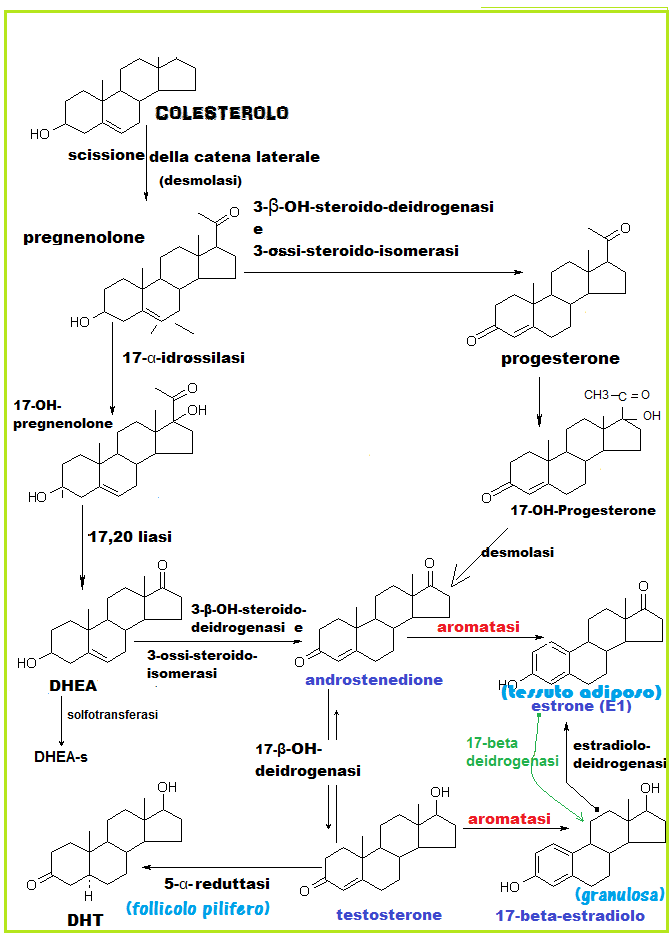
L’aromatasi o citocromo P450-19A è l’enzima che interviene nella trasformazione dell’androstenedione in estrone e del testosterone in 17-β-estradiolo (1). Infatti il nome deriva dalla sua attività biochimica che consiste nell’aromatizzazione dell’anello A mediante l’ossidazione di un gruppo metilico. L’aromatasi è presente soprattutto a livello gonadico ma lo si ritrova anche nel fegato, muscoli, cute, tessuto adiposo e a livello encefalico dove svolge un’azione antidepressiva in simbiosi con la dopamina ed, ancora insieme alla DA, un ruolo importante nella regolazione del desiderio sessuale (26-31). Il gene relativo (CYP19) è localizzato sul cromosoma 15q21.1 (1).
Polimorfismi dell’aromatasi: Il gene che codifica l’aromatasi (CYP19) è localizzato sul cromosoma 15q21.1. Sono noti vari polimorfismi di CYP19 coinvolti nella regolazione dell’attività dell’aromatasi attraverso la stabilizzazione dell’mRNA, l’aumento della trascrizione o la regolazione post-traduzionale dell’espressione. Tra questi vi è un polimorfismo C>T, localizzato a livello della regione 3’ non tradotta (1672 C→T). Alcuni studi hanno dimostrato che l’allele C è associato con una scarsa soppressione pituitaria durante la stimolazione ovarica. I pazienti con genotipo CC necessitano un numero di giorni maggiore per ottenere una soppressione pituitaria, rispetto ai pazienti con genotipo TT.
Il polimorfismo 1558 C>T produce un’iperattività dell’enzima con conseguente iperproduzione di estradiolo ed estrone ed aumentato rischio di ginecomastia e ca. endometriale e mammario (22-24).
Il deficit di aromatasi è una rara malattia, trasmessa come carattere autosomico recessivo. Nelle donne adulte, la sintomatologia clinica comprende ritardo puberale, ipoplasia mammaria e amenorrea primaria, con ovaio policistico. Durante la gravidanza, gli androgeni fetali non si convertono in estrogeni a causa del deficit dell’aromatasi placentare. Quindi si assiste ad un aumento dei livelli di testosterone nel plasma materno e una riduzione dei livelli di estrogeni. Di conseguenza, le donne gravide mostrano irsutismo, che si risolve spontaneamente dopo il parto. Alla nascita le neonate presentano pseudoermafroditismo da virilizzazione dei genitali esterni che si manifesta soprattutto con ipertrofia clitoridea.
Il deficit dell’aromatasi è un tratto distintivo del corredo endocrinologico delle pazienti PCOS e pazienti amenorroiche con anovulazione.
Inibitori dell’aromatasi (AI): Si suddividono in due gruppi: di tipo steroideo (AIS) e non steroideo. Gli inibitori steroidei si suddividono in irreversibili (AIS tipo I) e reversibili (AIS tipo II). Gli inibitori irreversibiliI si legano con legame covalente all’aromatasi producendo inattivazione enzimatica; gli inibitori steroidei reversibili si legano in modo reversibile all’aromatasi attraverso l’interazione di un eteroatomo. Gli inibitori dell’aromatasi di terza generazione (letrozolo, anastrazolo) sono tutti del tipo irreversibile. Gli AI vengono impiegati nel trattamento del carcinoma della mammella e delle ovaie nelle donne in menopausa, terapia dell’endometriosi e nella stimolazione ovarica controllata (COH).
a) terapia antiblastica: contrariamente alle donne in età fertile, nelle quali la maggior parte degli estrogeni è prodotta dalle ovaie, nelle donne in menopausa, in seguito alla cessazione dell’attività ovarica, la sintesi degli estrogeni è legata all’attività dell’aromatasi che converte l’androstenedione di origine surrenalica in estrone. Pertanto bloccando l’azione di questo enzima è possibile ridurre drasticamente i livelli di estrogeni con conseguente beneficio nel trattamento dei tumori correlati alla presenza di ormoni sessuali (2-5). Un’espressione anomala di aromatasi da parte dei fibroblasti è stata osservata nei Ca mammari e Ca endometriali, nei quali si è osservato un aumento della concentrazione locale di estrogeni (fino a 20 volte rispetto ai valori plasmatici) che promuovono appunto la crescita ormono-dipendente di queste lesioni (3-7).
Con obesità e età aumenta la conversione, catalizzata dall’aromatasi, dell’androstenedione in estrone, questa è una relazione molto importante per l’aumentata incidenza del Ca. dell’endometrio in donne obese e anziane.
Ci sono anche evidenze del ruolo che hanno gli estrogeni nella promozione del tumore alla mammella, è stata dimostrata una maggiore attività dell’aromatasi nel parenchima prossimale alla lesione neoplastica ed un’attività minore nel parenchima distale (7-10).
Per questo motivo nel trattamento dei Ca della mammella, oltre agli antagonisti degli estrogeni, vengono utilizzati anche gli inibitori dell’aromatasi.È stato considerato come obiettivo principale la sopravvivenza libera da eventi (Disease Free Survival, DFS), valutato in tempi diversi che è risultato migliore con IA rispetto a tamoxifene. Studi in metanalisi hanno valutato il rischio di recidiva di cancro al seno: l’uso degli IA è associato ad una riduzione assoluta del rischio del 2,9% ad un follow up mediano di 5 anni (14-17).
b) COH (Iperstimolazione Ovarica Controllata): le ovaie delle pazienti poor responders resistenti alla stimolazione con clomifene e/o gonadotropine possono essere responsive a cicli di stimolazione con HMG e inibitori dell’aromatasi. Il trattamento con inibitori di aromatasi di terza generazione come il letrozolo (Femara® cpr 2.5 mg) o l’anastrazolo (Arimidex® cpr 1 mg) o exemestane (Aromasin® cpr 25 mg), produce una riduzione della concentrazione plasmatica di estrogeni conseguente alla ridotta aromatizzazione degli androgeni a livello della granulosa. Viene a mancare Il feedback negativo estrogenico sulla secrezione gonadotropinica ipofisaria con iperattivazione della stessa come per il clomifene; ma, a differenza del clomifene, non si osserva l’intensa deplezione dei recettori estrogenici tipica della terapia con clomifene. Si viene a mimare un microambiente endocrino molto simile alle donne PCOS che notoriamente sono iperresponsive alla stimolazione ovarica.
c) terapia dell’endometriosi: recentemente gli inibitori dell’aromatasi sono stati proposti per il trattamento  dell’endometriosi. È stato suggerito che gli inibitori dell’aromatasi non solo riducono la sintomatologia algica, ma eradicano anche la malattia. Pertanto, tali farmaci potrebbero essere utilizzati o come alternativa alla chirurgia o come mezzo per la prevenzione di recidive nel post-operatorio. Precedenti studi hanno dimostrato che basse dosi di noretisterone acetato (Primolut-Nor® cpr 10 mg) alleviano la sintomatologia dolorosa nelle donne affette da endometriosi a livello retto-vaginale. Il vantaggio teorico di aggiungere gli inibitori dell’aromatasi al progestinico era rappresentato dalla speranza di “curare” la malattia oltre ad alleviare la sintomatologia dolorosa (19).
dell’endometriosi. È stato suggerito che gli inibitori dell’aromatasi non solo riducono la sintomatologia algica, ma eradicano anche la malattia. Pertanto, tali farmaci potrebbero essere utilizzati o come alternativa alla chirurgia o come mezzo per la prevenzione di recidive nel post-operatorio. Precedenti studi hanno dimostrato che basse dosi di noretisterone acetato (Primolut-Nor® cpr 10 mg) alleviano la sintomatologia dolorosa nelle donne affette da endometriosi a livello retto-vaginale. Il vantaggio teorico di aggiungere gli inibitori dell’aromatasi al progestinico era rappresentato dalla speranza di “curare” la malattia oltre ad alleviare la sintomatologia dolorosa (19).
La terapia non ha causato modificazioni conseguenze avverse sull’emocromo, markers di funzionalità epatica, funzionalità renale. Terapie effettuate per lunghi periodi hanno evidenziato elevazione della colesterolemia. Non vi sono state variazioni significative della densità minerale ossea sia a livello delle vertebre del rachide lombare che a livello del femore. Le pazienti hanno avuto i seguenti effetti collaterali: aumento di peso, sbalzi d’umore, astenia, dolore osseo e articolare, spotting vaginale, mialgie, cefalea, depressione, vampate di calore e nausea.
d) Virilità e libido nel maschio: bloccando l’aromatasi è possibile incrementare i livelli di testosterone attraverso tre meccanismi:
- il testosterone non viene convertito in estrogeni per il blocco dell’attività dell’aromatasi, che in vecchiaia risulta aumentata, e pertanto una maggiore quantità di testosterone rimane in circolo, Gli estrogeni in circolo favoriscono aumentata secrezione di SHBG, obesità e calo della libido. La somministrazione di testosterone non solo non risolve il problema, ma può aggravarlo in presenza di aromatasi perchè il risultato finale sarà un eccesso di produzione di estrone. La terapia con AI è la soluzione ottimale per ottenere un adeguato livello sierico di testosterone nelle persone anziane.
- ipersecrezione LH: la ridotta presenza di estrogeni viene interpretata dall’asse HPTA come mancanza di testosterone, di conseguenza aumenta il rilascio di LH che promuove la produzione di nuovo testosterone (9-13).
Gli inibitori dell’aromatasi sono molto diffusi nel mondo vegetale e appartengono soprattutto al  gruppo dei flavonoidi: quercitina (nella mela), apigenina (nel
gruppo dei flavonoidi: quercitina (nella mela), apigenina (nel  prezzemolo, sedano, carciofo, camomilla e basilico), narigenina (nella parte bianca degli agrumi), resveratrolo (nella buccia e semi dell’uva), oleuropeina (olive), naringina (nel pompelmo), risina (polline, miele, passiflora). Anche l’indolo-3-ilmetano, DIM, presente soprattutto nelle crocifere (broccoli, cavoli, verze, ecc.) ha un’ottima e sperimentata azione antiestrogenica (20). Gli inibitori dell’aromatasi sono anche presenti nel melograno, nei funghi champignon bianchi e nel tè. Una certa attività antiaromatasi è stata dimostrata anche per la melatonina (21). Lo zinco è un inibitore naturale dell’aromatasi; la dose quotidiana suggerita è di 30-90 mg/die. I flavoni della soia invece hanno un’azione antiestrogenica diretta senza agire sull’aromatasi.
prezzemolo, sedano, carciofo, camomilla e basilico), narigenina (nella parte bianca degli agrumi), resveratrolo (nella buccia e semi dell’uva), oleuropeina (olive), naringina (nel pompelmo), risina (polline, miele, passiflora). Anche l’indolo-3-ilmetano, DIM, presente soprattutto nelle crocifere (broccoli, cavoli, verze, ecc.) ha un’ottima e sperimentata azione antiestrogenica (20). Gli inibitori dell’aromatasi sono anche presenti nel melograno, nei funghi champignon bianchi e nel tè. Una certa attività antiaromatasi è stata dimostrata anche per la melatonina (21). Lo zinco è un inibitore naturale dell’aromatasi; la dose quotidiana suggerita è di 30-90 mg/die. I flavoni della soia invece hanno un’azione antiestrogenica diretta senza agire sull’aromatasi.
Effetti collaterali deli inibitori: IA sintetici possono causare una diminuzione della densità minerale ossea, osteoporosi e muscolo-scheletrici, effetti tutti dovuti alla deprivazione estrogenica (31-33).
DOPING: A causa di potenziali effetti sul testosterone ed a causa dell’utilizzo come coadiuvanti nei cicli con steroidi il comitato olimpico ha inserito nella lista delle sostanze considerate dopanti anche gli inibitori dell’aromatasi. Queste sostanze vengono utilizzate dalle atlete insieme agli androgeni per ridurre l’aromatizzazione degli steroidi stessi oppure nelle fasi successive al ciclo per ripristinare la funzionalità gonadica.
References:
- Faglia G, Beck-Peccoz P. Malattie del sistema endocrino e del metabolismo (4 ed). Mc Graw-Hill Italia, Milano 2006
- ATAC Trialists’ Group. Lancet 2005; 365: 60-2.
- Cuzick J et al. Lancet Oncol 2010; 11: 1135–41.
- The BIG 1-98 Collaborative Group. N Engl J Med 2009; 361: 766-76.
- The Arimidex, Tamoxifen, Alone or in Combination (ATAC) Trialists’ Group. Lancet Oncol 2008; 9: 45-53.
- American Society of Clinical Oncology Clinical Practice Guideline: Update on Adjuvant Endocrine Therapy for Women With Hormone Receptor–Positive Breast Cancer. J Clin Oncol 2010; 28: 3784-96.
- Colleoni M et al. J Clin Oncol 2011; 20; 29: 1117-24.
- National Comprehensive Cancer Network (NCCN). Breast cancer. Version 2.2011. www.nccn.org (accesso del 9.09.2011).
- Linee Guida AIOM: Neoplasia della mammella 2010. www.aiom.it/(accesso del 19.09.2011).
- ESMO 2011.Primary breast cancer: ESMO Clinical Practice Guidelines for diagnosis, treatment and follow-up. http://annonc.oxfordjournals.org/content/22/suppl_6/vi12.full.pdf+html (accesso
- del 19.09.2011).
- NICE 2009. Early and locally advanced breast cancer: diagnosis and treatment.www.nice.org/ (accesso del 19.09.2011).
- Gnant M. St. Gallen 2011: summary of the consensud discussion. Breast Care 2011; 6: 136-41.
- The ATAC (Arimidex, Tamoxifen Alone or in Combination) Trialists’ Group. Lancet 2002; 359; 2131-39.
- The Breast International Group (BIG) 1-98 Collaborative Group. N Engl J Med 2005; 353: 2747-57.
- Ring A et al. Cancer Res 2010; 70: 403s– 404s.
- Crivellari D et al. J Clin Oncol 2008; 26: 1972-9.
- Dowsett et al. J Clin Oncol 2010; 28: 509-18.
- Remorgida V, Abbamonte HL, Ragni N, Fulcheri E, Ferrero S. Letrozole and norethisterone acetate in rectovaginal endometriosis. Fertil Steril 2007;88:724-6.
- Indole 3 Carbinol – the safer, natural Tamoxifen? www.canceractive.com/cancer-active-page-link.aspx?n=1417.
- Martínez-Campa C et al, Melatonin inhibits aromatase promoter expression by regulating cyclooxygenases expression and activity in breast cancer cells. Br J Cancer. 2009 Nov 3;101(9):1613-9.
- Reich O, Regauer S., Tempfer C, Schneeberger C, Huber: Polymorphism 1558 C > T in the aromatase gene (CYP19A1) in low-grade endometrial stromal sarcoma. J.Eur J Gynaecol Oncol. 2011;32(6):626-7.
- Izabella Czajka-Oraniec, Wojciech Zgliczynski, Alina Kurylowicz, Michal Mikula and Jerzy Ostrowski: “Association between gynecomastia and aromatase (CYP19) polymorphisms”. European Journal of Endocrinology (2008) 158 721–727
- Michael N Okobia et al: “Simple tandem repeat (TTTA) n polymorphism in CYP19 (aromatase) gene and breast cancer risk in Nigerian women”. J Carcinog 2006,5:12
- Balthazart J, Foidart A. Brain aromatase and the control of male sexual behavior. J Steroid Biochem Mol Biol. 1993 Mar; 44(4-6):521-40.
- Baillien M, Balthazart J. A direct dopaminergic control of aromatase activity in the quail preoptic area. J Steroid Biochem Mol Biol. 1997 Sep-Oct; 63(1-3):99-113.
- Balthazart J, Baillien M, Ball GF. Interactions between aromatase (estrogen synthase) and dopamine in the control of male sexual behavior in quail. Comp Biochem Physiol B Biochem Mol Biol. 2002 May;132(1):37-55.
- Cornil CA et al. Rapid decreases in preoptic aromatase activity and brain monoamine concentrations after engaging in male sexual behavior. Endocrinology. 2005 Sep; 146(9):3809-20.
- Absil P et al. Distribution of DARPP-32 immunoreactive structures in the quail brain: anatomical relationship with dopamine and aromatase. J Chem Neuroanat. 2001 Jan;21(1):23-39.
- Schlinger BA, Callard GV. Aromatization mediates aggressive behavior in quail. Gen Comp Endocrinol. 1990 Jul; 79(1):39-53.
-
Lonning PE. Int.. J. Gynecol. Cancer. 2006; 16 (Suppl. 2):. 518[58] Jelovac D, L Macedo, Goloubeva OG, Handratta V, Brodie AM. Cancer Res.. 2005; 65 : 5439.
-
Marcom PK, Isaacs C, Harris L, Wong ZW, Kommarreddy A, Novielli N, Mann G, Tao Y, Ellis MJ.Breast Cancer Res.. Trattare. 2007; 102 : 43.
-
Leary A, Dowsett M. fr. J. Cancer. 2006; 95 :. 661 (31-33).


1 commento
Please let me know if you’re looking for a author for your weblog.
You have some really good posts and I feel I would be a good asset.
If you ever want to take some of the load off, I’d love to write some articles for your blog in exchange for a link back
to mine. Please send me an email if interested.
Thank you!