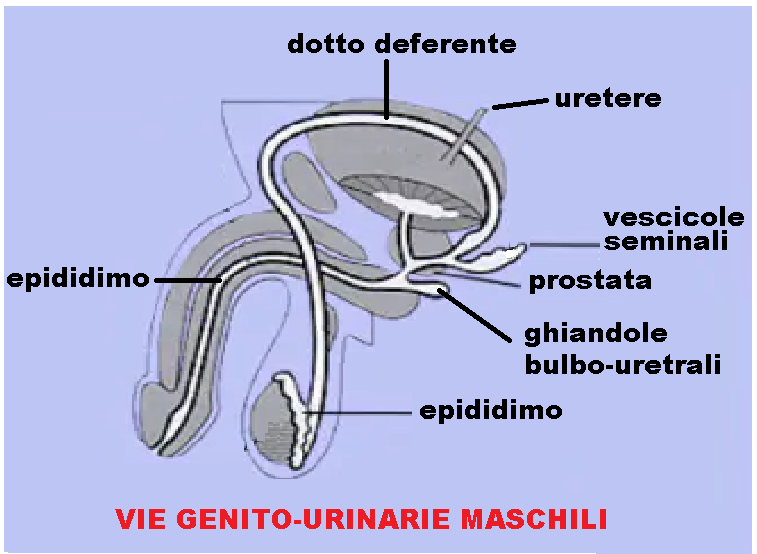
La spermiocoltura è l’esame diagnostico di laboratorio che consente l’individuazione di microrganismi patogeni nel liquido seminale. Essa è utile per individuare le infezioni a carico delle vie genito-urinarie: prostata, vescicole seminali, epididimo e uretra. L’esame diagnostico consigliato, per la ricerca di agenti patogeni nell’uretra, è il tampone uretrale.
La spermiocoltura è particolarmente utile quando si sta analizzando il seme per l’uso nella fecondazione in vitro o nell’inseminazione intrauterina. Numerosi studi hanno dimostrato che le infezioni del tratto genito-urinario maschile rappresentano fino al 15% dei casi di infertilità maschile.
Un’infezione del tratto genitale maschile può provocare sterilità sia per azione diretta sugli spermatozoi (riduzione della motilità per effetto dell’adesività batterica o per azione di sostanze spermiotossiche) che attraverso vari meccanismi indiretti.
Prima di raccogliere lo sperma, il paziente deve urinare per allontanare i batteri eventualmente presenti nell’uretra, dopodiché deve lavarsi le mani ed il pene con sapone, e sciacquare via ogni traccia di sapone ed asciugarsi con un asciugamano pulito. Il contenitore per il liquido seminale deve essere sterile, ed il tempo intercorrente tra raccolta e l’inizio dell’analisi al laboratorio di microbiologia non deve superare le tre ore (19). Evitare l’assunzione di antibiotici nei 10 giorni precedenti la raccolta.
Diversi campioni di 0,1 ml del liquido seminale vengono inoculati in altrettanti brodi di coltura adatti per i germi patogeni più frequentemente responsabili delle infezioni delle vie urinarie. Le piastre vengono conservate per 24 ore in termostato a 37 °C per 2-3 giorni per osservare l’eventuale crescita di colonie batteriche.
Falsi negativi – Alcune volte i risultati sono falsamente negativi (mancata crescita di colonie batteriche) nonostante la presenza di batteri nel liquido seminale e ciò avviene in quanto nel seme maschile sono presenti alcune sostanze che in determinate circostanze possono impedire la crescita batterica in laboratorio..
I principali agenti patogeni sono:
- Neisseria gonorrhoeae – Dopo un breve periodo di incubazione, 4-5 giorni, più dell’80% dei maschi presenta i sintomi dell’infezione primaria. Le uretriti gonococciche acute sono caratterizzate da abbondante essudato cremoso giallastro: nelle forme croniche l’essudato è meno tipico ed abbondante (15).
- Chlamydia trachomatis – è causa di malattie gravi sia per gli scarsi sintomi, sia per le cicatrizzazioni che provoca e che comportano importanti sequele specie per la fertilità. Essa è responsabile di oltre il 50% delle uretriti non gonococciche e di gran parte di quelle post-gonococciche. L’uretrite da Chlamydia può complicarsi con orchi-epididimite, prostatite, vescicolite, tutte causa di anomalie nella produzione, nella funzione e nel trasporto degli spermatozoi, che possono anche comportarsi come veicolo dell’infezione. L’esame viene eseguito su tampone uretrale (16-20).
- Ureaplasma urealyticum – è un batterio appartenente alla famiglia dei micoplasmi, che può causare infezioni soprattutto a livello delle mucose corporee, prediligendo in particolar modo quelle genitali; provoca prostatiti, epididimiti e uretriti e conseguenti alterazioni della motilità spermatozoaria.
La caratteristica di questo particolare battere è quella di metabolizzare l’urea con formazione di ammoniaca (21-23). - Mycoplasmi – Nell’uomo possono determinare uretriti, prostatiti e prostato-vescicoliti subacute, spesso accompagnate da emospermia; sono stati anche descritti casi di epididimiti e balaniti. Tra gli agenti infettivi i Mycoplasmi sono al primo posto come causa di infertilità maschile (24-27). I micoplasmi sono sensibili alle tetracicline e, in caso di resistenza, una terapia alternativa è costituita dall’azitromicina.
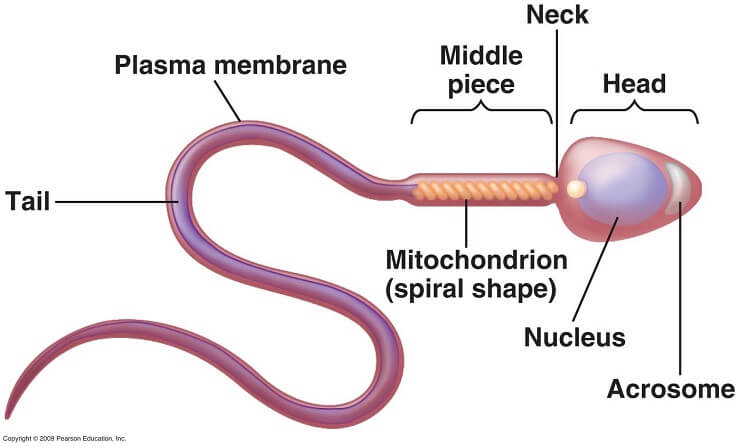
- Escherichia Coli – L’Escherichia coli esercita causa alterazioni ultrastrutturali sugli spz e conseguente compromissione della funzione acrosomiale e della motilità. La valutazione al microscopio elettronico ha rivelato alterazioni multiple e profonde nell’ultrastruttura degli spermatozoi come difetti della membrana e vacuoli citoplasmatici quasi esclusivamente (>90%) negli spermatozoi infetti Le alterazioni morfologiche hanno coinvolto tutte le strutture superficiali degli spermatozoi, in particolare la membrana plasmatica del mid-piece e del collo, nonché la membrana interna ed esterna dell’acrosoma (28-30).
- Trichomonas vaginalis – Colonizza l’uretra, la prostata, le vescicole seminali, l’epididimo ed i testicoli. Spesso si è portatori asintomatici del l’infezione con una modesta uretrite che normalmente non induce il paziente ad un controllo medico.
- Papilloma virus umano (HPV) – L’infezione genitale da Papilloma virus umano si trasmette essenzialmente attraverso i rapporti sessuali: è infatti una delle più frequenti malattie sessualmente trasmesse. Gli uomini con infezione sub-clinica rappresentano un serbatoio di riserva per reinfezioni successive alla terapia. Non è più ritenuto valido il cytobrush endouretrale. Il virus va ricercato nel liquido seminale effettuando un normale striscio osservato al MO e successivamente mediante PCR (Polymerase Chain Reaction) e ISH (in situ hybridization) indicata con il termine di PCR-ISH che è in grado di combinare l’estrema sensibilità della PCR con la capacità di localizzazione topografica dell’ibridazione in situ (31,32).
Bibliografia:
- World Health Organization. WHO Laboratory Manual for the Examination and Processing of Human Semen. 5th ed. Geneva, Switzerland: World Health Organization; 2010.
- Krause W. Male accessory gland infection. Andrologia. 2008;40:113–6.
- S, Fulcoli V, Weir JM, Pisanti F, Servello C, Destito A. Bacterial prostatitis: urine and spermatic fluid culture. Arch Ital Urol Androl. 2000 Apr;72(1):21-3.
- Moses Nnaemeka Alo: Semen Culture: A Comparative Analysis between Solid Media and Liquid Media Supplementation. OSR Journal of Pharmacy and Biological Sciences 5(5):67-72 · January 2013
- Pellati D, Mylonakis I, Bertoloni G, Fiore C, Andrisani A, Ambrosini G, et al. Genital tract infections and infertility. Eur J Obstet Gynecol Reprod Biol. 2008;140:3–11.
- Wolff H. The biologic significance of white blood cells in semen. Fertil Steril. 1995;63:1143–57.
- Esfandiari N, Saleh RA, Abdoos M, Rouzrokh A, Nazemian Z. Positive bacterial culture of semen from infertile men with asymptomatic leukocytospermia. Int J Fertil Womens Med. 2002;47:265–70.
- Kiessling AA, Desmarais BM, Yin HZ, Loverde J, Eyre RC. Detection and identification of bacterial DNA in semen. Fertil Steril. 2008;90:1744–56.
- Chen L, Yu SL, Rajesh H. Is semen polymorphonuclear leucocytes count a good predictor of male genital tract infection? Singapore Med J. 2013;54:328–31.
- Vilvanathan S, Kandasamy B, Jayachandran AL, Sathiyanarayanan S, Tanjore Singaravelu V, Krishnamurthy V, et al. Bacteriospermia and its impact on basic semen parameters among infertile men. Interdiscip Perspect Infect Dis 2016. 2016:2614692
- Moretti E, Capitani S, Figura N, Pammolli A, Federico MG, Giannerini V, et al. The presence of bacteria species in semen and sperm quality. J Assist Reprod Genet. 2009;26:47–56.
- Keck C, Gerber-Schäfer C, Clad A, Wilhelm C, Breckwoldt M. Seminal tract infections: Impact on male fertility and treatment options. Hum Reprod Update. 1998;4:891–903.
- Jarow JP, Kirkland JA, Jr, Assimos DG. Association of antisperm antibodies with chronic nonbacterial prostatitis. Urology. 1990;36:154–6.
- Esfandiari N, Saleh RA, Abdoos M, Rouzrokh A, Nazemian Z. Positive bacterial culture of semen from infertile men with asymptomatic leukocytospermia. Int J Fertil Womens Med. 2002;47:265–70.
- Centers for Disease Control and Prevention (CDC). Sexually transmitted diseases treatment guidelines. Ann Emerg Med. 2011;58:67–8.
- Pajovic B, Radojevic N, Vukovic M, Stjepcevic A. Semen analysis before and after antibiotic treatment of asymptomatic Chlamydia– and Ureaplasma-related pyospermia. Andrologia. 2013;45:266–71.
- Pajovic B, Radojevic N, Vukovic M, Stjepcevic A. Semen analysis before and after antibiotic treatment of asymptomatic Chlamydia– and Ureaplasma-related pyospermia. Andrologia. 2013;45:266–71.
- Manavi K, McMillan A, Young H. Genital infection in male partners of women with chlamydial infection. Int J STD AIDS. 2006;17:34–6.
- Hosseinzadeh S, Pacey AA, Eley A. Chlamydia trachomatis-induced death of human spermatozoa is caused primarily by lipopolysaccharide. J Med Microbiol. 2003;52(Pt 3):193–200.
- Idahl A, Abramsson L, Kumlin U, Liljeqvist JA, Olofsson JI. Male serum Chlamydia trachomatis IgA and IgG, but not heat shock protein 60 IgG, correlates with negatively affected semen characteristics and lower pregnancy rates in the infertile couple. Int J Androl. 2007;30:99–107.
- Montagut JM, Leprêtre S, Degoy J, Rousseau M. Ureaplasma in semen and IVF. Hum Reprod. 1991;6:727–9.
- de Jong Z, Pontonnier F, Plante P, Perie N, Talazac N, Mansat A, et al. Comparison of the incidence of Ureaplasma urealyticum in infertile men and in donors of semen. Eur Urol. 1990;18:127–31.
- Xu C, Sun GF, Zhu YF, Wang YF. The correlation of Ureaplasma urealyticum infection with infertility. Andrologia. 1997;29:219–26.
- Díaz-García FJ, Herrera-Mendoza AP, Giono-Cerezo S, Guerra-Infante FM. Mycoplasma hominis attaches to and locates intracellularly in human spermatozoa. Hum Reprod. 2006;21:1591–8.
- Talebi M. Asymptomatic infection with Mycoplasma hominis negatively affects semen parameters and leads to male infertility as confirmed by improved semen parameters after antibiotic treatment. Urology. 2017;100:97–102.
- World Health Organization. Global Incidence and Prevalence of Selected Curable Sexually Transmitted Infections. 2008. [Last accessed on 2017 Apr 21, Last accessed: 21 April 2017]. Available from: http://www.who.int/reproductivehealth/publications/rtis/stisestimates/en .
- Jensen JS. Mycoplasma genitalium: The aetiological agent of urethritis and other sexually transmitted diseases. J Eur Acad Dermatol Venereol. 2004;18:1–11.
- Diemer T, Huwe P, Michelmann HW, Mayer F, Schiefer HG, Weidner W. Escherichia coli-induced alterations of human spermatozoa. An electron microscopy analysis. Int J Androl. 2000;23:178–86.
- Schulz M, Sánchez R, Soto L, Risopatrón J, Villegas J. Effect of Escherichia coli and its soluble factors on mitochondrial membrane potential, phosphatidylserine translocation, viability, and motility of human spermatozoa. Fertil Steril. 2010;94:619–23.
- T. Diemer, P. Huwe, EW Hauck, W Weidner: Urogenital infection and sperm motility. Andrologia 2002;35,5:283-287
- de Villiers EM, Fauquet C, Broker TR, Bernard HU, zur Hausen H (Jun 2004). “Classification of papillomaviruses”. Virology 324 (1): 17–27.
- LOUISE T. CHOW, THOMAS R. BROKER and BETTIE M. STEINBERG: “The natural history of human papillomavirus infections of the mucosal epithelia”. Journal Compilation 2010 APMIS
- Pallett A, Hand K. Complicated urinary tract infections: Practical solutions for the treatment of multiresistant Gram-negative bacteria. J Antimicrob Chemother. 2010;65(Suppl 3):iii25–33.
- Damirayakhian MA, Perez-Pelaez M, Jeyendran RS. Antibiotic susceptibility of prostatovesicular fluid isolates. Infertility. 1987;10:95–101.
- Falk L, Fredlund H, Jensen JS. Tetracycline treatment does not eradicate Mycoplasma genitalium. Sex Transm Infect. 2003;79:318–9.
- Jernberg E, Moghaddam A, Moi H. Azithromycin and moxifloxacin for microbiological cure of Mycoplasma genitalium infection: An open study. Int J STD AIDS. 2008;19:676–9.
- Terada M, Izumi K, Ohki E, Yamagishi Y, Mikamo H. Antimicrobial efficacies of several antibiotics against uterine cervicitis caused by Mycoplasma genitalium. J Infect Chemother. 2012;18:313–7.