Ultimo aggiornamento 18/05/2020 18:22:07
“The delivery of the infant into the arms of a conscious and pain-free mother is one of the most exciting and rewarding moments in medicine”.
Storicamente, l’era dell’anestesia/analgesia in ostetricia fu inaugurata da James Young Simpson che per primo somministrò etere ad una partoriente con bacino deforme. Tale atto fu oggetto di contestazioni a sfondo etico fino al 1853, quando John Snow utilizzò cloroformio per assistere il parto della Regina Vittoria durante la nascita del suo ottavo figlio, il principe Leopold (1). In molti paesi, oggi, il ricorso generalizzato all’analgesia regionale per il travaglio e il parto è ancora poco diffuso ed oggetto di discussione. Secondo l’indagine del 2001, l’accettazione dell’analgesia epidurale raggiunge fino al 60% nei grandi centri di maternità degli Stati Uniti mentre le statistiche nazionali del 2005-2006 nel Regno Unito, riferiscono che solo il 35% delle gravide ha potuto usufruire dell’analgesia ostetrica. In Italia, l’accettazione del parto in analgesia è ancora poco diffusa e, ad eccezione di alcuni centri che eseguono un programma di analgesia durante il travaglio completo, la coscienza nazionale o l’accettazione di opzioni di antidolorifici per le donne in travaglio praticamente non esiste (2-5) nonostante che il 65% delle partorienti manifesti compliance positiva per tale tecnica (6-8).
Modificazioni funzionali indotte dalla gravidanza: conoscendo a fondo la fisiologia delle modificazioni materne in gravidanza, la biofisica degli scambi tra utero, placenta e feto, e le possibili interferenze farmacologiche, si può affermare che l’analgesia in gravidanza presenta percentuali di complicazioni accettabili (3-9).
- iperemia delle mucose per congestione capillare del tratto respiratorio (stato simil-infiammatorio), tanto da rendere spesso disagevole l’assistenza respiratoria e la intubazione tracheale,
- aumento del tono simpatico,
- attivazione coagulativa,
- diminuzione delle resistenze periferiche.
L’alcalosi respiratoria, l’aumento della gittata e della frequenza cardiaca, contribuiscono ad incrementare l’efficienza degli scambi gassosi.
L’aumento della volemia (+35%) è soprattutto a carico del volume plasmatico (+50%) e molto meno a carico della parte corpuscolata (+20%); ciò provoca emodiluizione e conseguentemente un’anemia da emodiluizione, soffi cardiaci funzionali, diminuzione della concentrazione delle proteine plasmatiche e conseguentemente un aumento della forma libera di numerosi farmaci utilizzati in anestesia.
Nel corso del travaglio le contrazioni uterine provocano un’autotrasfusione di circa 500 ml che permetterà poi di compensare la perdita emorragica fisiologica di 300-500 ml che accompagna il parto normale.
Queste modificazioni, sempre più accentuate con il procedere della gravidanza, si traducono, dal punto di vista anestesiologico, in una facilitazione sia dell’assorbimento sia dell’eliminazione degli anestetici.
Pertanto mentre le fasi di induzione e risveglio sono accelerate, il mantenimento della narcosi richiederà maggiore cura ed attenzione per mantenere costante lo stadio ed il livello desiderato di anestesia ed analgesia
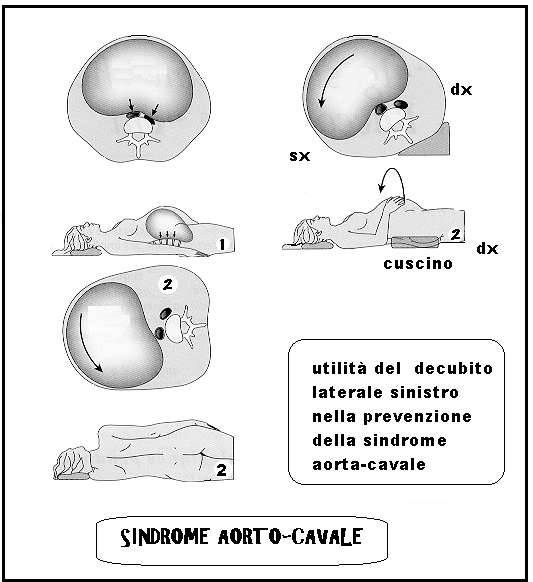
Solitamente la ventilazione assistita non rappresenta un problema, mentre l’ipotensione in narcosi è molto frequente (80%) fino a costituire la cosiddetta «sindrome ipotensiva da posizione supina» per la compressione della vena cava inferiore da parte dell’utero gravido. Tale sindrome, si può prevenire posizionando un cuscino sotto il lato destro della paziente oppure invitando la stessa a porsi in posizione laterale sinistra. In una limitata percentuale di casi, la sindrome si manifesta a livello clinico con pallore, dispnea, sensazione di nausea e malessere generalizzato e, se non viene corretta prontamente con il cambio di posizione della paziente, può determinare un grave crollo pressorio, talora irreversibile, per l’instaurarsi di circolo vizioso sostenuto da: mancato ritorno venoso, ipotensione, acidosi periferica distrettuale e shock.
La riduzione del ritorno venoso al cuore destro comporta un calo del volume/minuto cardiaco e successivo collasso cardiocircolatorio. Diminuisce anche la perfusione ematica del distretto placentare con conseguente ipossiemia fetale.
La compressione verrà ridotta o abolita durante le contrazioni uterine perché durante le contrazioni l’utero si solleva di circa 30° e con ciò diminuisce la pressione su cava e aorta. Inoltre la sindrome non insorge quando la parte presentata è ben impegnata nello scavo pelvico come avviene nel periodo espulsivo avanzato. La sindrome aorto-cavale si può accentuare in anestesia generale e ancora di più nell’anestesia spinale o peridurale.
Effetto Poseiro:
Per effetto Posero si intende il calo di pressione arteriosa a livello degli arti inferiori durante una contrazione (Posero e Bierniarz, 1964). In particolare si riduce solo il valore sistolico che si avvicina a quello diastolico e interessa più frequentemente e intensamente l’arto inferiore destro. La diagnosi si pone mediante palpazione del polso pedidio. Per comprendere l’etiologia dell’effetto Posero occorre ripensare al percorso dell’a. iliaca comune dx che nel suo percorso scavalca la 4a vertebra lombare e a quel livello può venire compressa dall’utero durante le contrazioni. Conseguentemente anche l’a. uterina dx riceve meno sangue e il feto può andare in ipossiemia. Nel decubito laterale sinistro questo effetto scompare (121).
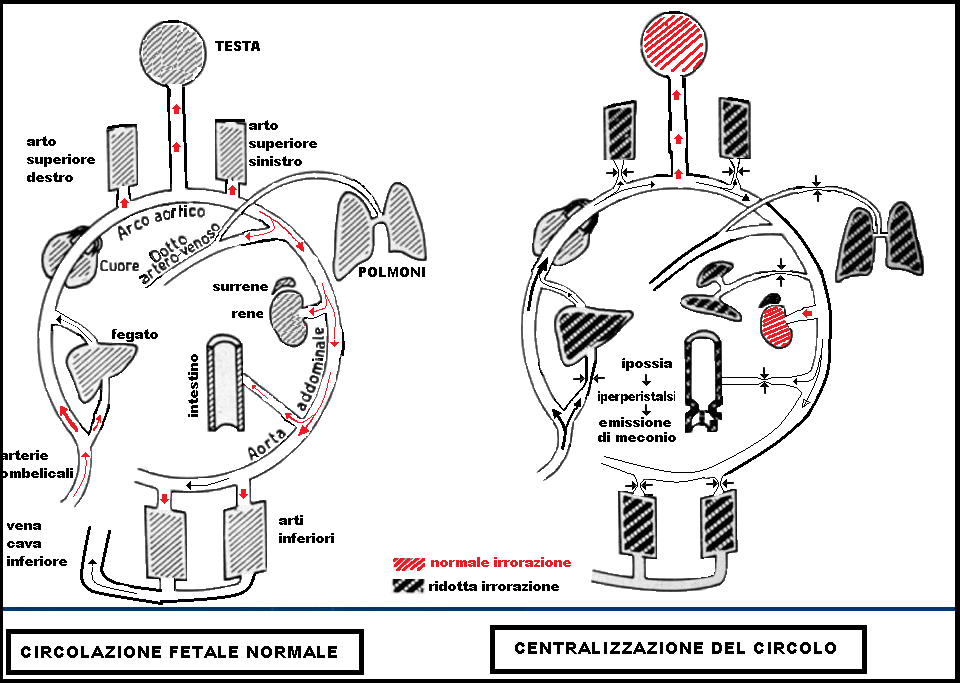
Brain Sparing Effect (BSE) e centralizzazione del circolo – In condizioni di benessere fetale, la flussimetria dell’arteria ombelicale presenta basse resistenze (grande quantità di flusso) mentre il circolo della cerebrale media presenta alte resistenze (piccola quantità di flusso). In condizioni di ipossia invece si osserva aumento dell’indice di resistenza dell’a. ombelicale mentre l’a. cerebrale media presenta una diminuzione delle resistenze al circolo che è indice di un aumento del flusso diastolico cerebrale compensatorio, il cosiddetto Brain Sparing Effect (BSE).
La persistenza di una risposta adattativa del tipo BSE consente una condotta di attesa per attuare le terapie preventive della prematurità/immaturità, mentre la perdita del BSE è stata seguita da un outcome neonatale sfavorevole ed è verosimile che la posticipazione del parto si risolverebbe in un aggravamento della prognosi (122-124). In caso di ipossia fetale assistiamo ad una prima fase che comprende brain sparing della a. cerebrale media, conservazione del flusso renale, restrizione del flusso circolatorio a livello epatico, polmonare, intestinale e degli arti. Se persiste ipossia fetale, si crea uno scompenso circolatorio caratterizzato da un flusso diastolico assente od invertito (reverse flow, REDF) nell’a. omebelicale, aumento dell’onda “reverse” in vena cava inferiore, pulsazione della vena ombelicale, decelerazioni tardive al tracciato cardiotocografico (CTG), ovvero sofferenza fetale (125,128)
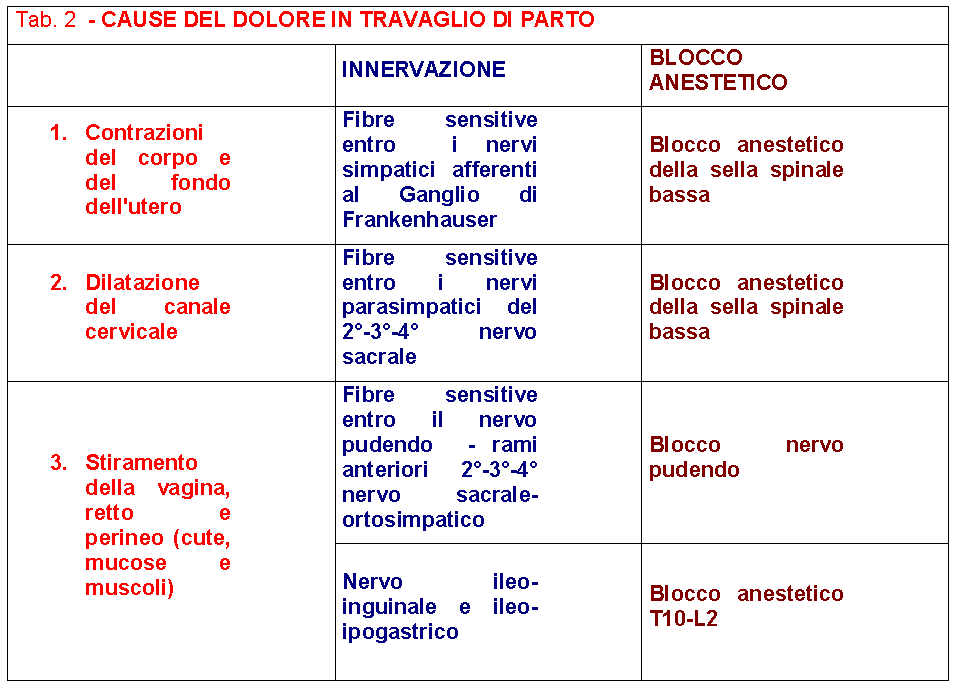
Dolore da parto: è un dolore di tipo viscerale cioè provocato dalla stimolazione rapida ed intensa di organi cavi o dallo stiramento di strutture muscolari e connettivali. E’ di difficile valutazione oggettiva, sia per quanto riguarda l’intensità che la durata, giacchè non sempre è possibile prevedere o stabilire a priori quale sarà la risposta della paziente al dolore e quanto tempo sarà necessario per l’espletamente del parto stesso. Il travaglio può durare da poche ore ad oltre 24 ore. I picchi di stimoli dolorosi possono durare dai 20” agli 80” con periodicità di 3-10 minuti.
Meccanismo che provoca il dolore del parto e le vie attraverso le quali esso viene condotto e discriminato. Nel corso del primo stadio (periodo dilatante), il dolore è dovuto alla dilatazione del collo e alla contrazione e distensione del corpo e del fondo dell’utero; le fibre sensitive che lo trasmettono sono quelle A delta (mielinizzate) e quelle C (non mielinizzate); le fibre Aδ conducono le sensazioni dolorose superficiali e acute mentre le fibre amieliniche (C) conducono le sensazioni dolorose ritardate o profonde. Le afferenze viscerali provenienti dal corpo e dal fondo dell’utero giungono alla grande rete gangliare circumcervicale (ganglio di Frankenhauser) e da lì mandano le fibre al plesso ipogastrico inferiore e quindi al plesso ipogastrico medio, poco sotto il promontorio, e quindi al plesso ipogastrico superiore sulla faccia anteriore di L5. Le fibre quindi giungono al plesso aortico addominale e tronco del simpatico a livello della IIa e IIIa vertebra lombare dove affluiscono anche i nervi ileo-ipogastrico e ileo-inguinale; questi ultimi raccolgono le stimolazioni provenienti dalla zona perineale. Le fibre continuando verso l’alto attraversano i rami comunicanti dell’XI° e del XII° nervo toracico e del I° nervo lombare per entrare nei rispettivi gangli spinali, e da questi al midollo dove prendono connessione sinaptica con gli interneuroni del fascio spino-talamico nel corno dorsale. I fasci spino-talamici sono antero-laterali e salgono al tronco encefalico dove si uniscono alle fibre afferenti del trigemino ed insieme giungono al talamo e quindi alla corteccia cerebrale frontale e all’area limbica corticale e sottocorticale. Quindi per assicurare un’analgesia sufficiente durante il travaglio di parto, dal suo primo insorgere (I° stadio) fino all’espletamento dello stesso, è necessario un blocco di durata variabile dalle 2 alle 12 ore che interessi le fibre sensitive e simpatiche da T10 a S5.
Innervazione degli organi genitali esterni e del perineo:
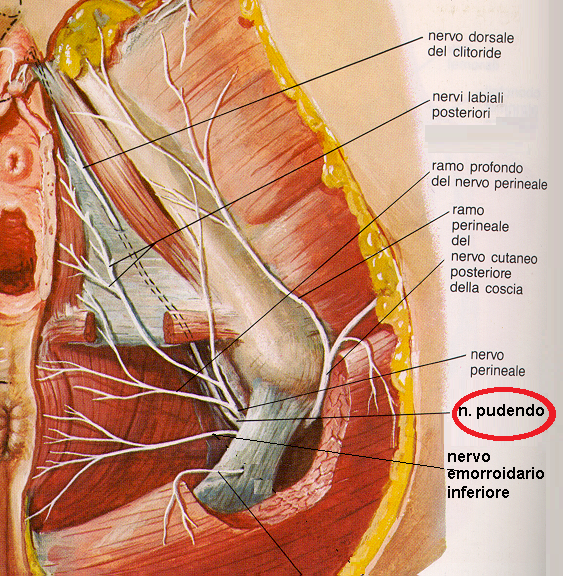
Il nervo pudendo internoè un nervo sensitivo e motorio simpatico. E’ formato dai rami anteriori del 2°, 3° e 4° nervo sacrale. Provvede all’innervazione motoria dei mucoli perineali e all’innervazione sensitiva della maggior parte dei muscoli perineali e dei genitali esterni. Contiene inoltre un certo numero di fibre parasimpatiche pre-gangliari. Derivato dai rami anteriori del secondo, terzo e quarto nervo sacrale, si costituisce come tronco unico ad 1 cm cranialmente alla spina ischiatica, esso lascia la pelvi attraverso il grande foro ischiatico, fra i muscoli piriforme e ischio-coccigeo. Rientra nella pelvi attraverso il piccolo forame ischiatico fra il lig. sacrospinoso e sacrotuberoso, medialmente all’arteria pudenda interna ed è qui che può essere facilmente raggiunto per il blocco anestetico tronculare. Poi continua all’interno del canale di Alcock (guaina fibrosa derivata dalla fascia del muscolo otturatorio interno), addossato alla fascia otturatoria stessa, sulla parete laterale della fossa ischio-rettale, per arrivare alla tuberosità ischiatica. Il nervo pudendo si divide in tre rami:
1) il nervo emorroidale inferiore, che perfora la parete mediale del canale di Alcock, attraversa la fossa ischio-rettale ed innerva il muscolo sfìntere esterno dell’ano e la cute del perineo.
2) Il nervo perineale, che decorre per breve tratto nel canale di Alcock per poi dividersi in un ramo profondo e in uno superficiale. Il ramo profondo manda filamenti ai muscoli sfintere esterno dell’ano ed elevatore dell’ano, poi perfora la base del diaframma uro-genitale per innervare i muscoli trasversi profondo e superficiale del perineo, i muscoli ischio-cavernoso e bulbo-cavernoso e lo sfintere dell’uretra membranosa. Il ramo superficiale si divide nei nervi labiali posteriori mediale e laterale, che innervano il grande labbro e il nervo dorsale del clitoride. Il ramo emorroidale inferiore del nervo pudendo (S2, S3, S4) contribuisce ad innervare la cute perianale. I rami cutanei perforanti del secondo e del terzo nervo sacrale perforano il legamento sacro-tuberoso e girano intorno al margine inferiore del muscolo grande gluteo, per innervare la natica e il contiguo perineo.
3) Il nervo dorsale del clitoride passa attraverso il diaframma uro-genitale e raggiunge il glande del clitoride.
I nervi seguenti contribuiscono alla innervazione della cute del perineo. I rami labiali anteriori del nervo ileo-inguinale (L1, L2) escono dall’anello inguinale superficiale per distribuirsi al monte di Venere e alla porzione superiore del grande labbro. Il ramo spermatico esterno del nervo genito-femorale (L1, L2) accompagna il legamento rotondo dell’utero attraverso il canale inguinale e manda ramuscoli al grande labbro. Anche il nervo ileo-ipogastrico (L1, L2) manda rami sensitivi alle grandi labbra e al monte di venere. I rami perineali del nervo cutaneo posteriore della coscia(SI, S2, S3) decorrono in avanti e medialmente, davanti alla tuberosità ischiatica, fino al margine laterale del perineo e al grande labbro. I nervi ano-coccigei (S4, S5) e il nervo coccigeo si uniscono lungo il coccige e poi perforano i legamenti sacro-tuberosi per innervare la regione ano-coccigea.
PRESIDI TERAPEUTICI NON FARMACOLOGICI: ambiente tranquillo, presenza del coniuge e di familiari, sostegno psicologico (10-12), massaggi, esercizi di relax muscolare e respirazione addominale, immersione in vasca da parto colma di acqua a 32-34 °C, ipnosi, agopuntura e moxa, stimolazione nervosa elettrica transcutanea (TENS) e ipnosi, tutto può essere utile per la gestione del dolore durante il travaglio (13-22).
La donna deve essere accuratamente informata sui pro e i contro, poiché da interviste è emersa per molte donne una dissociazione tra sollievo del dolore e soddisfazione. L’aver ben tollerato il dolore si associava ad una sensazione di autostima, di sfida raccolta e vinta, che il ricorso all’analgesia, in effetti, negava (6-8). Inoltre nelle puerpere e nei bambini che non hanno assunto analgesici durante il parto, si riscontrano maggiore secrezione di endorfine che facilitano la creazione del “bonding” o legame di interdipedenza madre-figlio (31,32).
La sala parto deve essere riscaldata, poco illuminata, lontana dai rumori del reparto, per favorire la concentrazione della partoriente ed evitare di aggredire il neonato con stimoli sensoriali irritanti che si aggiungono a quelli derivanti dalla separazione dall’ambiente uterino (6-8).
Iniezioni sottocutanee di acqua sterile: Alcuni AA. hanno riportato, in contrasto con altri, dati positivi con iniezioni di 1.5 ml di acqua sterile sottocute in corrispondenza delle spine iliache postero-superiori e 3 cm sopra ed 1 cm lateralmente ad esse. Le pazienti avvertono un intenso ma breve dolore nelle sedi di iniezioni dell’acqua; tale dolore è di molto inferiore all’iniezione di soluzione salina. Per diminuire la sensazione dolorosa è utile praticare le iniezioni durante le contrazioni uterine. A fronte dell’efficacia o meno di tale applicazioni occorre tener presente che non ci sono controindicazioni o effetti collaterali negativi di nessun tipo (23-27).
ANESTESIA PARACERVICALE:
Anestetizza il plesso e il ganglio ipogastrico inferiore (formati da fibre nervose tributarie dei metameri T11, T12 e L1 a livello del cul di sac utero-vaginale, in prossimità dell’a. uterina. Assicura l’anestesia del 3° superiore della vagina, del collo e della quasi totalità del corpo dell’utero.
Con la paziente in posizione ginecologica, disinfettare la vagina con soluzione iodurata non alcolica. La guida dell’ago viene introdotta in vagina fra indice e medio della mano controlaterale fino al fornice. Penetrare per 1 cm alle ore 5 e 7 del fornice per evitare l’a. uterina (l’uretere è spostato in alto dalla parte presentata e perciò difficilmente sarà leso), iniettare a ventaglio, a 1 cm di profondità nella sottomucosa, spostando leggermente l’ago ed aspirando sempre prima di iniettare, 5-10 ml di anestetico locale per lato mediante apposito ago monouso di 20-22 G, di lunghezza totale di 15 cm, immesso in una guida lunga 12.5 cm (Guida di Jowa) per cui solo 2.5 cm fuoriescono. Esiste in commercio anche un set con meccanismo a scatto (Neupab Medical Tecnology) realizzato proprio per questo tipo di anestesia (28-30).
Blocco del nervo pudendo: riservato al periodo espulsivo,prima di un’eventuale episiotomia, interessa il dolore perineale, vaginale e vulvare. Non è privo di complicanze e rischi (31,32). Il blocco pudendo è inadeguato per l’applicazione di forcipe, parti che richiedono manipolazione uterina, l’esame post-partum, la sutura di lacerazioni vaginali e cervicali, e l’esplorazione manuale della cavità uterina.
Gli anestetici utilizzati per il blocco pudendo sono la lidocaina all’1% (4,5 mg/kg con dose massima non superiore a 225 mg) oppure clorprocaina allo 0.5%-2% o bupivacaina 0.25% (2,5 mg/kg con dose massima non superiore a 175 mg) o mepivacaina 1%. La lidocaina è preferita per una maggiore durata dell’anestesia rispetto alla clorprocaina che ha una maggiore velocità di azione ma durata di efficacia molto minore della lidocaina. (60 minuti). L’aggiunta di epinefrina all’anestetico non sembra migliorare l’efficacia e la sicurezza del blocco (36-38).
Blocco del nervo pudendo per via perineale: si effettua ad una dilatazione >8 cm. Ponfi intradermici vengono prodotti bilateralmente a metà fra il retto e la  tuberosità ischiatica. Con il dito indice e quello medio della mano sinistra nella vagina, un ago di 10 cm (pudendal block needle della Rolon) viene inserito per via transcutanea nel punto medio fra la spina ischiatica e l’ano e guidato in un punto proprio sotto e oltre la spina ischiatica. Si aspira per essere sicuri di non aver punto l’a. pudenda e poi vengono iniettati 15 ml di anestetico locale in soluzione fisiologica, i quali bloccano il nervo pudendo interno, nel punto in cui questo passa dietro alla spina ischiatica prima di entrare nel canale del pudendo (canale di Alcock) formato dalla fascia otturatoria lateralmente alla fossa ischio-rettale e contenente il nervo e i vasi pudendi interni. Poi l’ago non viene ritirato del tutto, ma diretto lateralmente verso la tuberosità ischiatica dove vengono iniettati altri 15 ml di soluzione, con i quali si anestetizzano i rami perineali del nervo cutaneo posteriore della coscia. Poi si anestetizzano le ramificazioni labiali anteriori del nervo ileo-inguinale, dirigendo l’ago
tuberosità ischiatica. Con il dito indice e quello medio della mano sinistra nella vagina, un ago di 10 cm (pudendal block needle della Rolon) viene inserito per via transcutanea nel punto medio fra la spina ischiatica e l’ano e guidato in un punto proprio sotto e oltre la spina ischiatica. Si aspira per essere sicuri di non aver punto l’a. pudenda e poi vengono iniettati 15 ml di anestetico locale in soluzione fisiologica, i quali bloccano il nervo pudendo interno, nel punto in cui questo passa dietro alla spina ischiatica prima di entrare nel canale del pudendo (canale di Alcock) formato dalla fascia otturatoria lateralmente alla fossa ischio-rettale e contenente il nervo e i vasi pudendi interni. Poi l’ago non viene ritirato del tutto, ma diretto lateralmente verso la tuberosità ischiatica dove vengono iniettati altri 15 ml di soluzione, con i quali si anestetizzano i rami perineali del nervo cutaneo posteriore della coscia. Poi si anestetizzano le ramificazioni labiali anteriori del nervo ileo-inguinale, dirigendo l’ago  superficialmente e obliquamente in avanti, e vengono iniettati ancora 15 ml della soluzione, in modo radiale, verso la vagina e l’ano. Complessivamente vengono complessivamente utilizzati 90-100 cc di procaina allo 0,5% per entrambi i lati.
superficialmente e obliquamente in avanti, e vengono iniettati ancora 15 ml della soluzione, in modo radiale, verso la vagina e l’ano. Complessivamente vengono complessivamente utilizzati 90-100 cc di procaina allo 0,5% per entrambi i lati.
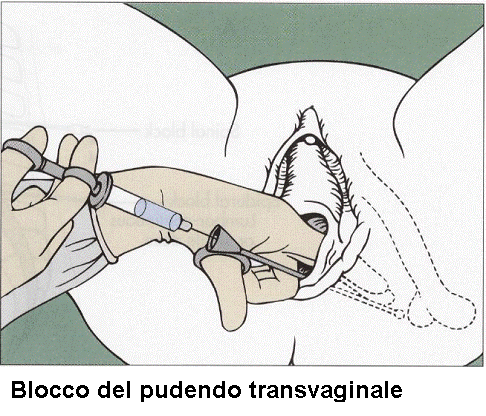
Blocco transvaginale del nervo pudendo:paziente in posizione litotomica; indice e medio dell’operatore inserite in vagina e con la punta dell’indice a contatto con la spina ischiatica; l’ago è guidato sulla punta del dito medio dell’operatore. Prima di iniettare l’anestetico occorre  aspirare per essere sicuri di non essere penetrati nei vasi pudendi che decorrono lateralmente al nervo. Per maggiore sicurezza si utilizzano, come per l’anestesia percutanea, alcuni dispositivi (Iowa trumpet o Kobak guide) (33-35).
aspirare per essere sicuri di non essere penetrati nei vasi pudendi che decorrono lateralmente al nervo. Per maggiore sicurezza si utilizzano, come per l’anestesia percutanea, alcuni dispositivi (Iowa trumpet o Kobak guide) (33-35).
Alcuni AA. preferiscono avvalersi, in enetrambe le tecniche, dell’ausilio della scansione ecografica, tomografica o fluoroscopica per una guida più sicura.
 Si iniettano 10-15 ml di anestetico a 0.5 cm inferiormente alla spina ischiatica ad una profondità di circa 1.5 cm, quindi si perfora con uno scatto lo spessore del legamento sacro-spinoso e si porta la punta dell’ago a 1 cm oltre il ligamento e si iniettano ulteriori 10-15 ml di anestetico in questa zona. Infine si ritira l’ago dalla guida e si sposta la punta della guida appena sopra la punta della guida appena sopra la spina ischiatica; si reinserisce l’ago e si iniettano altri 10-15 ml in questa zona.
Si iniettano 10-15 ml di anestetico a 0.5 cm inferiormente alla spina ischiatica ad una profondità di circa 1.5 cm, quindi si perfora con uno scatto lo spessore del legamento sacro-spinoso e si porta la punta dell’ago a 1 cm oltre il ligamento e si iniettano ulteriori 10-15 ml di anestetico in questa zona. Infine si ritira l’ago dalla guida e si sposta la punta della guida appena sopra la punta della guida appena sopra la spina ischiatica; si reinserisce l’ago e si iniettano altri 10-15 ml in questa zona.
Alcuni AA., in entrambe le tecniche, preferiscono praticare una sola iniezione di 10 ml di anestetico nella zona immediatamente posteriore alla spina ischiatica.
Efficacia del blocco pudendo: Il blocco del pudendo, pur in in mani esperte, è efficace solo nel 50-90% dei casi essendo il perineo innervato anche dai nervi genito-femorali e ileo-inguinale. In caso di insufficiente anestesia, una piccola dose supplementare di anestetico può essere aggiunta monitorando le condizioni materne e fetali. L’effetto anestetico si avverte dopo 10 minuti circa e dura 20-60 minuti circa (39,40). L’avvenuta anestesia è provata dalla mancanza di reazione ad uno stimolo cutaneo perineale.
Il blocco del n. pudendo non abolisce il dolore derivato dalle contrazioni uterine nè quello della dilatazione cervicale trasmesso attraverso le fibre simpatiche afferenti a T10-L2.
Controindicazioni: infezioni pelviche, allergia ad anestetici locali, discoagulopatie.
Rischi e complicazioni del blocco del pudendo:
- i farmaci possono entrare in circolo e provocare effetti sistemici sulla puerpera: bradicardia, tachicardia, ipotensione, lipotimia, tinnito. Inoltre il farmaco, penetrato in circolo, attraversa la placenta provocando effetti tossici sul feto. I neonati intossicati dall’anestetico locale in utero, alla nascita presentano ipotonia, midriasi pupillare, apnea, convulsioni e difficoltà all’allattamento al seno. Il recupero completo di solito si verifica in poche ore (41,42).
- Emorragia ed ematoma vaginale, retroperitoneale ed ischio-rettale da lacerazione dei vasi vaginali e/o dei vasi pudendi. Gli ematomi sono generalmente di piccola entità e non necessitano di intervento chirurgico (43).
- Infezione: ascessi retropsoas e retro-gluteali che diffondendosi superiormente lungo il muscolo psoas o lateralmente lungo l’otturatore interno producono dolore lombo-sacrale e o dell’anca, limitazione dei movimenti e febbre di tipo settico. La difficoltà di diagnosi precoce rendono questi ascessi particolarmente pericolosi (44-47).
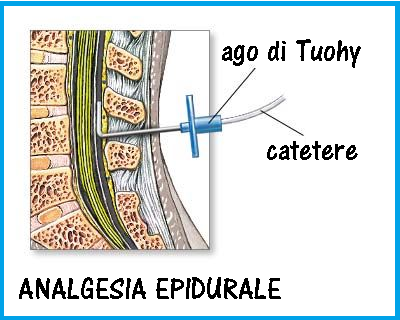
Analgesia epidurale: dovrebbe iniziare con dilatazione cervicale >3 cm ma recentemente L’American Society of Anesthesiologists (ASA), nelle Practice Guidelines for Obstetrical Anesthesia, e l’American College of Obstetricians and Gynecologists (ACOG) affermano che il criterio per decidere quando iniziare un’analgesia epidurale non deve essere il grado di dilatazione cervicale ma la richiesta materna indipendentemente dalla dilatazione e, ovviamente, previo consenso informato ed in assenza di controindicazioni (31,32). Il farmaco più utilizzato è la marcaina (Pubivacaina® 0.25-0.50% 30-40 ml) o ropivacaina 0.625%, meglio se associata a morfina (120) a 5 ml di sufentanil 1 mcg/ml o il più potente fentanyl 0.25 mcg/ml (34). Pochi studi hanno accertato l’utilità di precedere l’analgesia con un apporto di liquidi per flebo.
indipendentemente dalla dilatazione e, ovviamente, previo consenso informato ed in assenza di controindicazioni (31,32). Il farmaco più utilizzato è la marcaina (Pubivacaina® 0.25-0.50% 30-40 ml) o ropivacaina 0.625%, meglio se associata a morfina (120) a 5 ml di sufentanil 1 mcg/ml o il più potente fentanyl 0.25 mcg/ml (34). Pochi studi hanno accertato l’utilità di precedere l’analgesia con un apporto di liquidi per flebo.
Si può mantenere l’analgesia di parto anche tramite PCEA (Patient Controled Epidural Analgesia). La PCEA è accettata con soddisfazione dalle pazienti. Infatti con tale tecnica, la donna è in grado, attraverso un pulsante collegato ad una pompa computerizzata, di autosomministrarsi piccoli boli di soluzione analgesica nel cateterino epidurale quando ne sente la necessità e fino a raggiungere il livello analgesico desiderato (52-54).
L’ epidurale continua si è affermata negli anni come la tecnica più efficace e sicura per abolire  il dolore del parto consentendo allo stesso tempo la completa partecipazione della donna alla nascita del proprio figlio. Il catetere epidurale consente, inoltre, di poter passare velocemente da analgesia ad anestesia in caso di parto cesareo d’urgenza (55-60).
il dolore del parto consentendo allo stesso tempo la completa partecipazione della donna alla nascita del proprio figlio. Il catetere epidurale consente, inoltre, di poter passare velocemente da analgesia ad anestesia in caso di parto cesareo d’urgenza (55-60).
Complicanze epidurale:gravi complicanze a seguito di una epidurale sono rare (1/200.000 circa) (61-). Le più comuni complicanze dell’analgesia epidurale sono:
-
Difficoltà ad imbrecciare lo spazio interdiscale.
-
Mancata diffusione dell’anestetico (60-62)
-
Perforazione o lacerazione accidentale della dura madree dell’aracnoide (1/100); si manifesta con cefalea che in genere termina entro poche ore ma se persiste a lungo si può ricorrere ad una procedura nota come “blood patch”per sigillare il foro. Esso consiste nella iniezione nello spazio epidurale di un piccolo campione di sangue. Il sangue coagulandosi sigilla il
foro e il mal di testa si ferma.
-
prolungamento del travaglio: Le contrazioni uterine vengono percepite come un irrigidimento dell’addome. E’ dimostrato che l’epidurale comporta un prolungamento del secondo stadio del travaglio di parto
-
incremento di malposizioni fetali e di mancata rotazione interna;
-
si triplica l’uso di farmaci ossitocici (33)
-
aumenta la frequenza di parti strumentali (34,35)
-
necessità di cateterismo vescicale per una riduzione dello stimolo urinario.
-
ipotensione arteriosa con diminuzione del flusso placentare e ipossia fetale; è in assoluto la complicanza più frequente ed è associata a nausea e vertigini (63-72).
- eritema cutaneo
-
lombalgia da puntura o lacerazioni della dura madre e/o aracnoide: in alcuni casi può durare anche per mesi (63-72)
-
Infezione nel sito di iniezione nelle settimane dopo l’epidurale. Raramente l’infezione può evolvere in ascesso; quest’ultimo può portare a danni ai nervi fino alla paraplegia (61-74).
-
In 1/4000 casi si è avuta mortalità materna (64,72-74).
-
Non ci sono studi a medio e lungo periodo su eventuali danni dello sviluppo nell’infanzia (36-42, 72-79).
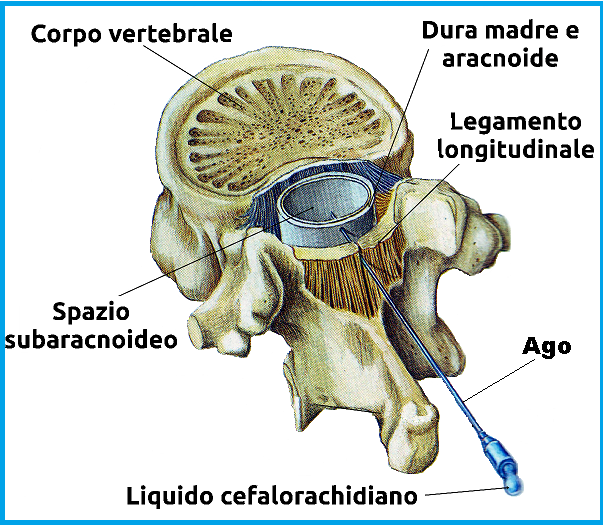
L’anestesia spinale, anche detta anestesia subaracnoidea, è un tipo di anestesia locale o regionale, che consiste nell’iniezione dell’anestetico al di sotto dell’aracnoide, all’interno del liquido cefalo-rachidiano, fluido corporeo che si trova nel sistema nervoso centrale. In tal modo viene bloccata la trasmissione dello stimolo nocicettivo al midollo. L’iniezione di solito viene praticata nella regione lombare, nello spazio L2-L3 o L3-L4, utilizzando un ago atraumatico, di acciaio, dotato di elevata flessibilità, con punta ad ogiva allungata priva di bordi taglienti; ciò consente una facile penetrazione della cute e dei legamenti e di separare le fibre nervose senza lederle, minimizzando eventuali lesioni a nervi e vasi sia durante l’inserimento che durante l’estrazione. Il bisello laterale consente un veloce scorrimento dei liquidi e una facile iniezione o aspirazione (89-92).
spazio L2-L3 o L3-L4, utilizzando un ago atraumatico, di acciaio, dotato di elevata flessibilità, con punta ad ogiva allungata priva di bordi taglienti; ciò consente una facile penetrazione della cute e dei legamenti e di separare le fibre nervose senza lederle, minimizzando eventuali lesioni a nervi e vasi sia durante l’inserimento che durante l’estrazione. Il bisello laterale consente un veloce scorrimento dei liquidi e una facile iniezione o aspirazione (89-92).
L’anestesia spinale ha diversi vantaggi:
- è semplice da praticare,
- agisce rapidamente,
- ha una percentuale di fallimento molto bassa,
- comporta un’assunzione minima di farmaci e si dimostra estremamente efficace nel rilassare i muscoli.

È la procedura d’elezione per i tagli cesarei volontari e per quelli che avvengono in situazioni d’emergenza, quando non è possibile posizionare un catetere epidurale. Per questo motivo, l’anestesia spinale è usata nei casi seguenti (87-92):
- Interventi chirurgici nella parte inferiore dell’addome, ad esempio interventi a carico dell’apparato genitale o urinario o interventi di ernia, oppure interventi a carico degli arti inferiori;
- Taglio cesareo.
In genere l’anestesia spinale viene usata per gli interventi di parto cesareo, mentre l’analgesia epidurale è scelta d’elezione per analgesia in travaglio e parto spontaneo.
Tra gli anestetici locali usati per l’anestesia spinale ricordiamo: la marcaina, la bupivacaina cloridrato, la ropivacaina cloridrato e la lignocaina cloridrato in associazione o meno con epinefrina.
- Marcaina 0.25% o 0.50% (Bupivacaina® cloridrato): La bupivacaina è un anestetico locale che stabilizza la membrana neuronale e impedisce la formazione e la trasmissione degli impulsi nervosi. Si tratta di un farmaco molto potente, quattro volte più potente della lignocaina, l’effetto anestetico è rapido e durevole. La bupivacaina serve per provocare una paralisi epidurale continua (78-88).
- Ropivacaina cloridrato (Naropina® 2 mg/ml 200 ml): la ropivacaina agisce esattamente come la bupivacaina ma, oltre all’effetto anestetico, possiede anche un’azione analgesica. Se assunta a dosaggi maggiori provoca un’anestesia chirurgica con blocco motorio, mentre a dosi inferiori svolge un’azione analgesica con effetto paralizzante minimo.
- Lignocaina cloridrato (Lidocaina®): La lignocaina ha lo stesso meccanismo anestetico della bupivacaina e della ropivacaina.
Complicanze dell’anestesia spinale:
- Cefalea post-anestesia: èdovuta alla fuoriuscita del liquido cefalo-rachidiano e/o alla puntura del midollo spinale durante l’anestesia spinale è la complicazione neurologica più frequente di questo tipo di anestesia. Il mal di testa post-anestesia di solito inizia da 12 a 36 ore dopo il parto e dura 2-7 giorni. Questo tipo di
 cefalea è caratterizzato da un dolore lancinante in corrispondenza del lobo frontale e/o occipitale, anche se può colpire altre zone della testa e del collo. A differenza della cefalea muscolo-tensiva, aumenta in posizione eretta e diminuisce se la pz. si sdraia. Sostituendo i classici aghi a punta tagliente con aghi sottili con punta priva di bordi taglienti, l’incidenza della cefaleadal 5% è ridotta quasi a zero(60-62). Un’altra causa, per fortuna rara, di cefalea da spinale è la meningite batterica e/o la più comune forma asettica. Questa forma si accompagna ad una cefalea non correlata alla postura, a classici sintomi di sofferenza meningea e, nella forma batterica, ad iperpiressia (93-100). L’iperpiressia materna da sola può compromettere il benessere fetale fino alla sua morte in utero (101).
cefalea è caratterizzato da un dolore lancinante in corrispondenza del lobo frontale e/o occipitale, anche se può colpire altre zone della testa e del collo. A differenza della cefalea muscolo-tensiva, aumenta in posizione eretta e diminuisce se la pz. si sdraia. Sostituendo i classici aghi a punta tagliente con aghi sottili con punta priva di bordi taglienti, l’incidenza della cefaleadal 5% è ridotta quasi a zero(60-62). Un’altra causa, per fortuna rara, di cefalea da spinale è la meningite batterica e/o la più comune forma asettica. Questa forma si accompagna ad una cefalea non correlata alla postura, a classici sintomi di sofferenza meningea e, nella forma batterica, ad iperpiressia (93-100). L’iperpiressia materna da sola può compromettere il benessere fetale fino alla sua morte in utero (101). - Insuccesso dell’anestesia spinale:rappresenta una delle condizioni più frustranti per un’anestesista, specie se esperto (63). Esistono molte condizioni che possono essere responsabili di questa situazione, anche se non sempre sono facilmente individuabili; infatti, alcuni autori riportano di punture subaracnoidee perfettamente riuscite, con reflusso di liquor evidente a livello del cono dell’ago, che poi non sono state accompagnate dall’attesa anestesia (64). Probabilmente, in questi casi, la responsabilità può essere attribuita ad un incompleto passaggio della punta dell’ago attraverso la membrana subaracnoidea, associata eventualmente a piccoli movimenti attribuibili al paziente o allo stesso anestesista che conducono l’ago al di fuori dello spazio subaracnoideo (65,66).
- Ipertermia ed ipotermia non associate con stati flogistici (97-108)
- letargia fetale e neonatale (16-17)
Analgesia con gas inalatori+ ossigeno (“gas and air analgesia”): i farmaci più comunemente utilizzati sono alotano, protossido di azoto -N2O-, enflurano, isoflurano, desflurano, xenon e propofol. Si tratta di un’analgesia semplice ed efficace che può essere gestita dalla stessa donna  (67) ma presenta effetti tossici per il feto mentre da alcune pazienti, affette da claustrofobia, la maschera non è sopportata; quest’ultimo ostacolo può essere superato utilizzando gli applicatori nasali invece della maschera. L’analgesia dura pochi minuti e i gas sono rapidamente escreti per via respiratoria. La complicazione principale della tecnica è una overdose di anestetico, che porta alla scomparsa dei riflessi protettivi delle vie aeree che può comportare vomito ed aspirazione endotracheale del contenuto gastrico (68-75). Confusione, eccitazione e sonnolenza sono i segni di overdose e richiedono riduzione della concentrazione di anestetico. La concentrazione di anestetico nella miscela inspirata non deve superare il 50% di N2O, enflurano 1% e 0,7% per Isoflurano. Se si utilizza l’analgesia inalatoria nella seconda fase del travaglio è consigliabile combinare inalazione analgesica con blocco del nervo pudendo e/o blocco paracervicale (109-119).
(67) ma presenta effetti tossici per il feto mentre da alcune pazienti, affette da claustrofobia, la maschera non è sopportata; quest’ultimo ostacolo può essere superato utilizzando gli applicatori nasali invece della maschera. L’analgesia dura pochi minuti e i gas sono rapidamente escreti per via respiratoria. La complicazione principale della tecnica è una overdose di anestetico, che porta alla scomparsa dei riflessi protettivi delle vie aeree che può comportare vomito ed aspirazione endotracheale del contenuto gastrico (68-75). Confusione, eccitazione e sonnolenza sono i segni di overdose e richiedono riduzione della concentrazione di anestetico. La concentrazione di anestetico nella miscela inspirata non deve superare il 50% di N2O, enflurano 1% e 0,7% per Isoflurano. Se si utilizza l’analgesia inalatoria nella seconda fase del travaglio è consigliabile combinare inalazione analgesica con blocco del nervo pudendo e/o blocco paracervicale (109-119).
BIBLIOGRAFIA
- Snow J. On administration of chloroform in during parturition. Assoc Med J. 1853;1:500–2.
- STEVEN D. SCHROCK and CAROLYN HARRAWAY-SMITH: Labor Analgesia Am Fam Physician. 2012 Mar 1;85(5):447-454.
- Sunil T PandyaLabour analgesia: Recent advances Indian J Anaesth. 2010 Sep-Oct; 54(5): 400–408.
- Wong CA. Advances in labor analgesia. Int J Womens Health. 2009;1:139–54. [PMC free article]
- Chestnut DH. Chestnut’s Obstetric anesthesia: Principles and practice. In: Chestnut DH, Polley LS, Tsen LC, Wong CA, editors. Philadelphia PA: Mosby Elsevier; 2009. pp. 405–501.
- Bonnel AM, Boureau F. Labor pain assessment: validity of a behavioral index. Pain. 1985;22:81–90.
- Ross A. Maternal satisfaction with labour analgesia. Baillieres Clin Obstet Gynaecol. 1998;12:499–512.
- Hodnett ED. Pain and women’s satisfaction with the experience of childbirth: a systematic review. Am J Obstet Gynecol. 2002:186(Suppl 5):S160–72.
- BROMAGE P.R. Mechanism of action of extradural analgesia. Br. J. Anaesth. 47: 199-212, 1975
- BROMAGE P.R. Epidural analgesia. Saunders W.B., USA, 1978
- Slade P, MacPherson SA, Hume A, Maresh M. Expectations, experiences and satisfaction with labour. Br J Clin Psychol. 1993;32:469–83.
- 6. Waldenström U. Experience of labor and birth in 1111 women. J Psychosom Res. 1999;47:471–82.
- Lowe NK. Explaining the pain of active labor: the importance of maternal confidence. Res Nurs Health. 1989;12:237–45.
- Simkin PP, O’hara M. Nonpharmacologic relief of pain during labor: Systemic reviews of five methods. Am J Obstet Gynecol. 2002;186:5;S131–59.
- LAWRENCE LEEMAN et al: The Nature and Management of Labor Pain: Part I. Nonpharmacologic Pain Relief. Am Fam Physician 2003;68(6):1109-1113
- Hodnett ED, Gates S, Hofmeyr GJ, Sakala C. Continuous support for women during childbirth. Cochrane Database Syst Rev. 2003;(Issue 3)
- Hodnett ED, Lowe NK, Hannah ME, Willan AR, Stevens B, Weston JA, et al. Effectiveness of nurses as providers of birth labor support in North American hospitals: a randomized controlled trial. JAMA. 2002;288:1373–81.
- Scott KD, Berkowitz G, Klaus M. A comparison of intermittent and continuous support during labor: a meta-analysis. Am J Obstet Gynecol. 1999;180:1054–9.
- Eckert K, Turnbull D, MacLennan A. Immersion in water in the first stage of labor: a randomized controlled trial. Birth. 2001;28:84–93.
- Ohlsson G, Buchhave P, Leandersson U, Nordstrom L, Rydhstrom H, Sjolin I. Warm tub bathing during labor: maternal and neonatal effects. Acta Obstet Gynecol Scand. 2001;80:311–4.
- Rush J, Burlock S, Lambert K, Loosley-Millman M, Hutchison B, Enkin M. The effects of whirlpool baths in labor: a randomized, controlled trial. Birth. 1996;23:136–43.
- Eriksson M, Mattsson LA, Ladfors L. Early or late bath during the first stage of labour: a randomised study of 200 women. Midwifery. 1997;13:146–8.
- Cammu H, Clasen K, Van Wettere L, Derde MP. ‘To bathe or not to bathe’ during the first stage of labor. Acta Obstet Gynecol Scand. 1994;73:468–72.
- Derry S, Straube S, Moore RA, Hancock H, Collins SL Cochrane 2012
- Melzack R & Schaffeberg D (1987) Low-back pain during labour Am J Obstet Gynecol 156. 901-5
- Mårtensson L & Wallin G. (2008) Sterile water injections as treatment for low-back pain during labour: review. Australian and New Zealand Journal of Obstetrics and Gynaecology; 48: 369–374
- Fogarty, V. Intradermal sterile water injections for the relief of low back pain in labour: A systematic review of the literature. (2008) Women and Birth; 21: 157-163
- Hutton EK, Kasperink M, Rutten M, Eitsma A, Wainman B (2009) Sterile water injection for labour pain: a systematic review and meta-analysis of randomised controlled trials. British Journal of Obstetrics and Gynecology (Published Online: 14 May, 2009).
- COVINO B.G., VASSALO H.D. Local anaesthetics: mechanisms of actions and clinical use. Grune and Stratton, New York, 1976
- Sunil T Pandya Labour analgesia: Recent advances Indian J Anaesth. 2010 Sep-Oct; 54(5): 400–408.
- William’s Obstetrics Twenty-Second Ed. Cunningham, F. Gary, et al, Ch. 19.
- Danforth’s Obstetrics and Gynecology Ninth Ed. Scott, James R., et al, Ch. 3.
- King R. Perineal anesthesia in labor. Surg Gynecol Obstet. 1916;23:615-8.
- Klink EW. Perineal nerve block; an anatomic and clinical study in the female. Obstet Gynecol. Feb 1953;1(2):137-46.
- Kohl GC. New method of pudendal block. Northwest Med. Oct 1954;53(10):1012-3.
- Kuhnert BR, Knapp DR, Kuhnert PM, Prochaska AL. Maternal, fetal, and neonatal metabolism of lidocaine. Clin Pharmacol Ther. Aug 1979;26(2):213-20.
- Schierup L, Schmidt JF, Torp Jensen A, Rye BA. Pudendal block in vaginal deliveries. Mepivacaine with and without epinephrine. Acta Obstet Gynecol Scand. 1988;67(3):195-7.
- Zador G, Lindmark G, Nilsson BA. Pudendal block in normal vaginal deliveries. Clinical efficacy, lidocaine concentrations in maternal and foetal blood, foetal and maternal acid-base values and influence on uterine activity. Acta Obstet Gynecol Scand Suppl. 1974;51-64
- Scudamore JH, Yates MJ. Pudendal block–a misnomer?. Lancet. Jan 1 1966;1(7427):23-4.
- Kuhnert BR, Knapp DR, Kuhnert PM, Prochaska AL. Maternal, fetal, and neonatal metabolism of lidocaine. Clin Pharmacol Ther. Aug 1979;26(2):213-20.
- Schnider SM, Levinson G, Ralston DH. Regional anesthesia for labor and delivery. In: Schnider SM, Levinson G, editors. Anesthesia for Obstetrics. 3rd Edition. Baltimore: Williams & Wilkins; 1993:135-153.
- Chase D, Brady JP. Ventricular tachycardia in a neonate with mepivacaine toxicity. J Pediatr. Jan 1977;90(1):127-9.
- Kurzel RB, Au AH, Rooholamini SA. Retroperitoneal hematoma as a complication of pudendal block. Diagnosis made by computed tomography. West J Med. Jun 1996;164(6):523-5.
- Wenger DR, Gitchell RG. Severe infections following pudendal block anesthesia: need for orthopaedic awareness. J Bone Joint Surg Am. Jan 1973;55(1):202-7.
- Hibbard LT, Snyder EN, McVann RM. Subgluteal and retropsoal infection in obstetric practice. Obstet Gynecol. Jan 1972;39(1):137-50.
- Svancarek W, Chirino O, Schaefer G Jr, Blythe JG. Retropsoas and subgluteal abscesses following paracervical and pudendal anesthesia. JAMA. Feb 28 1977;237(9):892-4.
- COLLEY P.S., HEAVNER J.E. Blood levels of bupivacaine after injection into the scalp with and without epinephrine. Anesthesiology 58: 81-84, 1981
- DATTA S., BROWN W.U., OSTHEIMER G.W., WEISS J.B., ALPER M.H. Epidural anaesthesia for cesarian section in diabetic parturients: maternal and neonatal acid-base status and bupivacaine concentration. Anesth. Analg. 60: 574-578, 1981
- KUNHERT B.R., PHILIPSON E.H., PIMENTAL R., KUNHERT P.M. Assessment of motor blockade during epidural anaesthesia. Anesthesiology 56: 477-478,1982
- LANZ E., THEISS D., KELLNER G., ZIMMER M., STAUDTE H.W. Assessment of motor blockade during epidural anaesthesia. Anesth. Analg. 62: 889-893, 1983
- LITTLEWOOD D.G., BUCKLEY P., COVINO B.G., SCOTT D.B., WILSON J. Comparative study of various local anaesthetic solution in extradural block in labour. J. Anaesth. 51: 475-515, 1979
- David R. Gambling, Patrick Yu Colm Cole, Graham H. McMorland, Lynne Palmer: A comparative study of patient controlled epidural analgesia (PCEA) and continuous infusion epidural analgesia (CIEA) during labour Canadian Journal of Anaesthesia May 1988, Volume 35, Issue 3, pp 249-254
- M. van der Vyver, S. Halpern and C.G. Joseph Patient-controlled epidural analgesia versuscontinuous infusion for labour analgesia: a meta-analysis. Brit J. Anaest 2002;89,3:459-465.
- Ferrante, F. Michael; Rosinia, Francis A.; Gordon, Charles; Datta, Sanjay The Role of Continuous Background Infusions in Patient-Controlled Epidural Analgesia for Labor and Delivery. Anesthesia & Analgesia: 1994;79,1:
- Mann C. et al: Comparison of Intravenous or Epidural Patientcontrolled Analgesia in the Elderly after Major Abdominal Surgery Anesthesiology 2000;92:433-441
- Liu SS, Carpenter RL, Neal JM: Epidurdl anesthesia and analgesia: Their role in postoperative outcome. ANESTHESIOLOGY 1995;82: 1474 – 506 2.
- Egbert AM, Parks LH, Short LM, Burnett ML: Randomized trial of postoperative patientcontrolled analgesia vs intramuscular narcotics in frail elderly men. Arch Intern Med 1990; 150:1897-903
- Bollish SJ, Collins CL, Kirking DM, Bartlett RH: Efficacy of patient. controlled versus conventional analgesia for postoperative pain. Clin Pharm 1985; 448-52 5.
- Dahl JB, Rosenberg J, Hansen BL, Hjortso NC, Kehlet H: Differential analgesic effects of low-dose epidural morphine and morphinebupivacaine at rest and during mobilization after major abdominal surgery. Anesth Andlg 1992; 74:362-5
- Liu SS, Carpenter RL, Mackey DC, Thirlby RC, Rupp SM, Shine TSJ, Feinglass NG, Metzger PP, Fulmer JT, Smith SL: Effects of perioperative analgesic technique on rate of recovery after colon surgery. ANESTHESIOLOGY 1995; 83:757- 65
- J. S. CRAWFORD Some maternal complications of epidural analgesia for labour Anaestesia Volume 40, Issue 12, pages 1219–1225, December 1985
- Pan PH, Bogard TD, Owen MD: Incidence and characteristics of failures in obstetric neuraxial analgesia and anesthesia: a retrospective analysis of 19,259 deliveries. Intern J Obst Anest. Volume 13, Issue 4, October 2004, Pages 227–233
- Paech MJ, Godkin R and Webster S: Complications of obstetric epidural analgesia and anaesthesia: a prospective analysis of 10 995 cases. International Journal of Obstetric Anesthesia Volume 7, Issue 1, January 1998, Pages 5–11
- Loo CC, Dahlgren, Irested L: Neurological complications in obstetric regional anaesthesia. Int J Obst Anest 2000;9,2:99-124.
- de JONG R.H., DAVIS N.L. Treating bupivacaine arythmias preliminary report. Reg. Anaesth. 5: 99-103, 1981
- LIU P.L., FELDMAN H.S., COVINO B.G. Comparative CNS and cardiovascular toxicity of various local anaesthetic agents. Anesthesiology 55: A 156, 1981
- BLOCK A., COVINO B.G. Effect of local anaesthetic agents on cardiac conduction and contractility.Reg. Anaesth. 6: 55-61, 1981
- CONKLIN K.A., ZIADLOU-RAD F. Bupivacaine cardiotoxicity in a pregnant patient with mitral valve prolapse. Anesthesiology 58: 596, 1983
- PRENTISS J.E. Cardiac arrest following caudal anaesthesia. Anesthesiology 50: 51-53, 1979
- MATHER L.E., TUCKER G.T. Pharmacokinetics and biotransformation of local anaesthetics Int. Anaesthesiol. Clin. 16: 23-51, 1978
- MOORE D.C. et al. Arterial and venous plasma levels of bupivacaine following epidural and intercostal nerve block. Anesthesiology 45: 39-45, 1976
- PEDERSEN H., MORISHIMA H.O., FINSTER M. Uptake and effects of local anaesthetics in mother and fetus. Int. Anaesthesiol. Clin. 16: 73-89, 1978
- RALSTON D.H., SHNIDER S.M. The fetal and neonatal effects of regional anaesthesia in obstetrics. Anesthesiology 48: 34-54, 1978
- REYNOLDS F., HARGROVE R.L., WYMAN J.B. Maternal and foetal plasma concentrations of bupivacaine after epidural block. Br. J. Anaesth. 45: 1049-1053, 1973
- SCANLON J.W., OSTHEIMER G.W., LURIE A.O., BROWN W.U., WEISS J.B., ALPER M.H. Neurobehavioral responses and drug concentrantions in newborns after maternal epidural anaesthesia with bupivacaine. – Anesthesiology 45: 400-405, 1976
- STEEN P.A., MICHENFELDER J.D. Neurotoxicity of anesthetics. Anesthesiology 50: 437-453, 1979
- SCOTT D.B. Toxicity caused by local anesthetic drugs. Br. J. Anaesth. 53: 553-554, 1981
- TUCKER G.T., COOPER S., LITTLEWOOD D., BUCLEY F.P., COVINO B.G., SCOTT D.B. Observed and predicted accumulation of local anaesthetic agents during continuous extradural analgesia. Br. J. Anaesth. 49: 237-242, 1977
- WIDMAN B. Plasma concentration of local anaesthetic agents in regard to absorption, distribution and elimination, with special reference to bupivacaine. – Br. J. Anaesth. 47: 231-236, 1975
- REYNOLDS F., TAYLOR G. Plasma concentration of bupivacaine during continuous epidural analgesia in labour: the effect of adrenaline. Br. J. Anaesth. 43: 436-440, 1971
- THOMAS J., LONG G., MOORE G., MORGAN D. Plasma protein binding and placental transfer of bupivacaine. Clin. Pharm. Therap. 19: 426-434, 1976
- TUCKER G.T., MATHER L.E. Pharmacokinetics of local anaesthetic agent. Br. J. Anaesth. 47: 213-278, 1975
- TUCKER G.T., MATHER L.E. Clinical pharmacokinetics of local anaesthetics. Clin. Pharmacokin. 4: 241-278, 1979
- McCLURE J.H.:Ropivacaine Br. J. Anaesth. 76:300-307, 1996
- EDDLESTON J.M. et al.: A double-blind comparison of 0.25% ropivacaine and 0.25% bupivacaine for extradural analgesia in labour. Br. J. Anaesth. 76:66-71, 1996
- DATTA S. et al.: Clinical effects and maternal anf fetal plasma concentrations of epidural Ropivacaine versus Bupivacaine for Cesarian section. Anesth. 1346-1353, 1995
- American Society of Anesthesiologists Task Force on Ostetric Anesthesia. Practice guidelines for obstetrical anestesia. Anesthesiology 2007;106:843-863.
- American College of Obstetricians and Gynecologists. Committee on Obstetrics: Maternal and fetal medicine. Pain relief during labor. ACOG opinion no. 118. ACOG: Washington, D.C., 1992.
- Lewis M.: Epidural and spinal anaesthesia in labour. Obst, Gynaec Reprod Medic 1996;6,2:67-83
- Niveen El-Wahab and Neville Robinson: Analgesia and anaesthesia in labour. Obst, Gynaec Reprod Medic 2014;24,4:96-102
- Fubo Tian et al: Continuous spinal anesthesia with sufentanil in labor analgesia can induce maternal febrile responses in puerperas. Int J Clin Exp Med. 2013; 6(5): 334–341.
- de Orange FA, Passini R Jr, Amorim MM, Almeida T, Barros A. Combined spinal and epidural anaesthesia and maternal intrapartum temperature during vaginal delivery: a randomized clinical trial. Br J Anaesth. 2011;107:762–768. [PubMed]
- Philip JMD, Alexander JM, Sharma SK, Leveno KJ, McIntire DD, Wiley J. Epidural analgesia during labor and maternal fever. Anesthesiology. 1999;90:1271–1275. [PubMed]
- 3. Dashe JS, Rogers BB, McIntire DD, Leveno KJ. Epidural analgesia and intrapartum fever: placental findings. Obstet Gynecol. 1999;93:341–344. [PubMed]
- 4. Segal S. Labor epidural analgesia and maternal fever. Anesth Analg. 2010;111:1467–1475. [PubMed]
- Sharma SK. Epidural analgesia during labor and maternal fever. Curr Opin Anaesthesiol. 2000;13:257–260. [PubMed]
- Macaulay JH, Bond K, Steer PJ. Epidural analgesia in labor and fetal hyperthermia. Obstet Gynecol. 1992;80:665–9. [PubMed]
-
Vallejo MC, Kaul B, Adler LJ, Phelps AL, Craven CM, Macpherson TA, Sweet RL, Ramanathan S. Chorioamnionitis, not epidural analgesia, is associated with maternal fever during labour. Can J Anaesth. 2001;48:1122–1126. [PubMed]
-
Petrova A, Demissie K, Rhoads GG, Smulian JC, Marcella S, Ananth CV. Association of maternal fever during labor with neonatal and infant morbidity and mortality. Obstet Gynecol. 2001;98:20–27.
- Peillon P, Dounas M, Lebonhomme JJ, Guittard Y. [Severe hypothermia associated with cesarean section under spinal anesthesia] . Ann Fr Anesth Reanim. 2002;21:299–302.
- Sayyid SS, Jabbour DG, Baraka AS. Hypothermia and excessive sweating following intrathecal morphine in a parturient undergoing cesarean delivery. Reg Anesth Pain Med. 2003;28:140–143. [PubMed]
- Hess PE, Snowman CE, Wang J. Hypothermia after cesarean delivery and its reversal with lorazepam. Int J Obstet Anesth. 2005;14:279–283. [PubMed]
- Fischer MO, Dequire PM, Kalem A, Gerard JL, Plaud B. [Hypothermia after spinal anaesthesia: implication of morphine?] . Ann Fr Anesth Reanim. 2006;25:296–298. [PubMed]
- Salmi P, Kela J, Arvidsson U, Wahlestedt C. Functional interactions between delta- and mu-opioid receptors in rat thermoregulation. Eur J Pharmacol. 2003;458:101–106.
- Romanovsky AA. Thermoregulation: some concepts have changed. Functional architecture of the thermoregulatory system. Am J Physiol Regul Integr Comp Physiol. 2007;292:R37–46
- .Ryan KF, Price JW, Warriner CB, Choi PT. Persistent hypothermia after intrathecal morphine: case report and literature review. Can J Anaesth. 2012;59:384–8.
- Michelle Collins, A Case Report on the Anxiolytic Properties of Nitrous Oxide during Labor, Journal of Obstetric, Gynecologic & Neonatal Nursing, 2015, 44, 1, 87Wiley Online Library
- Johanna Jokinen, Stephanie Weibel, Arash Afshari, Thorsten Artmann, Leopold HJ Eberhart, Nathan Leon Pace, Yvonne Jelting, Peter Kranke, Peter Kranke, Cochrane Database of Systematic Reviews, 2015Wiley Online Library
- Morris S. Clark, Ann L. Brunick, Handbook of Nitrous Oxide and Oxygen Sedation, 2015, 147CrossRef
- Mary J Renfrew, Alison McFadden, Maria Helena Bastos, James Campbell, Andrew Amos Channon, Ngai Fen Cheung, Deborah Rachel Audebert Delage Silva, Soo Downe, Holly Powell Kennedy, Address Malata, Felicia McCormick, Laura Wick, Eugene Declercq, Midwifery and quality care: findings from a new evidence-informed framework for maternal and newborn care, The Lancet, 2014, 384, 9948, 1129
- Trudy Klomp, Judith Manniën, Ank de Jonge, Eileen K. Hutton, Antoine L.M. Lagro-Janssen, What do midwives need to know about approaches of women towards labour pain management? A qualitative interview study into expectations of management of labour pain for pregnant women receiving midwife-led care in the Netherlands, Midwifery, 2014, 30, 4, 432
- Sarah A. Starr, Curtis L. Baysinger, Inhaled Nitrous Oxide for Labor Analgesia, Anesthesiology Clinics, 2013, 31, 3, 623
- Trudy Klomp, Inhaled analgesia for pain management in labour, Journal of Evidence-Based Medicine, 2012, 5, 4, 241Wiley Online Library
- Abboud, T.K., et al., Isoflurane or halothane for cesarean section: comparative maternal and neonatal effects. Acta Anaesthesiol Scand, 1989. 33(7): p. 578–81.
- Abboud, T.K., et al., Isoflurane or halothane for cesarean section: comparative maternal and neonatal effects. Acta Anaesthesiol Scand, 1989. 33(7): p. 578–81.
- 24. Abboud, T.K., et al., Desflurane: a new volatile anesthetic for cesarean section. Maternal and neonatal effects. Acta Anaesthesiol Scand, 1995. 39(6): p. 723–6.
- Abboud, T.K., et al., Intravenous propofol vs thiamylal-isoflurane for caesarean section, comparative maternal and neonatal effects. Acta Anaesthesiol Scand, 1995. 39(2): p. 205–9.
- Abouleish, E., et al., Combined intrathecal morphine and bupivacaine for cesarean section. Anesth Analg, 1988. 67(4): p. 370–4.
- Klaus Goeschen: “Riduzione persistente della perfusione ematica utero-placentare” in Cardiotocografia Pratica, CIC Edizioni Internazionali, 1998 Roma; pag. 7-10
- Scherjon SA, Smolders De Haas H, Kok JH, Sondervan Ha. The brain sparing effect antenatal cerebral Doppler findings in relation to neurologic outcome in very preterm infants. Am J Ob Gyn 1993;169-175.
- Madazli R, Uludağ S, Ocak V. Doppler assessment of umbilical artery, thoracic aorta and middle cerebral artery in the management of pregnancies with growth restriction. Acta Obstet Gynecol Scand. 2001;80 (8): 702-7.
- Ferrazzi E et al. Temporal sequence of abnormal Doppler changes in the pheripheral and central circulatory systems of the severely growth restricted fetus. Ultrasound Obstet Gynecol 2002;19,2:140-46.
-
Battaglia C, Artini PG, Galli PA et al. Absent or reversed end diastolic flow in umbelical artery and severe intrauterine growth retardation. Acta Obstet Scand 1993;72:167-171.