 L’embolia da liquido amniotico (Amniotic Fluid Embolism, AFE) è una rara ma grave complicanza della gravidanza e del parto; più raramente può interessare IVG, aborto spontaneo, revisioni cavitarie post-abortum e amniocentesi. Riguarda il passaggio di liquido amniotico nel circolo ematico materno con conseguente ostruzione dei vasi polmonari e induzione di una sindrome flogistica-anafilattoide che può compromettere la funzionalità cardio-respiratoria e cerebrale e la fisiologia della coagulazione (1-3). Fu descritta per la prima volta nel 1941 da Steiner e Luschbaugh dopo che essi ebbero ritrovato detriti cellulari di origine fetale e annessiale nella circolazione polmonare di donne decedute durante il parto (4-7).
L’embolia da liquido amniotico (Amniotic Fluid Embolism, AFE) è una rara ma grave complicanza della gravidanza e del parto; più raramente può interessare IVG, aborto spontaneo, revisioni cavitarie post-abortum e amniocentesi. Riguarda il passaggio di liquido amniotico nel circolo ematico materno con conseguente ostruzione dei vasi polmonari e induzione di una sindrome flogistica-anafilattoide che può compromettere la funzionalità cardio-respiratoria e cerebrale e la fisiologia della coagulazione (1-3). Fu descritta per la prima volta nel 1941 da Steiner e Luschbaugh dopo che essi ebbero ritrovato detriti cellulari di origine fetale e annessiale nella circolazione polmonare di donne decedute durante il parto (4-7).
Etiologia e Fattori di rischio:
- L’embolia amniotica nel 70% dei casi si presenta durante un travaglio di parto laborioso con rottura delle acque e liquido tinto di meconio o durante un parto precipitoso,
- nel 19% dei casi si può verificare durante un taglio cesareo
- in una piccola percentuale (11%) anche nel post-partum di un parto spontaneo, lacerazioni cervicali e rottura di utero, polidramnios, amnioinfusione, dopo un aborto, durante e dopo revisione cavitaria o successivamente ad amniocentesi (4-6).
- Anamnesi positiva allergica nel 41% delle pazienti AFES
- multiparità,
- età materna avanzata
- cardiopatie
- feto di sesso maschile
- trauma
|
travaglio laborioso |
70% |
| taglio cesareo | 19% |
| parto spontaneo eutocico, revisione cavitaria, IVG, aborto spontaneo, amniocentesi, trauma, incidente automobilistico | 11% |
Fisiopatologia: non ancora completamente chiarita.
Il liquido amniotico normalmente è separato dal circolo materno dalle membrane amnio-coriali. In condizioni normali, durante il travaglio di parto, quando si rompono le membrane, il liquido amniotico, per la legge di gravità, tende normalmente ad scorrere verso il basso, non a risalire verso l’alto. Inoltre le contrazioni uterine strozzano gli osti vascolari della zona di inserzione placentare e non permettono al LA di entrare nel circolo ematico materno.
- INGRESSO NEL CIRCOLO EMATICO MATERNO – in particolari condizioni favorenti, sovramenzionate, la chiusura delle bocche vascolari è assente o insufficiente e permette l’ingresso nel circolo ematico materno di LA, tossine batteriche, cellule squamose fetali e detriti vari tutti dotati di attività allergenica.
- OCCLUSIONE VENE POLMONARI – il materiale sospeso nel liquido amniotico occlude meccanicamente le vene polmonari
- ANAPHYLACTOID SYNDROME OF PREGNANCY (ASP) – subito dopo, come confermato dai dati raccolti dal National Amniotic Fluid Embolus Registry, il processo assume i caratteri di una reazione flogistico-immunologica innescata dagli antigeni I principali antigeni presenti nel liquido amniotico (meconio, particelle di vernice caseosa, endotossine batteriche, cellule squamose fetali). Questo processo è più simile all’anafilassi che all’embolismo e il termine Anaphylactoid Syndrome of Pregnancy (ASP) è stato proposto anche perché non sempre i componenti classici del liquido amniotico vengono ritrovati nell’AFE (7-9).
- SYSTEMIC INFLAMMATORY RESPONSE SYNDROME (SIRS) – l‘ingresso in circolo di fattori flogistici produce attivazione del complemento (C3, C4), degranulazione mastocitaria con
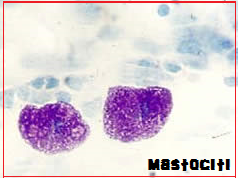 liberazione di istamina, triptasi, leucotrieni e prostaglandine. Ciò provoca l’instaurarsi di una sindrome infiammatoria sistemica, systemic inflammatory response syndrome (SIRS) che produce danni diffusi ma in particolare su encefalo e polmoni (distress respiratorio acuto, ARDS).
liberazione di istamina, triptasi, leucotrieni e prostaglandine. Ciò provoca l’instaurarsi di una sindrome infiammatoria sistemica, systemic inflammatory response syndrome (SIRS) che produce danni diffusi ma in particolare su encefalo e polmoni (distress respiratorio acuto, ARDS). - CID – Lo stimolo flogistico libera fattori tromboplastinici dal tessuto endoteliale, dai monociti e dalle piastrine con attivazione della coagulazione intravascolare dapprima distrettuale e poi generalizzata (CID). I fattori tromoplastinici innescano la cascata coagulatoria che coinvolge il fattore VIIa e gli ioni calcio (Ca++) che ha come principale tappa la conversione della protrombina circolante a trombina che causa la precipitazione del fibrinogeno sotto forma di monomeri di fibrina che avvolgono i coaguli rossi piastrinici stabilizzandoli (coaguli bianchi o trombi stabilizzati). La coagulazione intravascolare coinvolge soprattutto il letto vascolare polmonare, con il risultato di rallentare ulteriormente gli scambi respiratori, accentuare la dispnea e aggravare la cianosi. Nell’embolia amniotica il rischio maggiore non deriva dai fenomeni emorragici, bensì dalla progressiva ostruzione del letto vascolare polmonare secondaria alla deposizione di microtrombi (cuore polmonare acuto).
Le porte d’entrata presunte attraverso cui il liquido amniotico raggiunge la circolazione sanguigna sono:
- le vene endocervicali (che sovente si lacerano anche nei parti eutocici)
- i vasi della zona di inserzione placentare, soprattutto in caso di placenta previa e distacco intempestivo di placenta normalmente inserita o incisione isterotomica del cesareo che attraversi la placenta (8-11).
Le conseguenze sono spesso letali: edema polmonare, CID, convulsioni; la morte si verifica nel 30-60% dei casi (1/15.000 gravidanze). Non è possibile prevenire l’AFE. Nonostante i progressi nella terapia, l’outcome di sopravvivenza senza sequele della gravida affetta da AFES è ancora drammaticamente scarso. Il feto non sopravvive quasi mai allo shock materno e le poche pazienti che riescono a soppravvivere presentano comunque delle gravi sequele neurologiche (10-18).
La diagnosi in genere è effettuata per esclusione di altre patologie. Per la somiglianza ai sintomi clinici dello shock settico e anafilattico, spesso la diagnosi di certezza viene effettuata solo all’autopsia per il riscontro di cellule squamose fetali nei vasi polmonari. Tuttavia le cellule squamose fetali si riscontrano molto frequentemente anche nel circolo ematico delle gravide non affette da AFES. Clinicamente la gravida AFES presenta dolore toracico, brividi improvvisi, sudorazione, cianosi, dispnea, tachipnea severa, schok. Successivamente subentrano agitazione, ipotensione arteriosa, broncospasmo, convulsioni fino all’arresto respiratorio e cardiaco.
La diagnosi può essere confermata dalla presenza di capelli fetali e cellule squamose fetali nel sangue, nella saliva e, in autopsia, nel ventricolo sinistro materno (10-16).

TC spirale: emboli venosi polmonari
La tomografia computerizzata (TC) spirale, che ha ormai completamente sostituito l’angiografia tradizionale, permette la visualizzazione diretta dell’embolo dopo iniezione di mezzo di contrasto.
Radiografia del torace: l’RX del torace è un esame di grande utilità soprattutto perché permette di escludere alcune delle condizioni morbose con cui si pone la diagnosi differenziale, tuttavia in circa il 50% dei casi dei pazienti con EP la lastra del torace è negativa. Vengono considerati reperti classici la focale riduzione o scomparsa della trama vascolare (segno dell’ipoemia, segno di Westermark) così come un’opacità verso la periferia del polmone, a forma di cuneo (segno di Hampton).
ECG: fornisce informazioni riguardo allo stato del ventricolo destro, il quale può andare incontro ad uno scompenso acuto a causa dell’ipertensione polmonare improvvisa. L’esecuzione dell’ECG nei pazienti con sospetta AFES è utile per escludere la presenza di un infarto del miocardio. Nei pazienti con AFES quest’esame strumentale è normale o mostra anomalie da sovraccarico acuto del ventricolo destro, descritte con la sigla S1Q3T3 (onda S profonda in D1, onda Q in D3 e onda T negativa in D3);
Ecocardiogramma – È un esame che permette di valutare la funzione ventricolare destra e che raramente consente la visualizzazione diretta dell’embolo, permette tuttavia la visualizzazione di segni indiretti di AFES a livello ventricolare destro, quali dilatazione dello stesso, eventuale rigurgito tricuspidale, e soprattutto il cosiddetto “movimento paradosso del setto interventricolare”, ovvero uno spostamento del setto durante la sistole dal ventricolo destro verso il ventricolo sinistro.
Istamina: mediatore chimico dell’infiammazione, ad azione vasodilatatoria arteriolare e permeabilizzante, tutte caratteristiche molto importanti nei fenomeni infiammatori; il rallentamento del flusso sanguigno e l’aumentata permeabilità dei vasi in una zona appena colpita da un trauma, permette infatti il passaggio di globuli bianchi ed altre sostanze coinvolte nel confinamento e nella riparazione del danno. Se la vasodilatazione arteriolare è estesa, provoca ipotensione, altrimenti prevale l’effetto ipertensivo da vasocostrizione delle grosse arterie. Possiede azione broncocostrittrice. Suoi antagonisti sono la ranitidina e altri H2 antagonisti. il dosaggio dell’istamina, o di suoi metaboliti, è molto difficile da fare ed i risultati non sempre soddisfacenti. Tanto che è stata praticamente abbandonata nei laboratori di analisi.
Triptasi sierica: è una serin proteasi prodotta unicamente nei granuli del citoplasma dei mastociti, utilizzata come indicatore di infiammazione e attivazione di questi leucociti. Il suo dosaggio (v.n. <11,4 ng /ml) risulta più efficace di quello dell’istamina nel valutare la gravità della reazione immunitaria, in quanto la sua concentrazione plasmatica correla direttamente con la gravità delle manifestazioni cliniche (41-44).
L’embolia da villi coriali, descritta per la prima volta da Schmorl nel 1893, è ancora più rara dell’AFES e si verifica in caso di traumatismi molto gravi. La sintomatologia e il management sono simili all’AFES (17,18).
Terapia:
- Estrazione immediata del feto – consente una sopravvivenza materna dell’80% ma di questi solo il 50% non presentano encefalopatia ipossica ed emorragia intraventricolare.
- Somministrazione di ossigeno: l‘inalazione di ossigeno con maschera è sempre indicata, ma nei casi più gravi è necessario ricorrere ad una ventilazione assistita ed ad una intubazione tracheale.
- il ripristino della pressione arteriosa e della gittata cardiaca,
- Correzione di una eventuale coagulopatia disseminata (CID).
- Reintegrazione della volemia, correzione degli squilibri elettrolitici,
- Somministrazione di cortisonici: 500 mg. di idrocortisone sodio-succinato (Flebocortid® fl im/ev) ogni 6 ore fino al miglioramento.
- Arrestare la formazione del coaugulo e prevenire eventuali recidive emboliche mediante somministrazione di eparina. Eparina in infusione continua (bolo di 80 U/Kg subito, poi 18 U.I./kg/h di peso corporeo). Attualmente si preferisce l’eparina a basso peso molecolare (LMWH) che ha come vantaggi il non modificare il PTT (quindi non richiede esami di controllo) e il poter essere somministrata sottocute (100 U/kg). Questo a patto che il rischio emorragico non sia elevato e non ci sia insufficienza renale (19-24).
- Lisare il trombo mediante farmaci trombolitici – si utilizzano attualmente urochinasi, streptochinasi oppure l’attivatore tissutale del plasminogeno (rt-PA). A causa dell’elevato rischio di emorragia tali farmaci sono usati solo in casi selezionati di pazienti emodinamicamente instabili. L’embolectomia chirurgica ha perso importanza con l’impiego dei trombolitici e la disostruzione mediante catetere intravenoso rx-guidato.
- digitale, antibiotici.
References:
- Fong A, Chau CT, Pan D, et al. Amniotic fluid embolism: antepartum, intrapartum and demographic factors. J Matern Fetal Neonatal Med. 2014 Jun 30. 1-6.
- Skerman JH, Rajab KE. Amniotic fluid embolism. Kuwait Med J. 2003;35:91–7.
-
A. Rudra, S. Chatterjee, S. Sengupta, B. Nandi, and J. Mitra Amniotic fluid embolism Indian J Crit Care Med. 2009 Jul-Sep; 13(3): 129–135.
- Clark SL. Amniotic fluid embolism. Obstet Gynecol. 2014 Feb. 123 (2 Pt 1):337-48.
- Clark SL, Hankins GD, Dudley DA et al: “Amniotic fluid embolism: analysis of the national registry”. AM J Ob Gynecol; 1995;172,4:1167-1169.javascript:void(0);
- Gei G, Hankins GD. Amniotic fluid embolism: An update. Contemporary OB/GYN. 2000;45:53–62.
- Green B. T., Umana E. Amniotic fluid embolism. South Med J 2000;93(7):721-3.
- Stein PD, Matta F, Yaekoub AY. Incidence of amniotic fluid embolism: relation to cesarean section and to age. J Womens Health (Larchmt). 2009 Mar. 18(3):327-9.
-
Rainio J, Penttila A. Amniotic fluid embolism as a cause of death in a car accident: A case report. Forensic Sci Int. 2003;137:231–4.
- Hassart TH, Essed GG. Amniotic fluid embolism after transabdominal amniocentesis. Eur J Obstet Gynecol Reprod Biol. 1983;16:25–30.
- Aguilera LG, Fernandez C, Plaza A, et al. Fatal amniotic fluid embolism diagnosed histologically. Acta Anaesthesiol Scand. 2002 Mar. 46(3):334-7. [Medline].
- Hankins GD, Snyder R, Dinh T, et al. Documentation of amniotic fluid embolism via lung histopathology. Fact or fiction?. J Reprod Med. 2002 Dec. 47(12):1021-4. [Medline].,
- Kobayashi H, Ohi H, Terao T. A simple, noninvasive, sensitive method for diagnosis of amniotic fluid embolism by monoclonal antibody TKH-2 that recognizes NeuAc alpha 2-6GalNAc. Am J Obstet Gynecol. 1993 Mar. 168(3 Pt 1):848-53. [Medline].
- Clark SL, Romero R, Dildy GA, Callaghan WM, Smiley RM, Bracey AW, et al. Proposed diagnostic criteria for the case definition of amniotic fluid embolism in research studies. Am J Obstet Gynecol. 2016 Jun 29.
- Clarke SL, Pavlova Z, Greenspoon J, Horenstein J, Phelan JF. Squamous cell in the maternal pulmonary circulation. Am J Obstet Gynecol. 1986;154:104–6.
- Lim Y, Loo CC, Chia V, Fun W. Recombinant factor VIIa after amniotic fluid embolism and disseminated intravascular coagulopathy. Int J Gynaecol Obstet. 2004 Nov. 87(2):178-9. [Medline].
- Clark SL, Pavlova Z, Greenspoon J, et al. Squamous cells in the maternal pulmonary circulation. Am J Obstet Gynecol. 1986 Jan. 154(1):104-6. [Medline].
- Farrar SC, Gherman RB. Serum tryptase analysis in a woman with amniotic fluid embolism. A case report. J Reprod Med. 2001 Oct. 46(10):926-8. [Medline].
- arcus BJ, Collins KA, Harley RA. Ancillary studies in amniotic fluid embolism: a case report and review of the literature. Am J Forensic Med Pathol. 2005 Mar. 26(1):92-5. [Medline].
- James CF, Feinglass NG, Menke DM, Grinton SF, Papadimos TJ. Massive amniotic fluid embolism: Diagnosis aided by emergency transesophageal echo cardiography. Int J Obstet Anesth. 2004;13:279–83.
- Kramer MS, Rouleau J, Baskett TF, Joseph KS, Maternal Health Study Group of the Canadian Perinatal Surveillance System. Amniotic-fluid embolism and medical induction of labour: a retrospective, population-based cohort study. Lancet. 2006 Oct 21. 368(9545):1444-8.
- Knight M, Tuffnell D, Brocklehurst P, Spark P, Kurinczuk JJ. Incidence and risk factors for amniotic-fluid embolism. Obstet Gynecol. 2010 May. 115(5):910-7. [Medline].
- Benson MD. Current concepts of immunology and diagnosis in amniotic fluid embolism. Clin Dev Immunol. 2012. 2012:946576. [Medline]. [Full Text].
- Clark SL. Amniotic fluid embolism. Clin Obstet Gynecol. 2010 Jun. 53(2):322-8. [Medline].
- Benson MD, Kobayashi H, Silver RK, et al. Immunologic studies in presumed amniotic fluid embolism. Obstet Gynecol. 2001 Apr. 97(4):510-4. [Medline].
- Clark SL, Hankins GD, Dudley DA, et al. Amniotic fluid embolism: analysis of the national registry. Am J Obstet Gynecol. 1995 Apr. 172(4 Pt 1):1158-67; discussion 1167-9. [Medline].
- Kingston NJ, Baillie T, Chan YF, Reddy DJ, Stables SR. Pulmonary embolization by chorionic villi causing maternal death after a car crash. Am J Forensic Med Pathol 2003;24(2):193-7.
- Kingston NJ, Baillie T, Chan YF, Reddy DJ, Stables SR. Pulmonary embolization by chorionic villi causing maternal death after a car crash. Am J Forensic Med Pathol. 2003 Jun;24(2):193-7.
- Goldhaber SZ, Pulmonary thromboembolism, in Kasper DL, Braunwald E, Fauci AS, et al. (a cura di), Harrison’s Principles of Internal Medicine, 16th, New York, NY, McGraw-Hill, 2005, pp. 1561–65,
- Rahimtoola A, Bergin JD, Acute pulmonary embolism: an update on diagnosis and management, in Current problems in cardiology, vol. 30, nº 2, febbraio 2005, pp. 61–114,
- Kumar,Abbas,Fausto, Mitchell, Basic Pathology, New Delhi, Elsevier, 2010, p. 98, ISBN 978-81-312-1036-9.
- Kenneth E. Wood, An approach to Venous Thomboembolism/Pulmonay Embolism in the Critically Ill, in Michael J. Murray, Douglas B. Coursin, Ronald G. Pearl e Donald S. Prough (a cura di), Critical Care Medicine: Perioperative Management: Published Under the Auspices of the American Society of Critical Care Anesthesiologists (ASCCA), Lippincott Williams & Wilkins, 2002, p. 536, ISBN 978-0-7817-2968-0.
- Wells PS, Anderson DR, Rodger M, Stiell I, Dreyer JF, Barnes D, Forgie M, Kovacs G, Ward J, Kovacs MJ. Excluding pulmonary embolism at the bedside without diagnostic imaging: management of patients with suspected pulmonary embolism presenting to the emergency department by using a simple clinical model and d-dimer. Ann Intern Med. 2001 Jul 17;135(2):98-107. PubMed PMID 11453709
- Wolf SJ, McCubbin TR, Feldhaus KM, Faragher JP, Adcock DM. Prospective validation of Wells Criteria in the evaluation of patients with suspected pulmonary embolism. Ann Emerg Med. 2004 Nov;44(5):503-10. PubMed PMID 15520710
- Society for Maternal-Fetal Medicine (SMFM). Electronic address: pubs@smfm.org, Pacheco LD, Saade G, Hankins GD, Clark SL. Amniotic fluid embolism: diagnosis and management. Am J Obstet Gynecol. 2016 Aug. 215 (2):B16-24.
- Kaneko Y, Ogihara T, Tajima H, Mochimaru F. Continuous hemodiafiltration for disseminated intravascular coagulation and shock due to amniotic fluid embolism: report of a dramatic response. Intern Med. 2001 Sep. 40(9):945-7.
- Hsieh YY, Chang CC, Li PC, Tsai HD, Tsai CH. Successful application of extracorporeal membrane oxygenation and intra-aortic balloon counterpulsation as lifesaving therapy for a patient with amniotic fluid embolism. Am J Obstet Gynecol. 2000 Aug. 183(2):496-7.
- Lim Y, Loo CC, Chia V, Fun W. Recombinant factor VIIa after amniotic fluid embolism and disseminated intravascular coagulopathy. Int J Gynaecol Obstet. 2004 Nov. 87(2):178-9.
- Stanten RD, Inverson LI, Daugharty TM, Lovett SM, Crystal T, Blumenstock E. Amniotic fluid embolism causing catastrophic pulmonary vasoconstriction: Diagnosis by transesophageal echocardiogram and treatment by cardiopulmonary bypass. Obstet Gynecol. 2003;102:496–8.
- Tanaka T, McRae BJ, Cho K, Cook R, Fraki JE, Johnson DA, Powers JC, Mammalian tissue trypsin-like enzymes. Comparative reactivities of human skin tryptase, human lung tryptase, and bovine trypsin with peptide 4-nitroanilide and thioester substrates, in J. Biol. Chem., vol. 258, nº 22, novembre 1983, pp. 13552–7, PMID 6358206.
- Vanderslice P, Ballinger SM, Tam EK, Goldstein SM, Craik CS, Caughey GH, Human mast cell tryptase: multiple cDNAs and genes reveal a multigene serine protease family, in Proc. Natl. Acad. Sci. U.S.A., vol. 87, nº 10, maggio 1990, pp. 3811–5, DOI:10.1073/pnas.87.10.3811,
- Valent P, Horny HP, Triggiani M, Arock M, Clinical and laboratory parameters of mast cell activation as basis for the formulation of diagnostic criteria, in Int. Arch. Allergy Immunol., vol. 156, nº 2, 2011, pp. 119–27,
- Farrar SC, Gherman RB. Serum tryptase analysis in a woman with amniotic fluid embolism. A case report. J Reprod Med. 2001 Oct. 46(10):926-8.
- Fineschi V, Gambassi R, Gherardi M, Turillazzi E. The diagnosis of amniotic fluid embolism: An immunohistochemical study for the quantification of pulmonary mast cell tryptase. Int J Legal Med 1998;111:238-43.
- Benson MD, Kobayashi H, Silver RK, Oi H, Greenberger PA, Terao T. Immunologic studies in presumed amniotic fluid embolism. Obstet Gynecol 2001;97:510-4.
- Benson MD: A hypotesis regarding complement activation and amniotic fluid embolism. Med Hypoteses 2007;68:1019-1025
- Oi H, Kobayashi H, Hirashima Y, Yamazaki T, Kobayashi T, Terao T. Serological and immunohistochemical diagnosis of amniotic fluid embolism. Semin Thromb Hemost 1998;24:479-84.
- Esposito RA, Coppa G, Giangola G et al: Successful treatment of post-partum shock caused by amniotic fluid embolism with cardiopulmonary artery thromboembolectomy. Am J Obstet Gynecol 1990;163:572-574
- Annecke T, Geisenberger T, Kurzi R, PenninHeindl B: ” algorithm-based coagulation management of catastrophic amniotic fluid embolism. Blood Coagul Fibrinolysis 2010:21:95-100
- Lee PH, Shulman MS, Vellayappan U, Symes JF, Olenchock SA Jr. Surgical treatment of an amniotic fluid embolism with cardiopulmonary collapse. AnIJ n Thorac Surg 2010;90:1694-6.
- McDonnell NJ, Chan BO, Frengley RW: Rapid reversal of critical haemodynamic compromise with nitric oxide in a parturient with amniotic fluid embolism. Int J Obstet Anesth 2007;16:269-2073
- Stroup J, Haraway D, Beal JM: Aprotinin in the management of coagulopathy associated with amniotic fluid embolus. Pharmacotherapy 2006;26:689-693.






