L’epatite B è la più comune delle infezioni epatiche in tutto il mondo. È causata dal virus dell’epatite B  (HBV) che attacca le cellule epatiche e può portare a insufficienza epatica, cirrosi (cicatrizzazione) o cancro al fegato nel corso della vita. Il virus è trasmesso attraverso il contatto con sangue infetto (piercing, tatuaggi, iniezioni, interventi chirurgici, emotrasfusioni, estrazioni dentarie, spazzolini da denti, rasoi da barba), i rapporti sessuali non protetti e la trasmissione materno fetale in gravidanza e puerperio (1).
(HBV) che attacca le cellule epatiche e può portare a insufficienza epatica, cirrosi (cicatrizzazione) o cancro al fegato nel corso della vita. Il virus è trasmesso attraverso il contatto con sangue infetto (piercing, tatuaggi, iniezioni, interventi chirurgici, emotrasfusioni, estrazioni dentarie, spazzolini da denti, rasoi da barba), i rapporti sessuali non protetti e la trasmissione materno fetale in gravidanza e puerperio (1).
L’epatite B si manifesta nella donna in gravidanza con sintomatologia in genere non severa, con caratteristiche cliniche uguali a quelle delle donne normali (Ittero, febbre, anoressia, febbre, dolori addominali, vomito, nausea, rash cutanei, prurito, artralgia, gastroenterite e diarrea) (1-5). Il peiodo medio di incubazione della malattia è di 6-8 settimane.
diarrea) (1-5). Il peiodo medio di incubazione della malattia è di 6-8 settimane.
Circa il 10% delle pazienti che si infettano con il virus diventano portatrici sane o affette da epatite cronica attiva; dunque sono potenziali fonti di contagio per altri individui così come per il feto, spesso senza saperlo. L’epatite fulminante si verifica raramente (0.1 – 0.5%) ed è dovuta alla massiva immuno-mediata lisi degli epatociti infettati. Si verifica soprattutto nei pazienti defedati, con deficit immunitario, coinfettati da altri tipi di virus dell’epatite e nei tossico-dipendenti (6).
Trasmissione materno-fetale dell’epatie B:
a) Epatite acuta contratta in gravidanza: In caso di infezione contratta dalla gravida, il rischio di trasmissione materno-fetale è molto basso (10%) se l’infezione è stata contratta nel I – II° trimestre di gravidanza, ma aumenta al 50-70% se l’epatite insorge nel III° trimestre di gravidanza o peggio al momento del travaglio di parto (1-4); il virus attraversa facilmente la barriera placentare o può infettare il feto durante il passaggio nel canale del parto. L’infezione neonatale può essere anche legata a trasmissione orizzontale in caso di familiari portatori di HBsAg. In gravidanza l’infezione del feto non comporta aumento significativo di mortalità o malformazioni (2,3). Invece si osserva un significativo aumento dei parti pre-termine e del basso peso fetale alla nascita (SGA, Small for Gestational Age) (3,4).
b) Madre portatrice asintomatica di HBsAg: Il rischio di trasmissione materno-fetale è del 10%; aumenta fino al 70-90% in caso di positività materna per l’antigene e. In questo caso, il bambino, non protetto, svilupperà un’epatite cronica o lo stato di portatore sano entro il primo anno di vita in una elevata percentuale di casi (70-90%). La trasmissione del virus è più frequente nel III° trimestre ed in travaglio. Rari sono i casi di epatite fulminante neonatale; poco più frequenti sono le forme di epatite acuta (65-67).
c) HBcAb isolato: le gravide con profilo sierologico di “anti-HBc isolato” presentano un rischio di trasmissione materno-fetale dell’1% (65-67).
d) Allattamento: Il rischio di trasmissione attraverso l’allattamento al seno è  molto controverso: l’HBs Ag è presente nel latte in circa il 70% dei casi, ma la trasmissione dell’infezione per via orale richiede una carica virale molto elevata, per cui l’allattamento al seno è consentito se la madre è HBeAg negativa, secondo le direttive del WHO (World Health Organitation).
molto controverso: l’HBs Ag è presente nel latte in circa il 70% dei casi, ma la trasmissione dell’infezione per via orale richiede una carica virale molto elevata, per cui l’allattamento al seno è consentito se la madre è HBeAg negativa, secondo le direttive del WHO (World Health Organitation).
DIAGNOSTICA DI LABORATORIO:
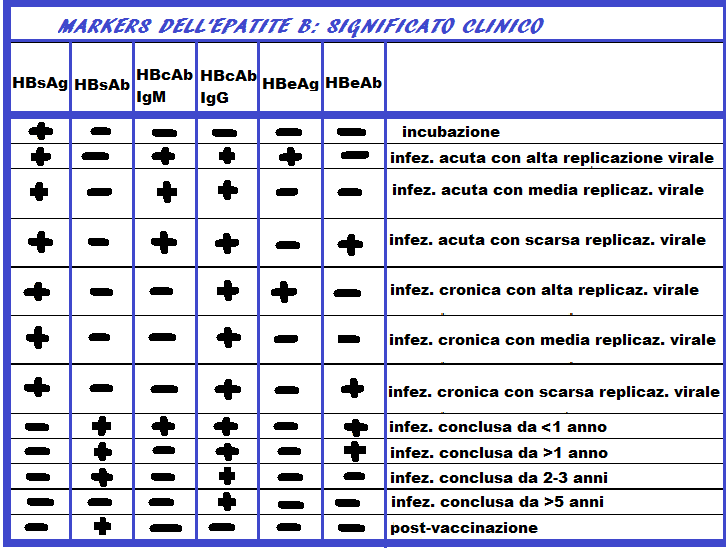
HBsAg: antigene di superficie del virus, detto anche antigene Australia, è il primo marker a comparire precedendo sia la comparsa delle transaminasi che la sintomatologia. E’ sempre un segnale di allarme. Scompare 1-2 mesi dopo la comparsa dell’ittero, ma a volte dura anche 6 mesi. Appena scompare si fa presente l’anticorpo HBsAb come segnale positivo.
 HBsAb: anticorpi che si formano in risposta all’infezione da HBV e segnano la guarigione sierologica. Sono presenti anche nelle persone vaccinate e nei portatori sani. L’HBsAb Fornisce protezione per lungo tempo se raggiunge un titolo proteggente (>10 UI/L). La contagiosità di una persona, già colpita da HBV e con titolo proteggente di HBsAb, è nulla ed il virus pur se non eliminato definitivamente non è più in grado di provocare Cirrosi o tumore del fegato . Prova ne è che la ricerca diretta del virus (HBVDNA) in questi pazienti da sempre esito negativo ( < 20 UI/L). Questo esame va effettuato all’inizio della gravidanza e ripetuto tra la 33a e la 35a settimana di gestazione
HBsAb: anticorpi che si formano in risposta all’infezione da HBV e segnano la guarigione sierologica. Sono presenti anche nelle persone vaccinate e nei portatori sani. L’HBsAb Fornisce protezione per lungo tempo se raggiunge un titolo proteggente (>10 UI/L). La contagiosità di una persona, già colpita da HBV e con titolo proteggente di HBsAb, è nulla ed il virus pur se non eliminato definitivamente non è più in grado di provocare Cirrosi o tumore del fegato . Prova ne è che la ricerca diretta del virus (HBVDNA) in questi pazienti da sempre esito negativo ( < 20 UI/L). Questo esame va effettuato all’inizio della gravidanza e ripetuto tra la 33a e la 35a settimana di gestazione
HBcAb (anticorpo anti-core): non fornire alcuna protezione o immunità contro il virus dell’epatite B. Indica che una persona è stata esposta al virus dell’epatite B. Nell’anticorpo HBcAb è importante distinguere le IgM che compaiono per prime e che se persistono sono segno infausto, dalle IgG che invece denotano una più bassa contagiosità nel portatore e persistono per tutta la vita. L’HBeAb unito alle transaminasi elevate (segno di intensa citolisi) a volte si unisce alla presenza dell’HB DNA nel siero, segno di replicazione virale all’interno degli epatociti.
HBeAg: è la proteina solubile componente interna del nucleocapside. Compare precocemente ed è segno di intensa replicazione virale. Quest’antigene scompare generalmente alcuni giorni dopo il picco delle transaminasi (ma comunque prima che scompaia HBsAg) lasciando il posto ai relativi anticorpi HBeAb. La persistenza dell’antigene HBeAg è segno prognostico negativo e di alta infettività. Nelle donne in gravidanza la presenza dell’antigene HbeAg rapppresenta un segno di quasi certa trasmissione al neonato.
HBeAb: si forma in reazione alla presenza di HBeAg e persiste per 1-2 anni.
Transaminasi, Bilirubinemia totale e parziale, γ-GT, LDH, PT, PTT e ATT completano la routine degli esami di laboratorio nelle epatiti B.
Terapia:
-
In genere la terapia è sintomatica. Si consiglia riposo a letto per 10 giorni sotto controllo medico monitorando i parametri di coagulazione e di funzionalità epatica.
- Tenofovir disoproxil (TDF), è un farmaco appartiene alla classe dei cosiddetti antiretrovirali, inibitori nucleotidici della transcriptasi inversa. In Italia il farmaco è venduto con il nome commerciale di Viread™, nella forma farmaceutica di compresse da 123 mg. E’ consigliato, alla dose di 300 mg/die anche in gravidanza (unico antiretrovirale ammesso in gravidanza!) se sono presenti alti valori delle transaminasi ed in particolare della ALT nonostante il rischio di nefrotossicità, acidosi lattica e osteomalacia per trattamenti di lunga durata. Effetti collaterali possibili: astenia, lipotimia, cefalea, nausea e vomito (67-69). Un moderato numero di dati in donne in gravidanza (tra 300 e 1.000 gravidanze esposte) indica che non vi sono malformazioni o tossicità fetale/neonatale associate a Tenofovir disoproxil fumarato. Il tenofovir è classificato in classe B dalla FDA (Food and Drug Administration) per tossicità riproduttiva in vivo, ma non evidenziata nella donna. Il tenofovir è escreto con il latte e quindi la somministrazione in allattamento è sconsigliata a causa della mancanza di dati sugli effetti indesiderati sul poppante.
- Interferone alfa (INF alfa, peg-interferone alfa-2a): molecola proteica naturale con attività immunomodulante, antivirale e antiproliferativa. Sconsigliata la somministrazione in gravidanza e allattamento (Linee Guida EASL, 2012) ed inserito in classe C dalla FDA.
Prevenzione
- Taglio cesareo di elezione: praticato per prevenire l’infezione fetale da HBV durante il passaggio nel canale del parto. E’ oggetto di controversia: molti AA. lo ritengono inutile se la carica virale non è molto alta (66-68).
- Immunizzazione attiva e passiva: i neonati di madre HBsAg positiva o di persone a rischio di infezione devono essere trattati con la somministrazione immediata di immunoglobuline specifiche (HBIG) (immunizzazione passiva) e, dopo 12 ore, la somministrazione di vaccino specifico (immunizzazione attiva). La somministrazione di immunoglobuline specifiche (HBIG) alla dose di 0,5 ml è effettuata subito dopo la nascita e una prima dose di vaccino dopo 12 ore ed altre due dosi a distanza di 6 e 12 mesi. L’immunizzazione attiva e passiva hanno buona efficacia nel prevenire la trasmissione perinatale della malattia (90-95%), mentre la sola immunizzazione attiva previene l’infezione neonatale nel 70-90% dei casi. La prevenzione dell’infezione da HVB in Italia rientra nei programmi di vaccinazione obbligatoria. E’ importante anche i bambini nati da madre sana vengano vaccinati contro l’epatite B!
Epatite D: Accanto all’epatite B si deve necessariamente inserire l’epatite D, una sovrainfezione epatica causata dall’HDV, un virus a RNA che non può svilupparsi in assenza del virus HBV. La sovrainfezione dell’HDV determina la comparsa dell’antigene delta (HDV Ag). All’insoegere della infezione si potrà individuare l’HDV-RNA nel sangue, successivamente si avrà la comparsa degli anticorpi anti HDV prima IgM e poi IgG.
Bibliografia:
- Sookoian S. Liver disease during pregnancy: acute viral hepatitis. Ann Hepatol 2006; 5:231.
- Hieber JP, Dalton D, Shorey J, Combes B. Hepatitis and pregnancy. J Pediatr 1977; 91:545.
- Söderström A, Norkrans G, Lindh M. Hepatitis B virus DNA during pregnancy and post partum: aspects on vertical transmission. Scand J Infect Dis 2003; 35:814.
- Jonas MM. Hepatitis B and pregnancy: an underestimated issue. Liver Int 2009; 29 Suppl 1:133.
- Degertekin B, Lok AS. Indications for therapy in hepatitis B. Hepatology 2009; 49:S129.
- Potthoff A, Rifai K, Wedemeyer H, et al. Successful treatment of fulminant hepatitis B during pregnancy. Z Gastroenterol 2009; 47:667.
- Wright TL, Mamish D, Combs C, et al. Hepatitis B virus and apparent fulminant non-A, non-B hepatitis. Lancet 1992; 339:952.
- Lao TT, Chan BC, Leung WC, et al. Maternal hepatitis B infection and gestational diabetes mellitus. J Hepatol 2007; 47:46.
- Lao TT, Tse KY, Chan LY, et al. HBsAg carrier status and the association between gestational diabetes with increased serum ferritin concentration in Chinese women. Diabetes Care 2003; 26:3011.
- Lobstein S, Faber R, Tillmann HL. Prevalence of hepatitis B among pregnant women and its impact on pregnancy and newborn complications at a tertiary hospital in the eastern part of Germany. Digestion 2011; 83:76.
- Connell LE, Salihu HM, Salemi JL, et al. Maternal hepatitis B and hepatitis C carrier status and perinatal outcomes. Liver Int 2011; 31:1163.
- Tan HH, Lui HF, Chow WC. Chronic hepatitis B virus (HBV) infection in pregnancy. Hepatol Int 2008; 2:370.
- Rawal BK, Parida S, Watkins RP, et al. Symptomatic reactivation of hepatitis B in pregnancy. Lancet 1991; 337:364.
- Lin HH, Wu WY, Kao JH, Chen DS. Hepatitis B post-partum e antigen clearance in hepatitis B carrier mothers: Correlation with viral characteristics. J Gastroenterol Hepatol 2006; 21:605.
- ter Borg MJ, Leemans WF, de Man RA, Janssen HL. Exacerbation of chronic hepatitis B infection after delivery. J Viral Hepat 2008; 15:37.
- Yang YB, Li XM, Shi ZJ, Ma L. Pregnant woman with fulminant hepatic failure caused by hepatitis B virus infection: a case report. World J Gastroenterol 2004; 10:2305.
- Nguyen G, Garcia RT, Nguyen N, et al. Clinical course of hepatitis B virus infection during pregnancy. Aliment Pharmacol Ther 2009; 29:755.
- Shaheen AA, Myers RP. The outcomes of pregnancy in patients with cirrhosis: a population-based study. Liver Int 2010; 30:275.
- Brown RS Jr, Verna EC, Pereira MR, et al. Hepatitis B virus and human immunodeficiency virus drugs in pregnancy: findings from the Antiretroviral Pregnancy Registry. J Hepatol 2012; 57:953.
- Han GR, Cao MK, Zhao W, et al. A prospective and open-label study for the efficacy and safety of telbivudine in pregnancy for the prevention of perinatal transmission of hepatitis B virus infection. J Hepatol 2011; 55:1215.
- Pan CQ, Han GR, Jiang HX, et al. Telbivudine prevents vertical transmission from HBeAg-positive women with chronic hepatitis B. Clin Gastroenterol Hepatol 2012; 10:520.
- Van Rompay KK, Durand-Gasselin L, Brignolo LL, et al. Chronic administration of tenofovir to rhesus macaques from infancy through adulthood and pregnancy: summary of pharmacokinetics and biological and virological effects. Antimicrob Agents Chemother 2008; 52:3144.
- Gibb DM, Kizito H, Russell EC, et al. Pregnancy and infant outcomes among HIV-infected women taking long-term ART with and without tenofovir in the DART trial. PLoS Med 2012; 9:e1001217.
- Wang L, Kourtis AP, Ellington S, et al. Safety of tenofovir during pregnancy for the mother and fetus: a systematic review. Clin Infect Dis 2013; 57:1773.
- Viganò A, Mora S, Giacomet V, et al. In utero exposure to tenofovir disoproxil fumarate does not impair growth and bone health in HIV-uninfected children born to HIV-infected mothers. Antivir Ther 2011; 16:1259.
- Siberry GK, Williams PL, Mendez H, et al. Safety of tenofovir use during pregnancy: early growth outcomes in HIV-exposed uninfected infants. AIDS 2012; 26:1151.
- Intron-A [package insert]. Kenilworth, NJ. Schering Corporation; 1994.
- Trotter JF, Zygmunt AJ. Conception and pregnancy during interferon-alpha therapy for chronic hepatitis C. J Clin Gastroenterol 2001; 32:76.
- Cundy KC, Sueoka C, Lynch GR, et al. Pharmacokinetics and bioavailability of the anti-human immunodeficiency virus nucleotide analog 9-[(R)-2-(phosphonomethoxy)propyl]adenine (PMPA) in dogs. Antimicrob Agents Chemother 1998; 42:687.
- Van Rompay KK, Hamilton M, Kearney B, Bischofberger N. Pharmacokinetics of tenofovir in breast milk of lactating rhesus macaques. Antimicrob Agents Chemother 2005; 49:2093.
- Benaboud S, Pruvost A, Coffie PA, et al. Concentrations of tenofovir and emtricitabine in breast milk of HIV-1-infected women in Abidjan, Cote d’Ivoire, in the ANRS 12109 TEmAA Study, Step 2. Antimicrob Agents Chemother 2011; 55:1315.
- Wong S, Chan LY, Yu V, Ho L. Hepatitis B carrier and perinatal outcome in singleton pregnancy. Am J Perinatol 1999; 16:485.
- Tse KY, Ho LF, Lao T. The impact of maternal HBsAg carrier status on pregnancy outcomes: a case-control study. J Hepatol 2005; 43:771.
- Reddick KL, Jhaveri R, Gandhi M, et al. Pregnancy outcomes associated with viral hepatitis. J Viral Hepat 2011; 18:e394.
- Safir A, Levy A, Sikuler E, Sheiner E. Maternal hepatitis B virus or hepatitis C virus carrier status as an independent risk factor for adverse perinatal outcome. Liver Int 2010; 30:765.
- Stevens CE, Beasley RP, Tsui J, Lee WC. Vertical transmission of hepatitis B antigen in Taiwan. N Engl J Med 1975; 292:771.
- Xu DZ, Yan YP, Choi BC, et al. Risk factors and mechanism of transplacental transmission of hepatitis B virus: a case-control study. J Med Virol 2002; 67:20.
- Stevens CE, Toy PT, Tong MJ, et al. Perinatal hepatitis B virus transmission in the United States. Prevention by passive-active immunization. JAMA 1985; 253:1740.
- Chen HL, Lin LH, Hu FC, et al. Effects of maternal screening and universal immunization to prevent mother-to-infant transmission of HBV. Gastroenterology 2012; 142:773.
- Thompson ND, Perz JF, Moorman AC, Holmberg SD. Nonhospital health care-associated hepatitis B and C virus transmission: United States, 1998-2008. Ann Intern Med 2009; 150:33.
- Guidelines for Perinatal Care. In: American Academy of Pediatrics and American College of Obstetricians and Gynecologists, 4th ed, Washington, DC 1997. p.286.
- Soldan K, Ramsay M, Collins M. Acute hepatitis B infection associated with blood transfusion in England and Wales, 1991-7: review of database. BMJ 1999; 318:95.
- Pan C, Han GR, Zhao W, et al. Virologic factors associated with failure to passive-active immunoprophylaxis in infants with HBsAg-positive at birth. Hepatology 2011; 54:878A.
- Burk RD, Hwang LY, Ho GY, et al. Outcome of perinatal hepatitis B virus exposure is dependent on maternal virus load. J Infect Dis 1994; 170:1418.
- Li XM, Shi MF, Yang YB, et al. Effect of hepatitis B immunoglobulin on interruption of HBV intrauterine infection. World J Gastroenterol 2004; 10:3215.
- Wiseman E, Fraser MA, Holden S, et al. Perinatal transmission of hepatitis B virus: an Australian experience. Med J Aust 2009; 190:489.
- Wen WH, Chang MH, Zhao LL, et al. Mother-to-infant transmission of hepatitis B virus infection: significance of maternal viral load and strategies for intervention. J Hepatol 2013; 59:24.
- Kubo A, Shlager L, Marks AR, et al. Prevention of vertical transmission of hepatitis B: an observational study. Ann Intern Med 2014; 160:828.
- Lin HH, Lee TY, Chen DS, et al. Transplacental leakage of HBeAg-positive maternal blood as the most likely route in causing intrauterine infection with hepatitis B virus. J Pediatr 1987; 111:877.
- Ohto H, Lin HH, Kawana T, et al. Intrauterine transmission of hepatitis B virus is closely related to placental leakage. J Med Virol 1987; 21:1.
- Bai H, Zhang L, Ma L, et al. Relationship of hepatitis B virus infection of placental barrier and hepatitis B virus intra-uterine transmission mechanism. World J Gastroenterol 2007; 13:3625.
- Zhang SL, Yue YF, Bai GQ, et al. Mechanism of intrauterine infection of hepatitis B virus. World J Gastroenterol 2004; 10:437.
- López M, Coll O. Chronic viral infections and invasive procedures: risk of vertical transmission and current recommendations. Fetal Diagn Ther 2010; 28:1.
- Towers CV, Asrat T, Rumney P. The presence of hepatitis B surface antigen and deoxyribonucleic acid in amniotic fluid and cord blood. Am J Obstet Gynecol 2001; 184:1514.
- Ko TM, Tseng LH, Chang MH, et al. Amniocentesis in mothers who are hepatitis B virus carriers does not expose the infant to an increased risk of hepatitis B virus infection. Arch Gynecol Obstet 1994; 255:25.
- Chen LZ, Zhou WQ, Zhao SS, et al. A nested case-control study of maternal-neonatal transmission of hepatitis B virus in a Chinese population. World J Gastroenterol 2011; 17:3640.
- Song YM, Sung J, Yang S, et al. Factors associated with immunoprophylaxis failure against vertical transmission of hepatitis B virus. Eur J Pediatr 2007; 166:813.
- Beasley RP, Stevens CE, Shiao IS, Meng HC. Evidence against breast-feeding as a mechanism for vertical transmission of hepatitis B. Lancet 1975; 2:740.
- Hill JB, Sheffield JS, Kim MJ, et al. Risk of hepatitis B transmission in breast-fed infants of chronic hepatitis B carriers. Obstet Gynecol 2002; 99:1049.
- Wang J, Zhu Q, Zhang X. Effect of delivery mode on maternal-infant transmission of hepatitis B virus by immunoprophylaxis. Chin Med J (Engl) 2002; 115:1510.
- Yang J, Zeng XM, Men YL, Zhao LS. Elective caesarean section versus vaginal delivery for preventing mother to child transmission of hepatitis B virus–a systematic review. Virol J 2008; 5:100.
- Shi Z, Yang Y, Ma L, et al. Lamivudine in late pregnancy to interrupt in utero transmission of hepatitis B virus: a systematic review and meta-analysis. Obstet Gynecol 2010; 116:147.
- Xu WM, Cui YT, Wang L, et al. Lamivudine in late pregnancy to prevent perinatal transmission of hepatitis B virus infection: a multicentre, randomized, double-blind, placebo-controlled study. J Viral Hepat 2009; 16:94.
- Reichen J et al. Hepatitis B Virusinfektion: Diagnose, klinische Folgen, Therapie und Prophylaxe. PRAXIS 2002;91:307-319.
- Michielsen PP, Van Damme P. Viral hepatitis and pregnancy. Acta Gastro-Enterologica Belgica 1999;72:21-29.
- Grob P, Jilg W, Bornhak H, Gerken G, Gerlich W, Günther S, Hess G, Hüdig H, Kitchen A, Margolis H, Michel G, Trepo C, Will H, Zanetti A, Mushahwar I. Serological Pattern of “Anti-HBc alone”: Report of a workshop. Journal of Medical Virology 2000;62:450-455
- G. Woo, G. Tomlinson; Y. Nishikawa; M. Kowgier; M. Sherman; DK. Wong; B. Pham; WJ. Ungar; TR. Einarson; EJ. Heathcote; M. Krahn, Tenofovir and entecavir are the most effective antiviral agents for chronic hepatitis B: a systematic review and Bayesian meta-analyses. in Gastroenterology, vol. 139, nº 4, ottobre 2010, pp. 1218-29
- J. Jones, J. Colquitt; J. Shepherd; P. Harris; K. Cooper, Tenofovir disoproxil fumarate for the treatment of chronic hepatitis B infection. in Health Technol Assess, 14 Suppl 1, maggio 2010, pp. 23-9
- CM. Perry, D. Simpson, Tenofovir disoproxil fumarate: in chronic hepatitis B. in Drugs, vol. 69, nº 16, novembre 2009, pp. 2245-56