L’assenza di una vagina adeguata per i rapporti sessuali è un problema psico-fisico molto importante che si pone in presenza di setti vaginali, ipoplasia vaginale o aplasia vaginale (S. di Morris, S. di Rokitansky-Kuster-Hauser, ermafroditismo, disgenesia gonadica, sinus urogenital syndrome, S. adrenogenitale,
agenesia del pene) (1,2).
L’obiettivo della vaginoplastica è quello di creare uno spazio fra il retto e la vescica che consenta soddisfacenti rapporti sessuali.
In genere c’è scarsa informazione riguardo a quale sia la migliore tecnica chirurgica da utilizzare in caso di aplasia e ipoplasia vaginale e sono carenti le notizie sui risultati a lungo termine (3) soprattutto riguardo alla vita sessuale (4,5,46). La tecnica non-chirurgica con i dilatatori vaginali, considerando l’ottimo rapporto costo/benefici, resta fondamentale per il trattamento di donne con ipoplasia vaginale e dovrebbe essere usata come prima tecnica ma occorre che il moncone vaginale sia elastico ed abbia una profondità di almeno 2 cm. Alcune pazienti sono capaci di sviluppare una vagina adeguata attraverso multipli tentativi di rapporti sessuali, ma questi soggetti sono l’eccezione piuttosto che la regola (6-8).
Le tecniche chirurgiche più comunemente utilizzate sono:
- Dilatatori meccanici di Frank
- Sellino di Ingram
- Vaginoplastica di Abbe-Wharton-Mclndoe
- Trapianto con colon sigmoideo sec. Pratt
- Intervento di Vecchietti classico
- Omental flaps
- Vulvo-vaginoplastica sec. Williams
- Intervento di Vecchietti in LPS
- Trasposizione peritoneale sec. Davydov e variante di Adamyan e Soong
- Neovagina con lembo di amnios
- Neovagina con lembi di mucosa buccale
- Neovagina con barriera assorbibile
- Balloon tecnique
- Flaps miocutanei (muscolo gracile)
- Flaps fasciocutanei pudendi (Malaga flaps)
Tutte le pazienti sono preliminarmente sottoposte ad accurato esame clinico ginecologico, determinazione del cariotipo, ecografia pelvica ed urografia.
1) Dilatazione vaginale sec.Frank: presenta buone percentuali di successo (70-80%) e scarse complicazioni per cui è da considerarsi come procedura standard per tutte le pazienti con un  minimo di introflessione vaginale. Sono disponibili molti tipi di dilatatori che vengono utilizzati per 20-60 minuti 2-3 volte al giorno collocati nella tasca vaginale e possono esse mantenuti in situ manualmente oppure con la biancheria intima o pantaloncini corti. Alla paziente viene consigliato di sedersi su una superficie dura (ad esempio una sedia di legno), esercitando pressione sul dilatatore, che è diretto lungo l’asse longitudinale della vagina. Il progresso iniziale può essere lento finché i fasci dell’elevatore dell’ano non si divaricano ma, una volta che questo è stato compiuto, la dilatazione può procedere rapidamente e in genere è completata entro 2-6 mesi (9). Il fastidio della lunga durata della terapia con dilatatori è compensata, in caso di successo, dall’aver evitato un intervento chirurgico e i rischi connessi, disporre di un tessuto embriologicamente destinato a tal luogo e a tali funzioni, assenza di perdite atipiche, assenza di odori sgradevoli, assenza di complicanze e necessità di reinterventi chirurgici, assenza di fallimenti a lungo termine.
minimo di introflessione vaginale. Sono disponibili molti tipi di dilatatori che vengono utilizzati per 20-60 minuti 2-3 volte al giorno collocati nella tasca vaginale e possono esse mantenuti in situ manualmente oppure con la biancheria intima o pantaloncini corti. Alla paziente viene consigliato di sedersi su una superficie dura (ad esempio una sedia di legno), esercitando pressione sul dilatatore, che è diretto lungo l’asse longitudinale della vagina. Il progresso iniziale può essere lento finché i fasci dell’elevatore dell’ano non si divaricano ma, una volta che questo è stato compiuto, la dilatazione può procedere rapidamente e in genere è completata entro 2-6 mesi (9). Il fastidio della lunga durata della terapia con dilatatori è compensata, in caso di successo, dall’aver evitato un intervento chirurgico e i rischi connessi, disporre di un tessuto embriologicamente destinato a tal luogo e a tali funzioni, assenza di perdite atipiche, assenza di odori sgradevoli, assenza di complicanze e necessità di reinterventi chirurgici, assenza di fallimenti a lungo termine.
2) Una variante di questo metodo è il sellino da bicicletta di Ingram, nel quale è usato uno sgabello simile a un sellino di bicicletta per applicare i dilatatori di diametro crescente; buoni risultati (70%) sono presentati dall’A. e da altri AA. anche con varianti, come l’introduzione di un fulcro che consente di variare la direzione del dilatatore (10-13).
3) Vaginoplastica di Abbe-Wharton-Mclndoe con innesto cutaneo di adeguato spessore è la procedura chirurgica più comunemente usata per la creazione di una neovagina. Può essere usata nelle pazienti in cui fallisce la dilatazione vaginale, in quelle che rifiutano di provare la dilatazione e in quelle che non hanno una tasca vaginale. Il perineo viene aperto con un’incisione trasversale attraverso la mucosa vaginale tra l’uretra anteriormente e la forchetta posteriormente. Il piano fasciale viene separato con una dissezione fine e smussata, che include la divisione del rafe mediano. Viene a crearsi una cavità lunga 10-12 cm con un diametro di 4- 5 centimetri. In questa fase deve essere fatta attenzione per evitare lesioni alla vescica o al retto (13,14). E’ praticata un’emostasi accurata con punti di sutura e applicazione di garze imbevute di acqua calda e adrenalina.
L’innesto cutaneo in genere è prelevato dalla regione glutea o dall’esterno coscia con dermatomero. Il lembo così ottenuto è forato con un grosso ago ed è posizionato su uno stampo di gommapiuma sgonfiabile e ricoperto da condom. Lo stampo ricoperto da cute è introdotto nello spazio creato e lasciato in situ per 7-10 giorni. Alcuni punti di sutura assicurano l’estremo distale dell’innesto alla cute vulvare. Ogni 7 giorni lo stampo viene sostituito con un altro simile; dopo un mese si inizia ad utilizzare uno stampo in silastic (12,13). Dopo 3 mesi si possono consentire i rapporti sessuali. Una dieta a basso contenuto di scorie è consigliata; la copertura antibiotica è assicurata dalla somministrazione di gentamicina 160 mgx2/die o amoxicillina-ac. clavulanico 1gr x2/die per 7 giorni (14,15).
Le complicazioni comprendono emorragie, cicatrizzazione anomala nel sito dell’innesto, dolore perineale, difficoltà a urinare e defecare nell’immediato periodo post-operatorio. La caduta dell’innesto può portare alla formazione di tessuto di granulazione con stenosi cicatriziale della volta vaginale (12-16). I dilatatori vaginali devono essere usati nel post-operatorio, per prevenire la stenosi, finché non vengono iniziati normali rapporti sessuali. In passato, veniva raccomandato l’uso di un innesto di amnios, per evitare il dolore e il pericolo di un innesto cutaneo (19). Questo approccio non è più raccomandato a causa della potenziale trasmissione di infezioni (15-18).
D) trapianto con colon sigmoideo sec. Pratt: un innesto di un segmento del colon sigmoideo è usato per creare un canale vaginale. Questa procedura è indicata soprattutto per le pazienti che hanno perso la funzione vaginale a causa di un intervento chirurgico pelvico radicale o di irradiazione (18-20).
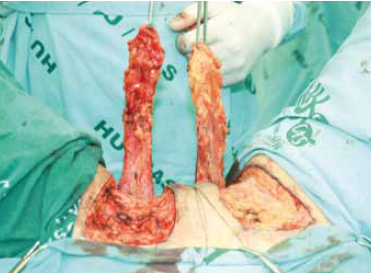
La tecnica chirurgica prevede un approccio combinato addomino-perineale (23). Nel tempo perineale viene praticata una dissezione tra l’uretra e il retto per creare un letto per il condotto colon neovaginale. Il tempo addominale prevede preliminarmente la mobilizzazione del colon sinistro (o discendente) fino alla flessura splenica. L’a. mesenterica inferiore, l’a. colica e l’a. emorroidaria superiore sono accuratamente identificate. Un segmento di 14 cm circa di sigma viene asportato con il suo peduncolo vascolare identificato nell’a. emorroidaria superiore con i rami retto-sigmoidei dopo aver sezionato e legato il ramo ascendente dell’a. colica e le arteriole sigmoidee e il relativo mesentere (fig. S1).
Il flap sigmoideo è ruotato sul suo asse di 180° (fig S2) per evitare lo stiramento dell’a. emorroidaria superiore e delle arterie retto-sigmoidee e fatto passare attraverso il tunnel addomino-perineale e fissato nella fossa vaginale (21-23).
L’estremità prossimale del sigma, ruotato di 180°, è tirato attraverso il canale vaginale fino a che sporga di . circa 3-4 cm dall’introitus. Un segmento di 3-4 cm di prolasso è essenziale perché nel periodo post-operatorio ci sarà la tendenza alla retrazione. Se il flap fosse resettato a filo con la rima vulvare si produrrebbero stiramenti e stenosi dell’innesto nel post-operatorio (fig. S3)
Si procede quindi ad anastomosi termino-terminale fra Il moncone rettale e il colon sinistro con la cucitrice SEE come di routine nelle emicolectomie.
Un tutore vaginale in gommapiuma morbida viene posto in vagina e bloccato con pochi punti. Dopo 2-3 settimane, in ambulatorio, si rimuove il tutore e, con bisturi elettrico, l’eccesso di flap. I rapporti sessuali sono consentiti a cicatrizzazione avvenuta.
Le principali complicanze dell’intervento di Pratt sono rappresentate da: eccessive secrezioni mucose anche maleodoranti, stenosi vulvare, prolasso della mucosa, ostruzione parziale della vescica, ematoma perineale, infezioni superficiali, prolasso vaginale, nonché le complicanze chirurgiche associate alla resezione del colon, compresa la morte della paziente (18-23).
5) Intervento di Vecchietti: La tecnica che Vecchietti introdusse nel 1965 prevede l‘inserimento, a livello del fondo cieco della vagina, di una dispositivo di forma ovalare che viene successivamente messo in trazione continua con fili che dall’interno dell’addome fuoriescono all’esterno e sono progressivamente stirati in alto di 1 cm al giorno mediante un semplice apparecchio meccanico (27-31). Il grande vantaggio è che la vagina è formato dal tessuto embriologicamente destinato a quella funzione (24,25). La gravidanza non è possibile per queste donne che possono, nei paesi dove ciò è permesso, usufruire della fecondazione in vitro con propri ovociti e della maternità surrogata (“utero in affitto”).
Complicanze ed effetti indesiderati della tecnica di Vecchietti:
- solleva l’angolo posteriore uretro-vescicale, rendendolo più ottuso, con rischio di causare incontinenza urinaria da sforzo ed, in seguito, incontinenza da stress.
- variazione del pavimento pelvico equilibrio è stato sospettato (77).
- la necessità di utilizzare lo speciale dispositivo di trazione addominale per molti giorni (78).
G) Omental “J” flap: Questa tecnica si può applicare in pazienti sottoposte a totale  eviscerazione pelvica con o senza coloproctostomia. In queste circostanze, la vagina potrebbe essere ricostruita con un lembo omentale (36). L’intervento è effettuato in anestesia generale con la paziente i posizione litotomica. Modificando il lembo omentale (flap), si può creare un cilindro omentale che viene suturato all’introito vulvare ed allineato con un innesto
eviscerazione pelvica con o senza coloproctostomia. In queste circostanze, la vagina potrebbe essere ricostruita con un lembo omentale (36). L’intervento è effettuato in anestesia generale con la paziente i posizione litotomica. Modificando il lembo omentale (flap), si può creare un cilindro omentale che viene suturato all’introito vulvare ed allineato con un innesto  cutaleo. Circa il 40% delle pazienti riferiscono di ave sperimentato l’orgasmo sessuale. L’innesto cutaneo prelevato dalle natiche o interno cosce possiede recettori e alla fine diventa indistinguibile dalla mucosa vaginale normale. Attualmente, non è noto se l’indice di maturazione del trapianto può essere influenzata dalla somministrazione di estrogeni. La neovagina deve rimanere dilatata mediante un tutore vaginale fino a quando la guarigione è completa. Successivamente, un tutore morbido in Silastic deve rimanre applicato per 24 ore/24 per 6 mesi, tranne che durante i rapporti sessuali ovviamente. Dopo questo periodo, il tutore in vaginale in Silastic verrà applicato solo di notte (26).
cutaleo. Circa il 40% delle pazienti riferiscono di ave sperimentato l’orgasmo sessuale. L’innesto cutaneo prelevato dalle natiche o interno cosce possiede recettori e alla fine diventa indistinguibile dalla mucosa vaginale normale. Attualmente, non è noto se l’indice di maturazione del trapianto può essere influenzata dalla somministrazione di estrogeni. La neovagina deve rimanere dilatata mediante un tutore vaginale fino a quando la guarigione è completa. Successivamente, un tutore morbido in Silastic deve rimanre applicato per 24 ore/24 per 6 mesi, tranne che durante i rapporti sessuali ovviamente. Dopo questo periodo, il tutore in vaginale in Silastic verrà applicato solo di notte (26).
Il moncone rettale è stata lasciato, è sta praticata una sigmoidostomia. L’omento è stato portato giù come uno sportello ed è stato suturato al promontorio sacrale posteriormente e della sinfisi pubica anteriormente. Quindi il cilindro è sturato alla parete vaginale.
7) Vulvo-vaginoplastica sec. Williams: prevede la creazione di un ponte perineale usando le piccole labbra. I suoi vantaggi sono la semplicità e la possibilità che non sia necessario l’uso di dilatatori; tuttavia richiede un buon sviluppo labiale e determina un angolo vaginale anormale (27).
8) Tecnica di Vecchietti varietà laparoscopica: La variante laparoscopica fu introdotta da Gauwerky (28-31) nel 1992 ed offre buoni risultati con maggiore compliance delle pazienti (32)
Dopo aver svuotato la vescica tramite cateterismo, si pratica adeguato pneumoperitoneo
e il laparoscopio è introdotto per via transombelicale. Due trequarti ancillari vengono introdotti in zona sovrapubica per favorire una perfetta esplorazione pelvica; quindi questi due trocart vengono ritirati e le le due porte di accesso utilizzate per introdurre da entrambi i lati un ago dritto che viene fatto passare fra vescica e retto fino a raggiungere e perforare il moncone vaginale (fig. 3A). I fili sono collegati al dispositivo vaginale (fig. 3B) e al dispositivo sovrapubico e messi in tensione. Un’ulteriore variazione prevede che i fili di trazione siano sostituiti da sling Reemex, utilizzate nella terapia chirurgica dell’incontinenza urinaria da sforzo, e il dispositivo di trazione addominale è posizionato all’altezza della linea interspino-iliaca. Tale posizionamento permette una trazione più orizzontale che evita la compressione sull’uretra. L’integrità di vescica e retto vengono monitorati continuamente mediante cistoscopio e rettoscopio (27-32).
Riassumendo la tecnica di Vecchietti versione laparoscopica prevede:
- cateterizzazione vescicale
- esplorazione rettale per valutazione del tessuto perineale dove ricavare lo spazio per la neovagina.
- pressione con uno o due dita sulla membrana vaginale in modo da creare un punto di riferimento per l’endoscopista
- sotto controllo lps, penetrazione in cavità addominale con ago montato che perfora la membrana pseudo-imeneale e il peritoneo.
- una pinza laparoscopica tira i fili nella cavità addominale e quindi esternamente per via extra-peritoneale.
- i fili di trazione vengono passati attraverso il supporto di base rettangolare addominale e collegati al varitensor.
- Si avvia la trazione.
Il dispositivo di trazione viene rimosso dopo che la neovagina ha raggiunto la profondità di almeno 7-8 cm, che in genere si ottiene tra il sesto e il nono giorno dopo l’intervento chirurgico. Le pazienti potrebbero essere dimesse dall’ospedale 48-72 ore dopo l’intervento e monitorate ogni 48 ore in modo da regolare la tensione del filo. La terapia analgesica adeguata è di solito necessaria già da subito, prima ancora di regolare la tensione del filo. La valutazione della maturazione vaginale è effettuata dopo 6 e 12 mesi mediante vaginoscopia e test di Schiller.
9) Trasposizione peritoneale sec. Davydov e variante di Adamyan e Soong:
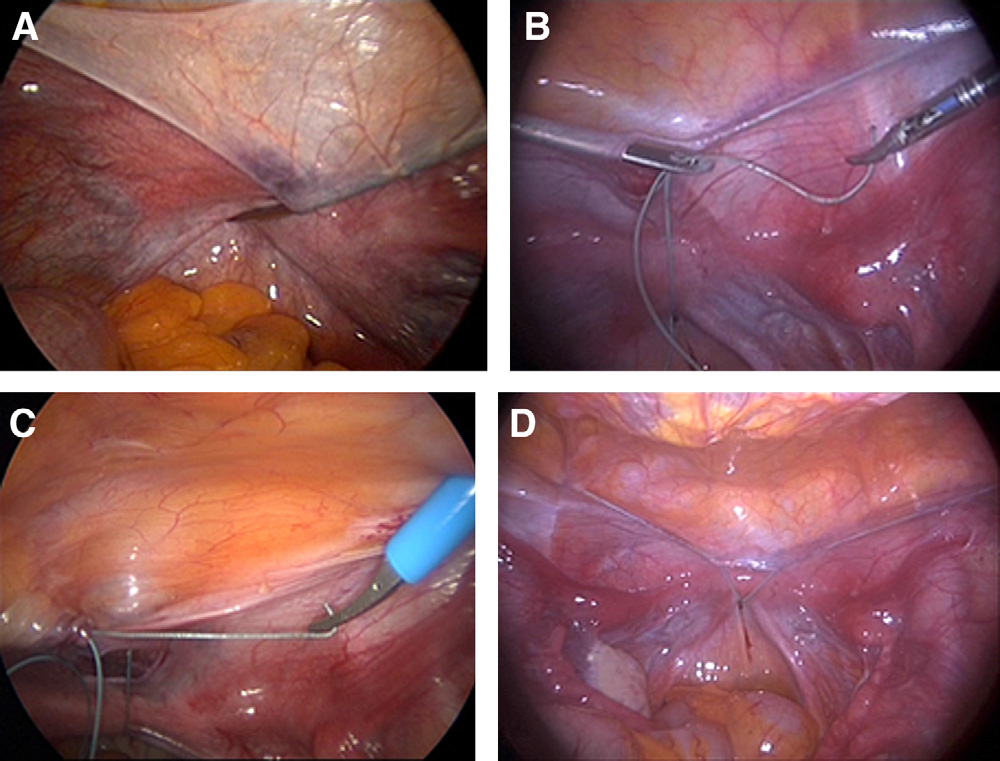
La tecnica di trasposizione peritoneale laparoscopica di Davydov modificata da Adamyan e Soong, comporta un duplice approccio: laparoscopico e perineale. In laparoscopia si esplorano gli organi addomino-pelvici, si sollevano le tube e si visualizza il peritoneo immediatamente sottostante che viene inciso trasversalmente per 4-5 cm. Sotto la guida del dito indice inserito nel retto della paziente, questa incisione viene approfondita per circa 1 cm nel tessuto connettivo che separa la vescica dal retto (fig. A). Per mobilizzare il peritoneo, si tagliano entrambi i ligamenti rotondi e si completa la incisione fra i due ligamenti (fig. B). Si visulizzano entrambi gli ureteri (fig. C) e la giunzione retto-sigmoidea (fig. D) (33-36).
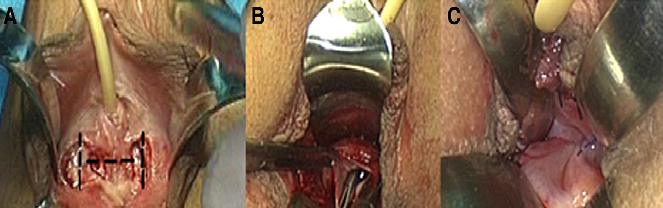
Il tempo perineale prevede l’incisione del moncone vaginale e il collegamento con lo spazio addominale creato laparoscopicamente. L’incisione vaginale è a forma di H con un taglio trasversale alla base delle piccole labbra e due incisioni verticali lateralmente alle estremità della incisione trasversale (Fig. 2A). La dissezione tra la vescica e retto è continuata in alto creando due gallerie paramediane, mentre il rafe mediano è tagliato in seguito. Il chirurgo procede per via smussa e taglientie fino a giungere sui margini peritoneali precedentemente incisi per via lps. I margini peritoneali vengono poi collegati alla mucosa del vestibolo con punti staccati, partendo dalla linea mediana dove la mobilitazione dei margini è più semplice (Fig. 2B). Quando la sutura è completata un tampone di garza paraffinata viene inserito nella neo-vagina (Fig. 2C). La rimozione del catetere e del tampone vaginale e l’applicazione di dilatatori vaginali vengono praticati 48 ore dopo l’intervento chirurgico (35-45).
10) Neovagina con amnios: si utilizza la tecnica chirurgica di McIndoe modificata utilizzando, al posto di un lembo cutaneo, il sacco amniotico di un parto a termine appena  espletato di gravidanza fisiologica (46-52). Dopo gli entusiasmi iniziali, e nonostante la provata attitudine dell’epitelio amniotico alla trasformazione metaplastica in epitelio squamoso (52), tale metodica è stata quasi completamente abbandonata a causa del fallimento del trapianto a lungo termine dovuto a retrazione del tessuto amniotico, a necrosi dello stesso insufficiente vascolarizzazione e per la compressione esercitata dalle pareti vaginali (55).
espletato di gravidanza fisiologica (46-52). Dopo gli entusiasmi iniziali, e nonostante la provata attitudine dell’epitelio amniotico alla trasformazione metaplastica in epitelio squamoso (52), tale metodica è stata quasi completamente abbandonata a causa del fallimento del trapianto a lungo termine dovuto a retrazione del tessuto amniotico, a necrosi dello stesso insufficiente vascolarizzazione e per la compressione esercitata dalle pareti vaginali (55).
11) Neovagina con mucosa buccale (53)
12) Neovagina con barriera assorbibile (54)
13) Neovagina con flap miocutaneo gracile:
La paziente è collocata in posizione litotomica modificata con le ginocchia flesse di 30°; disinfezione perineale, anestesia generale. Una linea segna il riconoscimento del muscolo gracile. Un lembo cutaneo  di 21 cm di lunghezza e 6 cm di larghezza è scolpito avendo al centro la linea del gracile (fig. G1)
di 21 cm di lunghezza e 6 cm di larghezza è scolpito avendo al centro la linea del gracile (fig. G1)
L’incisione comprende cute e sottocute fino ai fasci muscolari (fig. G2). Il tratto prossimale viene risparmiato per assicurare l’innervazione e l’irrorazione.
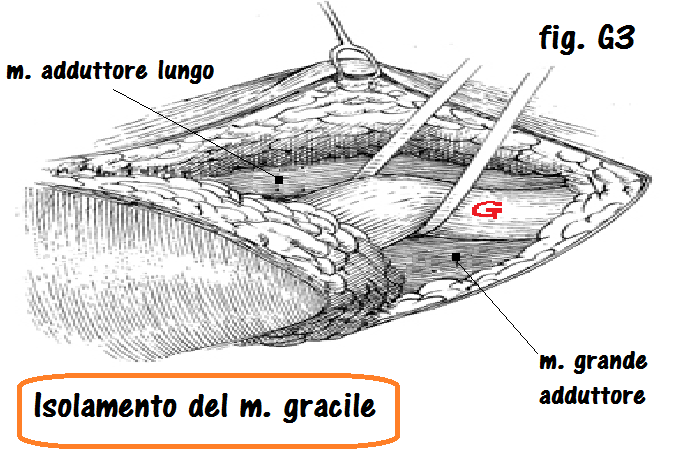
Il muscolo gracile è isolato e sollevato mediante fettuccia ombelicale. Nella fig. G3 si riconoscono, oltre al muscolo gracile (G), il m. grande adduttore e l’adduttore lungo.
 Il muscolo gracile è sezionato ad una distanza di 21 cm circa dal capo prossimale ischiatico (fig. G4)
Il muscolo gracile è sezionato ad una distanza di 21 cm circa dal capo prossimale ischiatico (fig. G4)
Il m. gracile è suturato sul lembo cutaneo con punti staccati assorbibili n. 0 (fig. G5).
Escissione del tratto prossimale del m. gracile con una piccola forbice di Metzenbaum fino all’area neuro-vascolare che deve essere scrupolosamente lasciata intatta per assicurare l’irrorazione e la sensibilità del flap (fig. G6).
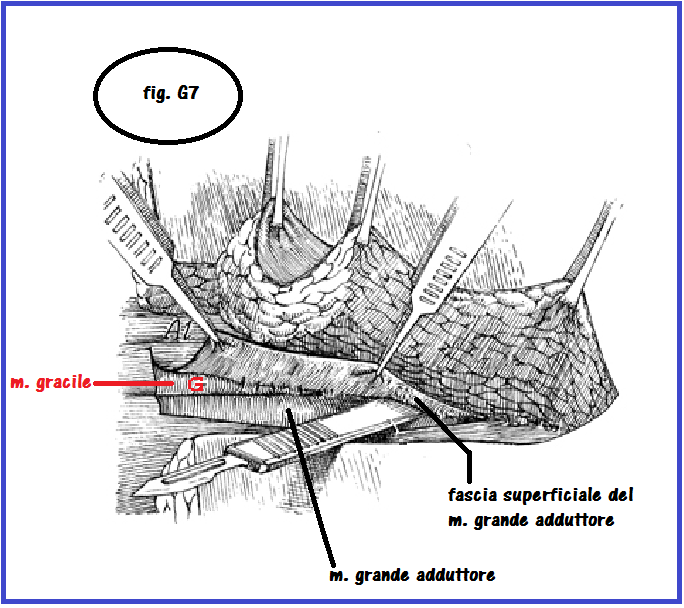
La localizzazione del fascio neuro-vascolare può essere facilitata incidendo la fascia superiore del m. grande adduttore e scollandola in direzione mediale mediante uno strumento non tagliente come il manico del bisturi (fig. G7) e con l’ausilio del color-doppler
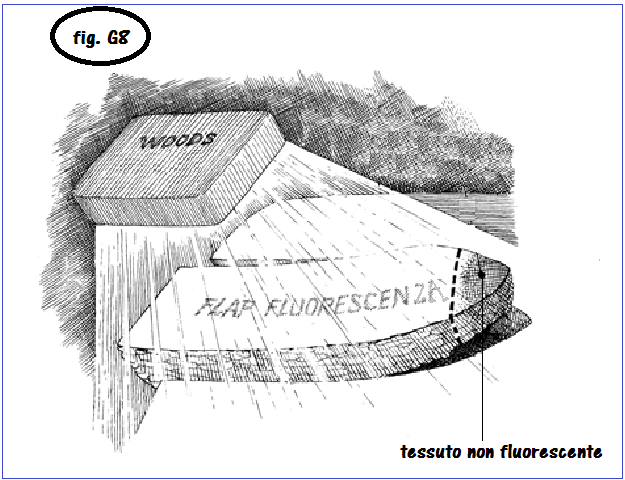
La lampada di Wood è utilizzata per valutare la vitalità del flap: Tre minuti dopo aver iniettato ev alla paziente 10 cc di soluzione di fluoresceina al 10%, i tessuti vitali appariranno di un colore giallo vivo mentre una colorazione viola scuro indicherà tessuto non vitale e quindi da eliminare prima dell’innesto.
La porzione distale del m. gracile viene sezionata dall’attacco ischiatico e suturata sul lembo cutaneo.
il flap completamente libero con il suo peduncolo vascolo-nervoso viene fatto passare sotto le grandi labbra e posizionato nella cavità vaginale dove si affronterà con il flap controlaterale. E’ importante, al fine di assicurare la sensibilità erogena della neovagina, salvaguardare la funzionalità delle terminazioni sottolabiali del nervo pudendo e del nervo cutaneo posteriore .I problemi di questa tecnica sono l’entità della cicatrice, la difficoltà di posizionamento del lembo nella neo-cavità ed il rischio di necrosi del flap (55,67-69).
14) Flaps fasciocutanei pudendi (Malaga flaps): consentono la ricostruzione vaginale e una connessione uterovaginale nelle pazienti con agenesia vaginale e un utero funzionale. La pz. ò posta in posizione litotomica. Sulla zona crurale vengono marcate le linee di incisione dei flaps (fig. P1) che sono creati da un’incisione di 15 x 6 cm, dal margine laterale delle grandi labbra al margine mediale delle cosce. L’incisione scolpisce i lembi in profondità fino alla fascia profonda dei muscoli adduttori della coscia (fig. P2). Il peducolo prossimale del lembo è lascato integro per preservarne l’irrorazione. Due tunnel sono praticati sotto le grandi labbra bilateralmente dai margini mediali dei lembi fino alla tasca retto-vaginale appena creata. In questi tunnel vengono fatti passare i flaps che rivestiranno la vagina. Le estremità distali vengono suturate alla cervice uterina dove si incroceranno con un angolo di 70-90°; le estremità prossimali verranno suturate alla rima vulvare. Si ottiene una vagina di 9 cm circa che non necessita di dilatazione post-operatoria nè di tutori vaginali. L’irrorazione dei flaps è assicurata dai rami terminali dall’a. perineale superficiale. La sensibilità erogena della neovagina è da riferire al nervo pudendo e al nervo cutaneo posteriore (56-64) .
I principali vantaggi di questa tecnica sono la non necessità di dilatazione postoperatoria, la salvaguardia della sensibilità erogena e la cicatrice poco appariscente (56-65).. Lo svantaggio principale è la presenza di alcuni secrezioni vaginali sebacea e la presenza di peli nel rivestimento vaginale; quest’ultima può essere attenuata da pre e postoperatoria depilazione laser (66-69).

15. Balloon vaginoplastica: introdotta da Ali El Saman nel 2007 utilizzando il palloncino del catetere di Foley che viene inserito, in laparoscopia, nello spazio retto-uterino creato mediante dissezione per via smussa. Il catetere viene fatto avanzare con cautela e gradualità (70-76).
Come ogni tecnica innovativa, è stata sottoposta a numerose variazioni e modifiche allo scopo di ottenere il massimo di sicurezza ed efficacia.
Vantaggi della balloon vaginoplastica rispetto alle altre tecniche che utilizzano flaps tissutali:
- Assenza di rischio di neoplasia del tessuto esogeno. Il cancro della neovagina è stato documentato con una frequenza inquietante ed insorge in epoca precoce rispetto al cancro della vagina naturale (79). Si suppone che la displasia del tessuto trapiantato sia imputabile allo stress meccanico a cui è stato sottoposto e al contatto di nuovi tessuti diversi da quelli naturali.
- Assenza di cicatrici
- Minore incidenza di stenosi
- Minore incidenza di dispareunia
- Minore incidenza di morbidità e mortalità
Per tutti questi motivi, la maggior parte degli AA. a livello mondiale sono attualmente orientati a favorire gli interventi di dilatazione vaginale che presentano una percentale di successo dell’81% e bassi indici di complicazioni (80-84).
Tecnica chirurgica: in anestesia generale viene inserita un’ottica laparoscopica di 10 mm e due trocar ancillari da 5 mm sovrapubici.
Dopo aver effettuata un’eplorazione generale pelvi-addominale, si afferra il peritoneo che ricopre lo spazio retto-vescicale, lo si incide e si crea, per via smussa, una tasca retto-vaginale fino a raggiungere la cupola dell’abbozzo vaginale. Per evitare lacerazioni rettali può essere di aiuto una garza montata inserita nel retto e un catetere metallico inserito in vescica che vengono manovrati dall’esterno, su indicazione dell’operatore, per allontanare il retto e la vescica dalla linea di dissezione.
Il trocar ancillare di sinistra viene estratto e sostituito da una pinza smussata che effettua un delicato scollamento del peritoneo dal punto di penetrazione del trocar rimosso fino alla tasca retto-vescicale appena creata.
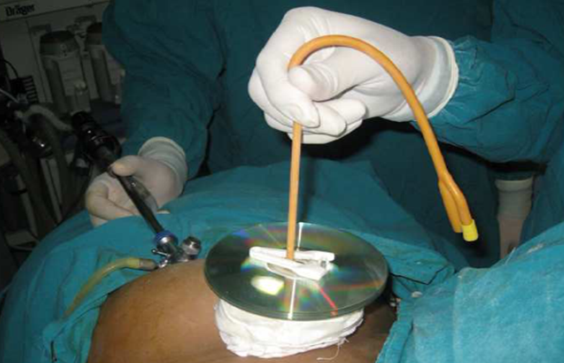
Si rimuove questa pinza e attraverso la via da essa creata viene fatto avanzare un catetere di Foley 18F siliconato che attraversa il tunnel appena creato fino a raggiungere la tasca retto-vescicale.
Un pinza a punta sottile penetra la cupola vaginale, afferra la punta del foley e la porta all’esterno. Il palloncino del Foley è gonfiato con 6 ml di soluzione salina.
Si mette in tensione il catetere e lo si blocca a livello cutaneo con due pinze da cordone ombelicale posizionate sopra un supporto metallico a sua volta poggiato su uno strato garze sterili ed ovatta per evitare lacerazioni cutanee.
Varianti tecniche
!) Vaginoplastica ballon laparoscopica senza dissezione della tasca retto-vescicale:
Un catetere di Foley viene manipolato da un inseritore appositamente progettato, per farlo passare extra  peritonealmente fino a raggiungere la cupola vaginale. Una pinza è introdotta attarverso la fosseta vaginale per portare all’esterno la punta del catetere. Dopo aver gonfiato il palloncino con 6 ml di soluzione fisiologia, il catetere è posto in trazione e fissato all’esterno. Una graduale trazione di 1-2 cm al giorno è applicata sullo stelo del catetere dal lato addominale per una settimana. I rapporti sessuali sono consigliati fin da una settimana dopo l’intervento (85,86).
peritonealmente fino a raggiungere la cupola vaginale. Una pinza è introdotta attarverso la fosseta vaginale per portare all’esterno la punta del catetere. Dopo aver gonfiato il palloncino con 6 ml di soluzione fisiologia, il catetere è posto in trazione e fissato all’esterno. Una graduale trazione di 1-2 cm al giorno è applicata sullo stelo del catetere dal lato addominale per una settimana. I rapporti sessuali sono consigliati fin da una settimana dopo l’intervento (85,86).
2) Vaginoplastica con Foley per via retropubica: la vescica è cateterizzata con catetere rigido. Viene effettuata un’incisione di 7 mm appena lateralmente alla linea mediana e 2 cm sopra la sinfisi pubica. Un ago da pick-up ovocitario con il mandrino viene piegato per assecondare la curvatura dello spazio del Retzius fra parete anteriore della vescica e pube, viene fissato alla punta del catetere di Foley e introdotto, attraverso la breccia cutanea appena praticata, nello spazio di Retzius in direzione della cupola vaginale. Il chirurgo con il dito indice della mano sinistra tende la cupola vaginale in modo da creare un punto di riferimento per l’ago che scende guidato dalla mano destra dello stesso chirurgo. Una piccola incisione della cupola vaginale consente al dito del chirurgo di avvicinarsi ancora di più alla punta dell’ago e di facilitrne il passaggio. Durante la fase di passaggio, il catetere rigido posto in vescica viene spinto lateralmente per evitare lacerazioni della vescica che viene controllata con cistoscopio appena completata la fase di passaggio (87). L’estremità prossimale del Foley è fissata ad una piastra fenestrata di acciaio con pinze da cordone ombelicale.
3° Vaginoplastica con trazione trans-retropubica: un’incisione sovrapubica larga 7 mm viene praticata bilateralmente alla linea mediana e 2 cm sopra la sinfisi. Un grosso ago a sciabola viene caricato con mesh in prolene di 1 cm di larghezza e 30 cm di lunghezza e fatto passare dall’estremità laterale del moncone vaginale all’incisione sovrapubica. Il capo prossimale è bloccato da una pinza mentre il capo distale, vaginale ,è inserito e legato in uno dei due fori di in un dispositivo di propilene a forma di oliva fornito di 2 fori laterali. Il catetere vescicale mandrinato viene spostato controlateralmente per evitare danni vescicali durante il passaggio dell’ago. Un controllo cistoscopico rassicura sull’integrità vescicale. Un catetere a permanenza assicurerà la pervietà uretrale durante gli 8 giorni di trazione (88-90). Il vantaggio della tecnica è ovvia: non richiede laparotomia o laparoscopia e l’introduzione dell’ago è piuttosto agevole soprattutto se si utilizzano aghi progettati ad hoc con finestra anteriore che evita la necessità di estrazione dell’ago dall’incisione sovrapubica (91-92).
BIBLIOGRAFIA:
- Griffen JE,Creighton E,Madden JD,Harrod MJ,Wilson JD.Congenital absence of the vagina:the Mayer-Rokitansky-Küster-Hauser syndrome.Ann Intern Med 1976; 85:224-236.
- Strubbe EH, Thijn CJ, Willemsen WN, Lappohn R. Evaluation of radiographic abnormalities of the hand in patients with the Mayer-Rokitansky-Kuster-Hauser syndrome. Skeletal Radiol 1987;16:227-31
- Mobus VJ, Kortenhorn K, Kreienberg R, Freidberg V.Long term results after operative correction of vaginal aplasia.Am J Obstet Gynecol 1996; 175:617-624.
- Aittomaki C, Eroila H, Kajanoja P. A population-based study of the incidence of Mullerian aplasia in Finland. Fertil Steril 2001;76:624-5. 4. Edmonds DK. Congenital malformations of the genital tract. Obstet Gynecol Clin North Am 2000;27:49-62
- Laufer MR. Congenital absence of the vagina: in search of the perfect solution. When, and by what technique, should a vagina be created? Curr Opin Obstet Gynecol. 2002 Oct;14(5):441-4.
- Minna M Joki-Erkkilä, Pentti K Heinonen: “Presenting and long-term clinical implications and fecundity in females with obstructing vaginal malformations”. J Ped Adolesc Gynecol 2003;16,5:307-312
- Lindenman E, Shepard MK, Pescovitz OH (1997). Miillerian agenesis: an update. Obstet Gynecol 90, 307-312.
- Rock JA (1997). Surgery for anomalies of the miillerian ducts. In: Rock JA, Thompson JD, eds. Te Linde’s operative gynecology. 8’ ediz. Philadelphia: Lippincott-Raven, 687-729.
- Frank R.T: The formation of an artificial vagina without operation. Am Obstet Gynecol 1938; 35:1053- 5.
- Lee MH Non-surgical treatment of vaginal agenesis using a simplified version of Ingram’s method. Yonsei Med J. 2006 Dec 31;47(6):892-5.
- Ingram JM. The bicycle seat stool in the treatment of vaginal agenesis and stenosis: a preliminary report. Am J Obstet Gynecol. 1981 Aug 15;140(8):867-73.
- Lankford JA1, Haefner HK. Modification of the Ingram bicycle seat stool for the treatment of vaginal agenesis and stenosis. Int J Gynaecol Obstet. 2008 Sep;102(3):301-3. doi: 10.1016/j.ijgo.2008.04.018. Epub 2008 Jul 7.
- Williams JK, Lake M, Ingram JM. The bicycle seat stool in the treatment of vaginal agenesis and stenosis. J Obstet Gynecol Neonatal Nurs. 1985 Mar-Apr;14(2):147-50.
- S. Saraf, P. Saraf, McIndoe Vaginoplasty: Revisited in The Internet Journal of Gynecology and Obstetrics, vol. 6, nº 2, Internet Scientific Publications, 2007,
- Sas A., Martínez de la Tejada B., Dexeus S., et al. “Reconstrucción Vaginal mediante Técnica de McIndoe”. Prog. ObstetGinecol. 2001; 44:17-22
- Grio R., Ambroggio G. P., D’Addato F., Bello L., Leotta E., Tersiev P., Febo G., Tessarolo M., Lanza A.: “Proposta di nuova metodica di neovagina nella sindrome di Rokitansky. Revisione della letteratura ed illustrazione della casistica”. Minerva Ginecologica 2002 Aprile;54(2):161-70
- McIndoe AH, Bannister JB.An operation for the cure of congenital absence of the vagina. J Obstet Gynaecol Br Emp 1938; 45: 490- 494.
- McIndoe A. The treatment of congenital absence and obliterative conditions of vagina. Br J Plast Surg 1950; 2:254-67
- Hojsgaard A, Villadsen I. Mcindoe procedure for congenital vaginal agenesis: complications and results. Br J Plast Surg 1995; 48(2):97-102.
- Franz RC. Sigmoid colon vaginoplasty: a modified method.Br J Obstet Gynecol 1996; 103:1148-1155.
- Parsons JK, Gearhart SL, Gearhart JP. Vaginal reconstruction utilizing sigmoid colon: Complications and long-term results. J Pediatr Surg. 2002 Apr;37(4):629-33.
- Khen-Dunlop N, Lortat-Jacob S, Thibaud E, Clément-Ziza M, Lyonnet S, Nihoul-Fekete C. Rokitansky syndrome: clinical experience and results of sigmoid vaginoplasty in 23 young girls. J Urol. 2007 Mar;177(3):1107-11.
- Kapoor R, Sharma DK, Singh KJ, Suri A, Singh P, Chaudhary H, Dubey D, Mandhani A.Sigmoid vaginoplasty: long-term results. Urology. 2006 Jun;67(6):1212-5.
- Hiroi H, Yasugi T, Matsumoto K, Fujii T, Watanabe T, Yoshikawa H, Taketani Y. Mucinous adenocarcinoma arising in a neovagina using the sigmoid colon thirty years after operation: a case report. J Surg Oncol. 2001 May;77(1):61-4.
- Vecchietti G, [Creation of an artificial vagina in Rokitansky-Küster-Hauser syndrome] in Attual Ostet Ginecol, vol. 11, nº 2, 1965, pp. 131–47, PMID 5319813.
- Vecchietti, G. “Creazione de neovagina secondo Vecchietti”. In Trattato di Técnica chirurgica. Vol. XVI/1: 249-253. Editorial Utet. Torino.1986
- Creatsas G, Deligeoroglou E, Makrakis E, Kontoravdis A. Papadimitriou L. Creation of a neovagina following Williams vaginoplasty and Creatsas modification in 111 patients with Mayer-Rokitansky-Kuster-Hauser syndrome. Fertil Steril 2001; 76:1036–40.
- Frantzides C.T., Madan AK, Ferguson RL, Kumari NVA; Laparoscopic omentalcerebellar pedicled graft harvest; Surg. Laparosc. Endosc. & Percutaneous 12:383-386,2002.
- ^ Fedele L, Bianchi S, Tozzi L, Borruto F, Vignali M, A new laparoscopic procedure for creation of a neovagina in Mayer-Rokitansky-Kuster-Hauser syndrome in Fertil. Steril., vol. 66, nº 5, 1996, pp. 854–7, PMID 8893702.
- Gawerky JF, Wallwiener D, Bastert G., “An endocopically assisted technique for construction of a neovagina”. Arch Gynecol. Obstet. 1992; 252(2): 59-63
- Stefano Bianchi, Giada Frontino, Nevio Ciappina, Elisa Restelli, and Luigi Fedele, Creation of a neovagina in Rokitansky syndrome: comparison between two laparoscopic techniques Fertil Steril 2011;95,3:1098-1101
- Fedele L, Bianchi S, Frontino G, Fontana E, Restelli E, Bruni V. The laparoscopic Vecchietti’s modified technique in Rokitansky syndrome: anatomic, functional, and sexual long term results. Am J Obstet Gynecol 2008;198:377.e1–6.
- Fedele L, Busacca M, Candiani M, Vignali M. Laparoscopic creation of a neovagina in MayerRokitansky-Kuster-Hauser syndrome by modification of Vecchietti’s operation. Am J Obstet Gynecol 1994;171:268–9
- Davydov SN. Colpopoiesis from the peritoneum of the uterorectal space. Akush Ginekol (Mosk) 1969;45:60-2.
- Davydov SN, Zhvitiascvili OD. Formation of vagina (colpopoiesis) from peritoneum of Douglas pouch. Acta Chir Plast 1974;16:35-41.
- Friedberg V. [Die bildung einter Kunstilchen Sheide mittels peritoneum]. Geburtsh Frauenheilkd 1974;34:719-23.
- Soong YK, Chang FH, Lai YM, Lee CL, Chou HH. Results of modified laparoscopically assisted neovaginoplasty in 18 patients with congenital absence of vagina. Hum Reprod 1996;11:200-3
- Adamyan LV, Kulakov VIVI, Murvatov KD, Zurabiani Z. Application of endoscopy in surgery for malformations of genitalia. J Am Assoc Gynecol Laparosc 1994;1:S1.
- Soong YK, Chang FH, Lai YM, Lee CL, Chou HH. Results of modified laparoscopically assisted neovaginoplasty in 18 patients with congenital absence of vagina. Hum Reprod 1996;11:200–3.
- Dargent D, Marchiole P, Giannesi A, Benchaib M, Chevret-Measson M, Mathevet P. Laparoscopic Davydov or laparoscopic transposition of the peritoneal colpopoiesis described by Davydov for the treatment of congenital vaginal agenesis: the technique and its evolution. Gynecol Obstet Fertil 2004;32:1023–30. 9.
- Fedele L, Frontino G, Restelli E, Ciappina N, Motta F, Bianchi S. Creation of a neovagina by Davydov’s laparoscopic modified technique in patients with Rokitansky syndrome. Am J Obstet Gynecol 2010;202:33.e1–6.
- Templeman CL, Hertweck SP, Levine RL, Reich H. Use of laparoscopically mobilized peritoneum in the creation of a neovagina. Fertil Steril 2000;74:589-92.
- Giannesi A, Marchiole P, Benchaib M, Chevret-Measson M, Mathevet P, Dargent D. Sexuality after laparoscopic Davydov in patients affected by congenital complete vaginal agenesis associated with uterine agenesis or hypoplasia. Hum Reprod 2005;20:2954-7.
- Delga P, Potiron L. Sigmoid colpoplasty by laparoscopic and perineal surgery: a first case relative to Rokitansky-Kuster-Hauser syndrome. J Laparoendosc Adv Surg Tech 1997;7:195-9. 22.
- Darai E, Toullalan O, Besse O, Potiron L, Delga P. Anatomic and functional results of laparoscopic-perineal
- Ashworth MF, Morton KE, Dewhurst J, Lilford RJ, Bates RG. Vaginoplasty using amnion. Obstet Gynecol, 1986; 67:443-446.
- C. Fotopoulou, J. Sehouli, N. Gehrmann, I. Schoenborn and W. Lichtenegger. Functional and anatomic results of amnion vaginoplasty in young women with Mayer-Rokitansky-Kuster-Hauser syndrome (MRKH). Fertility and Sterility. 2010; 94:217-322
- Sethi Pruthwiraj, Devi Sujata, Achanta Vivekanand, Samantroy Subharanjan: Vaginoplasty by using amnion graft in a patient of vaginal agenesis associated with MayerRokitansky-Kuster-Hauser Syndrome. Perspectives in medical research 2013; 1: 26-28
- Chohan A, Burr F, Mansoor H, Falak T. Amnion graft in vaginoplasty–an experience at 3 teaching hospitals of Lahore. Biomedica 2006;22(1):21–4.
- Sarwar I, Sultana R, Nisa R U, Qayyum I. Vaginoplasty using amnion graft in patients of vaginal agenesis associated with Mayer-Rokitansky-Kuster-Hauser syndrome. J Ayub Med Coll Abbottabad 2010; 22 : 7-10.
- L.F. Bleggi-Torres, B. Werner and M.J. Piazza: Ultrastructural study of the neovagina following the utilization of human amniotic membrane for treatment of congenital absence of the vagina. Braz J Med Biol Res, July 1997, Volume 30(7) 861-864
- Fotopoulou C, Sehouli J, Gehrmann N,Schoenborn I, Lichtenegger W. Functional and anatomic results of amnion vaginoplasty in young women with Mayer-Rokitansky-Küster-Hauser syndrome. Fertil Steril. 2010 Jun;94:317-23.
- Lin WC, Chang CYY, Shen YY, Tsai HD. Use of autologous buccal mucosa for vaginoplasty: a study of eight cases. Hum Reprod 2003;18:604–7.
- Jackson ND, Rosenblatt PL. Use of interceed absorbable adhesion barrier for vaginoplasty. Obstet Gynecol 1994; 84:1048–50.
- McCraw JB, Massey FM, Shanklin KD, Harten CE. Vaginal reconstruction with Gracilis myocutaneous flap. Plast Reconstr Surg 1976;58:176-83.
- JS Contreras, IP Romero, JC Mancera, LE Hernández Vivar: Corrección quirúrgica de la agenesia vaginal. Ginecol Obstet Mex 2006;74:37-47
- García FJ, Jul C, Terrones JM, Valdés C. Vaginoplastía con técnica de colgajos de Málaga. Actualidad Obstétrico Ginecológica 2001;13:193-9.
- Giraldo F, Solano A, Mora MJ, Abehsera M, et al. The Malaga flap for vaginoplasty in the Mayer-Rokitansky-Kuster-Hauster syndrome: experience and early-term results. Plast Reconstr Surg 1996;98(2):305-12.
- Wee JT, Joseph VT. A new technique of vaginal reconstruction using neurovascular pudendal-thingh flaps: a preliminary report. Plast Reconstr Surg 1989;83(4):701-9. 12.
- Lindenman E, Shepard MK, Pescovitz OH. Mullerian agenesis: an update. Obstet Gynecol 1997;90(2):307-12. 13. Reid R. Local and distant skin flaps in the reconstruction of vulvar deformities. Am J Obstet Gynecol 1997;177:1372-84.
- Monstrey S, Blondeel P, Van Landuyt K, Verpaele A, et al. The versatility of the prudential thigh fasciocutaneous flaps used as an island flap. Plast Reconstr Surg 2001;107(3):719-25.
- Whetzel TP, Lechtman AN. The gracilis myofasciocutaneous flap: vascular anatomy and clinical application. Plast Resconstr Surg 1997;99(6):1642-52.
- Selvaggi G1, Monstrey S, Depypere H, Blondeel P, Van Landuyt K, Hamdi M, Dhont M.: Creation of a neovagina with use of a pudendal thigh fasciocutaneous flap and restoration of uterovaginal continuity. Fertil Steril. 2003 Sep;80(3):607-11.
- W S Azman, A S Halim, I A Samad: The Pudendal Thigh Fasciocutaneous Flap for Vaginal Atresia Reconstruction. Med JMalaysia Vol 60 No 4 October 2005
- Monstrey S, Blondeel P, Landuyt KV. The versatility of the pudendal thigh fasciocutaneous flap used as an island flap. Plast Recons Surg 2001;107:719-25
- Karocooglan N. Hair growth in the vagina after reconstruction with pudendal thigh flaps in congenital vaginal agenesis. Plast Reconstr Surg 1997;100:1618.
- McCraw JB, Massey FM, Shanklin KD, Horton CE.Vaginal reconstruction with gracilis myocutaneous flaps. Plast Reconstr Surg. 1976 Aug;58(2):176-83.
- Cain JM1, Diamond A, Tamimi HK, Greer BE, Figge DC.The morbidity and benefits of concurrent gracilis myocutaneous graft with pelvic exenteration. Obstet Gynecol. 1989 Aug;74(2):185-9.
- Benson C1, Soisson AP, Carlson J, Culbertson G, Hawley-Bowland C, Richards F. Neovaginal reconstruction with a rectus abdominis myocutaneous flap. Obstet Gynecol. 1993 May;81(5 ( Pt 2)):871-875.
- El Saman AM, Fathalla MM, Nasr AM, Youssef MA (August 2007). “Laparoscopically Assisted Balloon Vaginoplasty for Management of Vaginal Aplasia”. International Journal of Gynaecology and Obstetrics 98 (2): 134–137
- El Saman AM (April 2010). “Retropubic Balloon Vaginoplasty for Management of Mayer-Rokitansky-Küster-Hauser Syndrome”. Fertil. Steril. 93 (6): 2016–2019.
- El Saman AM, Fathalla MM, Zakherah MS, Shaaban OM, Nasr A. “Modified balloon vaginoplasty: the fastest way to create a natural: minor changes in technique eliminate the need for customized instruments. Am J Obstet Gynecol. 2009 Nov;201(5):546.e1-5.
- El Saman AM, Zakherah MS, Nasr AM, Fathalla MM (Jan 2009). “Distension versus traction in laparoscopically assisted balloon vaginoplasty for management of vaginal aplasia”. Int J Gynaecol Obstet 104 (1): 72–3.
- El Saman AM, Tawfik RM, Hussian M, Abdella MS. “Outpatient balloon vaginoplasty for treatment of vaginal aplasia: retropubic balloon vaginoplasty was performed as an office procedure under local anesthesia. Am J Obstet Gynecol. 2011 Aug; 205(2):161.e1-3.
- El Saman AM, Habib DM, Ibrahim I, Kamel M, Barker N, Bedaiwy MA (Apr 2013). “Laparo endoscopic single site balloon vaginoplasty (LESS-BV)”. J Pediatr Adolesc Gynecol 26 (2): e29–32.
- Atef M.M. Darwish Balloon Vaginoplasty: A Revolutionary Approach for Treating Vaginal Aplasia. Medicine » Obstetrics and Gynecology » “Advanced Gynecologic Endoscopy”, book edited by Atef Darwish, ISBN 978-953-307-348-4, Published: August 23, 2011 under CC BY-NC-SA 3.0 license. © The Author(s).
- Bianchi M, Sola V, Ricci P, Pomes C. Late postoperative urinary stress incontinence after a laparoscopic-assisted Vecchietti procedure for neovagina creation in a patient with Rokitansky syndrome: successful treatment with the TVT-O technique. J Minim Invasive Gynecol 2007;14(1):116–8.
- Jansen FW, Kolkman W, Bakkum EA, de Kroon CD, Trimbos-Kemper TC, Trimbos JB.Complications of laparoscopy: an inquiry about closed- versus open-entry technique. Am J Obstet Gynecol 2004;190(3):634–8.
- Schober JM. Cancer of the neovagina. J Pediatr Urol 2007;3:167–70.
- Liao L, Doyle J, Crouch NS, Creighton SM. Dilation as treatment for vaginal agenesis and hypoplasia: a pilot exploration of benefits and barriers as perceived by patients. J Obstet Gynaecol 2006;26:144–8.
- Ismail-Pratt IS, Bikoo M, Liao LM, Conway GS, Creighton SM. Normalization of the vagina by dilator treatment alone in Complete Androgen Insensitivity Syndrome and Mayer-Rokitansky-Kuster-Hauser Syndrome. Hum Reprod 2007;22:2020–4.
- Laufer MR. Congenital absence of the vagina: in search of the perfect solution. When, and by what technique, should a vagina be created? Curr Opin Obstet Gynecol 2002;14:441–4.
- Abramov Y,Webb A, Miller J, Alshahrour A, Botros S, Goldberg R, et al. Biomechanical characterization of vaginal versus abdominal surgical wound healing in the rabbit. Am J Obstet Gynecol 2003;194:1472–7.
- Abramov Y, Gandhi S, Botros S, Goldberg R, ShermanW, Rurak M, et al. Do alterations in vaginal dimensions after reconstructive pelvic surgeries affect the risk for dyspareunia? Am J Obstet Gynecol 2005;192:1573–7.
- El Saman AM, Fathalla MM, Nasr AM, Youssef MA. Laparoscopically assisted balloon
vaginoplasty for management of vaginal aplasia. Int J Gynecol Obstet 2007;98:134–7. - El Saman AM, Zakheraha MS, Nasra AM, Fathalla MM. Distension versus traction in
laparoscopically assisted balloon vaginoplasty for management of vaginal aplasia.
Int J Gynecol Obstet 2007;98:134–7. - Darwish AM. Fine needle vaginoplasty: a simplified novel approach for correction of
vaginal aplasia. Fertil Steril. 2010 Jun;94(1):309-12. - [60] Darwish AM. Transretropubic traction vaginoplasty for correction of vaginal aplasia.
Int J Gynaecol Obstet. 2009 Dec;107(3):262-5 - Bent AE. Sling and bulking agent placement procedures. Rev Urol 2004;6 (Suppl 5):S26–46.
[62] - Bianchi M, Sola V, Ricci P, Pomes C. Late postoperative urinary stress incontinence after
a laparoscopic-assisted Vecchietti procedure for neovagina creation in a patient
with Rokitansky syndrome: successful treatment with the TVT-O technique. J
Minim Invasive Gynecol 2007;14(1):116–8. - Darwish AM, Mohammad AM. A new era for treating vaginal aplasia using transretropubic balloon vaginoplasty approach. Fertil Steril. 2011 Mar 1;95(3):1104-8.
- El Saman AM. Retropubic balloon vaginoplasty for management of Mayer-Rokitansky-Kuster-Hauser syndrome. Fertil Steril 2009.
- El Saman AM. Retropubic balloon vaginoplasty for management of Mayer-Rokitansky-Kuster-Hauser syndrome. Fertil Steril 2009.
- El Saman AM. Combined retropubic balloon vaginoplasty and laparoscopic
canalization: a novel blend of techniques provides a minimally invasive treatment
for cervicovaginal aplasia. Am J Obstet Gynecol 2009;201:333 e331-335 - El Saman AM. Retropubic balloon vaginoplasty for management of Mayer-Rokitansky-
Küster-Hauser syndrome. Fertil Steril. 2010 Apr;93(6):2016-9.)