L’uretere è un condotto muscolo-membranoso, pari e simmetrico, che collega il rene alla vescica. Le fistole uretero-vescicali sono dotti membranosi che creano un tratto di comunicazione fra uretere e vescica. Possono essere ad insorgenza immediata in seguito a lesioni cruente della parete ureterale o ad insorgenza tardiva (10-15 giorni) in seguito a lesioni ischemiche da ipercompressione o da devascolarizzazione o da aderenze post-chirurgiche della parete ureterale(1-6).
Le fistole uretero-vaginali si presentano con una frequenza di 0.8% nell’isterectomia semplice e 1-4% nell’isterectomia allargata o parti prolungati o terapia radiante addomino-pelvica o neoplasie o endometriosi. I tessuti devascolarizzati o ipercompressi durante l’intervento, vanno incontro a necrosi e quindi alla formazione di fistole (6-10).
La diagnosi si basa sulla perdita di urina in vagina, parziale o completa ostruzione ureterale all’esame urografico.
La terapia prevede la possibilità di stenting ureterale mantenuto per circa 60 giorni e, in caso di insuccesso, uretero-neostomia per le fistole basse o ricostruzione ureterale per le fistole medio-alte per via laparotomica o celioscopica.
La prevenzione può essere con la cateterizzazione bilaterale degli ureteri mediante stent a “doppio J” prima delle isterectomie complicate (40,41).
Tecnica chirurgica di riparazione delle fistole uretero-vaginali:
- Stenting ureterale: l’incannulamento dell’uretere è effettuato con un tubicino metallico o di propilene morbido del diametro medio di 2 mm e lungo 30.40 cm. Lo stent più usato è quello a “doppio J”, morbido, con le estremità a ricciolo, a coda di m
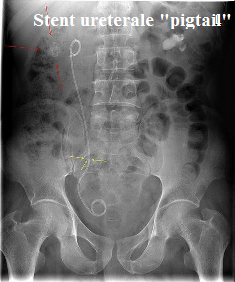 aiale, double pigtail stent, multiforo. Le estremità a rcciolo posizionate nella pelvi renale ed in vescica impediscono lo spostamento dello stent. Viene lasciato in situ per 45-60 giorni circa ma può essere lasciato anche 3 mesi senza ulteriori complicanze. E’ rimosso facilmente in ambulatorio, sotto controllo cistoscopico, instillando preliminarmente lubrificante, contenente anestetico locale, in uretra. Consente una percentuale di guarigione del 60% circa, Se eseguito mediante guide idrofiliche si riduce il traumatismo ed aumentano le possibilità di valicare il tratto stenotico. Effetti indesiderati comprendono pollachiuria, disuria, ematuria e febbre. La pollachiuria è dovuta alla stimolazione meccanica del detrurs
aiale, double pigtail stent, multiforo. Le estremità a rcciolo posizionate nella pelvi renale ed in vescica impediscono lo spostamento dello stent. Viene lasciato in situ per 45-60 giorni circa ma può essere lasciato anche 3 mesi senza ulteriori complicanze. E’ rimosso facilmente in ambulatorio, sotto controllo cistoscopico, instillando preliminarmente lubrificante, contenente anestetico locale, in uretra. Consente una percentuale di guarigione del 60% circa, Se eseguito mediante guide idrofiliche si riduce il traumatismo ed aumentano le possibilità di valicare il tratto stenotico. Effetti indesiderati comprendono pollachiuria, disuria, ematuria e febbre. La pollachiuria è dovuta alla stimolazione meccanica del detrurs ore da parte dell’estremità dello stent presente in vescica. Il dolore in genere è lieve e si attenua con il tempo; in caso di aumento occorre sospettare un’ostruzione o malposizionamento dello stent, Un lieve rialzo termico è da considerare fisiologico, mentre un rialzo termico >37.5 °C depone per un’infezione urinaria e blocco parziale del lume dello stent. Una modesta ematuria che talvolta si presenta può essere minimizzata bevendo una maggiore quantità di liquidi (>2 litri/die). Un’ematuria considerevole e prolungata deve far sospettare un’eccessiva protrusione dell’estremità distale in vescica. Complicanze: sono a rischio di stenosi in caso di forte compressione (13-14) e comunque devono essere sostituiti ogni 3 mesi o anche prima (15). L’uso di stents metallici è riservato ai casi di nei casi di fallimento dei stent morbidi, nei casi in cui si prevede una forte compressione luminare post-intervento e nei casi di stenosi serrata insormontabile con gli stent morbidi e infine quando si prevede una permanenza dello stent superiore ai 3 mesi (15). Tuttavia, a causa di complicanze molto più frequenti rispetto agli stent morbidi, il loro uso, attualmente, è riservato quasi esclusivamente ai casi di stenosi ureterale da neoplasia (16). I tipi di stent metallici più utilizzati sono lo stent autoespansibile (Wallstent), il palloncino espandibile (“Strecker stent” in tantalio, facile da posizionare anche perchè dotato di ottima radiopacità), il termoespandibile in nikel-titanio che possiede un segmento termoespansibile in funzione di ancoraggio ad una o entrambe le estremità (Memocath, JJ stent), lo stent rivestito con dacron o polietilene per aumentarne la biocompatibilità (ma il suo posizionamento è gravato da un’elevata percentuale di “migrazione” dovuta principalmente all’induzione di un’aumentata peristalsi ureterale ma in compenso ha una bassa percentuale di calcificazioni e iperplasia endoteliale; recentemente è stato introdotto il “double pigtail” metallico composto da una lega di nickel-cobalto-chromo-molibdeno, può essere monitorato anche con RMN e presenta una bassa incidenza di incrostazioni e migrazione (17-33).
ore da parte dell’estremità dello stent presente in vescica. Il dolore in genere è lieve e si attenua con il tempo; in caso di aumento occorre sospettare un’ostruzione o malposizionamento dello stent, Un lieve rialzo termico è da considerare fisiologico, mentre un rialzo termico >37.5 °C depone per un’infezione urinaria e blocco parziale del lume dello stent. Una modesta ematuria che talvolta si presenta può essere minimizzata bevendo una maggiore quantità di liquidi (>2 litri/die). Un’ematuria considerevole e prolungata deve far sospettare un’eccessiva protrusione dell’estremità distale in vescica. Complicanze: sono a rischio di stenosi in caso di forte compressione (13-14) e comunque devono essere sostituiti ogni 3 mesi o anche prima (15). L’uso di stents metallici è riservato ai casi di nei casi di fallimento dei stent morbidi, nei casi in cui si prevede una forte compressione luminare post-intervento e nei casi di stenosi serrata insormontabile con gli stent morbidi e infine quando si prevede una permanenza dello stent superiore ai 3 mesi (15). Tuttavia, a causa di complicanze molto più frequenti rispetto agli stent morbidi, il loro uso, attualmente, è riservato quasi esclusivamente ai casi di stenosi ureterale da neoplasia (16). I tipi di stent metallici più utilizzati sono lo stent autoespansibile (Wallstent), il palloncino espandibile (“Strecker stent” in tantalio, facile da posizionare anche perchè dotato di ottima radiopacità), il termoespandibile in nikel-titanio che possiede un segmento termoespansibile in funzione di ancoraggio ad una o entrambe le estremità (Memocath, JJ stent), lo stent rivestito con dacron o polietilene per aumentarne la biocompatibilità (ma il suo posizionamento è gravato da un’elevata percentuale di “migrazione” dovuta principalmente all’induzione di un’aumentata peristalsi ureterale ma in compenso ha una bassa percentuale di calcificazioni e iperplasia endoteliale; recentemente è stato introdotto il “double pigtail” metallico composto da una lega di nickel-cobalto-chromo-molibdeno, può essere monitorato anche con RMN e presenta una bassa incidenza di incrostazioni e migrazione (17-33).
- INCISIONE CUTANEA SECONDO PFANNESTIEL
- INCSIONE VESCICALE VERTICALE
- INDIVIDUAZIONE, DISSEZIONE ED ISOLAMENTO URETERALE
- CREAZIONE TUNNEL SOTTOMUCOSO TRANS – TRIGONALE
- RESEZIONE URETERE TERMINALE ED ANASTOMOSI
- STENT URETERALE
- CONTROLLO USG dopo 15 gg, 6 mesi e 12 mesi
- UROGRAFIA dopo 12 mesi
a) ricostruzione mediante ansa ileale: la tecnica prevede un accesso mediano transperitoneale che consente una visualizzazione completa del tratto ureterale da sostituire e permette di isolare il segmento intestinale che prenderà il posto dell’uretere. Di solito viene scelto l’ileo terminale che viene staccato dal resto dell’intestino (mantenendo però integra la sua vascolarizzazione), irrigato abbondantemente con soluzione salina e collegato in alto all’uretere integro o direttamente alla via urinaria renale (pelvi renale) e in basso, alla vescica. Ovviamente l’intervento prevede la ricostruzione della continuità intestinale. Di solito, viene lasciato un catetere internamente all’intestino utilizzato per ricostruire l’uretere (stent JJ) o una sonda nefrostomica fuoriuscente dalla cute del fianco. Vengono sistemati 2 drenaggi in corrispondenza delle anastomosi e un drenaggio nella cavità peritoneale. È necessario inoltre posizionare un catetere vescicale che verrà tenuto a dimora per 2 settimane o più.
Preparazione preoperatoria: prevede l’uso di purganti per os ad alto dosaggio in modo da avere l’intestino da utilizzare completamente pulito da feci. È utile inoltre somministrare antibiotici ad azione “intestinale” per avere a disposizione un intestino potenzialmente sterile. È indicato il posizionamento preliminare di un catetere ureterale per favorire l’identificazione dell’uretere nei casi in cui per pregressi interventi chirurgici si sia sviluppata un’intensa reazione periureterale. La nefrostomia percutanea preliminare permette di ristabilire la funzione renale a livelli ottimali prima di procedere all’intervento chirurgico. La durata dell’intervento è di circa 6 ore e prevede una degenza di 2-3 settimane.
Vantaggi: il vantaggio maggiore è quello di una metodica di salvataggio che può essere eseguita con un buon margine di sicurezza quando sia stata eseguita un’accurata selezione dei pazienti e quando sia stata posta un’attenzione particolare ai dettagli chirurgici. Rispetto alle tecniche endourologiche assicura risultati di durata nel tempo. Svantaggi: è un intervento di chirurgia ricostruttiva maggiore che coinvolge due apparati (gastroenterico e urinario). Può essere tecnicamente complesso, non attuabile in tutti i pazienti, di lunga durata operatoria e con un lungo decorso post-operatorio e conseguente lento rientro alle attività lavorative e potenzialmente interessato da complicanze temibili anche per la vita.
Effetti collaterali: l’eliminazione con le urine di muco intestinale può durare anche qualche anno. La presenza di una batteriuria cronica è molto frequente (circa il 40%) ma non provoca nessun danno. I disturbi idroelettrolitici sono molto rari se i pazienti hanno una buona funzione renale ed epatica.
Complicanze: le complicanze possono essere molte e riguardare i due distretti interessati nell’intervento: intestino e vie urinarie. Tutte le complicanze dell’uso di segmenti intestinali nella chirurgia urologica:
- occlusione intestinale post-operatoria da briglie aderenziali che si creano nel peritoneo per effetto dell’escissione di un tratto di intestino;
- deiscenza dell’anastomosi enterica (oggi molto rara per l’uso costante di una buona preparazione intestinale e delle suturatici automatiche);
- necrosi di un tratto ileale e conseguente deiscenza dell’anastomosi pielointestinale o enterovescicale;
- ostruzione del tratto intestinale di sostituzione per tappi di muco (soprattutto nelle fasi precoci);
- possibilità di un danno renale progressivo da acidosi per riassorbimento di urine (Tanagho);
- possibile reflusso vescico-renale anche nel caso in cui siano state applicate tecniche anti-reflusso;
- infezione urinaria asintomatica in % variabile dal 40 al 60%;
- diarrea.
Attenzioni da porre alla dimissione:
alla dimissione la paziente è ancora portatrice di stent ureterale o nefrostomia percutanea; pertanto deve rimanere sotto stretto controllo medico e condurre una vita molto tranquilla (ridotto stress fisico, scarsa attività sportiva, regime alimentare moderato). È importante assumere bicarbonato di sodio 1 g al dì refratto in 2 somministrazioni e praticare terapia con antibiotici (di solito per os) per qualche settimana.
Si raccomanda inoltre una dieta ricca di liquidi e vitamine. La normale attività lavorativa potrà essere ripresa dopo circa 1 mese dalla dimissione (questo periodo può essere variabile in relazione al tipo di paziente e al tipo di lavoro praticato).
Ricostruzione ureterale con graft peritoneale: Questa metodica presenta come vantaggio la facilità del prelievo, la disponibilità illimitata e la mancanza di complicanze relative al prelievo stesso, che lo rendono preferibile ad alttre metodiche come l’utilizzo di mucosa buccale, ansa colica, ileo, appendice, etc. (37-39).
All’interno dell’uretere ricostruito viene posizionato un catetere ureterale autostatico (stent) o fuoriuscente dall’uretra (1-2). l’intervento ha una durata molto variabile in relazione alle condizioni di aderenze dei tessuti e alla loro vitalità (mediamente da 2 a 4 ore).
Antibiotico-profilassi: è molto importante un trattamento antibiotico preliminare ad alto dosaggio e per via parenterale. Di solito la paziente affetto da una lesione ureterale post-chirurgica o indotta da un trattamento ureteroscopico è affetta da uno stato febbrile indotto dall’ostruzione e dallo stravaso urinario per cui già pratica una terapia antibiotica e molto spesso è già stata sottoposta a nefrostomia percutanea allo scopo di tenere drenato il sistema urinario).
Tipo e durata del ricovero: l’intervento viene effettuato esclusivamente in regime di ricovero ordinario (la paziente è quasi sempre proveniente da un altro reparto o da un altro ospedale) e prevede una degenza post-operatoria di circa 3 giorni per lo stenting e di 7-10 giorni per le altre opzioni chirurgiche open.
Risultati: i risultati per gli interventi open sono positivi nel 90% dei casi; sono superiori a quelli, crescenti, della riparazione endoscopica (30-70%).
Complicanze: le complicanze possibili della chirurgia open e lps sono:
– deiscenza della sutura dei due monconi ureterali: può aver luogo quando l’anastomosi viene effettuata sotto tensione per mancanza di “stoffa”; può essere una piccola deiscenza che con un tutore in situ (catetere ureterale) si risolve spontaneamente o una grave deiscenza che richiede un nuovo intervento ricostruttivo con esiti non sempre fausti;
– stenosi dell’anastomosi: di questa ci si accorge dopo aver rimosso il tutore (catetere ureterale) e può beneficiarsi di una seconda ripararazione endourologica.
Attenzioni da porre alla dimissione: alla dimissione va suggerito alla paziente di praticare una terapia antibiotica a lungo termine; di praticare una vita tranquilla con alimentazione leggera.
Come comportarsi in caso di complicanze a domicilio: in caso di febbre associata a dolori lombari dal lato sottoposto ad intervento è opportuno riconsultare un urologo per valutare il problema. Piccoli fastidi irritativi vescicali legati alla presenza dello stent possono essere trattati con antispastici vescicali per os.
Controlli: il primo controllo post-operatorio viene fatto dopo 3 settimane con esami generali ematochimici e urinocoltura. A 4-6 settimane viene rimosso lo stent. A 3 mesi viene praticata l’ecografia renale e a 6 mesi può essere praticata l’urografia.
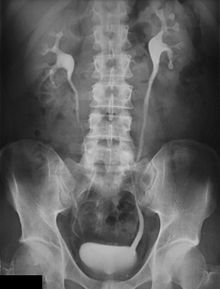
Urografia
IVU, urografia: indagine radiologica dell’apparato urinario, eseguita mediante opacizzazione dei reni e delle vie escretrici grazie alla somministrazione endovena di un mezzo di contrasto radiopaco che viene eliminato attraverso l’urina. Permette l’esplorazione e lo studio, sia a livello morfologico che funzionale, delle varie sezioni che compongono l’apparato urinario. Prima di sottoporsi ad IVU occorre eseguire alcuni esami come ECG, azotemia, cretininemia, QPE, e si deve seguire una dieta a base di alimenti poveri di scorie nei giorni precedenti all’esame, assumere un purgante e praticare un clistere evacuativo il giorno precedente l’esame che deve essere affrontato a digiuno da almeno 8 ore prima. Si utilizzano come mezzi di contrasto composti organici idrosolubili triodati (uroangiografico), iniettati per via endovenosa a bolo o ad infusione lenta. Si eseguono radiogrammi a tempi prestabiliti (basale, nei primi minuti dopo l’infusione, a seguire radiogrammi ogni 5 minuti), al termine dell’infusione si pratica uno scanogramma per evidenziare la vescica a pieno riempimento, si fa urinare la paziente e si effettua uno scanogramma post-minzione. L’esame ha una durata di circa 45 minuti. Controindicazioni all’esame sono iperazotemia elevata e gravi cardiopatie ed ovviamente lo stato di gravidanza.
La cistouretrografia minzionale (Voiding CystoUrethro-Graphy, VCUG) è abitualmente eseguita come tempo finale di una IVU.
L’ureteropielografia retrograda (Retrograde Uretero-Pyelography, RUP) consente di ottenere un’ureterografia passiva iniettando il mezzo di contrasto per via retrograda in corso di cistoscopia attraverso un cateterino ureterale normale o con estremità conico-olivare introdotto nella papilla ureterale.
La tomografia assiale computerizzata, TAC (computed tomography, CT) è una tecnica che utilizza un fascio di radiazioni sottili prodotto da un tubo radiogeno che ruota attorno al paziente ottenendo immagini di sezioni trasversali dello stesso. Le immagini sono il risultato dell’elaborazione dei valori di assorbimento del fascio nei vari organi e tessuti, eseguita dal computer raffrontandole varie densità con una scala di grigi, a sua volta caratterizzata dalla finestra selezionata.La scansione e la ricostruzione dell’immagine digitale della struttura attraversata richiedono un certo tempo e il paziente avanza nel tubo a ogni scansione. Si ottengono scansioni assiali, coronali e sagittali caratterizzate da un elevato grado di risoluzione spaziale. L’esame può essere eseguito in condizioni basali o con utilizzo di mezzi di contrasto triiodati tradizionali.Gli ureteri si evidenziano nelle scansioni assiali, grazie alla presenza del mdc nel loro lume, come immagini
UROTAC
rotondeggianti iperdense corrispondenti alla loro sezione trasversa. La ricostruzione multiplanare consente una visione simil-urografica.
TAC spirale: La CTspirale (spiral computed tomography SCT) èuna CTdi esecuzione molto più rapida, dato che la rotazione del sistema tubo-detettori e la traslazione del paziente avvengono contemporaneamente e perché l’esame è in grado di ottenere l’acquisizione d’immagini che, anziché riferirsi a uno strato come nella CTconvenzionale, riguardano un volume corporeo.
Queste pagine fanno parte del sito fertilitycenter.it in internet da marzo 2011. I testi, le tabelle, i disegni e le immagini pubblicati in queste pagine sono coperte da copyright ma a disposizione di tutti per copia e riproduzione purchè venga citata la fonte con link al sito www.fertilitycenter.it.
Ringrazio i lettori per la loro cortese attenzione e li prego di voler comunicare le loro osservazioni e consigli su eventuali errori o esposizioni incomplete.
Grazie. Enzo Volpicelli
References:
- . L.N. Zinman, J.A. Libertino: “Chirurgia dell’uretere medio e prossimale“. In “Chirurgia Urologica Ricostruttiva” di J.A. Libertino. Mosby Italia, 1998.
- J.E. Fowler jr.: “Chirurgia dell’uretere”. In “Manuale di Chirurgia Urologica”. Momento Medico, 1992.
- A. Greenstein, M.J. Vernon Smith, W.W. Koontz: ”Chirurgia dell’uretere”. In “Urologia di Campbell”. Verduci Editore, VII Edizione, 1999.
- Antonakopoulos, G.N., Fuggle, W.J., Newman, J. et al. (1985) Idiopathic hydronephrosis. Arch. Pathol. Lab. Med. 109, 1097-1101.Hinman, F. (1995).
- Atlante di anatomia chirurgica in urologia. Roma, Verduci Editore
- Kaneto, H., Orikasa, S., Chiba, T. et al. (1991) Three-D muscular arrangement at the ureteropelvic junction and its changesin congenital hydronephrosis. Astereo-morphometric study. J. Urol. 146, 909-914.
- Maizels, M., Stephens, F.D. (1980) Valves of the ureter as a causef primary obstruction of the ureter: anatomic, embryologicand clinical aspects. J. Urol. 123, 742-747.
- Matsuno, T., Tokunaka, S., Koyanagi, T. (1984) Muscular development in the urinary tract. J. Urol.132, 148-152.
- Ostling, K. (1942) The genesis of hydronephrosis: Particularlywith regard to the changes at the ureteropelvic junction. Acta Chir. Scand. 86(suppl), 72-74.
- L.N. Zinman, J.A. Libertino: “Chirurgia dell’uretere medio e prossimale“. In “Chirurgia Urologica Ricostruttiva” di J.A. Libertino. Mosby, Italia, 1998.
- J.E. Fowler jr.: “Chirurgia dell’uretere”. In “Manuale di Chirurgia Urologica”. Momento Medico, 1992.
- A. Greenstein, M.J. Vernon Smith, W.W. Koontz: ”Chirurgia dell’uretere”. In “Urologia di Campbell”. Verduci Editore, VII Edizione, 1999.
- Ganatra AM, Loughling KM. The management of malignant ureteral obstruction treated with ureteral stents. J Urol. 2006;174:2125–8.[PubMed]
- Christman MS, L’esperance JO, Choe CH, Stroup SP, Auge BK. Analysis of ureteral stent compression force and its role in malignant obstruction. J Urol. 2009;181:392–6.[PubMed]
- Abdulrahman Al Aown, Kyriazis Iason, Kallidonis Panagiotis, and Evangelos N. Liatsikos: “Clinical experience with ureteral stents”. Indian J Urol. 2010 Oct-Dec; 26(4): 474–479.
- Sountoulides P, Pardalidis N, Sofikitis N.: “Endourologic management of malignant ureteral obstruction: Indications, results, and quality-of-life issues”. J Endourol. 2010;24:129–42.[PubMed]
- Pauer W, Lugmayr H. Metallic Wallstents: A new therapy for extrinsic ureteral obstruction. J Uro. 1992;148:281–4.
- Kulkarni RP, Bellamy EA. A new thermo-expandable shape-memory nickel-titanium alloy stent for the management of ureteric strictures. BJU Int. 1999;83:755–9.[PubMed]
- Kulkarni RP, Bellamy EA. Nickel-titanium shape-memory alloy memokath 051 ureteral stent for managing long term ureteral obstruction: 4-year experience. J Urol. 2001;166:1750–4.[PubMed]
- Klarskov P, Nordling J, Nielsen JB. Experience with Memokath 051 ureteral stent. Scand J Urol Nephrol. 2005;39:169–72.[PubMed]
- Papatsoris AG, Buchholz N. A novel thermo-expandable ureteral metal stent for the minimally invasive management of ureteral strictures. J Endourol. 2010;24:487–91.[PubMed]
- Maan Z, Patel D, Moraitis K, El-Husseiny T, Papatsoris AG, Buchholz NP, et al. Comparison of stent-related symptoms between conventional double-J stents and a new-generation thermoexpandable segmental metallic stent: A validated-questionnaire-based study. J Endourol. 2010;24:589–93.[PubMed]
- Tekin MI, Aytekin C, Aygun C, PeSkircioglu L, Boyvat F, Ozkardes H. Covered metallic ureteral stent in the management of malignant ureteral obstruction: Preliminary results. Urology. 2001;58:919–23.[PubMed]
- Barbalias GA, Liatsikos EN, Kalogeropoulou C, Karnabatidis D, Zabakis P, Athanasopoulos A, et al. Externally coated ureteral metallic stents: An unfavorable clinical experience. Eur Urol. 2002;42:276–80.[PubMed]
- Trueba Arguinarena FJ, Fernandez Del Busto E. Self-expanding polytetrafuoroethylene covered nitinol stents for the treatment of ureteral stenosis: Preliminary report. J Urol. 2004;172:620–3.[PubMed]
- Carraffiello G, Desai MR, Moskovitz B, Nativ O, Santos EM. Mid-term results with the new self-expanding, large caliber, Allium ureteral stent:experience of 4 centers. Eur Urol Suppl. 2010;9:98.
- Blaschko SD, Deane LA, Krebs A, Abdelshehid CS, Khan F, Borin J, et al. In- vivo evaluation of flow characteristics of novel metal ureteral stent. J Endourol. 2007;21:780–3.[PubMed]
- Borin JF, Melamud O, Clayman RV. Initial experience with full-length metal stent to relieve malignant ureteral obstruction. J Endourol. 2006;20:300–4.[PubMed]
- Wah TM, Irving HC, Cartledge J. Initial experience with the Resonance metallic stent for antergrade ureteric stenting. Cardiovasc Intervent Radiol. 2007;30:705–10.[PubMed]
- Nagele U, Kuczyk MA, Horstmann M, Hennenlotter J, Sievert KD, Schilling D, et al. Initial clinical experience with full-length metal ureteral stents for obstructive ureteral stenosis. World J Urol. 2008;26:257–62.[PubMed]
- Lopez-Huertas HL, Polcari AJ, Acosta-Miranda A, Turk TM. Metallic ureteral stents: A cost-effective method of managing benign upper tract obstruction. J Endourol. 2010;24:483–5.[PubMed]
- Garg T, Guralnick ML, Langenstroer P, See WA, Hieb RA, Rilling WS, et al. Resonance metallic ureteral stents do not successfully treat ureteroenteric strictures. J Endourol. 2009;23:1199–201.[PubMed]
- Liatsikos E, Kallidonis P, Kyriazis I, Constantinidis C, Hendlin K, Stolzenburg JU, et al. Ureteral Obstruction: Is the full metallic double-pigtail stent the way to go? Eur Urol. 2010;57:480–6.[PubMed]
- Antonelli A; Simeone C; Frego E; Minini G; Bianchi U; Cunico SC: ” Surgical treatment of ureteral obstruction from endometriosis: our experience with thirteen cases”. Int Urogynecol J Pelvic Floor Dysfunct. 2004; 15(6):407-12; discussion 412
- Casati E, Boari A. Contributo sperimentale alla plastica dell’ uretere. Atti Accad Scient Med Nat 1894; 14: 149.2 .
- Ockerblad NF. Reimplantation of the ureter into the bladder by a flap method. J Urol 1947; 57: 845.
- Powell SJ, Engelbrecht HE, Welchmann NM. Hydronephrosis and urinary tract bilharzias: a radiological and necropsy survey. Trans Roy Soc Tropical Med Hygiene 1968; 62:231-7
- Sommerville JJF, Naude JH. Segmental ureteric replacement: an animal study using a free non-pedicled graft. Urol Res 1984; 12:115-9
- Naude JH. Buccal mucosal grafts in the treatment of ureteric lesions. BJU International 1999; 83:751-4
- Badar Murtaza, Arshad Mahmood, Waqar Azim Niaz, Muhammad Akmal, Hussain Ahmad: “Ureterovaginal fistula – etiological factors and outcome”. J. of Pakistan Medical Association; October 2012
- Billemeyer BR, Nygaard IE, Kreder KJ. Ureterouterine and vesicoureterovaginal fistulas as a complication of cesarean section. J Urol 2001; 165: 1212-3.
**********************************************************************************************************************
Queste pagine fanno parte del sito fertilitycenter.it in internet da marzo 2011. I testi, le tabelle, i disegni e le immagini pubblicati in queste pagine sono coperte da copyright ma a disposizione di tutti per copia e riproduzione purchè venga citata la fonte con Link al sito www.fertilitycenter.it.
Ringrazio i lettori per la loro cortese attenzione e li prego di voler comunicare le loro osservazioni e consigli su eventuali errori o esposizioni incomplete.
Grazie. Enzo Volpicelli.





2 commenti
You are so cool! I don’t think I’ve truly
read through something like this before.
So nice to find somebody with a few unique thoughts on this topic.
Really.. thanks for starting this up. This web site is one thing that
is required on the web, someone with a little originality!
This is very interesting, You are a very skilled blogger.
I have joined your feed and look forward to seeking more of your excellent post.
Also, I have shared your website in my social networks!