Ultimo aggiornamento 2022-01-01 17:25:58
Quando la chirurgia diventa conservativa e ricostruttiva si evidenzia il dominio della fisiologia sull’anatomia, dell’area funzionale sull’organo, dove per “area funzionale” si intende una sede topografica adatta a svolgere un compito istituzionale di uno o più organi.
La suddivisione topografica funzionale della regione annessiale comprende una zona prossimale uterina, una zona dei mesi ed una zona distale o infundibulare.
I rapporti spaziali presenti nella frazione prossimale uterina sottolineano la relativa indipendenza fra i mezzi di sostegno anteriori e l’assetto annessiale nel corso dei movimenti uterini mentre è ben conservata la fluttuanza ovaro-tubarica. Quest’ultima si avvale di una unicità direzionale nei grossi spostamenti passivi della tuba e dell’ovaio. Viene però conservata all’interno una sufficiente indipendenza per i loro piccoli, ma importantissimi adattamenti spaziali, indispensabili per garantire, fra l’altro, unità e armonia d’azione tubo-ovarica nel corso del pick-up ovocitario.
Nella zona medio-annessiale interessante è la posizione ovarica che, proteggendo il suo meso da interferenze meccaniche esterne protegge la normale perfusione parenchima aanche nella fase di massima compressione follicolare. Il legame che intercorre fra la retroversione del corpo uterino per aumento congestizio del suo peso nella fase pre-ovulatoria e il conseguente abbassamento e centralizzazione dell’ampolla tubarica nel cavo del Douglas è funzionale all’unità d’azione tubo-ovarica richiesta dal pick-up.
 Sempre in questa azione intermedia, infine, l’ampiezza della fossetta pre-ovarica e la lassità del mesosalpinge non oppongono resistenza ai complessi giochi peristaltici della tuba in qualsiasi posizione fisiologica essa venga costretta e assicurano una costante e ottimale perfusione arteriosa. Ciò porta a una libera realizzazione dei fenomeni di captazione fimbrica e di trasporto ampollare del gamete femminile. Una realizzazione dei suddetti fenomeni si ottiene nella zona distale attraverso la libertà di movimento della porzione fimbrica tubarica permessa dal suo ampio meso che, pur nel rispetto della coerenza tubo-ovarica a sua volta assicurata dall’omonimo legamento, facilita la perfusione arteriosa del tratto e quindi la sua importante funzionalità peristaltica.
Sempre in questa azione intermedia, infine, l’ampiezza della fossetta pre-ovarica e la lassità del mesosalpinge non oppongono resistenza ai complessi giochi peristaltici della tuba in qualsiasi posizione fisiologica essa venga costretta e assicurano una costante e ottimale perfusione arteriosa. Ciò porta a una libera realizzazione dei fenomeni di captazione fimbrica e di trasporto ampollare del gamete femminile. Una realizzazione dei suddetti fenomeni si ottiene nella zona distale attraverso la libertà di movimento della porzione fimbrica tubarica permessa dal suo ampio meso che, pur nel rispetto della coerenza tubo-ovarica a sua volta assicurata dall’omonimo legamento, facilita la perfusione arteriosa del tratto e quindi la sua importante funzionalità peristaltica.
CAVO DEL DOUGLAS:
La forma a imbuto del cavo del Douglas realizza una vasca nel cui fondo ristretto si può raccogliere una discreta quantità di liquido peritoneale in circolazione libera. In tale configurazione la disposizione degli annessi rispetto ai piani inclinati laterali del cavo facilita sia l’espulsione dell’uovo verso il fondo dello spazio, che lo scivolamento in questa sede della terminazione fimbrica. Inoltre, l’assenza di tasche, fessure o di anfratti, permette la creazione di una vasca unitaria di raccolta dei fluidi pelvici ed evita la formazione di sequestri di liquido e materiale follicolare. Tutto ciò comporta unità, armonia fra tuba, ovaio e cavo del Douglas nel corso del pick-up ovocitario.
ORGANI PERIUTERINI:
Le fisiologiche variazioni dimensionali di vescica e retto non interferiscono con i fenomeni della captazione ovocitaria. Una vescica piena favorisce la retroversione uterina mentre il riempimento dell’ampolla rettale innalza il fondo del cavo del Douglas. L’ansa del sigma fissata all’angolo posteriore sinistro dello stretto superiore (legamento infundibolo-pelvico) impedisce che la confluenza del colon discendente nel retto passi a ponte sopra l’utero o impegni in toto il cavo del Douglas interferendo così drammaticamente con la crescita o cronicamente con la mobilità del corpo uterino. L’ingresso del sigma nella pelvi sul margine sacrale riduce al minimo le interferenze del sigma con l’area di pick-up ovulare sinistra. Infine la dimensione, la superficie tondeggiante e la configurazione ad ansa dell’ileo, impedisce che la sua occupazione del cavo retto-uterino si spinga fino al retrofondo del cavo del Douglas e che annulli così lo spazio di raccolta del liquido libero peritoneale e la sua comunicazione con i versanti annessiali.
Considerando ora la circolazione artero-venosa e linfatica locale dobbiamo affermare che la maggioranza degli organi periuterini, (colon, sigma, retto intraperitoneale, cieco, appendice) ha un flusso arterioso e venoso di origine e sbocco extrapelvico. Ciò comporta in primo luogo una regolazione arteriosa relativamente indipendente dallo stato funzionale in atto presso gli organi genitali. Il torrente venoso inoltre, come succede anche per alcuni organi genitali, si getta principalmente in vasi di maggiore deflusso assicurando così una più elastica e tempestiva controrisposta agli stati variamente fisiologici di congestione pelvica a cui l’organo deve, per la sua collocazione topografica, sottostare.
Concludendo, per l’apparato genitale femminile, sottoposto a repentine evoluzioni, la creazione nell’ambiente pelvico di una unità autonoma di coordinazione vascolare è utile ai fenomeni di crescita ovulare, ai meccanismi di deiscenza follicolare e alle sequenze topodinamiche che preparano o facilitano il pick-up ovocitario.
COMPLESSO TUBA-OVAIO:
La funzionalità tubarica riveste un ruolo cruciale nei processi di captazione e trasporto dell’oocita, di migrazione e capacitazione degli spermatozoi, di fecondazione e trasporto dell’embrione nelle primissime fasi di sviluppo verso l’utero.
Captazione dell’ovocita
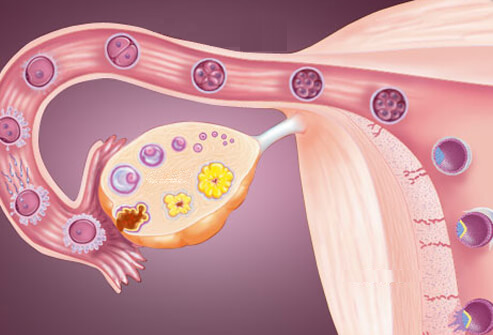
In alcune specie il pick-up è assicurato da una struttura membranosa, la borsa ovarica, che comprende in una unica concamerazione le fimbrie e la superficie ovarica. Nella specie umana si ha al momento dell’ovulazione una apposizione dell’infundibulo all’ovaio per la azione muscolare della fimbria ovarica a del mesosalpinge. L’ovocita, contornato dal cumulo ooforo, viene a trovarsi in stretto contatto con le cellule ciliate infundibulari che, grazie al battito ciliare sincrono, lo sospingono verso l’ampolla. La maggior parte degli Autori sono concordi nel ritenere che questo sarebbe il meccanismo principale di captazione dell’ovocita. Dati sperimentali e clinici dimostrano tuttavia che esistono altri meccanismi di captazione dell’ovocita. Gravidanze instauratesi in donne con solo un ovaio e tuba controlaterale presenti dimostrano ad esempio come la giusta posizione infundibulo-ovaio omolaterale non sia indispensabile. In queste circostanze è ipotizzabile il pick-up dell’ovocita direttamente dal cavo del Douglas come avverrebbe anche in caso di gravidanze a termine instauratesi dopo sterilizzazione tubarica in seguito a fistolizzazione del segmento tubarico prossimale al blocco.
Il pick-up dell’ovocita del Douglas avvalora le osservazioni già formulate da Westman negli anni 30 e riproposte da Maia e Coutinho più recentemente che segnalano una negativizzazione della pressione endotubarica conseguente all’attività peristaltica che si estrinseca come capacità di aspirazione dell’ovocita. Studi sperimentali sul coniglio hanno tuttavia dimostrato che la legatura estrinseca dell’infundibulo e il blocco dell’attività peristaltica con il propanololo non impedivano il pick-up dell’ovocita.
La fertilità possibile in donne con la sindrome delle cilia immobili ci dimostra infine che anche l’attività ciliare non sarebbe indispensabile alla captazione dell’ovocita. Se prendiamo quindi in considerazione i tre principali fattori considerati nel maccanismo del pick-up: apposizione infundibulo-superficie ovarica, motilità ciliare e aspirazione, nessuno è in conclusione strettamente necessario potendo verosimilmente il deficit di un meccanismo venir compensato dall’attività degli altri.
Trasporto dell’ovocita nel suo tragitto verso l’utero l’ovocita è trattenuto nell’ampolla per il periodo di tempo più lungo: 72 ore circa. Durante tale soggiorno avvengono i processi di maturazione ovocitaria, di fertlizzazione e le prime segmentazioni dello zigote. Il passaggio dell’ovocita nell’ampolla è il risultato del battito ciliare pro-uterino, della pressione negativa ampollare e delle contrazioni segmentarie della parete. Tali contrazioni provocano dei movimenti oscillatori dell’ovocita che di per sè non provocano alcun avanzamento in direzione uterina. L’avanzamento dell’ovocita è assicurato soprattutto dal battito ciliare pro-uterino.
L’ovocita è fecondato a livello della della giunzione istmo-ampollare; la stessa giunzione subisce quindi un processo di stenosi che blocca l’ovocita fecondato per 60 ore. Dopo tale interruzione, l’ovocita fecondato transita velocemente attraverso il tratto istmico per arrivare in cavità uterina circa 80 ore dopo l’ovulazione a uno stadio di 8-12 cellule (blastula). Dati clinici e sperimentali smentiscono la presenza di uno sfintere adrenergico a livello della giunzione istmo-ampollare come era stato postulato da Brundin nel 1965. La resezione microchirurgica della giunzione istmo-ampollare non ha effetto negativo sulla fertilità nel coniglio e Winston riporta un 63% di gravidanze a termine dopo anastomosi istmo-ampollare per pregressa sterilizzazione, intervento che comporta necessariamente la rimozione della giunzione istmo-ampollare. Il prolungato soggiorno dell’ovocita e dello zigote nell’ampolla e il temporaneo arresto della progressione a livello della giunzione istmo-ampollare sarebbero da imputare quindi ad altri meccanismi. Si avrebbe una sorta di impedimento funzionale dell’istmo di tipo transitorio imputabile sia a fattori non meglio precisabili legati all’attività contrattile della parete, che alla presenza di un muco particolarmente viscoso e tenace con un effetto barriera rispetto al trasporto dello zigote. Tale blocco, come abbiamo detto, è temporaneo e il trasporto successivo dell’embrione nel tratto istmico è assicurato essenzialmente dall’attività muscolare.
La giunzione utero-tubarica potrebbe avere un ruolo importante nel regolare l’ingresso dell’embrione in cavità uterina. Su di essa agisce il sistema nervoso ortosimpatico e gli α-recettori modulati dagli steroidi ovarici. Un ruolo chiave nel controllo dell’attività muscolare è giocato inoltre dalle prostaglandine che tra l’altro agiscono anche sulla funzione ciliare aumentando la frequenza del battito ciliare. La PGF2α determina una contrazione di tutti gli strati muscolari mentre la PGE2 ha un effetto miorilassante particolarmente a livello del tratto istmico. Lo studio dell’attività mioelettrica della salpinge è resa alquanto difficile, anche a livello sperimentale, dal fatto che la muscolatura liscia, a differenza di quanto accade nel muscolo striato, non c’è una relazione univoca tra variazioni del potenziale di membrana ed effetto meccanico. Si può ad esempio osservare una contrazione o un rilasciamento della muscolatura senza una variazione del potenziale di membrana e viceversa alla depolarizzazione può susseguire sia una contrazione che un rilasciamento della muscolatura liscia.
Trasporto del gamete maschile:
Nella donna spermatozoi sono presenti nella tuba già pochi minuti dopo la deposizione in vagina.
Il trasporto dello spermatozoo nel tratto uterino è assicurato sia dalla motilità intrinseca del gamete maschile che dall’attività peristaltica dell’utero stimolata dall’ossitocina e dalle prostaglandine di origine seminale e uterina.
Soltanto poche centinaia di spermatozoi raggiungono la porzione ampollare della tuba. La normale morfologia e motilità riscontrate in questi spermatozoi è frutto di un meccanismo di selezione a
monte sia qualitativo che quantitativo. A livello tubarico sarebbero la giunzione utero-tubarica e l’istmo a possedere questa funzione di barriera funzionale e filtro. Va ricordato che il trasporto degli spermatozoi attraverso il canale cervicale avviene secondo una fase di progressione rapida e una fase lenta, intermittente.
Il significato di questo fenomeno non è chiaro, sta di fatto che spermatozoi mobili possono essere rinvenuti nell’ampolla fino a 80-85 ore dopo il coito. Secondo alcuni Autori tali spermatozoi, in quanto mobili, avrebbero ancora conservata la capacità fecondante mentre secondo altri il periodo di tempo in cui gli spermatozoi conservano tale capacità sarebbe dimezzato. Va qui ricordato per inciso che l’ovocita nella specie umana è fecondabile per un periodo non superiore alle 10-12 ore.
La progressione degli spermatozoi nel tratto istmico avviene in senso opposto al battito ciliare. Tale fatto sarebbe reso possibile secondo Jansen dalla secrezione in periodo ovulatorio da parte delle cellule secretive di un muco particolarmente denso che neutralizza il battito ciliare ma che non impedisce l’ascesa nemaspermica.
Secondo Blandau l’onda ciliare sarebbe neutralizzata e surclassata da dalle contrazioni muscolari tubariche centripete particolarmente vivaci a livello istmico nel periodo pre-ovulatorio. Secondo altri invece quest’onda ciliare di verso opposto al tragitto degli spermatozoi sarebbe proficua alla loro risalita perchè i nemaspermi sarebbero dotati di reotropismo negativo, cioè acquisirebbero vivaci e rapidi movimenti attivi solo se sottoposti ad un flusso controcorrente.
Riassumendo si può quindi dire che il trasporto degli spermatozoi nella tuba è il risultato sinergico della motilità del gamete maschile, dell’attività contrattile tubarica e della secrezione tubarica.
La funzione ciliare non darebbe quindi alcun contributo al trasporto nemaspermico nella specie umana.
Il processo di “capacitazione”:
Infine gli spermatozoi per essere in grado di fertilizzare gli ovociti devono completare la loro maturazione nelle vie genitali femminili. Questo processo, chiamato capacitazione, inizia in vagina e si completa a livello tubarico: riguarda una serie di modificazioni che avvengono a carico della membrana plasmatica dello spermatozoo. La funzione svolta dalle secrezioni tubariche e dalle cellule del cumulo ooforo ovocitarie nel processo di capacitazione non è ancora del tutto chiarito; del resto la capacitazione può completarsi già nel canale cervicale e può essere indotta con relativa facilità in vitro con terreni di coltura ben definiti.
Va infine rilevato che se fino a pochissimo tempo fa sembrava che l’incontro tra gamete maschile e femminile fosse del tutto casuale, recentissime osservazioni di Aitken suggeriscono l’importanza di fattori chemiotattici di “attrazione” fra i gameti.
Conclusioni
L’unico concetto organico che ci sentiamo di trarre dalla valutazione dei dati sovraesposti riguarda, se così si può dire, la ridondanza della funzionalità tubarica. Come abbiamo visto nell’esposizione dei vari meccanismi del pick-up dell’ovocita, la funzione tubarica può essere interpretata come un sistema complesso al cui funzionamento concorrono vari sottosistemi non solo in modo sinergico ma anche in modo indipendente l’uno dall’altro e con la capacità infine di ognuno di poter sopperire, almeno parzialmente, al deficit di altri sottosistemi.
Se valutiamo finalisticamente l’importanza cruciale della funzione tubarica, la ridondanza di base del sistema è di grandissima utilità in quanto permette il suo funzionamento anche in condizioni non ottimali.
Al di là di questo concetto generale, forse un pò astratto, nonostante i numerosissimi dati che provengono sia da studi sperimentali che da esperienze cliniche, le nostre conoscenze sulla fisiologia tubarica sono tuttavia ancora incomplete, tanto è vero che non disponiamo a tutt’oggi di un esame diagnostico veramente predittivo sulla sua funzionalità.
Ed è per questo che nostra attività clinica le valutazioni prognostiche possono venire contraddette ancora troppo spesso. A tale proposito ancora nel 1979 Pauerstein e Eddy, tra i più autorevoli esperti sull’argomento osservano: “Dopo più di mezzo secolo d’interesse clinico riguardo alle problematiche della sterilità femminile, siamo incapaci di valutare in modo accurato anche un solo aspetto della funzionalità tubarica. Il nostro armamentario clinico è limitato alla valutazione della permeabilità tubarica ai mezzi gassosi o liquidi e alla ispezione della sua superficie peritoneale”. Forse un pò pessimisti ma sicuramente non molto distanti dal vero. Indubbiamente un passo avanti è stato compito con la recente introduzione della salpingoscopia che permette una valutazione “in vivo” della mucosa endotubarica per tutto il tratto ampollare.
Salpingoscopi sottilissimi e flessibili sono allo studio per l’esplorazione del tratto istmico e interstiziale. Tale tecnica si sta rivelando di grande importanza prognostica nella valutazione pre-operatoria di interventi di salpingoplastica distale. Siamo quindi in grado oggi di valutare in modo dettagliato sia la superficie tubarica esterna, peritoneale, sia quella endoluminale mucosa. Ancora del tutto inesplorata a livello clinico è l’attività muscolare della salpinge se si eccettuano i dati chimografici della insufflazione utero-tubarica, la cui attendibilità nel valutare l’attività contrattile è però messa in dubbio dalla maggior parte degli Autori. E’ sicuramente azzardato fare previsioni sul futuro ma sicuramente l’affascinante percorso conoscitivo sulla fisiologia tubarica porterà degli ulteriori contributi alla terapia della sterilità femminile di origine tubarica. Non ci meraviglieremmo se su tali basi si potranno rivedere criticamente tendenze cliniche odierne come la fecondazione extracorporea, in alcuni casi sicuramente motivate se non addirittura indispensabili, ma in altri casi forse troppo frettolose nel dare la tuba per spacciata.
MORFOLOGIA
Nonostante il suo piccolo diametro (2-4 mm), l’istmo è fornito di una cospicua tonaca muscolare che gli conferisce la caratteristica di essere inestensibile e duro alla palpazione. Da studi sperimentali condotti su animali e da osservazioni cliniche in campo umano è emerso che la resezione di tutto o parte dell’istmo è compatibile con una buona percentuale di fertilità.
RISALITA DEGLI SPERMATOZOI
Gli spermatozoi sono decisamente dotati di motilità propria. Ciò nondimeno l’apparato genitale femminile, in una condizione di piena funzionalità, partecipa attivamente alla loro risalita. A livello istmico il movimento oscillatorio delle ciglia è diretto verso l’ostio uterino, generando un’onda ciliare ed uno spostamento di liquido endoluminale con direzione opposta a quella degli spermatozoi. Benchè le cellule ciliate siano scarsamente rappresentate a livello istmico, questa loro attività potrebbe creare un serio impedimento alla progressione dei nemaspermi. Ma nel periodo preovulatorio e al momento dell’ovulazione, a livello istmico le contrazioni muscolari antiperistaltiche sembrano essere di primaria importanza nel trasporto degli spermatozoi verso l’ampolla in quanto questi “saltano” le pliche, sottraendosi all’azione contraria dell’onda ciliare. Secondo altri Autori invece, quest’onda ciliare di verso opposto al tragitto degli spermatozoi sarebbe proficua alla loro risalita perchè i nemaspermi sarebbero dotati di reotropismo negativo, cioè acquisireb-bero vivaci e rapidi movimenti attivi solo se sottoposti ad un flusso controcorrente.
TRAGITTO DELL’UOVO NELLA TUBA
CAPTAZIONE: al momento dell’ovulazione i vasi che decorrono nelle fimbrie, paralleli al loro asse, si fanno congesti e proiettano le fimbrie stesse, lanceolate e fluttuanti verso l’ovaio, inglobandolo quasi completamente.
Le ciglia che tappezzano la mucosa delle fimbrie entrano allora in gioco creando una corrente diretta verso l’ostio addominale della tuba. A questo livello nel frattempo si è creata una pressione negativa, generata dalle contrazioni muscolari della tuba, che aspira l’uovo attraendolo nell’ampolla.
TRASPORTO: a livello ampollare le ciglia battono verso la giunzione ampullo-istmica e quindi continuano nello stesso verso l’onda di trasporto.
Secondo Palmer la muscolatura tubarica avrebbe un’enorme importanza non nella progressione del contenuto luminale ma in una antitetica azione di arresto del trasporto dell’ovocita per dare tempo all’endometrio di prepararsi all’annidamento; questa azione di blocco in condizioni fisiologiche deve durare 60 ore circa. L’arresto si verifica soprattutto a livello della giunzione istmo-ampollare grazie alla sua contrattura. Nel complesso meccanismo che regola il trasporto dell’uovo spetta comunque all’apparato ciliare la funzione principale.
References:
-
Lyons RA, Saridogan E, Djahanbakhch O. The reproductive significance of human Fallopian tube cilia. Hum Reprod Update. 2006;12(4):363–72.
-
Woodruff JD, Pauerstein CJ. The fallopian tube; structure, function, pathology, and management. Baltimore: Williams & Wilkins; 1969.
-
Amso NN, Crow J, Lewin J, Shaw RW. A comparative morphological and ultrastructural study of endometrial gland and fallopian tube epithelia at different stages of the menstrual cycle and the menopause. Hum Reprod. 1994;9(12):2234–41.
-
Crow J, Amso NN, Lewin J, Shaw RW. Morphology and ultrastructure of fallopian tube epithelium at different stages of the menstrual cycle and menopause. Hum Reprod. 1994;9(12):2224–33.
-
Ferenczy A, Richart RM, Agate FJ, Jr, Purkerson ML, Dempsey EW. Scanning electron microscopy of the human fallopian tube. Science. 1972;175(4023):783–4.
-
Patek E. The epithelium of the human fallopian tube. A surface ultrastructural and cytochemical study. Acta Obstetricia et Gynecologica Scandinavica Suppl. 1974;31:1–28.
-
Satir P. Mechanisms of ciliary movement: contributions from electron microscopy. Scanning Microsc. 1992;6(2):573–9. [Abstract] [Google Scholar]10. Jarboe EA. Fallopian tube. In: Mutter GL, Prat J, editors. Pathology of the female reproductive tract. 3. Edinburgh: Churchill Livingstone; 2014. pp. 459–86.
-
Pauerstein CJ, Woodruff JD. The role of the “indifferent” cell of the tubal epithelium. Am J Obstet Gynecol. 1967;98(1):121–5. [Abstract] [Google Scholar]12. Ovalle WK, Nahirney PC. Female reproductive system. In: Ovalle WK, Nahirney PC, editors. Netter’s essential histology. 2. Philadelphia: Elsevier Saunders; 2013. pp. 403–29.
-
Cunningham FG, Leveno K, Bloom S, Hauth J, Rouse D, Spong C. Williams obstetrics. 23. New York: McGraw-Hill Medical; 2010.
-
Jansen RP. Endocrine response in the fallopian tube. Endocr Rev. 1984;5(4):525–51.
-
Eddy CA, Pauerstein CJ. Anatomy and physiology of the fallopian tube. Clin Obstet Gynecol. 1980;23(4):1177–93.
-
Pauerstein CJ, Woodruff JD, Zachary AS. Factors influencing physiologic activities in the fallopian tube; the anatomy, physiology, and pharmacology of tubal transport. Obstet Gynecol Surv. 1968;23(3):215–43.
-
Djahanbahkch O, Ezzati M, Saridogan E. Physiology and pathophysiology of tubal transport: ciliary beat and muscular contractility, relevance to tubal infertility, recent research, and future directions. In: Ledger WL, Tan SL, Bahathiq A, editors. The fallopian tube in infertility and IVF practice. Cambridge: Cambridge University Press; 2010. pp. 18–29.
-
Satir P. The role of axonemal components in ciliary motility. Comp Biochem Physiol A Comp Physiol. 1989;94(2):351–7.
-
Satir P. Structural basis of ciliary movement. Environ Health Perspect. 1980;35:77–82.
-
Satir P, Matsuoka T. Splitting the ciliary axoneme: implications for a “switch-point” model of dynein arm activity in ciliary motion. Cell Motil Cytoskeleton. 1989;14(3):345–58.
-
Sale WS, Satir P. Direction of active sliding of microtubules in Tetrahymena cilia. Proc Natl Acad Sci U S A. 1977;74(5):2045–9.
-
Verdugo P. Ca2 + −dependent hormonal stimulation of ciliary activity. Nature. 1980;283(5749):764–5.
-
Hoops HJ, Witman GB. Outer doublet heterogeneity reveals structural polarity related to beat direction in Chlamydomonas flagella. J Cell Biol. 1983;97(3):902–8.
-
Hagiwara H, Ohwada N, Aoki T, Takata K. Ciliogenesis and ciliary abnormalities. Med Electron Microsc Off J Clin Electron Microsc Soc Jpn. 2000;33(3):109–14.
-
Hagiwara H, Ohwada N, Aoki T, Suzuki T, Takata K. The primary cilia of secretory cells in the human oviduct mucosa. Med Mol Morphol. 2008;41(4):193–8.
-
Hoyer-Fender S. Centriole maturation and transformation to basal body. Semin Cell Dev Biol. 2010;21(2):142–7.
-
Seeley ES, Nachury MV. The perennial organelle: assembly and disassembly of the primary cilium. J Cell Sci. 2010;123(Pt 4):511–8.
-
Sanderson MJ. High-speed digital microscopy. Methods (San Diego, Calif) 2000;21(4):325–34
-
Nasr G, Schoevaert D, Marano F, Venant A, Legrand JJ. Progress in the measurement of ciliary beat frequency by automated image analysis: application to mammalian tracheal epithelium. Anal Cell Pathol J Eur Soc Anal Cell Pathol. 1995;9(3):165–77.
-
Verdugo P, Johnson NT, Tam PY. beta-Adrenergic stimulation of respiratory ciliary activity. J Appl Physiol Respir Environ Exerc Physiol. 1980;48(5):868–71.
-
Allen-Gipson DS, Romberger DJ, Forget MA, May KL, Sisson JH, Wyatt TA. IL-8 inhibits isoproterenol-stimulated ciliary beat frequency in bovine bronchial epithelial cells. J Aerosol Med Off J Int Soc Aerosols Med. 2004;17(2):107–15.