La flussimetria (o velocimetria doppler) materno-fetale è una tecnica ecografica ampiamente utilizzata per valutare la funzionalità feto-placentare e materna attraverso lo studio del relativo flusso ematico. Si basa sul cosiddetto effetto Doppler, ossia sulla variazione di frequenza che si ottiene quando un fascio di ultrasuoni (emesso in questo caso dalla sonda ecografica) incontra e viene riflesso da un corpo in movimento (il flusso ematico).
Con la flussimetria si valuta il rapporto fra sistole e diastole espressi in vari indici, che dovrebbero rispecchiare il grado di distensibilità del vaso e quindi dare un’idea delle resistenze (o impedenza) al flusso vascolare. L’indice di resistenza tende a diminuire con il progredire della gravidanza in tutti i vasi del distretto utero-placentare, tranne che nell’aorta discendente dove gli indici si mantengono abbastanza costanti. Per quello che riguarda la valutazione dell’altezza della diastole, anzitutto si deve dire che un periodo diastolico alto ed uniforme è buono, invece se è basso e ci sono incisure (notch) è indice di sofferenza fetale (1-4).
Cenni sulla fisica degli ultrasuoni e sulle attrezzature: Le onde elastiche comprese tra 16 e 20.000 vibrazioni al secondo (Hertz = Hz) sono quelle che possono essere percepite dal nostro udito. Queste si manifestano come suoni e l’intervallo tra 16 e 20.000 Hz è denominato campo dell’udibilità. Le onde di frequenza ≤16 Hz prendono  il nome di sottosuoni o infrasuoni quelle di frequenza >20.000 Hz vengono dette ultrasuoni. Gli ultrasuoni trovano applicazione in Medicina, nella diagnostica ecografica per immagine e nell’indagine Doppler che aggiunge alla prima la possibilità di valutare i flussi ematici all’interno di un vaso.
il nome di sottosuoni o infrasuoni quelle di frequenza >20.000 Hz vengono dette ultrasuoni. Gli ultrasuoni trovano applicazione in Medicina, nella diagnostica ecografica per immagine e nell’indagine Doppler che aggiunge alla prima la possibilità di valutare i flussi ematici all’interno di un vaso.
Gli ultrasuoni, analogamente ai suoni, hanno una velocità di propagazione che è diversa a seconda del mezzo attraversato, così che essa ad esempio è di 1.500 m/sec. nell’acqua e di 342 m/sec. nell’aria. Inoltre in un mezzo omogeneo gli ultrasuoni si propagano in una sola direzione, mentre i suoni si diffondono in tutte le direzioni. Il fascio di ultrasuoni in un determinato mezzo subisce un’attenuazione che è proporzionale al prodotto della velocità del fascio in quel mezzo per la densità del mezzo stesso (impedenza acustica). Se il fascio di ultrasuoni durante il suo percorso incontra una “interfacie” che divide due mezzi, con diversa impedenza acustica, in parte prosegue nel nuovo mezzo in parte inverte la propria direzione (fenomeno della riflessione ad eco) e la parte riflessa è tanto maggiore, rispetto alle tonalità del fascio incidente, quanto maggiore è la differenza delle impedenze acustiche dei due mezzi (1).
I segnali ecografici sono di due tipi:
- tipo A “A-mode”: la traccia luminosa, che si sposta orizzontalmente, registra a forma di spicchi di varia altezza gli echi normali o patologici della struttura in esame;
- tipo B “B-mode”: l’eco si traduce come punto isolato o come tratteggio lineare.
Gli strumenti lavorano inoltre in real-time e time-motion. I real-time possono suddividersi in due tipi:
- monocristallo oscillante all’intero delle sonde;
- multicristallo costituito da cortine di trasduttori eccitati elettricamente.
Il time motion rappresenta sul display la morfologia del movimento delle strutture in esame, come si utilizza in ecocardiografia.
Effetto doppler
Gli apparecchi Doppler si avvolgono dell’effetto Doppler che fu descritto per la prima volta nel 1842 dall’Autore da cui poi prese il nome (Christian Doppler). L’autore dimostrò l’esistenza di una variazione di frequenza, Delta -F, tra un’onda emessa (FI) ed un’onda ricevuta (Fr) quando ci sia uno spostamento relativo del recettore rispetto alla sorgente ultrasonora ossia le frequenze di un pacchetto di onde sonore o acustiche aumentano se il recettore si avvicina alla sorgente e diminuiscono se questo si allontana. Stessi effetti si hanno quando è la sorgente che si muove rispetto al recettore.
sorgente che si muove rispetto al recettore.
Gli apparecchi Doppler quindi rappresentano dei rilevatori di movimento e trovano la loro utilizzazione nelle misurazioni dei flussi essendo in grado di fornirci il Doppler shift, ossia la differenza tra le frequenze emesse e quelle ricevute quando la superficie riflettente è in movimento (particelle corpuscolate del sangue all’intero dei vasi). La frequenza di ritorno risulterà infatti alterata in rapporto a quella originale.
Gli apparecchi Doppler sono in grado di fornire le differenze tra frequenze emesse e ricevute ossia il “Doppler shift” che inoltre risulta di solito <20 Hz e >17 Hz, rientrando quindi tra le frequenze udibili dall’orecchio umano. Questo segnale può quindi, una volta filtrato, per escludere frequenze esterne di disturbo, essere trascritto su carte millimetrate o riprodotto con amplificatore audio.
Un apparecchio una volta calcolata la velocità del flusso, la trasforma in un punto del modo B, la inserisce in un time-motion e sullo schermo appare una curva indice della velocità dell’oggetto materia d’esame: il picco rappresenta la velocità massima del sangue nel vaso considerato e la base del picco rappresenta la velocità minima.
In un vaso il flusso è di tipo laminare, e la velocità è più rapida al centro ed è minima alla periferia del vaso. Questo fenomeno può essere visualizzato e studiato quantitativamente attraverso lo “spettro Doppler’. La visualizzazione consiste nella rappresentazione, su monitor video o su carta fotosensibile, della distribuzione ed intensità delle diverse frequenze Doppler. Lo studio quantitativo avviene tramite un analizzatore del sonogramma Doppler che è in grado di calcolare la frequenza massima e media in un certo periodo dell’osservazione oppure la media di tali frequenze durante un ciclo cardiaco o più cicli.
Comunque sia è poi in grado di calcolare dalla frequenza media la velocità media del sangue nel vaso e da questa la quantità di flusso secondo la formula: Q = (VxA) dove Q = flusso, V = velocità media. A = area del vaso. Sapendo che il vaso ha una sezione circolare, è sufficiente calcolare il diametro, per cui Q = II d2 V/4. Ovviamente questi calcoli vengono eseguiti dagli stessi apparecchi.
Questa è la flussimetria quantitativa che è soggetta nel suo calcolo a numerosi errori soprattutto riguardo alla valutazione dei vari parametri che la determinano. Si è perciò localizzata l’attenzione sulla flussimetria qualitativa soggetta a minori influenze negative.
DOPPLER CONTINUO
Il Doppler continuo utilizza due cristalli continuamente attivi, uno come emettitore e l’altro come ricevitore. Da questo tipo di schemi non si possono ricavare informazioni sulle profondità dei bersagli in movimento (mancanza di “range resolution”), ma è possibile registrare livelli di velocità anche molto elevati, fino a circa 15 m/sec.
Il Doppler continuo in realtà esegue una media di tutte le velocità esposte sul display, ossia non è in grado di differenziare, ad esempio a livello vascolare, cellule ematiche che abbiano stessa direzione nel moto ma diversa velocità (più lente verso la parete del vaso, più veloci al centro).
Nel Doppler continuo il segnale che ne emerge è l’insieme quindi di tutte le particelle corpuscolate che si muovono nella regione sensibile al fascio ultrasonico.
Doppler pulsato
Gli strumenti Doppler ad onde pulsate (DP) vanno necessariamente adottati quando si vuole conoscere la sede di origine di un determinato flusso. E’ quello utilizzato di routine. Il trasduttore è costituito da un solo cristallo piezoelettrico che agisce alternativamente da trasmettitore e da ricevitore. In base quindi all’intervallo di tempo che intercorre fra la trasmissione dell’impulso e la ricezione dei corrispondenti echi, che provengono da diversi volumi di sangue disposti a varie distanze dalla sonda che contiene i trasduttori, si possono studiare vari flussi campionari all’interno del vaso.
COLOR DOPPLER (PULSATO)
Il Color Doppler o Color Flow Mapping, introdotto nel 1986, è un sistema duplex basato sul Doppler pulsato, dove il flusso è rappresentato a colori. Ciò consente l’acquisizione di informazioni qualitative della velocità del flusso e della sua direzione all’interno della sezione anatomica bidimensionale, permettendo di combinare in tempo reale informazioni integrabili sulla funzione della struttura e sulla velocità del flusso sanguigno. Le informazioni vengono codificate in un colore rosso se il flusso è anterogrado, in blu se retrogrado con una tonalità di brillantezza relativa alla velocità del flusso stesso. Questi apparecchi sono diventati oggi talmente sofisticati da riconoscere anche i flussi più lenti ed i vasi più sottili.
POWER DOPPLER
Il power doppler partendo dall’ampiezza degli echi riflessi, che a sua volta dipende dalla densità degli eritrociti, genera segnali di colore intravascolari mentre il color doppler si basa sulla differenza media della frequenza doppler e per questo motivo è angolo-dipendente ed è soggetto al fenomeno dell’aliasing.
I parametri comunemente utilizzati per la flussimetria fetale sono:
- S/D ratio (SDR): systolic velocity / diastolic velocity
- pulsatility index (PI) (Gosling index): (PSV – EDV) / TAV
- resistance index (RI) (Pourcelot index): (PSV – EDV) / PSV
- PSV: peak systolic velocity
- EDV: end diastolic velocity
- TAV: time averaged velocity
Flussimetria a. ombelicale: se è necessario studiare la funzionalità placentare l’esame interesserà l’inserzione placentare del cordone; se desideriamo eseguire un controllo della fisiopatologia circolatoria fetale (ipossia fetale e centralizzazione del circolo) preleveremo il segnale presso l’inserzione addominale fetale.
I dati derivanti da distretti iuxta-placentari risultano più stabili e riproducibili giacché la placenta va incontro a modificazioni lente, basate prevalentemente su fattori strutturali più che umorali e nervosi. Al contrario il segnale derivante da un distretto iuxta-fetale è estremamente variabile in conseguenza dei fattori umorali ed endocrini del feto stesso e delle sue condizioni emodinamiche del momento. E’ ovvio che i
valori tratti a livello fetale non possono essere utilizzati per costruire una curva e non devono essere presi nel loro valore assoluto, ma essere valutati soltanto nell’ambito di un mapping fetale allargato. Inoltre occorre considerare che a partire dalla 28-30ª settimana i valori P.I. del versante fetale divengono sensibilmente più alti rispetto al versante iuxta-placentare (5-7).
Anche per questo distretto arterioso come per ogni altro distretto flussimetrico si deve porre molta attenzione nell’eseguire la rilevazione con un angolo di insonazione favorevole e quindi preferibilmente al di sotto dei 60º. In particolare bisogna evitare di registrare il segnale durante l’attività respiratoria fetale e materna giacché in tali condizioni il profilo del’onda diventa irregolare (8-14).
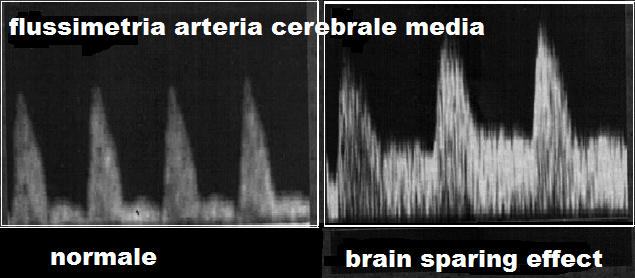
In condizioni di benessere fetale, la flussimetria dell’arteria ombelicale presenta basse resistenze (grande quantità di flusso) mentre il circolo della cerebrale media presenta alte resistenze (piccola quantità di flusso). In condizioni di ipossia invece si osserva aumento dell’indice di resistenza dell’a. ombelicale mentre l’a. cerebrale media presenta una diminuzione delle resistenze al circolo che è indice di un aumento del flusso diastolico cerebrale compensatorio, il cosiddetto Brain Sparing Effect (BSE) (15,16). La presenza di BSE impone un monitoraggio attento e continuo del benessere materno-fetale ma la capacità di compensazione permette di poter attendere la piena maturità polmonare fetale prima di espletare il parto. La perdita del BSE invece impone l’espletamento del parto anche in condizioni critiche fetali data l’incapacità del feto ad innescare o mantenere il meccanismo di compensazione. Lasciare proseguire la gravidanza in queste condizioni equivale ad esporre il feto a fondato rischio di gravissime lesioni cerebrali e a morte fetale (17-27).
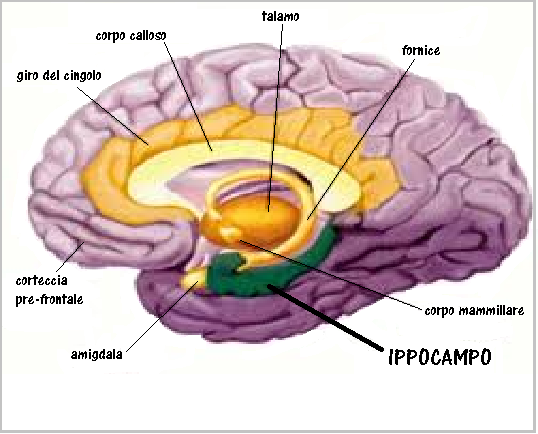
Un elevato PI ombelicale a 28-38 settimane di gravidanza è stato correlato a patologie cardiache neonatali (28) e ad uno scarso sviluppo dell’ippocampo e disturbi dell’attività cognitiva e della memoria in bambini nell’età scolare soprattutto nei feti IUGR, ma anche nei feti AGA (29-36).
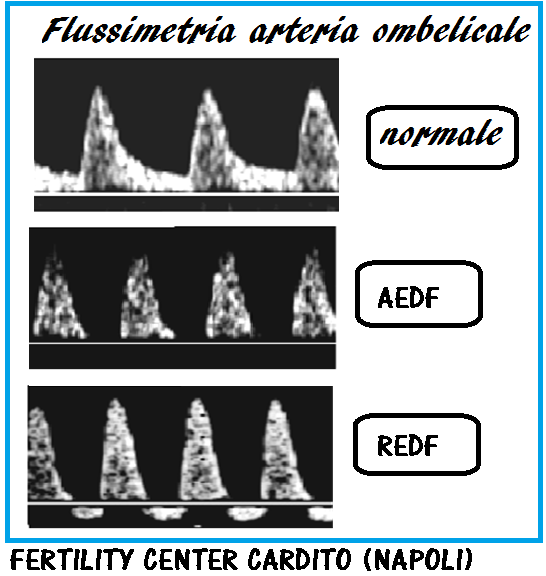
AED, REDF/BSE/Decelerazioni tardive – L’osservazione di flusso tele-diastolico assente (Absent end Diastolic Flow, AED) o invertito (Reversed end Diastolic Flow, REDF) nell’arteria ombelicale costituisce un fattore di rischio elevato per mortalità prenatale perchè tali alterazioni compaiono in una fase tardiva, già datata, di sofferenza fetale e dopo centralizzazione del circolo (BSE). Il tempo che intercorre tra la la comparsa di decelerazioni tardive all’esame cardiotocografico e l’osservazione di flusso diastolico assente o invertito è variabile da uno a sei giorni (37,38). La somministrazione materna di betametasone induce un ritorno del flusso telediastolico dopo 24 ore dalla somministrazione del farmaco e la positività persiste per 48 ore. Tale efficacia però non si osserva nelle gravidanze gemellari e multiple (39-43).
Classificazione della gravità: nell’ipossia fetale la forma d’onda della velocità del sangue dell’arteria ombelicale cambia in modo progressivo come segue:
- Aumento PI e RI; Riduzione S/D
- Riduzione del flusso diastolico finale
- Flusso diastolico finale assente (AEDF)
- Inversione del flusso diastolico finale (REDF) (37,38)
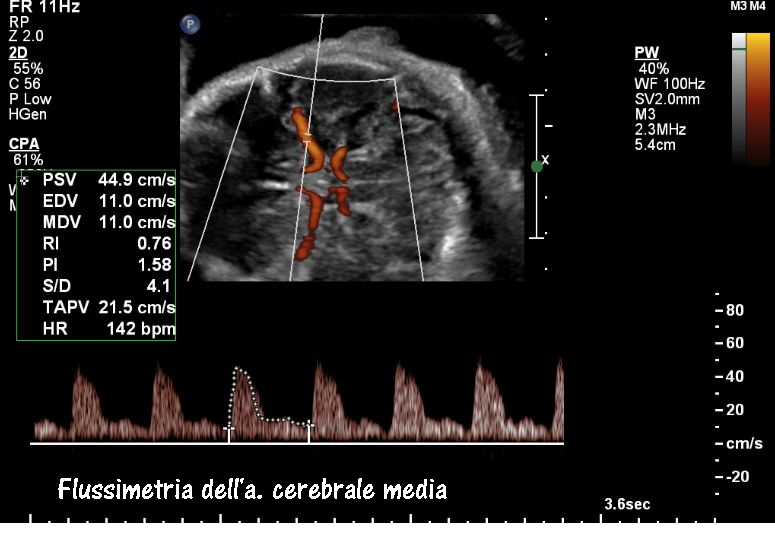
Arteria cerebrale media: lo studio della flussimetria dell’a. cerebrale media (MCA) ha acquisito enorme importanza nella valutazione del benessere fetale soprattutto in presenza di anomalie degli indici velocimetrici dell’a. ombelicale (UA). In tal caso è tassativa l’indagine flussimetrica sulla MCA ed il rapporto con la flussimetria dell’a. ombelicale. Anomalie dell’indice di pulsatilità (PI) e S/D ratio della MCA, e del rapporto MCA/UA sono significativamente correlate, rispetto ai feti con flussimetria normale, a maggior rischio di gestosi, maggiori percentuali di taglio cesareo per distress fetale (76.7% versus 62.5%,P<0.0001), basso indice di Apgar a 5 minuti dalla nascita (61.9% versus 22.4%, P<0.0001), maggior numero di IUGR (7.18% versus 1.76%,P<0.0001) (44-47).
Tecnica di scansione: Tutte le misurazioni sono state effettuate con la gravida in posizione semiseduta con la testa e il petto leggermente elevate. Per la misura dell’MCA, è stata ottenuta una scansione assiale della testa fetale a livello di peduncoli cerebrali, quindi il colore Doppler è stato utilizzato per visualizzare il poligono di Willis e il caliper è stato posizionato entro 1 cm dall’origine dell’MCA. L’angolo tra il fascio ultrasonografico e la direzione del flusso sanguigno (angolo di insonazione) da consigliare sempre deve essere <30 gradi.
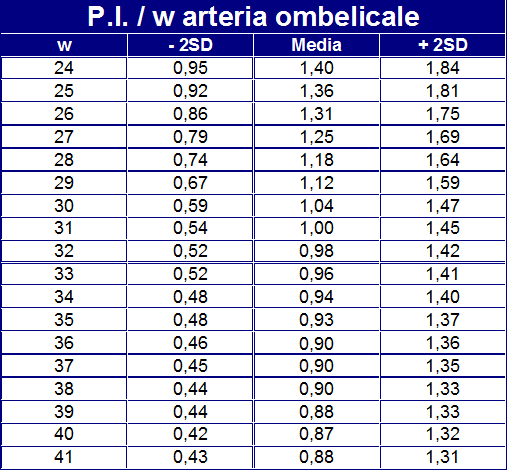
Il PI dell’a. ombelicale è considerato anormale quando è >2SD, Il PI della MCA è considerato anormale quando i valori sono <5th percentile. MCA/UA PI<1 è considerato anormale (48-50).
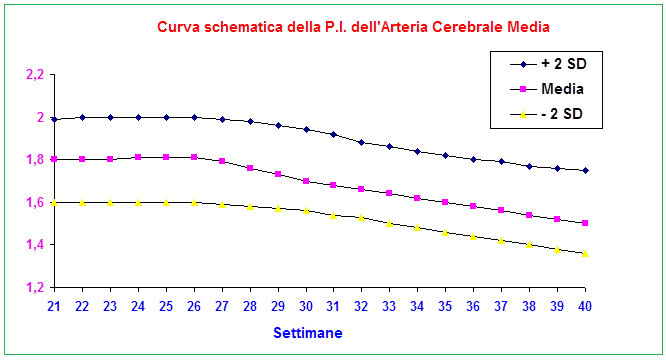
- in caso di ritardo di crescita il feto ridistribuisce il flusso di sangue verso quegli organi che necessitano maggiormente di ossigeno e nutrienti per svilupparsi correttamente, come il cuore ed il sistema nervoso centrale. Tale processo è chiamato centralizzazione del circolo (brain sparring effect). Per questo motivo si assiste ad una dilatazione dell’arteria cerebrale media con aumento del flusso diastolico al fine di aumentare l’apporto di ossigeno e nutrienti. Da un punto di vista clinico la modificazione dell’arteria cerebrale media dimostra che il feto sta cercando di compensare il ridotto apporto di ossigeno. Tuttavia, questo dato è un segno molto tardivo della compromissione del benessere fetale ed è significativamente associato al rischio di sviluppare gravi complicazioni del SNC fetale o morte fetale (51-62).

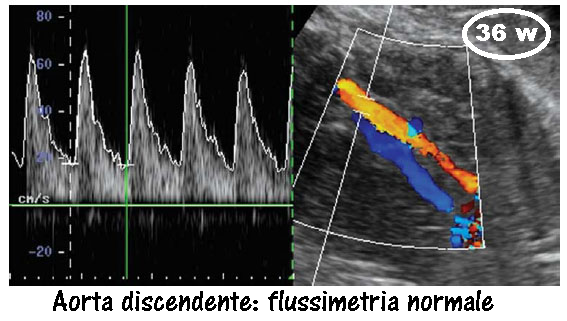
AORTA ADDOMINALE: l’aorta discendente fetale è un vaso di grande calibro, facilmente visualizzabile da ultrasuoni Doppler fin dalle prime fasi della vita fetale. Il suo indice di resistenza (RI) e l’indice di pulsatilità (PI) forniscono una buon indice per valutare l’emodinamica del sistema circolatorio fetale e il benessere fetale.
- La zona da esaminare consigliata è la porzione di aorta che va dal diaframma al carrefour delle aa. iliache.
- L’angolo di scansione deve essere inferiore ai 60º preferibilmente compreso tra i 60 ed i 45º.
- L’osservazione va compiuta durante fasi di quiete fetale e comunque in assenza di movimenti respiratori che, come noto, alterano profondamente la forma dell’onda sia a causa dell’effetto depressivo a livello toracico che per l’aritmia respiratoria che a volta si associa.
- Le donne fumatrici devono astenersi dal fumo almeno 2 ore prima dell’esame
- La visualizzazione dell’arco aortico talvolta è difficile, conseguentemente alla frequente posizione fetale dorsoanteriore e all’attenuazione ad ultrasuoni causata dalla colonna vertebrale. Per superare questa difficoltà, si cerca di stimolare il feto a cambiare posizione e si invita la madre ad assumere un decubito un decubito laterale.
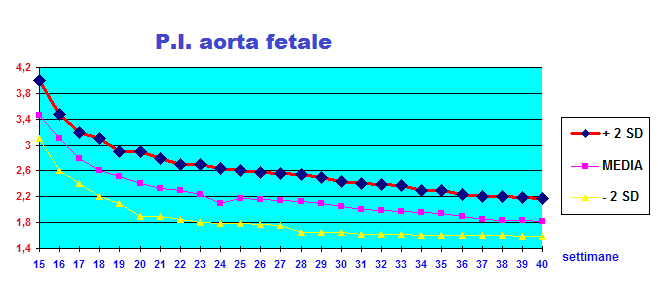
Curva e Range di normalità: Il flusso nell’aorta comincia molto precocemente e si può esplorare ecograficamente già alla 9ª-10ª settimana. In questa epoca solitamente l’onda diastolica è assente ed inizia a visualizzarsi a partire dall’inizio del IIº trimestre per poi rimanere costante per il resto della gestazione. L’indice di pulsatilità scende rapidamente durante le prime 20 settimane di gravidanze per attestarsi stabilmente sui valori di 1.8-2.0 dopo tale epoca (63-65).
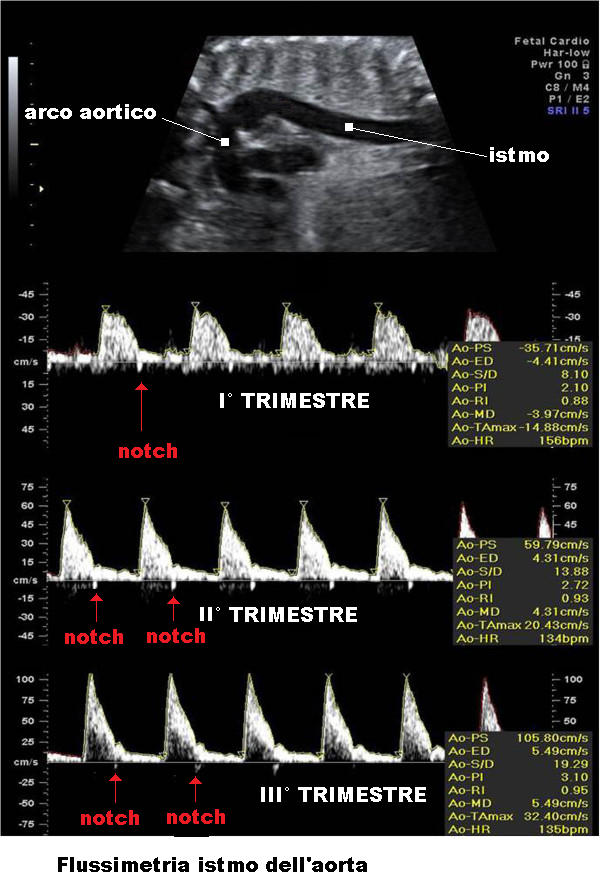
Il profilo dell’onda aortica all’esame Doppler è caratterizzato da un picco sistolico, un notch post-sistolico e un flusso diastolico terminale. La fase di accelerazione (picco sistolico) riflette la contrattilità cardiaca mentre la fase diastolica è in relazione alla resistenza vascolare periferica. Il notch post-sistolico è dato dalla chiusura della valvola aortica nella fase precoce della diastole ventricolare e corrisponde a un lieve decremento di velocità del flusso aortico.
Lo spettro flussimetrico Doppler dell’aorta è modulato da diverse variabili circolatorie come l’inotropismo cardiaco fetale, l’impedenza arteriosa del sistema vascolare periferico, l’ematocrito fetale (anemia fetale) e l’equilibrio acido-base. Durante un periodo di sofferenza ipossica il feto risponde direttamente attraverso il rilascio di epinefrina e norepinefrina indipendentemente dalla stimolazione simpatica. L’attivazione dei recettori alfa-adrenergici durante l’ipossia causa un aumento della pressione arteriosa e vasocostrizione splacnica. Anche la vasopressina plasmatica aumenta in risposta all’ipossia. Un progressivo cronico inasprisi di tali condizioni ridurrà prima il tratto diastolico prima con lieve appianamento (Flattening End Diastolic Flow, FEDF) quindi con riduzione sempre più evidente dell’onda diastolica fino a farla scomparire (Absent End Diastolic Flow, AEDF) mentre l’indice di pulsatilità aumenta. Perdurando lo stato di sofferenza, si può arrivare all’inversione del flusso telediastolico (Reversed End Diastolic Flow, REDF). I feti con RED nullo o invertito rappresentano una categoria ad altissimo rischio, con alta incidenza di IUGR asimmetrico, enterocolite necrotizzante, necrosi surrenalica e scompenso cardiocircolatorio. La prognosi clinica è sempre riservata sia quoad vitam che quoad valetitudinem. L’intervento ostetrico non deve essere differito se non in base ad una sicura motivazione di immaturità. (66-80).
CAVA INFERIORE
a) Tecnica di registrazione: La cava inferiore viene facilmente individuata in una scansione passante per il seno delle vene cava e comprendente l’atrio destro. Numerose altre scansioni sono state proposte e sono tutte efficaci purché si tengano presenti le regole generali di ottimizzare l’angolo di insonazione e di evitare interferenze con organi vicini (vene sovraepatiche e atrio destro). Il profilo velocimetrico è caratterizzato da una onda trifasica con due onde centrpete rispetto al cuore ed una breve onda retrogada. La prima onda centripeta è detta onda «S» corrispondente al rilasciamento atriale e contemporaneo alla sistole ventricolare. La seconda onda e detta «D» segue la prima senza intervallo e corrisponde alla diastole ventricolare durante pertanto il periodo di riempimento ventricolare passivo. La terza breve onda «A» deriva da un piccolo rigurgito che si osserva durante la sistole atriale. Si possono inoltre osservare delle modificazioni del profilo velocimetrico della vena cava in differenti condizioni: durante i movimenti di inspirazione la velocità aumenta per ritornare progressivamente alla normalità. Durante le extrasistole di tipo atriale è presente un’onda di rigurgito dovuta al flusso retogrado provocato dalla contrazione atriale.
c) Uso e significato clinico: Lo studio della morfologia dell’onda della vena cava ha assunto importanza negli ultimi periodi per la possibilità di individuare dei livelli di progressica ingravescenza nella fase dello scompenso che segue l’aggravarsi della condizione della centrilizzazione del circolo. Secondo una logica progressione di eventi emodinamici, una volta che ci troviamo di fronte alla scomparsa della onda diastolica in aorta (EDF 0) l’onda velocimetrica cavale presenta delle modificazioni del suo profilo. In particolare si notano questi progressivi fenomeni:
- abbreviamento dell’onda S con visualizzazione di un intervallo S/D nel quale il flusso è completamente assente. Ciò deriva dalla brevità dei flussi sistolici con scomparsa dell’onda diastolica nell’aorta.
- importante rigurgito atriale dovuto al flusso inverso, presente durante la sistole atriale, quando questo non riempe più il ventricolo di destra per le ragioni sopra esposte.
Il profilo velocimetrico rappresenta pertanto un andamento caratteristico «a va e vieni» con l’onda A addirittura più alta dell’onda S.
La maggior parte degli Autori è concorde nel riscontrare tale condizione non solo nel ritardo di crescita ma anche in condizioni di tachi-aritmia. Secondo alcuni le modificazioni dell’onda cavale si collocano in rapida processione dall’azzeramento dell’onda tele-diastolica in aorta alla inversione di quest’ultima.
Considerando che esistono delle strette correlazioni di tipo velocimetrico tra la vena inferiore e la vena ombelicale anche quest’ultima può manifestare delle modificazioni pur tardive, nella sofferenza fetale. Il back-flow nella cava inferiore si trasmette a ritroso nei distretti venosi di questa tributari (Foreward block). In condizioni di grave sofferenza con rigurgito cavale si può incontrare una pulsatilità anche nella vena ombelicale. La pulsatilità è data dall’onda di rigurgito atriale destro, ed è sincrona con la pulsazione cardiaca. Il flusso pertanto non prosegue più in modo continuo come avviene normalmente nella vena ombelicale, ma interrompendosi (ed a volte anche negativizzandosi) durante il moto di reflusso destro, presenta una pulsatilità tipica di un flusso arterioso.
Si noti pertanto che trattasi di fenomeni legati alle fasi più avanzate della sofferenza fetale intra-uterina che stanno tra il periodo della acidosi e dello scompenso, fasi nelle quali l’intervento clinico non è più rinviabile e l’osservazione passiva degli eventi deve essere limitata solo a quei casi in cui l’induzione di un parto non darebbe comunque nessuna garanzia di sopravvivenza del feto.
7.9 – OSSERVAZIONI SUI RITORNI VENOSI SISTEMICI: La vena ombelicale dopo aver incontrato il dotto venoso compie una curva verso sinistra e si unisce nei rami della vena porta. Nella vena porta il flusso è di tipo francamente venoso, lievemente ondulatorio, mentre nella vena ombelicale esso si mantiene caratterizzato da una velocità costante. La vena ombelicale presenta una certa pulsatilità fino alla 13ª settimana; epoca oltre la quale la pulsatilità scompare. Il sangue che attraversa il fegato si riunisce nelle vene sovraepatiche. La quantità di flusso che attraversa questi vasi è maggiore man mano che ci avviciniamo a termine di gravidanza giacché il flusso si sottrae in tale periodo allo shunt del dotto venoso. I rami sovraepatici sono ben visibili in color doppler e tendono e raccogliersi verso l’alto confluendo nella vena cava poco al di sopra del dotto venoso. Il profilo velocimetrico in tali vasi presenta un andamento analogo a quello descritto per la cava inferiore, ma il suo significato clinico nel feto, nelle diverse condizioni fisopatologiche, è ancora tutto da studiare.
L’onda «S» deriva dalla sistole ventricolare ed è la maggiore. L’onda «d» rappresenta lo scorrimento del sangue verso l’atrio di destra nel periodo di riempimento ventricolare passivo e l’inizio della sistole atriale. L’onda «A» rappresenta la telesistole atriale e descrive un flusso retrogrado.
La morfologia del profilo velocimetrico muta in diverse condizioni. Durante un’extrasistole, particolarmente di tipo sovraventricolare, si osserva una netta inversione del flusso durante la contrazione atriale. Una inversione del flusso durante l’extrasistole si osserva anche nel dotto venoso, sebbene con caratteristiche diverse. Durante l’attività respiratoria il flusso delle sovraepatiche si modifica. Si osserva infatti per azione della pressione negativa endotoracica una fusione dell’onda «S» e dell’onda «D» con un aumento dell’afflusso all’atrio di destra. Tale reperto si visualizza bene in color doppler dove la direzione del flusso inverte i colori durante l’inspirazione e l’espirazione.

DOTTO VENOSO DI ARANZIO:
Questa struttura, anche se poco studiata rappresenta uno dei distretti vascolari di maggiore importanza sia per la fisiologica crescita fetale sia per il meccanismo di compenso nei casi di ipossia.
a) Tecnica di registrazione: Il dotto venoso si reperta con una certa facilità fino alla 25ª settimana di gestazione e con maggiore difficoltà dopo tale periodo. Esso è localizzato alla curvatura della vena ombelicale prima che questa pieghi a destra dell’addome fetale per congiungersi con il ramo sinistro della vena porta. Il suo diametro varia con l’età gestazionale e allo stesso modo la possibilità che venga reperito in una scansione standard dell’addome fetale si riduce man mano che l’età gestazionale avanza. Oltre la 30ª settimana la struttura presenta delle notevoli variazioni di dimensioni nel corso del periodo di osservazione. In altri termini tende a rilasciarsi e a restringersi, contraendosi in seguito a stimoli di varia natura. Di certo sappiamo che esso è ben innervato, è sensibile alle variazioni di ossigeno.
La maggiore difficoltà nella tecnica di rilevazione del suo flusso non risiede tanto nella visualizzazione, quando nel corretto calcolo dell’angolo di incidenza. Inesattezze nel posizionamento del segmento marker si traducono in importanti errori di calcolo. Conviene pertanto tenersi sempre in angoli piuttosto stretti (intorno ai 30º) in modo tale da non incorrere in errori importanti. L’onda che ne deriva presenta un classico aspetto trifasico simile a quello riscontrabile nella cava inferiore ma solitamente privo del piccolo flusso retrogrado corrispondente alla contrazione atriale in tele-diastole. Delle 3 onde l’onda S (sistole ventricolare-rilasciamento atriale) risulta più ampia e di maggiore velocità per tutto il periodo della gravidanza, fino al IIIº trimestre. Viene seguita da un onda D (diastole ventricolare, riempimento ventricolare passivo) che cresce progressivamente fino a termine di gravidanza che uguaglia e talvolta supera per durata l’onda S. La terza onda detta A (contrazione atriale tele-diastolica) è una breve e profonda incisura dovuta al brusco rallentamento della direzione anterograda del flusso.
| DOTTO VENOSO | |
| Onda S | Sistole ventricolare |
| Onda D | Diastole ventricolare |
| Onda A | Contrazione atriale |
b) Curva e range di normalità: sia la velocità media che la velocità di picco tendono a salire nel corso della gravidanza in relazione inversa a quanto accade per le dimensioni del dotto.
c) Uso e significato clinico: Il dotto venoso rappresenta il primo e più importante meccanismo messo in atto dal feto in condizioni di deprivazione. Qualora incontrasse un periodo di riduzione ossigenativa durante il IIº trimestre di gravidanza il feto tenderebbe ad aprire stabilmente il dotto venoso e shuntare la circolazione epatica tendendo ridurre drasticamente il passaggio di sangue nel ramo sinistro della vena porta. Questo meccansimo è alla base del profilo disauxologico noto come feto piccolo sproporzionato. La riduzione dell’apporto ematico al fegato e agli organi ad esso collegati ha come prima conseguenza la riduzione della circonferenza addominale con aumento del rapporto circonferenza cranica-circonferenza addominale. Il dotto venoso risulterà quindi aperto e facilmente localizzabile in tutti i feti in cui si sta instaurando tale processo. In conseguenza del suo rilasciamento la velocità media del dotto venoso tende ad abbassarsi, riducendosi peraltro anche la velocità di picco. Enorme importanza di tale meccanismo è che esso avviene prima che si instauri la centralizzazione del circolo. Si può pertanto facilmente comprendere che nel periodo della riapertura del dotto ci troviamo ancora in una fase di assoluto compenso in cui abbiamo tempo per organizzare e predisporre tutto quanto riteniamo opportuno per l’ottimare svolgersi della gravidanza.
Il termine «riapertura del dotto» è quello che meglio esprime a nostro parere la fenomenologia legata al primo meccanismo di compenso. Si è infatti già detto che il dotto è stabilmente pervio durante i primi due trimestri di gravidanza, corrispondente al periodo di accrescimento strutturale.
Nel IIIº trimestre (fase di accrescimento ponderale) esso è di regola, come già detto, contratto e solo ciclicamente pervio. In occasione della necessità di un compenso il dotto si «riapre» stabilmente, ripristinando pertanto quel meccanismo che era fisologico durante i primi mesi di gravidanza. Questo meccanismo spiega pertanto il gran numero di IUGR asimmetrici che giungono alle osservazioni ambulatoriali senza altri segni di sofferenza fetale, né tanto meno di centralizzazione del circolo. Si deve comunque tener presente che tra questi soggetti si vanno configurando quelli che evolvono in modo progressivamente ingravescenti.
L’impiego clinico del monitoraggio del dotto venoso nella diagnosi e nel controllo dei feti affetti da ritardo di crescita o da ipossia cronica è ancora in fase di studio e per molti aspetti controverso. Una tra tutte è quella riscontrabile nei feti “large”. In questi feti il dotto è solitamente ampio anche a termine di gravidanza perché comunque la portata ematica della vena ombelicale è notevole. La quantità di flusso che shunta il fegato è quindi maggior rispetto ai soggetti normali. Si consideri però che, anche a dotto ampio, la velocità di picco e quella media risultano sempre elevate come di norma avviene a termine di gravidanza per i feti normosviluppati. Il concetto di «ampia pervietà del dotto» che noi utilizziamo come parametro di valutazione dell’attività del dotto, è del tutto soggettivo. Non è quindi riproducibile ed impiegabile sul piano clinico anche per questa ragione. Più corretto, anche se non esente da critiche, è il dato che ci proviene dalla misurazione della velocità media e della velocità di picco. Bisogna però tener presente diverse variabili che vanno standardizzate nel modo più rigido possibile:
- studiare i feti in fase di quiete;
- utilizzare angoli di incidenza < 30º;
- utilizzare apparecchiature di ottima sensibilità;
- esperienza dell’operatore.
Queste accortezze, unite a buon senso ed alla possibilità di estendere immediatamente lo studio flussimetrico ad altri distretti venosi od arteriosi, fanno della valutazione funzionale della velocità del dotto un metodo di grande interesse speculativo che, passato al vaglio de tempo e dell’esperienza, sarà in grado di fornire informazioni riguardo ai primi segnali di adattamento del feto ad un’iniziale ipossia.

– ARTERIE RENALI
a) Tecnica di registrazione: Lo studio delle arterie renali necessita di una apparecchiatura di buona qualità e particolarmente agevole risulta individuare il flusso mediante il color Doppler che, in un buon numero di casi, permette di osservare anche il flusso delle arterie interlobar. Mediante la sonda endovaginale è possibile riconoscere la presenza di un flusso sistolico già a partire dalla 14ª settimana di gestazione. Il metodo più semplice risulta quello di eseguire una scansione trasversale dell’addome e porsi il più in asse possibile alla derivazione del flusso nell’arteria. L’onda diastolica dell’arteria renale compare dalla 15ª-18ª settimana di gestazione. Da questo periodo in poi si nota una progressiva e lineare riduzione dell’indice di pulsatilità in relazione all’aumento della compliance dell’organo.
b) Curva e range di normalità: La curva dell’arteria renale mostra una progressiva riduzione del P.I. dalla 16ª settimana fino a termine. I valori del P.I. variano da una media di 2.3-3.0 nel secondo trimestre di gravidanza fino a 1.8-2.5 a termine. La letteratura riporta valori lievemente più alti verosimilmente a causa dei limiti posti dalle apparecchiature usate in passato. L’apparecchiature da noi utilizzate ermettono infatti di visualizzare con estrema disinvoltura e precisione i profili velocimetrici anche a carico delle arterie interlobari, i cui valori risultano inferiori a quelli della renale comune.
c) Uso e significato clinico: La validità della registrazione del P.I. dell’arteria renale risiede soprattutto nella comprensione di alcuni fenomeni fisiopatologici che avvengono nella vita intrauterina. Dalla fisologia sappiamo che il flusso renale è in relazione alla filtrazione glomerulare e quindi in certa misura dalla quantità di urina prodotta. Si deve considerare che il P.I. dell’arteria renale nel feto è sostanzialmente più alto di quello che troviamo nell’adulto, ciò è dovuto alle alte resistenze vascolari del rene fetale. A causa di queste alte resistenze il flusso sanguigno renale è piuttosto basso rappresentando solo il 3-7% della gittata cardiaca durante il secondo trimestre di gravidanza46. Va inoltre detto che durante la vita prenatale la vascolarizzazione non è uniforme ed il flusso plasmatico predilige le zone iuxta-midollari a quelle corticali. Benché il flusso renale sia basso, il rene fetale produce una grande quantità di urine. Nella pecora la produzione di urina è circa il 25% del volume di filtrazione glomerulare49 valore molto alto se lo si paragona a quello dell’adulto e testimoniante una scarsa funzione di riassorbimento tubulare. Il rene fetale è inoltre capace di rispondere alle stesse influenze dell’adulto. IL sistema renina-angiotensina è addirittura 20 volte più attivo che nell’adulto stesso. La vascolarizzazione è inoltre soggetta ai recettori alfa e beta adrenergici, tale effetto sembra però antagonizzato dagli alti livelli di prociclina fetale al fine di mantenere una sufficiente diuresi. Secondo tali ipotesi si giustifica l’uso dell’indometacina nel polidramnios in virtù dell’attività antiprostaglandinica di tale farmaco e quindi della conseguente prevalenza del sistema renina-angiotensiona sulla diuresi. Nell’ipossia abbiamo quindi una serie di meccanismi (stimolazione adrenergica, attivazione sistema renina-angiotensina, attivazione del sistema arginina-vasopressina) in grado di ridurre il flusso renale. Ciò giustifica i dati della letteratura che dimostrano una riduzione del P.I. nei feti ipossici. Vias e Nicolaides trovarono una correlazione diretta tra pO2 fetale rilevata tramite cordocentesi ed il P.I. dell’arteria renale. Secondo Arduini esiste inoltre una buona correlazione con l’oligoidramnios quando questo si associa al ritardo di crescita. Sempre secondo lo stesso osservatore non ci sono correlazioni significative tra ritardo di crescita e bassi valori di P.I. della arteria renale quando la quantità di liquido amniotico fosse mantenuto entro i limiti della normalità58. Nella nostra esperienza non sono infrequenti le osservazioni di oligoidramnios con valore di pulsatilità dell’arteria renale perfettamente nella norma. Tali osse4rvazioni si riferiscono per lo più ai feti normosviluppati ed è probabile che in tali casi la genesi dell’oligoidramnios nulla abbia a che vedere con la riduzione del flusso renale. E’interessante notare che nei casi di oligoidramnios «fisiologico» che si osserva presso il termine della gravidanza o addirittura nella gravidanza post-termine non si osserva nessuna alterazione del P.I. dell’arteria renale. Questa osservazione va comunque riferita ai casi in cui non si associ il ritardo di crescita o alterazioni degli altri indici di pulsatilità. Da tutta questa interessante messe di informazioni si può pertanto intuire che durante il decorrere della gravidanza la quantità di liquido amniotico non è sempre in correlazione con la diuresi fetale, ma che possono intervenire fattori diversi, soprattutto presso il termine di gestazione, capace di influenzare in modo significativo il riassorbimento e quindi di ridurre il volume di liquido. Dal punto di vista clinico è risdultato talvolta utile misurare il flusso della arteria renale nei casi di oligoidamnios in cui si sospettava un ritardo di crescita oppure una rottura delle membrane. Nei soggetti in cui si è avuta rottura delle membrane e non ci sono segni di sofferenza fetale l’indice di pulsatilità dell’arteria renale si mantiene di solito nella norma. Il calcolo si può effettuare comunque su ognuna delle arterie renali e sulla media delle due rilevazioni.
DOTTO ARTERIOSO DI BOTALLO
a) Tecnica di registrazione
La visualizzazione del Dotto Arterioso è piuttosto agevole utilizzando un buon apparecchio bidimensionale od un Color Doppler. Esso si presenta come un ristringimento inbutiforme che segue direttamente l’emergenza del tronco polmonare prolungandolo. Il vaso è voluminoso in condizioni di normalità e per coglierlo con facilità è sufficiente seguire l’emergenza dell’arteria polmonare e individuare il punto in cui questa si divide tra i rami polmonari veri e propri ed il dotto. Seguendo l’arco della polmonare, in una scansione a 5 camere ed orientando opportunamente il trasduttore in modo tale da portarci ad una scansione di long axis, si può agevolmente riscontrare il dotto e seguirlo fino al suo ingresso in aorta. La sua presenza è inoltre rilevata dal fenomeno dell’Aliasing. A causa delle alte velocità di flusso è sovente osservare, nella porzione più prossimale dell’aorta un importante modifica di colore dovuta al fenomeno dell’Aliasing. Bisogna però fare attenzione a non confonderlo con l’aorta stessa che, dopo aver compiuto l’arco, torna nella stessa direzione del dotto verso il basso ed assume pertanto la stessa colorazione nel Color Doppler. In aorta infatti, all’incrocio con il dotto è presente una turbolenza di flusso che il Color Doppler rassomiglia al fenomeno dell’Aliasing. Si noti che: l’arco compiuto dalla polmonare con il Dotto è molto più ampio. Il Botallo è di grandi dimensioni e quindi probabilmente il vaso più facilmente reperibile. Si deve inoltre notare che il Botallo e la Polmonare sono in diretta continuazione l’uno dell’altra e quindi, per essere sicuri di campionare il segnale nel dotto, si devono avere alcune accortezze. Si visualizza la divisione Botallo/Vasi Polmonari oppure ci si tiene, nella misurazione, il più prossimali possibile all’aorta.
Il segnale acustico del dotto è caratterizzato da un rumore fischiante ad alta frequenza con una «coda» di bassa frequenza. Dal punto di vista grafico il segnale è bifasico con una sistole ad alta frequenza ed una diastole bassa e continua. la comparsa della diastole nel Botallo avviene prima della 20ª settimana. La sua registrazione non è però sempre possibile anche utilizzando una sonda endovaginale giacché non è facile ottenere dei pianbi di scansione che ne ottimizzano la registrazione. I valori velocimetrici sono piuttosto elevati e spesso si osserva il fenomeno dell’Aliasing in particolare quando non si ottimizza la PRF. La curva di velocità mostra un andamento in crescita fino a termine di gravidanza per la componente sistolica, la fase diastolica non si modifica sostanzialmente. La letteratura fornisce curve di velocità di picco talvolta dissimili tra di loro, e descrive valori che variano da 50 a 141 cm/s. Le differenze si possono spiegare in base alla variazione di velocità che nel dotto si possono osservare durante le fasi di respirazione. Inoltre si deve considerare come la corretta misurazione dell’angolo di incidenza del fascio Doppler, elemento essenziale per ottenere dati esatti, non è sempre agevole. Errori nella misurazione nell’angolo esporranno a gravi inesattezze. La nostra curva mostra un andamento progressivamente crescente dei valori di velocità di picco da circa 70 cm/s a 20 settimane fino a 150 a termine di gravidanza.
il flusso del tronco polmonare si continua direttamente con il Botallo restringendosi in esso e virando nel colore per il fenomeno dell’Aliasing.
L’arco dell’aorta è sempre molto più stretto dell’arco polmonare. La presenza del Botallo si nota sempre per un viraggio del colore detto Aliasing sia nella polmonare (a causa delle alte velocità) sia nell’arco aortico a causa dei fenomeni di turbolenza che avvengono per l’ingresso del sangue ivi portato dal dotto arterioso.
b) Ritardi di crescita: Si è già a lungo detto dell’estrema sensibilità del dotto alla ipossia ed alle prostaglandine. Sono particolarmente queste ultime sostanze a determinare, in caso di sofferenza fetale cronica o acuta, la progressiva chiusura del dotto che è alla base del meccanismo del brain sparing. La prima modificazione che si osserva è data dall’aumento della velocità sistolica, fenomeno che avviene nei vasi a calibro variabili e portata costante secondo la ben nota legge del teorema di Bernoulli. Secondo tale meccanismo infatti il flusso in arteria polmonare riduce la sua velocità aumentando la pressione. Nel dotto arterioso avviene il meccasnimo opposto: alte velocità basse pressioni. Con apparecchi a buona risoluzione già in condizioni di normalità si osservano fasi di contrazioni e rilasciamento del dotto arterioso. Nei ritardi di crescita questo fenomeno diventa molto evidente durante qualche minuto di osservazione.
Con il proseguire del processo si osserva un aumento delle resistenze a livello aortico con successiva riduzione della velocità di picco e allungamento TPV. Nei periodi finali del processo ipossico ed acidemico si osserva la massima costrizone duttale con assenza di flusso all’interno di esso.
c) Flusso duttale e movimenti respiratori: Durante l’attività respiratoria fetale si osservano ovvie variaizoni della pressione endo-toracica che si rifletteranno sulla vascolar4izzazione dell’arteria polmonare. La letteratura dimostra che esiste una riduzione della velocità di picco del dotto durante la fase dell’espansione polmonare. Assali ha messo in evidenza negli animali una riduzione delle resistenze del letto arterioso polmonare. Questo aumento di perfusione è oggi ben documentato utilizzando buone apparecchiature Color Doppler. L’aumento del flusso nell’arteria polmonare ha come conseguenza una riduzione dello shunt destro sinistro del dotto. Durante il proseguire della gestazione la differenza di velocità di picco (detta PV) aumenta progressivamente. Ciò equivale a dire che all’aumento dell’età gestazionale si osserva un aumento della irrorazione polmonare durante l’attività respiratoria. Questo dato è di estrema importanza e garantisce secondo alcuni Autori un regolare sviluppo polmonare.
Le maggiori differenze di velocità si osservano nel feto umano dopo il completamento della fase canalicolare dello sviluppo polmonare. Infatti nelle fasi successive alla 26ª settimane, meglio note come fasi sacculari e alveolare, la perfuzione polmonare tende a completarsi e le resistenze a tale livello si abbassano. Incuriositi dalle osservazioni degli Autori che ci hanno preceduti ed intuendo la grande utilità di questi studi come valutazione indiretta dell’espansione polmonare abbiamo osservato 85 gravidanze in età compresa tra la 30ª e 39ª settimana di gestazione e registrando in cm/sec le differenze di velocità di picco del dotto arterioso tra il riposo e l’ispirazione.
d) Ipoplasia polmonare: Lo studio della differenza della velocità di picco presenta una grande utlità nella diagnosi di ipoplasia polmonare, in tali casi infatti durante l’attività respiratoria non si descrivono quelle riduzioni velocimetriche dovute al passaggio di sangue nell’arteria polmonare. Questo tipo di valutazione supera sicuramente il valore predittivo della osservazione della attività respiratoria quale buon indice di crescita polmonare. La letteratura è stat infatti molto controversa tra coloro i quali asserivano che osservare l’attività respiratoria fetale garantiva una assenza di ipoplasia polmonare; e chi non dava a tale indicatore nessun valore reale. La visualizzazione della perfusione polmonare in Color Doppler presenta oggi un dato sicuramente importante che merita però di essere quantificato mediante la modulazione del flusso nel dotto arterioso. E’utile infatti valutare tale parametro in tutti i casi in cui si può sospettare una ipoplasia polmonare. La validità del metodo è stata già ampliamenti dimostrata nella predizione di insufficienza polmonare nei casi di prematura rottura delle membrane. Il metodo può essere utilizzato anche nei casi di ipoplasia toracica asfissiante che si accompagna a diverse malformazioni scheletriche. lo studio della vascolarizzazione polmonare e del dotto arterioso risultano utili nello stabilire il grado di ipoplasia polmonare che può complicare la presenza di una ernia diaframmatica. Esistono peraltro già dati morfologici che confermano l’esistenza di una ridotta irrorazione polmonare in tali casi. mentre la sistole cresce fino a un valore di 150 la diastole si modifica poco.
e) Dotto arterioso e prostaglandine
Alcuni studiosi hanno documentato l’insorgere di importanti modificazioni durante l’uso di anti-prostaglandinici nel feto umano. In particolare l’uso di indometacina a dosaggi di 100 mg somministrati alla madre arriva a produrre entro un’ora dalla somministrazione un aumento della velocità di picco del dotto arterioso di circa il 50% a termine di gravidanza. Da tali osservazioni appare chiaro che gli anti-prostaglandinici conducono ad una chiusura del dotto che, nel caso specifico della indimetacina può protrarsi a distanza di 24 ore dalla somministrazione. Si noti che esperimenti su modelli animali hanno dimostrato che le acute occlusioni del dotto conducono ad importanti effetti emodinamici quali: un immediato aumento della pressione polmonare, una riduzione della gettata di destra di circa il 70%, un aumento della gittata sinistra di circa il 20% e una caduta della gettata cardiaca complessiva di circa il 30-40%. Dal punto di vista emodinamico si nota un rigurgito della tricuspide che inizia immediatamente dopo l’occlusione del dotto ed altrettanto rapidfamente si risolve alla riapertura di questo. Queste osservazioni debbono pertanto farci riflettere sull’uso incondizionato di anti-prostaglandinici in prossimità del parto
Teorema di Bernoulli, riferito a rapporti tra pressione (p) e velocità (v) in condotti di diversa sezione. Facendo l’esempio dell’arteria polmonare e del dotto di Botallo, si noti come al restringimento di quest’ultimo le velocità aumentano. Il rapporto tra pressione e velocità è infatti costante.
ARTERIE UTERINE: La valutazione del flusso delle aa. uterine è una parte importante della valutazione del benessere del feto e della sua crescita normale. La presenza di anormali resistenze vascolari a livello delle arterie uterine alla fine del 1° trimestre permette di predire un elevato rischio di sviluppare nel 3° trimestre gravi patologie materne come l’ipertensione gestazionale, la pre-eclampsia e un ritardato accrescimento fetale (IUGR). Dopo la 26a settimana di gestazione lo studio delle arterie uterine ha scarso valore predittivo. per gestosi, pre-eclampsia e IUGR.
In uno stato non gravido e all’inizio della gravidanza il flusso nell’arteria uterina è di elevata pulsatilità con un elevato flusso sistolico e basso flusso diastolico. In gravidanza la resistenza al flusso sanguigno diminuisce gradualmente con l’epoca gestazionale in quanto si verifica una maggiore invasione trofoblastica del miometrio. Una resistenza anormalmente elevata può persistere nella preeclampsia e nell’IUGR. Un’alta resistenza spesso equivale ad una probabilità del 70% di pre-eclampsia e del 30% di IUGR. Se la resistenza è bassa, ha un eccellente valore predittivo negativo con una probabilità inferiore all’1% di sviluppare la preeclampsia o avere IUGR (186-189).
References:
- Matijevic, R. and Kurjak, A. The assessment of placental blood vessels by three-dimensional power Doppler ultrasound. J Perinat Med. 2002; 30: 26–32
- Guimarães Filho, H.A., da Costa, L.L., Araújo Júnior, E., Nardozza, L.M., Nowak, P.M., Moron, A.F. et al.Placenta: angiogenesis and vascular assessment through three-dimensional power Doppler ultrasonography. Arch Gynecol Obstet. 2008; 277: 195–200
- Salvesen K, Lees C, Abramowicz J, Brezinka C, Ter Har G, Marsal K. ISUOG statement on the safe use of Doppler in the 11 to 13+6-week fetal ultrasound examination. Ultrasound Obstet Gynecol 2011; 37: 628.
- Khare M, Paul S, Konje J. Variation in Doppler indices along the length of the cord from the intraabdominal to the placental insertion. Acta Obstet Gynecol Scand 2006; 85: 922 –928
- Acharya G, Wilsgaard T, Berntsen G, Maltau J, Kiserud T. Reference ranges for serial measurements of blood velocity and pulsatility index at the intra-abdominal portion, and fetal and placental ends of the umbilical artery. Ultrasound Obstet Gynecol 2005; 26: 162 –169.
- Acharya G, Wilsgaard T, Berntsen G, Maltau J, Kiserud T.Reference ranges for serial measurements of umbilical artery Doppler indices in the second half of pregnancy. Am J Obstet Gynecol 2005; 192: 937 –944.
- Sepulveda W, Peek MJ, Hassan J, Hollingsworth J. Umbilical vein to artery ratio in fetuses with single umbilical artery. UltrasoundObstet Gynecol 1996; 8: 23 –26.
- Upton M. N. Effects of parental smoking on the respiratory health of adults. Thorax 2004; 59, 274–276
- Matijevic, R. and Kurjak, A. The assessment of placental blood vessels by three-dimensional power Doppler ultrasound. J Perinat Med. 2002; 30: 26–32
- Guimarães Filho, H.A., da Costa, L.L., Araújo Júnior, E., Nardozza, L.M., Nowak, P.M., Moron, A.F. et al.Placenta: angiogenesis and vascular assessment through three-dimensional power Doppler ultrasonography. Arch Gynecol Obstet. 2008; 277: 195–200
- Salvesen K, Lees C, Abramowicz J, Brezinka C, Ter Har G, Marsal K. ISUOG statement on the safe use of Doppler in the 11 to 13+6-week fetal ultrasound examination. Ultrasound Obstet Gynecol 2011; 37: 628.
- Khare M, Paul S, Konje J. Variation in Doppler indices along the length of the cord from the intraabdominal to the placental insertion. Acta Obstet Gynecol Scand 2006; 85: 922 –928
- Acharya G, Wilsgaard T, Berntsen G, Maltau J, Kiserud T. Reference ranges for serial measurements of blood velocity and pulsatility index at the intra-abdominal portion, and fetal and placental ends of the umbilical artery. Ultrasound Obstet Gynecol 2005; 26: 162 –169.
- Acharya G, Wilsgaard T, Berntsen G, Maltau J, Kiserud T. Reference ranges for serial measurements of umbilical artery Doppler indices in the second half of pregnancy. Am J Obstet Gynecol 2005; 192: 937 –944.
- Scherjon SA, Smolders De Haas H, Kok JH, Sondervan Ha. The brain sparing effect antenatal cerebral Doppler findings in relation to neurologic outcome in very preterm infants. Am J Ob Gyn 1993; pag 169-175.
- Madazli R, Uludağ S, Ocak V. Doppler assessment of umbilical artery, thoracic aorta and middle cerebral artery in the management of pregnancies with growth restriction. Acta Obstet Gynecol Scand. 2001;80 (8): 702-7. Acta Obstet Gynecol Scand (link) –
- Sepulveda W, Peek MJ, Hassan J, Hollingsworth J. Umbili-cal vein to artery ratio in fetuses with single umbilical artery. UltrasoundObstet Gynecol 1996; 8: 23 –26.
- Marsál K. Rational use of Doppler ultrasound in perinatal medicine. J Perinat Med. 1994;22 (6): 463-74.
- Gagnon R, Van den hof M. The use of fetal Doppler in obstetrics. J Obstet Gynaecol Can. 2003;25 (7): 601-14. –
- Baschat AA, Gembruch U, Reiss I et-al. Relationship between arterial and venous Doppler and perinatal outcome in fetal growth restriction. Ultrasound Obstet Gynecol. 2000;16 (5): 407-13.
- . Maulik D, Mundy D, Heitmann E et-al. Evidence-based approach to umbilical artery Doppler fetal surveillance in high-risk pregnancies: an update. Clin Obstet Gynecol. 2010;53 (4): 869-78.
- Coppens M, Loquet P, Kollen M, De Neubourg F, Buytaert P. Longitudinal evaluation of uteroplacental and umbilical blood flow changes in normal early pregnancy. Ultrasound in obstetrics & gynecology : the official journal of the International Society of Ultrasound in Obstetrics and Gynecology. 7 (2): 114-21.
- Ferrazzi E et al. Temporal sequence of abnormal Doppler changes in the pheripheral and central circulatory systems of the severely growth restricted fetus. Ultrasound Obstet Gynecol 2002;19,2:140-46.
- Giorlandino S, Vizzone A. Flussimetria ostetrica materna fetale. CIC ed. internazionali 1993.
- Ianniello B, Gambardella V, D’Ettore A, Battista L, De Falco C, Scaldarella LO, Vitelli A, Tolino A. Diagnosi e management del ritardo di crescita intrauterino (IUGR). Rivista Italiana di Med Perin. Vol 6-n. 1 gen 2004:15-18.
- Nielson JP, Alfirevic Z. Doppler Ultrasound for fetal assessment in high risk pregnancies. In the Cochrane Library, Issue 2. Oxford: Update software, 2002.
- Trudinger BJ, Giles WB, Cook CM Uteroplacental blood flow velocity-time waveforms in normal and complicated pregnancy. .Br J Obstet Gynaecol. 1985 Jan; 92(1):39-45.
- Mone F, Thompson A, Stewart M, et al . Fetal umbilical artery Doppler pulsatility index as a predictor of cardiovascular risk factors in children—a long-term follow up study. J Matern Fetal Neonatal Med 2014;27:1633–6.
- Isaacs EB, Vargha-Khadem F, Watkins KE, et al . Developmental amnesia and its relationship to degree of hippocampal atrophy. Proc Natl Acad Sci USA 2003;28:13060–3.
- Mone F et al: Fetal umbilical artery Doppler pulsatility index and childhood neurocognitive outcome at 12 years. BMJ 2016;6,6
- de Boo HA, Harding JE . The developmental origins of adult disease (Barker) hypothesis. Aust N Z J Obstet Gynaecol2006;46:4–14.
- Levine TA, Grunau RE, McAuliffe FM, et al . Early Childhood neurodevelopment after intrauterine growth restriction: a systematic review. Pediatrics 2015;135:126–41.
- Wienerroither H, Steiner H, Tomaselli J, et al . Intrauterine blood flow and long-term intellectual, neurologic, and social development. Obstetr Gynecol 2001;97:449–53
- Geva R, Eshel R, Leitner Y, et al . Memory functions of children born with asymmetric intrauterine growth restriction. Brain Res 2006;1117:186–94.
- Hevner RF, Kinney HC . Reciprocal enthorhinal-hippocampal connections established by human fetal midgestation. J Comp Neurol 1996;372:384–94.
- D Amaral, Lavenex P, Ch 3. Hippocampal Neuroanatomy, in Andersen P, Morris R, Amaral D, Bliss T, O’Keefe J (a cura di), The Hippocampus Book, Oxford University Press, 2006,
- Battaglia C, Artini PG, Galli PA et al.Absent or reversed end diastolic flow in umbelical artery and severe intrauterine growth retardation. Acta Obstet Scand 1993;72:167-171.
- Hartung J et al. Outcome of 60 neonates who had ARED flow prenatally compared with a matched control group of appropriate-for-gestational age preterm neonates. Ultrasound Obstet Gynecol 2005;25:566-72.
- Barkehall-Thomas A, Thompson M, Baker LS, Edwards A, Wallace EM. Betamethasone associated changes in umbilical artery flow velocity waveforms in multiple pregnancies with umbilical artery absent end diastolic flow. Aust N Z J Obstet Gynaecol. 2003 Oct;43(5):360-3.
- Effect of maternal betamethasone on fetal and uteroplacental blood flow velocity waveforms.Thuring A, Malcus P, Maršál K.Ultrasound Obstet Gynecol. 2011 Jun; 37(6):668-72.
- Predicting perinatal outcome through changes in umbilical artery Doppler studies after antenatal corticosteroids in the growth-restricted fetus. Robertson MC, Murila F, Tong S, Baker LS, Yu VY, Wallace EM.Obstet Gynecol. 2009 Mar; 113(3):636-40.
- Fetal hemodynamic changes following maternal betamethasone administration in pregnancies with fetal growth restriction and absent end-diastolic flow in the umbilical artery. Nozaki AM, Francisco RP, Fonseca ES, Miyadahira S, Zugaib M.Acta Obstet Gynecol Scand. 2009; 88(3):350-4.
- Doppler velocimetry in the evaluation of fetal hypoxia. Gudmundsson S, Dubiel M.J Perinat Med. 2001; 29(5):399-407.
- Sterne G, Shields LE, Dubinsky TJ. Abnormal fetal cerebral and umbilical Doppler measurements in fetuses with intrauterine growth restriction predicts the severity of perinatal morbidity. J Clin Ultrasound. 2001;29:146–51.
- Madazli R, Uludag S, Ocak V. Doppler assessment of umbilical artery, thoracic aorta and middle cerebral artery in the management of pregnancies with growth restriction. Acta Obstet Gynecol Scand. 2001;80:702–7.
- Kassanos D, Siristatidis C, Vitoratos N, Salamalekis E, Creatsas G. The clinical significance of Doppler findings in fetal middle cerebral artery during labor. J Obstet Gynecol Reprod Biol. 2004;23:442–445.
- Vyas S, Nicolaides KH, Bower S, Campbell S. Middle cerebral artery flow velocity waveforms in fetal hypoxaemia. Br J Obstet Gynaecol. 1990;97:797–803.
- Williams KP, Wilson S. Maternal cerebral blood flow changes associated with eclampsia. Am J Perinatol. 1995;12:189–91. [PubMed]
- Neilson JP, Alfirevic Z. Doppler ultrasound for fetal assessment in high risk pregnancies. Cochrane Database Syst Rev. 2000
- 19. Gramellini D, Folli MC, Raboni S, Vadora E, Merialdi A. Gramellini D, Folli MC, Raboni S, Vadora E, Merialdi A.. Cerebral umbilical Doppler ratio as a predictor of adverse perinatal outcome. Obstet Gynecol. 1992;79:416–420. [PubMed]
- Hershkovitz R, Kingdom JCP, Geary M, Rodeck CH. Fetal cerebral blood flow redistribution in late gestation: identification of compromise in small fetuses with normal umbilical artery Doppler. Ultrasound Obstet Gynecol. 2000;15:209–212.
- Arias F. Accuracy of the middle-cerebral-to-umbilical- artery resistance index ratio in the prediction of neonatal outcome in patients at high risk for fetal and neonatal complications. Am J Obstet Gynecol. 1994;171:1541–5.
- Gramellini D, Folli MC, Raboni S, Vadora E, Merialdi A. Gramellini D, Folli MC, Raboni S, Vadora E, Merialdi A.. Cerebral umbilical Doppler ratio as a predictor of adverse perinatal outcome. Obstet Gynecol. 1992;79:416–420.
- Dubiel M, Breborowicz GH, Marsal K, Gudmundsson S. Fetal adrenal and middle cerebral artery in high risk pregnancy. Ultrasound Obstet Gynecol. 2000;16:414–418.
- Hernandez-Andrade E, S cheier M, Dzerega V, Carmo A, Nicolaides KH. Fetal middle cerebral artery peak systolic velocity in the investigation of non-imune hydrops. Ultrasound Obstet Gynecol. 2004;23:442–445.
- Strigini FA, De Luca G, Lencioni G, Scida P, Giusti G, Genazzani AR. Middle cerebral artery velocimetry: different clinical relevance depending on umbilical velocimetry. Obstet Gynecol. 1997;90:953–957.
- Makhseed M, Jirous J, Ahmed MA, Viswanathan DL. Middle cerebral artery to umbilical artery resistance index ratio in the prediction of neonatal outcome. Int J Gynaecol Obstet. 2000;71:119–25.
- Williams KP, Wilson S. Maternal cerebral blood flow changes associated with eclampsia. Am J Perinatol. 1995;12:189–91
- Severi FM, Bocchi C, Visentin A, Falco P, Cobellis L, Florio P, et al. Uterine and fetal cerebral Doppler predict the outcome of third trimester small-for-gestational age fetuses with normal umbilical artery Doppler. Ultrasound Obstet Gynecol. 2002;19:225–8.
- Dubiel M, Gudmundsson S, Gunnarsson G, Marsal K. Middle cerebral artery velocimetry as a predictor of hypoxemia in fetuses with increased resistance to blood flow in the umbilical artery. Early Hum Dev. 1997;47:177–84.
- Rizzo G, Arduini D, Luciano R, Rizzo C, Tortorolo G, Romanini C, et al. Prenatal cerebral Doppler ultrasonography and neonatal neurologic outcome. J Ultrasound Med. 1989;8:237–40.
- Brar HS, Horenstein J, Medearis AL, Platt LD, Phelan JP, Paul RH. Cerebral, umbilical and uterine resistance using Doppler velocimetry in postterm pregnancy. J Ultrasound Med. 1989;8:187–91.
- Hecher K, Spernol R, Szalay S, Stettner H, Ertl U. [Reference values for the pulsatility index and the resistance index of blood flow curves of the umbilical artery and fetal aorta in the 3d trimester]. Ultraschall Med. 1989 Aug;10(4):226-9.
- [Qualitative analysis with Doppler spectra of the umbilical artery and fetal aorta in normal pregnancies]. Chaoui R, Hoffmann H, Bollmann R, Zienert A, Halle H, Metzner J.Zentralbl Gynakol. 1990; 112(6):337-44.
- [Blood flow velocity and blood flow in umbilical cord blood vessels and in the fetal aorta in pregnancy]. Künzel W.Gynakologe. 1992 Oct; 25(5):292-6.
- Struijk PC, Mathews VJ, Loupas T, Stewart PA, Clark EB, Steegers EA, Wladimiroff JW. Blood pressure estimation in the human fetal descending aorta. Ultrasound Obstet Gynecol. 2008;32:673–681. doi: 10.1002/uog.6137.
- Bahlmann F, Wellek S, Reinhardt I, Krummenauer F, Merz E, Welter C. Reference values of fetal aortic flow velocity waveforms and associated intra-observer reliability in normal pregnancies. Ultrasound Obstet Gynecol. 2001;17:42–49. doi: 10.1046/j.1469-0705.2001.00306.x.
- Makikallio K, Jouppila P, Rasanen J. Retrograde aortic isthmus net blood flow and human fetal cardiac function in placental insufficiency. Ultrasound Obstet Gynecol. 2003;22:351–357. doi: 10.1002/uog.232. [PubMed] [Cross Ref]
- Fouron JC, Gosselin J, Raboisson MJ, Lamoureux J, Tison CA, Fouron C, Hudon L. The relationship between an aortic isthmus blood flow velocity index and the postnatal neurodevelopmental status of fetuses with placental circulatory insufficiency. Am J Obstet Gynecol. 2005;192:497–503. doi: 10.1016/j.ajog.2004.08.026.
- Del Río M, Martínez JM, Figueras F, López M, Palacio M, Gómez O, Coll O, Puerto B. Reference ranges for Doppler parameters of the fetal aortic isthmus during the second half of pregnancy. Ultrasound Obstet Gynecol. 2006;28:71–76.
- Nicolaides KH, Bilardo CM, Campbell S. Prediction of fetal anemia by measurement of the mean blood velocity in the fetal aorta. Am J Obstet Gynecol. 1990;162:209–212. doi: 10.1016/0002-9378(90)90852-X.
- Ferrazzi E, Bellotti M, Marconi A, Flisi L, Barbera A, Pardi G. Peak velocity of the outflow tract of the aorta: correlation with acid base status and oxygenation of the growth retarded fetus. Obstet Gynecol. 1995;85:663–668. doi: 10.1016/0029-7844(95)00021-I.
- Jouppila P, Kirkinen P. Increased vascular resistance in the descending aorta of the human fetus in hypoxia. Br J Obstet Gynaecol. 1984;91:853–856. doi: 10.1111/j.1471-0528.1984.tb03696.x.
- Tonge HM, Wladimiroff JW, Noordam MJ, van Kooten C. Blood flow velocity waveforms in the descending fetal aorta: comparison between normal and growth-retarded pregnancies. Obstet Gynecol. 1986;67:851–855.
- Luís Guedes-Martins, Ana Cunha, Joaquim Saraiva, Ana Rita-Gaio, Ana S Cerdeira, Filipe Macedo, and Henrique Almeida: Foetal aortic flow velocity waveforms in healthy and hypertensive pregnant women. Cardiovasc Ultrasound. 2014; 12: 1.
- Tonge HM, Wladimiroff JW, Noordam MJ, van Kooten C. Blood flow velocity waveforms in the descending fetal aorta: comparison between normal and growth-retarded pregnancies. Obstet Gynecol. 1986 Jun;67(6):851-5.
- Marsál K, Laurin J, Lindblad A, Lingman G. Blood flow in the fetal descending aorta. Semin Perinatol. 1987 Oct;11(4):322-34.
- Jouppila P, Kirkinen P. Noninvasive assessment of fetal aortic blood flow in normal and abnormal pregnancies. Clin Obstet Gynecol. 1989 Dec;32(4):703-9.
- Luís Guedes-Martins, Ana Cunha, Joaquim Saraiva, Ana Rita-Gaio, Ana S Cerdeira, Filipe Macedo, and Henrique Almeida Foetal aortic flow velocity waveforms in healthy and hypertensive pregnant women. Cardiovasc Ultrasound. 2014; 12: 1.
- [Longitudinal analysis of arterial Doppler parameters in growth retarded fetuses]. Miković Z, Mandić V, Djukić M, Egić A, Filimonović D, Cerović N, Popovac M.Srp Arh Celok Lek. 2003 Jan-Feb; 131(1-2):21-5.