Ultimo aggiornamento 08/10/2019 16:37:37
La laparoscopia ginecologica è una tecnica chirurgica che, a differenza della chirurgia tradizionale,  utilizza come porta di accesso piccole incisioni cutanee attraverso le quali si introducono gli strumenti specificamente progettati. Inoltre, paradossalmente e grazie alla telecamera, la visione degli organi addomino-pelvici è ingrandita e quindi più precisa.
utilizza come porta di accesso piccole incisioni cutanee attraverso le quali si introducono gli strumenti specificamente progettati. Inoltre, paradossalmente e grazie alla telecamera, la visione degli organi addomino-pelvici è ingrandita e quindi più precisa.
I termini laparoscopia e celioscopia derivano dal greco laparos (addome), koilia (cavità) e scopeo (vedere). La lps ginecologica fu eseguita per la prima volta da Raoul Palmer che ne illustrò indicazioni e tecnica nel 1947 (1-4). Dalla scuola di Palmer provengono  altri pionieri della chirurgia ginecologica laparoscopica: Melvin Cohen, Hans Frangenheim, Richard Fikentscher, Kurt Semm e Patrick Steptoe.
altri pionieri della chirurgia ginecologica laparoscopica: Melvin Cohen, Hans Frangenheim, Richard Fikentscher, Kurt Semm e Patrick Steptoe.
TECNICA: la paziente è posta in posizione di Trendelenburg (15°). A 1 cm sotto l’ombelico è praticata una piccola (1 mm) incisione che comprende cute e sottocute. Attraverso di essa è  introdotto l’ago di Verres per immettere CO2 ed ottenere la distensione della cavità addominale (pneumoperitoneo). L’introduzione dell’ago di Verres e successivamente del trocar da 10 avvengono “al buio”. Introducendo l’ago di Verres occorrerà sollevare la plica cutanea in cui è stata praticata l’incisione.
introdotto l’ago di Verres per immettere CO2 ed ottenere la distensione della cavità addominale (pneumoperitoneo). L’introduzione dell’ago di Verres e successivamente del trocar da 10 avvengono “al buio”. Introducendo l’ago di Verres occorrerà sollevare la plica cutanea in cui è stata praticata l’incisione.
 Sia per l’ago di Verres che per il trocar principale da 10 mm occorrerà valutare almeno grossolanamente lo spessore dello strato adiposo sottocutaneo e la distanza sottocutaneo-piano vascolare aorto-cavale per evitare di perforare questi ultimi. Nelle donne non obese lo spessore del pannicolo adiposo è di 1 cm circa e la distanza sottocute-vasi aorto-cavali è di 6 cm circa mentre nelle donne ad obesità lieve-moderata i valori sono rispettivamente di 3 e 10 cm e nelle obese il pannicolo adiposo giunge a 11 cm e la distanza sottocute- piano vascolare è di 13-17 cm. L’ago di Verres e il trocar principale vanno introdotti con un’inclinazione di 45° rispetto al piano cutaneo e la profondità è regolata sulle misure precedentemente descritte (35-38).
Sia per l’ago di Verres che per il trocar principale da 10 mm occorrerà valutare almeno grossolanamente lo spessore dello strato adiposo sottocutaneo e la distanza sottocutaneo-piano vascolare aorto-cavale per evitare di perforare questi ultimi. Nelle donne non obese lo spessore del pannicolo adiposo è di 1 cm circa e la distanza sottocute-vasi aorto-cavali è di 6 cm circa mentre nelle donne ad obesità lieve-moderata i valori sono rispettivamente di 3 e 10 cm e nelle obese il pannicolo adiposo giunge a 11 cm e la distanza sottocute- piano vascolare è di 13-17 cm. L’ago di Verres e il trocar principale vanno introdotti con un’inclinazione di 45° rispetto al piano cutaneo e la profondità è regolata sulle misure precedentemente descritte (35-38).
Raggiunta una pressione di 16 mm Hg nel pneumoperitoneo, l’ago di Verres sarà rimosso e verrà praticata una prova di pneumoperitoneo adeguato: una siringa da 10 cc con 3 cc di soluzione fisiologica è introdotta attraverso l’ombelico in addome: se il pneumoperitoneo è adeguato si osserveranno bolle di gas nella siringa. Quindi si introduce il trocar da 10 mm a punta smussa, piramidale in cui troverà alloggio il laparoscopio a sua volta connesso a fotocamera, videoregistratore, monitor e fonte luminosa. 2-3 incisioni sovrapubiche ospiteranno trocar da 5 mm e gli strumenti ancillari (pinza fenestrata -“a becco d’anitra”-, pinza babcock, pinza ultracision, forbici curve bipolari tipo Metzembaum, applicatore clip emostatiche in titanio Endoclip, manipolatore uterino, aspiratore/irrigatore, etc). Spesso è necessaria una seconda porta da 10 mm per ospitare strumenti come endo catch per la rimozione dei pezzi asportati, la suturatrice meccanica endo-GIA, la suturatrice per clips elicoidali o il morcellatore. La seconda porta da 10 mm sarà posizionata sulla linea mediana addominale a circa 5 cm sopra la sinfisi pubica mentre le due porte ancillari saranno posizionate all’altezza delle spine iliache antero-superiori sulla linea emiclaveare. L’insieme dei 4 punti di accesso così descritto costituirà un disegno “a diamante”.
Attraverso la vagina talvolta si introduce nel canale cervicale il manipolatore per poter muovere l’utero secondo necessità nel corso dell’intervento.
Terminato l’intervento, si estrae la strumentazione avendo cura di favorire la fuoriuscita, attraverso le incisioni addominali, del gas precedentemente introdotto. Si suturano le piccole incisioni chirurgiche.
L’intervento è praticato in anestesia generale e la paziente viene dimessa il giorno dopo. I costi, i giorni di degenza ospedaliera, le complicazioni e il distress sono decisamente inferiori a quelli della chirurgia laparotomica.
Rischi e complicazioni: L’intervento comporta i rischi comuni a tutti gli interventi chirurgici, legati al tipo di anestesia, all’età della paziente e alle sue condizioni generali (25-27).
Emorragie: per lacerazioni di aorta, vena cava, arterie e vene iliache comuni, aa. e vv. mesenteriche superiori ed inferiori, vasi epigastrici ad opera dell’ago di Verres o del trocar principale. Può accadere che per un imponente sanguinamento del “campo operatorio” in corso di videolaparoscopia sia necessario “convertire” l’intervento, trasformando l’accesso laparoscopico in tradizionale laparotomia. Una simile evenienza si presenta nel 3-4 % degli interventi. la prevenzione delle emorragie prevede:
- Sondino naso-gastrico per le pz. già sottoposte ad interventi addominali o soggette ad aerofagia o con difficoltà di induzione dell’anestesia.
- Valutazione del grado di obesità
- Introduzione a 45° dell’ago di Verres e del trocar primncipale
- Trendelenburg a 15-20°
- porte ancillari effettuate sotto visione diretta e per trasparenza
mortalità: 0,1- 0,02‰ (dovuta alle complicanze, soprattutto anestesiologiche).
Dolenzia alla spalla: è dovuta alla stimolazione del nervo frenico nella sua porzione sottodiaframmatica ad opera del pneumoperitoneo. Scompare normalmente nel giro di 2-3 giorni.
ALTRE COMPLICANZE: Perforazione gastrica (2/‰) e perforazioni intestinali (3-6/‰), ustioni (1.8/‰), lesioni ureterali e vescicali, infezioni, intrappolamento cicatriziale delle terminazioni nervose parietali (Abdominal Cutaneous Nerve Entrapment Syndrome, ACNES), Enfisema sottocutaneo (2-4 ‰).
Controindicazioni alla LPS: una controindicazione relativa è la presenza di esiti di peritonite o di un esteso processo aderenziale dovuto a una patologia infiammatoria o a un precedente intervento chirurgico: in queste situazioni aumenta il rischio di lesioni degli organi addominali e il tasso di conversione laparotomica. La laparoscopia, inoltre, non sempre è possibile in presenza di obesità grave, che aumenta del 5-10% il rischio di convertire l’intervento laparoscopico in laparotomia.
Strumentario: lo strumento di base è il laparoscopio. Ci sono molte variazioni di diametro: 10 mm, 5 mm e anche 2 mm e con un angolo di visuale da 0 a 30°. I Trocar di solito utilizzati hanno un diametro di 5mm e 10 mm. L’ago di  Verres è il preferito nella creazione del pneumoperitoneo. Usiamo un endoflator CO2 per creare il pneumoperitoneo ed una fonte di luce, una telecamera che si collega al laparoscopio e proietta l’immagine su un monitor a sua volta collegato ad un videoregistratore.
Verres è il preferito nella creazione del pneumoperitoneo. Usiamo un endoflator CO2 per creare il pneumoperitoneo ed una fonte di luce, una telecamera che si collega al laparoscopio e proietta l’immagine su un monitor a sua volta collegato ad un videoregistratore.
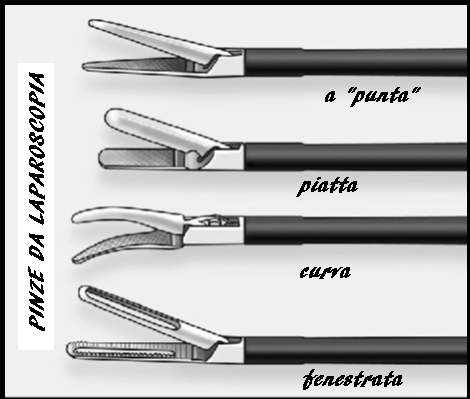
Durante l’esecuzione della lps posono essere utilizzati diversi strumenti parzialmente illustrati nell’immagine di seguito. Diversi tipi di pinze: da dissezione da presa, a singola o doppia azione, traumatiche o atraumatiche a seconda del disegno della punta distale. La stessa varietà può essere trovato in forbici che possono essere a lama rettilinea o curva o a gancio.
Elettrodi bipolari o unipolari a forma di ago, gancio o spatola. Metodi alternativi per elettrochirurgia sono i sistemi laser o a ultrasuoni.
Altri strumenti sono utilizzati per aspirazione e irrigazione, borse per estrazione del pezzo operatorio, portaghi per tecniche di sutura con annodatura intracorporea ed extracorporea; manipolatori uterini e infine morcellatori per frantumare campioni di tessuto e renderne facile l’estrazione, come fibromi o lo stesso utero (44-55).
Lavaggio degli strumenti: Lo strumentario poliuso prima di essere mandato alla sterilizzazione deve essere accuratamente pulito, e asciugato. Le tecniche di lavaggio degli strumenti vengono dettate dal modo in cui questi ultimi vengono progettati. Alcuni strumenti vengono completamente smontati e ogni pezzo viene lavato singolarmente. Altri invece non possono essere smontati e presentano una sorta di beccuccio all’interno del quale viene fatta scorrere acqua. Per quest’ultimo tipo di lavaggio si richiede un abbondante risciacquo (300 cc) sotto pressione alla fine di ogni uso. Un lavaggio incompleto seguito da una sterilizzazione in autoclave ad alta temperatura può determinare la coagulazione di proteine all’interno degli stessi canali appena descritti e può portare le varie articolazioni presenti nello strumentario al malfunzionamento.
La sterilizzazione dello strumentario chirurgico deve seguire gli standard di sicurezza. Questi dipendono dalla legislazione adottata in ogni singolo paese, che può richiedere diversi sistemi e tempi di sterilizzazione. Per esempio: in Germania la sterilizzazione del prione (malattia Creutzfeld-Jacob) è richiesta per legge; per questo motivo, la legislazione tedesca richiede la sterilizzazione in autoclave a vapore a 134 °C per circa 5 minuti. In Francia la legislazione francese richiede la sterilizzazione in autoclave a vapore a 134 °C per 18 minuti.
Altri sistemi di sterilizzazione sono l’Ossido di etilene e il perossido di idrogeno.
INDICAZIONI ALLA LAPAROSCOPIA DIAGNOSTICA:
La LPS è considerata la metodica “gold standard” per lo studio del dolore pelvico cronico, e la sterilità di durata >2 anni. Infatti con la LPS è possibile documentare la normalità degli organi
pelvici, l’eventuale presenza di aderenze e alterazione dei normali rapporti fra tube e ovaio e l’eventuale presenza di endometriosi.
Inoltre in corso di LPS è possibile verificare la pervietà tubarica (salpingocromoscopia) che risulta alterata nel 25% delle pazienti infertili. La salpingocromoscopia (SCS) consiste nell’iniettare tramite un catetere di Foley da 8 F con palloncino da tenuta, posizionato nel canale cervicale, un colorante (blu di metilene) il quale risalendo lungo la cavità uterina giunge nelle tube e, se queste sono pervie, fuoriesce dall’estremità ampollare nella cavità addominale. È importante nei casi di infertilità che la paziente abbia già eseguito un’isterosalpingografia o isterosonografia. Sulla diagnosi di pervietà tubarica può esserci discordanza fra ISG e LPS per 2 motivi:
1) la stessa ISG può modificare e risolvere il problema. Questa possibilità terapeutica si verifica con una certa frequenza soprattutto se l’operatore inietta il m.d.c. in scopia. In tal modo l’operatore ha la possibilità di modulare la forza di iniezione riuscendo spesso a “lavare” le tube e eliminare ostacoli meccanici endoluminali che, anche se modesti, ostacolano la normale progressione degli spermatozoi nei cicli fisiologici.
2) l’anestesia generale della LPS elimina eventuali spasmi presenti durante l’ISG.
Se la celioscopia, insieme a ISG e sonoisterografia, gioca un ruolo essenziale, nello studio della pervietà tubarica, essa permette di valutare anche la morfologia esterna dell’utero, i rapporti con gli annessi e la forma, grandezza e dislocazione delle ovaie, la presenza di follicoli preovulatori, stigma post-ovulatorio, corpo luteo, corpi albicans.
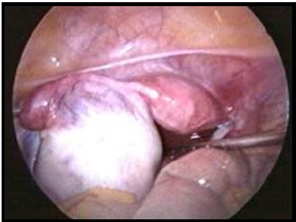
Masse ovariche: La necessità di chiarire la natura di molte tumefazioni ovariche borderline o sospetto di ca. ovarico costituisce una delle principali indicazioni della LPS diagnostica ed operativa per masse ovariche di diametro >8 cm.
Aspirazione del liquido peritoneale e washing: è la prima operazione da effettuare in caso di LPS o laparotomia. Qualora non si riesca ad individuare una sacca di liquido, si introduce in cavità 1 litro di soluzione fisiologica tiepida; la paziente viene fatta ruotare prima su un fianco e poi sull’altro in modo che il liquido si muova all’interno della cavità addominale; successivamente il liquido viene aspirato e si invia per l’esame citologico.
Ispezione lps accurata dell’ovaio in esame e di quello controlaterale, peritoneo, diaframma, omento, docce paracoliche, fegato ed intestino.
Emorragie intraperitoneali: Va inoltre sottolineata l’importanza della celioscopia nel riconoscimento delle emorragie intraperitoneali non gravidiche in cui il sanguinamento è poco abbondante, misconosciuto: la LPS consente un intervento chirurgico immediato.
Anomalie del tratto genitale: Un altro settore di interessante impiego della celioscopia riguarda le anomalie di sviluppo del tratto genitale con amenorrea primaria e secondaria. L’agenesia gonadica completa, la sindrome di Turner, i vari gradi di ipogonadismo, la sindrome di Rokitansky, la sindrome di Morris sono alcune delle forme morbose la cui diagnosi può essere posta o meglio confermata mediante la indagine celioscopica. Fondamentale è ancora la osservazione del contorno del fondo uterino per la diagnosi differenziale fra utero setto e utero bicorne (5).
PID (Pelvic Inflammatory Disease) – Caratterizzata da iperemia, edema, aderenze. Possibilità di adesiolisi percelioscopica.
Tubercolosi genitale: Caratterizzata dalla presenza di noduli caseosi localizzati sulla superficie tubarica e peritoneale. I pareri dei vari AA. al riguardo sono contrastanti. Infatti per alcuni AA. la celioscopia permette delle conclusioni diagnostiche soltanto nelle forme evolutive; invece nelle lesioni non caratteristiche, la cosiddetta «tubercolosi inapparente», la lps non è altrettanto perentoria. D’altra parte la possibilità di aderenze intestinali diffuse alla parete rende rischiosa un’approfondita esplorazione.
Fibromatosi uterina –
Varicocele pelvico: Il significato da attribuire al varicocele del peduncolo utero-ovarico, a volte molto voluminoso, ed alla congestione uterina non è ancora ben definito, potendosi osservare queste modificazioni della vascolarizzazione pelvica anche in assenza di ogni sintomatologia dolorosa e patologia funzionale.
Sindrome di Master e Allen: Una menzione a parte merita la cosidetta S. di Masters ed Allen, in cui la lacerazione traumatica degli elementi fibrosi del parametrio è associata alla retroflessione di un utero congestizio ed un varicocele utero-pelvico. Sul piano pratico, il riconoscimento celioscopico di questa sindrome, abitualmente osservata in seguito ad un parto laborioso, conduce alla riparazione chirurgica dei disordini anatomici, con scomparsa totale della sintomatologia dolorosa.
II° e III° look laparoscopico nel follow-up del ca. dell’ovaio: pone eventuali indicazioni per il reintervento, per la sospensione, variazioni o ripresa della chemioterapia.
Controllo LPS in corso di ISC operativa.
LAPAROSCOPIA GASLESS: La laparoscopia utilizzando CO2 viene più frequentemente impiegato per piccoli e medi fibromi ed in presenza di 1-3 miomi. La laparoscopia senza gas è indicata per la rimozione di grandi miomi intramurali ed in presenza di >3 miomi. La lps gasless (o isobarica) elimina gli effetti negativi e i rischi potenziali associati con insufflazione di CO2, riduce i tempi e i costi operatori, conserva l’accesso minimalista e consente di utilizzare gli strumenti laparotomici che sono più affidabili per la chiusura della breccia uterina; L’unico svantaggio è la perdita dell’effetto tampone esercitato dalla pressione del pneumoperitoneo sui piccoli vasi che riduce, nella lps tradizionale, il sanguinamento intraoperatorio (56-66).
- Litynski GS. “Raoul Palmer, World War II, and Transabdominal Coelioscopy. Laparoscopy Extends into Gynecology”. JSLS 1997 Jul-Sep; 1 (3):289-292.
- Gilbert Schlogel. “Raoul Palmer et l’aventure cœlio-chirurgicale de 1940 à 1995″ (PDF). Histoires des Sciences Medicales Vol. 30, Nr. 2, 1996 (in French): 281-287.
- Camran Nezhat. “Nezhat’s History of Endoscopy. Chapter 17. 1940’s”. Society of Laparoscopic Surgeons. Retrieved January 1, 2016.
- Palmer, R. “Instrumentation et technique de la coelioscopie gynecologique.”. Gynecol Obstet (Paris) 1947;46:420–431.
- Hayden A. et al.: The septate uterus: a review of management and reproductive outcome. Fert. Ster. Vol. 73, n. 1, Jan. 2000.
- Donnez J. and Nisolle M.: “An Atlas of Laser operative laparoscopy and hysteroscopy”. The Parthenon Publishing Group Ltd;1994.
- Kulier R, Boulvain M, Walker D, De Candolle G, Campana A: “Minilaparotomy and endoscopic techniques for tubal sterilisation (Review)”. Copyright © 2007 The Cochrane Collaboration. Published by JohnWiley & Sons, Ltd
- Letchworth AT, Kane JL, Noble AD. Laparoscopy or laparotomy for sterilization of women. Obstet Gynecol 1980;56(1):119–121.
- Meyer JH, King TM. Advances in Female Sterilisation Techniques.Hagerstown, Maryland, 1976. journal 1976;1:Advances in Female Sterilisation Techniques. Hagerstown, Maryland, 1976. Harper & Row, publishers.
- Sitompul H, Lun KC, Lumbanraja M, Kaban RM, Albar E, Siman-juntak P, Hanafiah MJ. Comparison of three types of tubal sterilisation: the Medan experience. Contraception 1984;29(1):55–63.
- Salem RM. New attention to the IUD: expanding women’s contraceptive options to meet their needs. Popul Rep B. 2006:1–26.
- Zakin D, Stern WZ, Rosenblatt R. Complete and partial uterine perforation and embedding following insertion of intrauterine devices: I. Classification, complications, mechanism, incidence, and missing string. Obstet Gynecol Survey. 1981;36(7):335–353
- Silva PD et al: “Laparoscopic Removal of a Perforated Intrauterine Device from the Perirectal Fat”
JSLS. 2000 Apr-Jun; 4(2): 159–162.
- Roke CM. A comparative study of the ease of removal of intrauterine contraceptive devices. Contraception. 1988;37:555–563.
- Waldron K. Intrauterine devices: insertion and removal: practical procedures. Aust Fam Physician. 1982;11:40–44.
- Bounds W, Hutt S, Kubba A, Cooper K, Guillebaud J, Newman GB. Randomised comparative study in 217 women of three disposable plastic IUCD thread retrievers. Br J Obstet Gynaecol. 1992;99:915–919.
- Tugrul S, Yavuzer B, Yildirim G, Kayahan A. The duration of use, causes of discontinuation, and problems during removal in women admitted for removal of IUD. Contraception. 2005;71:149–152.
- Shapiro AG. Management of the lost intrauterine contraceptive device. Obstet Gynecol. 1977;49:238–240.
- Ertopçu K. [Intrauterin device]. Turkiye Klinikleri J Gynecol Obst-Special Topics 2012;5(1):37-42
- Markovitch O, Klein Z, Gidoni Y, Holzinger M, Beyth Y. Extrauterine mislocated IUD: is surgical removal mandatory? Contraception 2002;66(2):105-8.
- Adoni A, Ben Chetrit A. The management of intrauterine devices following uterine perforation. Contraception 1991;43(1):77-81.
- Rao RP. Lost intrauterine devices and their localization. J Reprod Med 1978;20(4):195-9.
- Ohana E, Sheiner E, Leron E, Mazor M. Appendix perforation by an intrauterine contraceptive device. Eur J Obstet Gynecol Reprod Biol 2000;88(2):129-31.
- Browning JJ, Bigrigg MA. Recovery of the intrauterine contraceptive device from the sigmoid colon. Three case reports. Br J Obstet Gynaecol 1988;95(5):530-2.
- Bauman H., Jaeger P. and Huch A.: “Ureteral injury after laparoscopic tubal sterilization by bipolar elettrocoagulation”. Obstet, Gynecol., 1988;71:483-485.
- Stengel J.N., Felderman E.S. and Zamora D.: “Ureteral injury: complication of laparoscopic sterilization”. Urology;1974,4:341-342.
- Donnez J. and Nisolle M.: “An Atlas of Laser operative laparoscopy and hysteroscopy”. The Parthenon Publishing Group Ltd;1994.
- . B. Schwartz, P. A. Wingo, L. Antarsh, et al.1987 Female sterilization in the United States,. Fam Plann Perspect 1989;2120912
- D. J. Jamieson, S. D. Hillis, A. Duerr, et al.2000 Complications of interval laparoscopic tubal sterilization: findings from the United States collaborative review of sterilization. Obstet Gynecol;969971002
- Siedhoff MT, Wheeler SB, Rutstein SE, et al: “Laparoscopic Hysterectomy With Morcellation vs Abdominal Hysterectomy for Presumed Fibroid Tumors in Premenopausal Women: A Decision Analysis”. Am J Obstet Gynecol. 2015;212:591.e1-8
- Wu JM, Wechter ME, Geller EJ, Nguyen TV, Visco AG. Hysterectomy rates in the United States, 2003. Obstet Gynecol. 2007;110:1091-1095.
- Updated Laparoscopic Uterine Power Morcellation in Hysterectomy and Myomectomy: FDA Safety Communication. November 24, 2014.
- Nieboer TE, Johnson N, Lethaby A, et al. Surgical approach to hysterectomy for benign gynaecological disease. Cochrane Database Syst Rev 2009; :CD003677.
- Medeiros LR, Stein AT, Fachel J, et al. Laparoscopy versus laparotomy for benign ovarian tumor: a systematic review and meta-analysis. Int J Gynecol Cancer 2008; 18:387.
- Ahmad G, Gent D, Henderson D, et al. Laparoscopic entry techniques. Cochrane Database Syst Rev 2015; 8:CD006583.
- Schwartz ML, Drew RL, Andersen JN. Induction of pneumoperitoneum in morbidly obese patients. Obes Surg 2003; 13:601.
- Hurd WW, Bude RO, DeLancey JO, Pearl ML. The relationship of the umbilicus to the aortic bifurcation: implications for laparoscopic technique. Obstet Gynecol 1992; 80:48.
- Nezhat F, Brill AI, Nezhat CH, et al. Laparoscopic appraisal of the anatomic relationship of the umbilicus to the aortic bifurcation. J Am Assoc Gynecol Laparosc 1998; 5:135.
- van Lith DA, van Schie KJ, Beekhuizen W, du Plessis M. Cul-de-sac insufflation: an easy alternative route for safely inducing pneumoperitoneum. Int J Gynaecol Obstet 1980; 17:375.
- Sanders RR, Filshie GM. Transfundal induction of pneumoperitoneum prior to laparoscopy. J Obstet Gynaecol Br Commonw 1974; 81:829.
- Morgan HR. Laparoscopy: induction of pneumoperitoneum via transfundal puncture. Obstet Gynecol 1979; 54:260.
- Hurd WH, Bude RO, DeLancey JO, et al. Abdominal wall characterization with magnetic resonance imaging and computed tomography. The effect of obesity on the laparoscopic approach. J Reprod Med 1991; 36:473.
- Neudecker J, Sauerland S, Neugebauer E, et al. The European Association for Endoscopic Surgery clinical practice guideline on the pneumoperitoneum for laparoscopic surgery. Surg Endosc 2002; 16:1121.
- Hasselgren PO, Hagberg E, Malmer H, et al. One instead of two knives for surgical incision. Does it increase the risk of postoperative wound infection? Arch Surg 1984; 119:917.
- Chen NC, Towler MA, Moody FP, et al. Mechanical performance of surgical needle holders. J Emerg Med 1991; 9 Suppl 1:5.
- Stamp CV, McGregor W, Rodeheaver GT, et al. Surgical needle holder damage to sutures. Am Surg 1988; 54:300.
- Towler MA, Chen NC, Moody FP, et al. Biomechanics of a new atraumatic surgical needle holder. J Emerg Med 1991; 9:477.
- Corson, SL, Sedlacek, TV, Hoffman, JJ. Greenhill’s Surgical Gynecology. 5th Ed. Year Book Medical, Chicago, 1986.
- Abidin MR, Thacker JG, Lombardi SA, et al. Needle holder damage to surgical needles. Am Surg 1989; 55:681.
- Edlich RF, Towler MA, Rodeheaver GT, et al. Scientific basis for selecting surgical needles and needle holders for wound closure. Clin Plast Surg 1990; 17:583.
- Nichols, DH. Instruments and sutures. p. 120. In Nichols DH (ed): Gynecologic and Obstetric Surgery. Mosby-Yearbook, St. Louis, 1993.
- Bernstein G. Needle holders–an instrument especially for the left-handed surgeon. J Dermatol Surg Oncol 1988; 14:505.
- Bennett NT, Howard RJ. Quantity of blood inoculated in a needlestick injury from suture needles. J Am Coll Surg 1994; 178:107.
- Masterson BJ, Sullivan TG, Townsend PR. Development of a noncrushing vascular clamp for pelvic surgery. Am J Obstet Gynecol 1978; 132:113.
- Masterson, BJ. Selecting instruments for gynecologic surgery. Contemp Ob/Gyn 1978; 12:31.
- Sesti F, Melgrati L, Damiani A, Piccione E. Isobaric (gasless) laparoscopic uterine myomectomy. An overview. Eur J Obstet Gynecol Reprod Biol. 2006 Nov; 129(1):9-14. Epub 2006 May 24.
- Damiani A, Melgrati L, Marziali M, Sesti F, Piccione E. Laparoscopic myomectomy for very large myomas using an isobaric (gasless) technique. JSLS. 2005 Oct-Dec; 9(4):434-8.
- Damiani A, Melgrati L, Marziali M, Sesti F. Gasless laparoscopic myomectomy. Indications, surgical technique and advantages of a new procedure for removing uterine leiomyomas. J Reprod Med. 2003 Oct; 48(10):792-8.
- Gasless laparoscopy and conventional instruments. The next phase of minimally invasive surgery.
- Smith RS, Fry WR, Tsoi EK, Henderson VJ, Hirvela ER, Koehler RH, Brams DM, Morabito DJ, Peskin GW. Arch Surg. 1993 Oct; 128(10):1102-7.
- Alijani A, Cuschieri A. Abdominal wall lift systems in laparoscopic surgery: gasless and low-pressure systems. Semin Laparosc Surg. 2001;8(1):53–62. doi: 10.1053/slas.2001.23180.
- Bojahr B, Lober R, Straube W, Kohler G. Gasless laparoscopic-assisted radical vaginal hysterectomy with lymphadenectomy for cervical carcinoma. J Am Assoc Gynecol Laparosc. 1996;3(4):S4–S5. doi: 10.1016/S1074-3804(96)80141-1.
- Chin AK, Moll FH, McColl MB, Reich H. Mechanical peritoneal retraction as a replacement for carbon dioxide pneumoperitoneum. J Am Assoc Gynecol Laparosc. 1993;1(1):62–66. doi: 10.1016/S1074-3804(05)80762-5.
- . Johnson PL, Sibert KS. Laparoscopy. Gasless vs. CO2 pneumoperitoneum. J Reprod Med. 1997;42(5):255–259.
- Kruschinski D, Homburg S. Lift-(gasless) laparoscopic surgery under regional anesthesia. Surg Technol Int. 2005;14(5):193–196.
- Kruschinski D, Homburg S, Wockel A, Kapur A, Reich H. Lift-laparoscopic total hysterectomy as a routine procedure. Surg Technol Int. 2004;13:147–156.
- Mohammad E Parsanezhad et al: Hyperprolactinemia after laparoscopic ovarian drilling: An unknown phenomenon. Reproductive Biology and Endocrinology20053:31
- Glick SM, Roth J, Yalow RS: The regulation of growth hormone secretion, Recent Prog. Horm Res. 1965, 21: 241-244.
- Frantz AG, Lienberg DL, Noel GL: Studies on prolactin in man. Recent Prog Horm Res. 1972, 28: 527-590.
- Newsome HH, Rose JC: The response of human adrenocorticotrophic hormone and growth hormone to surgical stress. J Clin Endocrinol Metab. 1971, 33: 481-487.
- Charters AC, Odell WD, Thompson JC: Anterior pituitary function during surgical stress and convalescence. Radioimmunoassay measurement of blood TSH, LH, FSH and growth hormone. J Clin Endocrinol Metab. 1969, 29: 63-71.
- Soules MR, Sutton GP, Hammond CB, Haney AF: Endocrine changes at operation under general anesthesia: Reproductive hormone flactuations in young women. Fertil Steril. 1980, 33: 364-371.
- Tolis G, Hickey J, Guyda H: Effects of morphine on serum growth hormone, cortisol, prolactin and thyrid stimulating hormone in man. J Clin Endocrinol Metab. 1975, 41: 797-800.
- Noel GL, Suh HK, Stone JG, Frantz AG: Human prolactin and growth hormone release during surgery and other conditions of stress. Clin Endocrinol Metab. 1972, 35: 840-851.
-
Subarna Mitra, Prasanta Kumar Nayak, and Sarita Agrawal Laparoscopic ovarian drilling: An alternative but not the ultimate in the management of polycystic ovary syndrome J Nat Sci Biol Med. 2015 Jan-Jun; 6(1): 40–48.
-
Yuan Ch-Ch. Laparoscopic uterosacral nerve ablation and chronic pelvic pain. J Chin Med Assoc. 2006;69(3):101–103. doi: 10.1016/S1726-4901(09)70185-6.19. Royal College of Obstetricians and Gynaecologists (2006) The investigation and management of endometriosis. Green-top guideline no. 24. London
-
Kennedy S, Bergqvist A, Chapron C. ESHRE guideline for the diagnosis and treatment of endometriosis. Hum Reprod. 2005;20(10):2698–2704. doi: 10.1093/humrep/dei135.
-
National institute for health and clinical excellence: interventional procedure overview of laparoscopic uterine nerve ablation (LUNA) for chronic pelvic pain. February 2007.
-
Juang CM, Yen MS, Horng HC, Cheng CY, Yu HC, Chang CM. Treatment of primary deep dyspareunia with laproscopic uterosacral nerve ablation procedure: a pilot study. J Chin Med Assoc. 2006;69:110–114. doi: 10.1016/S1726-4901(09)70187-X.
-
Proctor ML, Latthe PM, Farquhar CM, Khan KS, and Johnson NP: Surgical interruption of pelvic nerve pathways for primary and secondary dysmenorrhea Cochrane Database of Systematic Reviews 2007 Issue 3 Copyright © 2007 The Cochrane Collaboration. Published by Wiley
-
Davis GD. Uterine prolapse after laparoscopic uterosacral transection in nulliparous airborne trainees. J Reprod Med. 1996;41:279–282.
-
Guyer C, Moors A, Louden K. An audit of conservative surgery for endometriosis in a district general hospital 1995–1998. J Obstet Gynaecol. 2000;20(5):514–516. doi: 10.1080/014436100434721.
-
Daniels J, Gray R, Hills RK, Latthe P, Buckley L, Gupta J, Selman T, Adey E, Xiong T, Champaneria R, Lilford R, Khan KS, LUNA Trial Collaboration Laparoscopic uterosacral nerve ablation for alleviating chronic pelvic pain: a randomized controlled trial. JAMA. 2009;302(9):955–961.
-
Xiong T, Daniels J, Middleton L, Champaneria R, Khan KS, Gray R, Johnson N, Lichten EM, Sutton C, Jones KD, Chen FP, Vercellini P, Aimi G, Lui WM (2007) International LUNA IPD Meta-analysis Collaborative Group: meta-analysis using individual patient data from randomised trials to assess the effectiveness of laparoscopic uterosacral nerve ablation in the treatment of chronic pelvic pain: a proposed protocol. BJOG. Dec;114(12):1580,
-
Palomba S, Russo T, Falbo A. Laparoscopic uterine nerve ablation versus vaginal uterosacral ligament resection in postmenopausal women with intractable midline chronic pelvic pain: a randomized study. Eur J Obstet Gynaecol. 2006;129:84–91. doi: 10.1016/j.ejogrb.2005.12.007.
-
Wilson ML, Farquhar CM, Sinclair OJ, Johnson NP (2000) Surgical interruption of pelvic nerve pathways for primary and secondary dysmenorrhea. [Review] [6 refs]. Cochrane Database Syst Rev.: (2000) CD001896
-
Stones, RW, Mountfield, J (2000) Interventions for treating chronic pelvic pain in women. [update of Cochrane Database Syst Rev. ;(2): CD000387 ; 10796713.]. [Review] [15 refs]. Cochrane Database Syst Rev. p. CD000387
-
Proctor ML, Latthe PM, Farquhar CM (2005) Surgical interruption of pelvic nerve pathways for primary and secondary dysmenorrhea. Cochrane Database of Systematic Reviews Issue 4: CD001896
-
Vercellini P, Aimi G, Busacca M, Apolone G, Uglietti A, Crosignani PG. Laparoscopic uterosacral ligament resection for dysmenorrhea associated with endometriosis: results of a randomized, controlled trial. Fertil Steril. 2003;80:310–319. doi: 10.1016/S0015-0282(03)00613-7.
-
Hammoud A, Gago LA, Diamond MP. Adhesions in patients with chronic pelvic pain: a role for adhesiolysis? Fertil Steril. 2004;82:1483–1491. doi: 10.1016/j.fertnstert.2004.07.948.
-
Johnson NP, Farquhar CM, Crossley S, Yu Y, Peperstraten AM, Sprecher M, Suckling J. A double-blind randomized controlled trial of laparoscopic uterine nerve ablation for women with chronic pelvic pain. BJOG. 2004;111:950–959. doi: 10.1111/j.1471-0528.2004.00233.x.
-
The LUNA Trial Collaboration: a randomized controlled trial to assess the efficacy of laparoscopic uterosacral nerve ablation (LUNA) in the treatment of chronic pelvic pain: the trial protocol. BMC Womens Health. 2003 3:6. Published online 2003 December 8. doi:10.1186/1472-6874-3-6
-
Hebbar S, Chawla C. Role of laparoscopy in evaluation of chronic pelvic pain. J Min Access Surg. 2005;1(issue 3):116–120. doi: 10.4103/0972-9941.18995.
-
Adolpho Roberto Kelm Junior et al: Nerve fibers in uterosacral ligaments of women with deep infiltrating endometriosis Journal of Reproductive Immunology Volume 79, Issue 1, October 2008, Pages 93-99