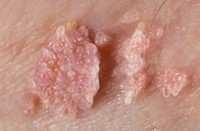
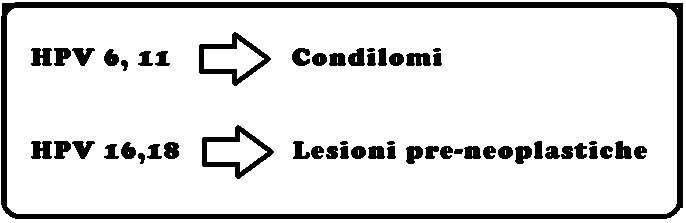
La vagina è una nicchia ecologica normalmente colonizzata da una flora polimicrobica. Oltre 70% delle donne asintomatiche presenta in vagina batteri aerobi ed anaerobi potenzialmente patogeni. Negli ultimi decenni Le infezioni da papillomavirus (HPV) hanno assunto una notevole attenzione scientifica sempre crescente a causa della sua correlazione con le lesioni neoplastiche del basso tratto vaginale. I meccanismi naturali di difesa sono principalmente il muco cervico-vaginale, il trofismo delle mucose esterogeno-dipendente, lattobacillo di Doederlein, acidità vaginale estrogeno-dipendente (pH 4 – 4,5). Al momento sono stati identificati oltre 100 tipi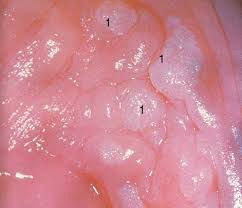 di HPV: più del 90% delle lesioni condilomatose (verruche) genitali sono associate ai tipi di HPV 6 e 11. I sottotipi di HPV ad elevato rischio oncogenico sono il 13, 16, 18, 31, 33, 35, 39, 45, 51, 52, 56, 58, 59, 68. I ceppi maggiormente a rischio sono il 16 e il 18 (HPV 18 e 18), responsabili da soli del 70% delle neoplasie della cervice uterina; gli stessi papillomavirus sono altresì responsabili di neoplasie del pene, dell’ano, della vagina, della vulva e dell’orofoaringe e oculari.
di HPV: più del 90% delle lesioni condilomatose (verruche) genitali sono associate ai tipi di HPV 6 e 11. I sottotipi di HPV ad elevato rischio oncogenico sono il 13, 16, 18, 31, 33, 35, 39, 45, 51, 52, 56, 58, 59, 68. I ceppi maggiormente a rischio sono il 16 e il 18 (HPV 18 e 18), responsabili da soli del 70% delle neoplasie della cervice uterina; gli stessi papillomavirus sono altresì responsabili di neoplasie del pene, dell’ano, della vagina, della vulva e dell’orofoaringe e oculari.
Oltre all’HPV, altri fattori di rischio di VaIN sono la presenza di CIN e VIN, il fumo, l’immunodepressione e la terapia radiante che può essere causa di stenosi e ulcerazioni vaginali.
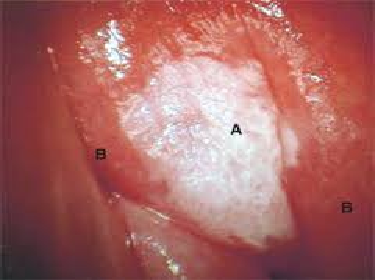
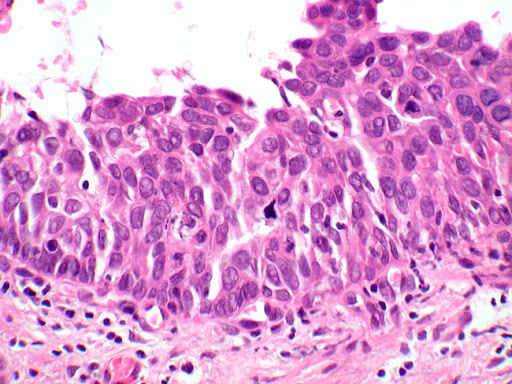
Le lesioni pre-cancerose vaginali (VaIN) sono lesioni rare (0.5% delle lesioni neoplastiche del tratto genitale inferiore, più rare dei carcinomi invasivi della vagina (1). Sono rilevate dalla citologia vaginale e confermate da colposcopia e soprattutto dall’esame istologico, si distinguono in L-SIL e H-SIL.
• L-SIL: lesioni di basso grado – o CIN -I (displasia lieve che interessa solo lo strato basale dell’epitelio), regrediscono spesso spontaneamente entro due anni e raramente portano al cancro.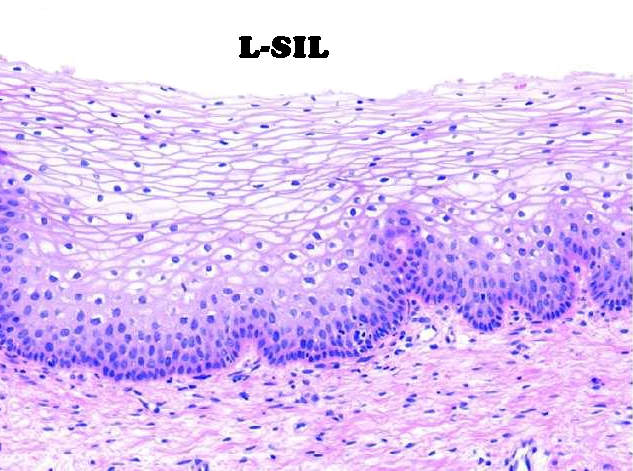
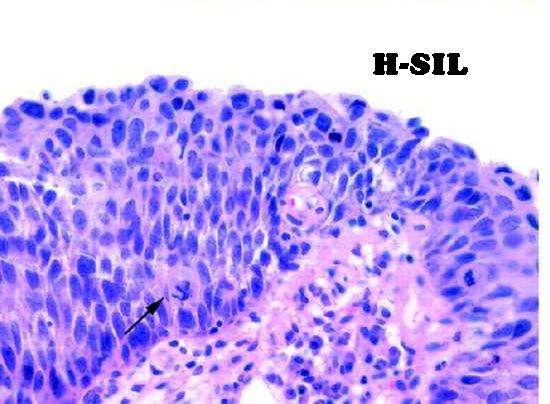
• H-SIL: lesioni di alto grado – CIN II e CIN III (displasia media e grave); comportano invece un rischio più elevato di evolvere in carcinoma a cellule squamose.
• Evoluzione neoplastica maligna avviene quando la lesione supera la membrana basale.
ETA’ MEDIA DI INSORGENZA – L’età media di riscontro della VaIN varia a seconda del grado della stessa: la VaIN III è più frequente nelle donne sessantenni, mentre il tpo VaIN I e II è più frequente nelle donne in epoca pre-menopausale (3). Ma sono state segnalate VaIN di alto grado anche in donne al di sotto dei 25 anni (4-6).
La VaIN è stata riscontrata isolatamente, sincrona o metacrona a neoplasie intraepiteliali cervicali e vulvari HPV correlate; l’associazione con la CIN è stata riscontrata nel 65% dei casi (4), quella con la VIN nel 10% dei casi (4,10). Tali associazione costituiscono, insieme alla multifocalità, un alto fattore di rischio per le recidive post-trattamento.
EZIOLOGIA – Nell’eziologia della VaIN il papillomavirus gioca un ruolo primario similmente a quanto avviene nelle CIN e nelle VIN (14,15); le VaIN di alto grado sono quasi tutte correlate ad HPV ad alto rischio, nella metà dei casi HPV 16 (16), mentre gli HPV 16 e 18 complessivamente sono stati riscontrati nel 64% dei casi, con altri HR-HPV implicati negli altri casi (17).
Altri fattori di rischio sono la radioterapia pelvica, l’immunodepressione e l’esposizione al DES nella vita endouterina. Nelle donne immunodepresse, sia per motivi iatrogeni (21) che in seguito all’infezione da HIV, è stata riscontrata una frequenza di VaIN fino al 5% della popolazione osservata (22-24), forse per un minor controllo immunologico generale e locale sulle infezioni da HPV oncogeni.
CLASSIFICAZIONE VaIN
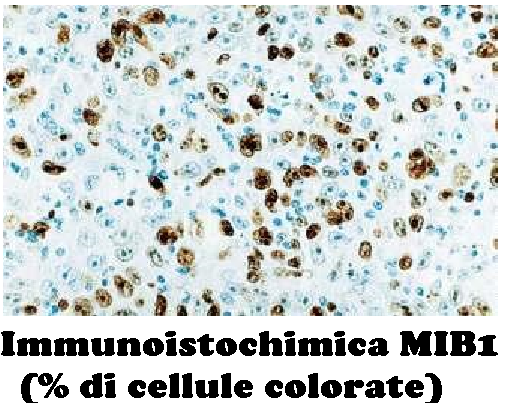
Le VaIN vengono classificate come per le altre lesioni intraepiteliali con potenzialità evolutiva in lesioni di basso grado (displasia lieve, o neoplasia intraepiteliale vaginale di grado 1, VaIN1) e in lesioni ad alto grado (displasia media e grave, neoplasia intraepiteliale vaginale di grado 2 e 3 e carcinoma in situ, VaIN 2 e 3). I criteri diagnostici per le varie categorie sono ben codificati; la riproducibilità per la diagnosi di alto grado è buona, mentre quella per la diagnosi di VaIN 1 non è alta; infatti viene riferita una sovrastima istologica (18). Tra le lesioni interpretate come VaIN 1 quelle realmente di significato displastico sarebbero positive in immunoistochimica al MIB-1 (18).
Topografia
In oltre l’80% dei casi la localizzazione della VaIN è sulla cupola o alla porzione media della vagina o al 1/3 superiore della vagina (colletto vaginale) . Questo è tanto più vero nelle donne isterectomizzate per CIN3-CIS (2). Per spiegare questa localizzazione preferenziale è stata invocata la comune origine embriologica della parte superiore della vagina e della cervice (2,3,5,7,11,12).
Diagnostica citologica
Il pap-test non sembra indicato come screening preventivo di massa per la diagnosi di VaIN (11-13, 35-37) mentre in caso di donne isterectomizzate per carcinoma il pap test dovrebbe essere sempre eseguito durante il follow-up per 10 anni. La citologia sarebbe sensibile per il riscontro delle VaIN 2-3 e dei casi con iniziale invasione; in caso di donne isterectomizzate per patologia benigna uterina sembra sia sufficiente un pap test ogni 2 anni (77-84).
Diagnostica colposcopica
In presenza di un sospetto citologico è essenziale uno studio accurato della vagina mediante la colposcopia, cosa che va fatta anche in tutti i casi di lesione cervicale.
Dopo applicazione di acido acetico in presenza di VaIN possono essere riscontrate aree acetochiare (11), anche rilevate o papillari, con aspetto che può ricordare il puntato, o associate a mosaico (11). Tali lesioni sono più facilmente evidenziabili dopo applicazione di Lugol, quando appariranno iodochiare o iodoirregolari.
TERAPIA
Nel trattamento della VaIN sono utilizzate numerose tecniche; quelle escissionali hanno il vantaggio di poterci dare un pezzo istologico su cui indagare l’eventuale presenza di un carcinoma già invasivo altrimenti occulto (29,40) che si ritrova con frequenza variabile dall’1% (26), al 12 (30) e fino al 28% (31) dei casi.
In ogni caso la profondità minima di trattamento deve essere di almeno 1.5 mm nello spessore della mucosa vaginale: infatti lo spessore dell’epitelio interessato dalla VaIN varia da 0.10 a 1.4 mm (41) e questo è particolarmente importante quando vengano utilizzate tecniche distruttive, quali la vaporizzazione laser o la folgorazione. Si deve sempre considerare che la parete vaginale è in stretto rapporto con l’uretra, la vescica, il retto, il cavo del Douglas, e che lo spessore di parete che separa la superficie vaginale da questi organi può essere di 5-7 mm. Questa particolare condizione può esporre al rischio di complicanze anche importanti, soprattutto con le tecniche escissionali di chirurgia tradizionale, e spiega il rischio di morbilità della radioterapia.
I risultati dei trattamenti riportati in letteratura sono molto variabili con qualsiasi tecnica; nelle migliori casistiche la remissione avverrebbe nel 70% dei casi dopo un singolo trattamento, mentre il trattamento combinato chirurgico o chemio-chirurgico delle recidive permetterebbe la remissione in un altro 24% di pazienti (8).
Recidive – I fattori di rischio per le recidive della VaIN, dopo la terapia, sono la multifocalità e la co-presenza di VIn e CIN (75).
Chirurgia a lama fredda
In caso di VaIN di alto grado con lesioni localizzate si può ricorrere alla colpectomia parziale prossimale o alle escissioni chirurgiche ampie; in caso di lesioni multifocali interessanti tutti i settori della vagina è stata proposta in passato anche la colpectomia totale, eventualmente associata all’isterectomia in presenza dell’utero.
Si tratta di interventi che possono essere mutilanti e che, anche nei casi più conservativi, generalmente comportano un accorciamento più o meno consistente della vagina con conseguente difficoltà o impossibilità alle relazioni sessuali.
Anche in caso di colpectomia totale. e susseguente creazione di neovagina è stata riportata la possibilità di recidiva di VaIN sulla neovagina! (8,42). La colpectomia parziale prossimale (upper colpectomy o upper vaginectomy), che prevede l’escissione del 1/3 speriore della vagina detto anche “colletto vaginale”, dopo isterectomia pregressa o contemporanea, potrebbe essere utile nel caso di lesioni di alto grado (H-SIL e Ca. in situ) che si indovano nella cicatrice della cupola o nei recessi laterali della stessa, o in casi selezionati di lesioni comunque colposcopicamente delimitabili al terzo superiore della vagina (68).
Si è dimostrata efficace (30,31,43), con percentuali di efficacia tra il 69 e l’88% (30) anche se sono state riportate recidive di VaIN di alto grado nella vagina residua e se è stata riportata l’evoluzione verso il carcinoma invasivo anche dopo questo intervento (30), pure ripetuto (8), forse da aree occulte di displasia. L’upper vaginctomy si è dimostrata utile, come terapia adiuvante e preventiva, dopo isterectomia, anche nei casi di cancro endometriale, ca. in situ, e ca. vaginale invasivo superficiale. Inoltre l’upper vaginectomy fornisce non un campione limtato di tessuto vaginale ma l’intera area di tessuto inficiato che può essere esaminato istologicamente in toto e che ha dato la possibilità di scoprire nel 27% dei casi un carcinoma occulto (40-43).
La tecnica della colpectomia parziale prossimale è ben descritta da Cardosi (9). Può essere effettuato per via laparotomica, vaginale o laparoscopica tradizionale o robot-assistita (69-72).
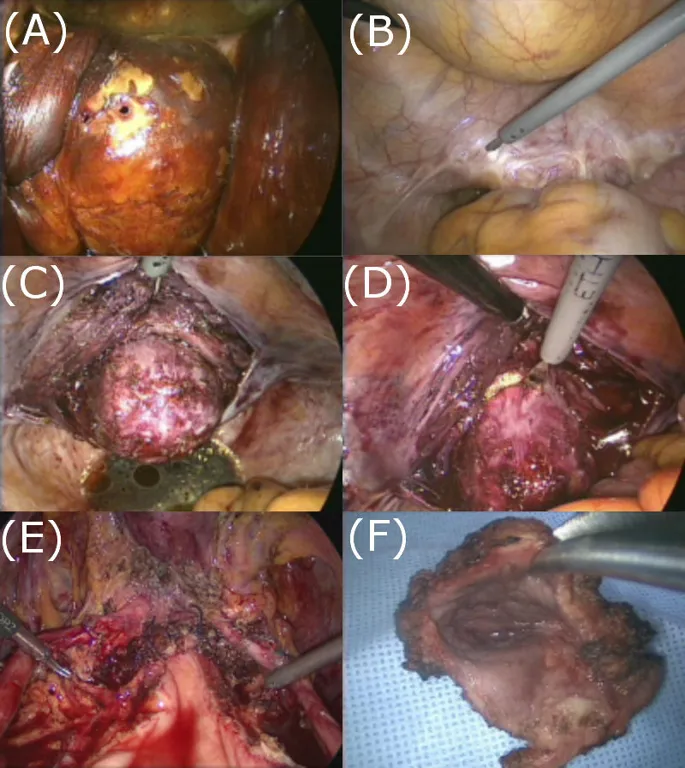
Surgical procedures in laparoscopic upper vaginectomy. (A) The planned cutting margin was identified after iodine application via a speculum examination. (B) Excision of the stump peritoneum. (C) The vaginal stump at the site of dissection of the vesicovaginal and rectovaginal spaces through the scar tissue and the isolation of the bladder pillar. (D) The resection of the upper vagina. (E) The vaginal cutting edge is restored. (F) The dissected upper vaginal specimen.
Si tratta di un intervento che può comportare complicanze in percentuale variabile attorno al 10%: lesioni coinvolgenti anche gli organi vicini (lesioni del retto, degli ureteri, lesioni vescicali, fistole vescico-vaginali; queste ultime, fortunatamente, quasi sempre guariscono spontaneamente con applicazione di Foley lasciato in situ per 3 mesi oltre che complicanze emorragiche (intra e post operatorie) e settiche (30). Fino al 22% dei casi non è poi stata riscontrata patologia all’esame istologico (30), forse perché la lesione principale era stata asportata anche incompletamente dalla biopsia con regressione degli eventuali residui.
Le escissioni chirurgiche ampie non sono state in grado di impedire comunque la recidiva in oltre il 30% dei casi e la comparsa al follow-up di carcinomi squamosi (40).
Per migliorare i risultati della chirurgia è stato proposto di associare l’escissione o la colpectomia parziale alla laservaporizzazione e al 5-fluorouracile topico.
Elettrochirurgia
La LEEP è stata utilizzata per eseguire la colpectomia parziale prossimale in caso di VaIN, in anestesia locale (29). I risultati sono stati buoni e in tutte le pazienti trattate con conferma di VaIN 2-3 è stato eseguito anche il trattamento complementare con il 5-Fu (29): in 15/15 pazienti considerate non c’è stata recidiva di malattia, la compliance al trattamento è stata ottima, non sono state osservate complicanze maggiori, le perdite ematiche sono state molto contenute. Peraltro sono state riportate con questa tecnica complicanze importanti anche se rare quali la perforazione del sigma (44). L’indicazione è per lesioni singole (28).
Non sono riportati in letteratura studi sull’uso dell’ago a radiofrequenza, che permette la resezione step-bystep come per il laser, ma che forse è tecnicamente più difficile da eseguire.
Laser CO2
Il trattamento con laser CO2 sarebbe curativo nel 42-90% dei casi (2,5,7,10,33,45), la facile ripetitività e gli scarsi effetti collaterali, unito alla precisione del trattamento, che può combinare escissione e ne, viene considerato da molti Autori il trattamento di scelta, associato o meno in caso di numerosità delle lesioni al 5-Fu topico (5,8,10,28,46,47).
L’uso del laser non è gravato dalle complicanze riportate con altri metodi (44), ma si tratta di una tecnica che richiede importanti investimenti economici e una lunga curva di apprendimento, soprattutto per quanto riguarda le tecniche escissionali sulla vagina; è una tecnica molto versatile che in mani esperte è in grado di trattare aree vaginali altrimenti difficilmente raggiungibili, quali i recessi angolari alla cupola dopo isterectomia (7).
Trattamento locale con acido tricloroacetico (TCA)
È stato riferito che il trattamento intravaginale con TCA al 50%, con applicazione settimanale per 1-4 settimane sarebbe in grado di determinare la regressione della VaIN nel 71.4% dei casi (48), considerando anche le VaIN1 (che probabilmente non sono da definire come VaIN e che possono probabilmente regredire anche da sole o in seguito alla biopsia); la regressione delle VaIN 2-3 sarebbe attorno al 53% (48). Alla fine gli Autori raccomandano il trattamento con TCA nelle VaIN 1, dove il successo sarebbe attorno al 100% con minimi effetti collaterali (48). In questo caso il vero punto è che probabilmente la VaIN 1 non va normalmente trattata.
Chemioterapia con 5-fluorouracile
Il trattamento con 5-Fluorouracile topico ha rilevato in passato, quando utilizzato come unico presidio terapeutico, fino all’85% di risultati positivi (49). Anche in lavori recenti la sua somministrazione intravaginale settimanale per almeno 10 settimane si è dimostrata efficace fino al 90% dei casi (32). I risultati sono comunque molto variabili nelle varie casistiche, e soprattutto considerando un follow-up prolungato i successi possono diminuire fino a giungere attorno al 30% dei casi (8).
Il trattamento teoricamente ha il vantaggio di trattare tutta la superficie vaginale, presenta comunque degli effetti collaterali (bruciori, perdite vaginali, dolori) che possono impedire una ottimale compliance della paziente, che è indotta ad abbandonare il trattamento. Questo aspetto può ovviamente influire sull’entità dei mancati successi. L’autoapplicazione necessita di apprendimento e non è sempre possibile.
Un’altra causa di possibile fallimento del trattamento è costituita dall’epitelio displastico sequestrato all’interno della cicatrice della cupola dopo isterectomia, dove il farmaco non può giungere (8,9).
È stata segnalata la comparsa di adenosi in casi trattati con 5-Fu (50).
Il trattamento chemiochirurgico: microchirurgia e 5-Fu In relazione agli scarsi risultati a distanza del trattamento con 5-Fu, questo è stato integrato in vario modo con a microchirurgia, soprattutto laser (8,47). Anche questa modalità di trattamento non si è dimostrata sempre efficace, e non è stata in grado di prevenire l’evoluzione verso il carcinoma invasivo (8). Gli Autori raccomandano questo tipo di trattamento solo quando la lesione di alto grado sia interamente visibile e accessibile alla microchirurgia (8).
Radioterapia
Negli anni ’90 del secolo scorso la radioterapia endocavitaria fu utilizzata ad alte dosi, fino a 65-70 Gy per lesioni multicentriche, al fine di evitare una eventuale chirurgia radicale (53).
Più recentemente la brachiterapia endocavitaria è stato proposta in caso di fallimento della laserterapia nelle donne già isterectomizzate (54). Ancora, il trattamento endocavitario va riservato a casi di plurirecidive in donne anziane con scarsa compliance ai trattamenti conservativi e nelle quali le scadenti condizioni generali non consentono  una chirurgia radicale (55).
una chirurgia radicale (55).
Ancora recentemente la radioterapia endocavitaria è stata proposta nelle donne isterectomizzate per CIN3 con residuo sulle pareti vaginali, sempre al fine di evitare la chirurgia demolitiva (51), con un ottimo successo terapeutico.
Negli ultimi anni sono stati utilizzati schemi a dosaggio intermedio, con l’erogazione di 48 Gy, con risultati sostanzialmente simili agli studi precedenti ma con minori effetti collaterali (56). Dosaggio medio Selectron era il metodo di scelta, tipicamente 48 Gy prescritto per il punto Z (situato 0,5 cm lateralmente alla superficie ovoidale) su due inserzioni a distanza di 1 settimana. Le pazienti devono essere informate sulla potenziale tossicità. Il follow-up a lungo termine è consigliato a causa del rischio di recidiva tardiva e di seconda malignità (85-88).
Terapie innovative
Imiquimod
L’imiquimod è un immunomodulante che induce la secrezione di alfa interferone, interleukina 12 e di TNF-alfa (Tumor Necrosis Factor alfa); stimola localmente l’attività natural killer, favorisce la maturazione e l’attività delle cellule di Langerhans, aumenta l’efficacia della risposta T-mediata (57). Il trattamento, già utilizzato nelle displasie vulvari, è ora allo studio con un apposito veicolo nelle displasie vaginali, e sono stati pubblicati i primi dati (58,59). Alcuni Autori (58) hanno utilizzato l’imiquimod soprattutto in donne con VaIN di basso grado, dove la riproducibilità diagnostica della lesione è scarsa e dove la frequenza di regressione spontanea può essere molto alta, anche come effetto della stessa biopsia e della clearence dell’infezione da HPV. Uno degli svantaggi è costituito dalla complessità del trattamento, che deve essere fatto almeno tre volte alla settimana per 8 settimane sotto guida colposcopica, con una scarsa compliance da parte delle pazienti e un notevole impegno da parte degli operatori sanitari. Recentemente è stato riportato che in donne con VaIN di alto grado HPV correlata, escludendo le donne isterectomizzate per CIN con VaIN alla cupola, l’uso
dell’imiquimod al 5% intravaginale, applicato secondo lo schema precedentemente descritto, può determinare la regressione verso le lesioni di basso grado o la semplice presenza dell’infezione da HPV, che peraltro persistono fin oltre l’80% dei casi (60); nel 46% dei casi ci sarebbe la negativizzazione della precedente positività dei nuclei per la p53 (60).
La recidiva di lesioni di alto grado sarebbe comunque superiore al 30% L’uso dell’imiquimod rappresenterebbe quindi solo una terapia transitoria in donne giovani affette da VaIN di alto grado HPV correlata (60). Anche una recente review dimostra come i dati realmente in nostro possesso siano pochi (61), e per ora resta un trattamento sperimentale da condurre solo all’interno di studi clinici controllati. In ogni caso deve essere esclusa la presenza di un carcinoma già anche inizialmente invasivo mediante adeguate biopsie.
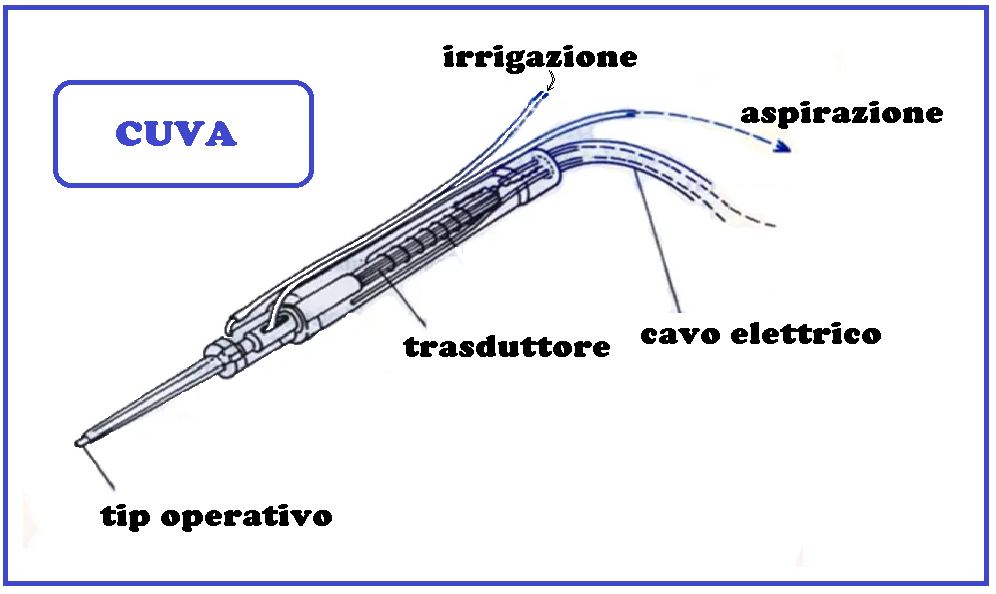
CUVA
Tra i trattamenti in sperimentazione va annoverato il bisturi ad ultrasuoni (CUVA cavitational ultrasonic surgical aspiration) in grado di frammentare e aspirare il tessuto neoplastica.
I dati iniziali su una casistica in cui erano presenti anche lesioni di basso grado riportano assenza di recidive nel 66% dei casi e il CUVA sarebbe più efficace anche nelle recidive (52% di successi contro 9% con altre metodiche, al follow-up) (62).
Il dolore postoperatorio sarebbe inferiore e la guarigione migliore rispetto al laser (63,73-76).
Terapia fotodinamica
La terapia fotodinamica utilizza un raggio laser con lunghezza d’onda di 635 nm ad una potenza di 80-125 J/cm2 dopo l’applicazione di un fotosensibilizzante (acido 5 amino levulinico – ALA – in gel al 10%) che viene attivamente e selettivamente incorporato nelle cellule displastiche. Viene utilizzata in via sperimentale per le VIN ed ora sono comparsi studi anche sulla VaIN con risultati non conclusivi; rispetto al laser CO2 sarebbero minori i tempi di guarigione (64).
Il vaccino anti HPV: possibile impatto sulle VaIN
Il vaccino anti HPV potrebbe far diminuire di 2/3 le lesioni intraepiteliali vaginali di alto grado, in quanto solo il 64% delle VaIN 2-3 sono causate da HPV 16 e 18 (17) e solo il 50% sarebbe causato da HPV 16 (16).
Probabilmente il vaccino farà diminuire di poco le VaIN di basso grado, dove è sì presente una elevata frequenza di HR-HPV ma dove ci sono segnalazioni che l’HPV 16 possa essere particolarmente poco frequente (16).
I primi dati riportano efficacia del 100% nella protezione di VaIN 2-3 per i tipi 16/18 nella popolazione naive e una diminuzione delle VaIN 2-3 complessive del 43% (65).
Recidive post-trattamenti
Dopo trattamento adeguato, in media, la possibilità di recidive SI AGGIRA attorno al 33% (4,8). Il rischio di recidiva è legato alla multifocalità (3) e all’estensione delle lesioni (8), per le difficoltà terapeutiche che comportano, e alla tecnica terapeutica utilizzata, anche se non sembra influenzato dallo stato dei margini negli interventi escissionali (7). Il recurrent rate tra trattamenti laser e quelli escissionali chirurgici (vaginectomia parziale) sarebbe simile secondo alcuni Autori (3) e molto diverso secondo altri, con una miglior performance della vaginectomia
parziale (0% vs 38% di recidive) (4). Fino all’89% dei casi di VaIN 2-3 trattate anche in più sedute sono risultate libere al follow-up di almeno 18 mesi (46).
Le recidive dopo trattamento sarebbero più frequenti anche in caso di lesioni di alto grado, in presenza di altre neoplasie intraepiteliali o invasive, HPV correlate, del basso tratto genitale, in presenza di persistenza di HPV oncogeni e nelle pazienti immunodepresse (8,66), anche se quest’ultima condizione non è stata sempre riscontrata essere un fattore di rischio indipendente statisticamente significativo (8). Nelle donne affette da lesioni displastiche HPV correlate in più settori del basso tratto genitale le recidive sarebbero correlate alla presenza di lesioni in più sedi, mentre il tabagismo, i disordini immunologici, le lesioni di alto grado e l’aver eseguito trattamenti non chirurgici non rappresenterebbero fattori di rischio significativi per la ricorrenza (67).
Anche la localizzazione della VaIN ai corni vaginali nelle donne isterectomizzate è stata messa in relazione con un alto tasso di recidive, probabilmente per la difficoltà di visualizzazione e di trattamento (2).
Le recidive possono avvenire anche a distanza di tempo in caso di vaginectomia totale e ricostruzione di una neovescica, anche se i casi riportati in letteratura sono pochi (42).
Management VaIN
In caso di VaIN di basso grado, dopo conferma istologica, la paziente può essere tranquillamente inviata a follow-up, che sarà citocolposcopico a 6 – 12 mesi; il follow-up andrà proseguito per almeno due anni dalla negativizzazione, quindi seguirà il timing previsto per
quella paziente indipendentemente dalla VaIN.
In caso di VaIN di alto grado la paziente andrà inviata al trattamento che dovrà essere possibilmente escissionale (per riconoscere i casi di microinvasione già presenti) ma che dovrà essere personalizzato in relazione all’estensione e alla numerosità delle lesioni, alle condizioni della paziente e all’età della stessa, favorendo la sua compliance al trattamento e al follow-up. Nella scelta del trattamento dobbiamo ricordare che spesso è necessario agire più volte sulle recidive, e che anche i trattamenti escissionali in caso di VaIN 2 e 3 hanno dimostrato un overall cure rate (considerando anche i retrattamenti) del 69% (7).
Va ricordato inoltre che l’efficacia dei trattamenti dipenderà anche dall’abilità dell’operatore e dalla famigliarità che possiede con la tecnica utilizzata (3,68).
Non esiste in letteratura un accordo unanime su quali siano le migliori tecniche di trattamento della VaIN e ogni trattamento ha i suoi vantaggi e svantaggi che debbono essere considerati valutando la situazione di ogni paziente.
Tra i trattamenti distruttivi sempre per le VaIN di alto grado le migliori performance sono quelle della laser vaporizzazione, con un cure rate fino al 69% (7), mentre per la diatermocoagulazione questa sarebbe solo
del 25%. Il 5 Fluoro uracile topico è risultato curativo in percentuali variabili dal 46 al 90% dei casi (32) e vengono riferite fino al 59% di recidive al follow-up (4).
Nella scelta del trattamento dobbiamo considerare l’età della paziente, la sua integrità psicofisica, le necessità di relazioni sessuali, la presenza di multifocalità delle lesioni vaginali, la loro numerosità, estensione e localizzazione.
In donne giovani con lesioni ben visibili, anche se estese, il trattamento di scelta consigliabile è, a nostro parere, il laser CO2 con modalità tecnica distruttiva/escissionale, eventualmente seguito dal 5-Fu topico; in presenza di lesioni diffuse o numerose il 5-Fu nei nostri protocolli precede il trattamento laser (5,32).
Lesioni isolate e ben visibili possono essere trattate anche con l’escissione con ago a radiofrequenza, o possono essere folgorate, facendo attenzione alla profondità di azione.
Il trattamento laser potrà essere più volte ripetuto, ma in pazienti che recidivano più volte con lesione alla cupola o nei corni vaginali dopo isterectomia potrebbe essere indicata la colpectomia parziale superiore (68).
Questo trattamento può essere considerato anche in donne anziane che non presentino compliance ai trattamenti conservativi, preferibilmente dopo recidiva; la colpectomia totale deve essere riservata a casi eccezionali, in cui la diffusione delle lesioni recidivanti non consente altrimenti un controllo della malattia. La radioterapia endocavitaria va riservata ai casi in cui potrebbe essere indicata la colpectomia totale o la vaginectomia superiore ma che non sono operabili per patologie intercorrenti o che rifiutano l’intervento, ritenuto lesivo della propria immagine corporea.
Dopo trattamento di una VaIN 2-3 il follow-up sarà citocolposcopico almeno semestrale per almeno due anni e, quindi, sarà annuale per almeno 5 o 10 anni. È stato suggerito di aggiungere l’HPV test per la ricerca dei ceppi oncogeni nel follow-up, in quanto sarebbe maggiore
la capacità di predire la persistenza della VaIN dopo trattamento (69).
References:
- Aho M., Vesterinen E., Meyer B., Purola E., Paavonen J.: Natural History of vaginal intraepithelial neoplasia. Cancer 1991;68:195-72.
- Audet-Lapointe P., Body G., Vauclair R., Drouin P., Ayoub J.: Vaginal intraepithelial neoplasia. Gynecol Oncol 1990;36:232-9
- Diakomanolis E., Stefanidis K., Rodolakis A., Haidopoulos D., Sindos M., Chatzipappas I., Michalas S.: Vaginal intraepithelial neoplasia: report of 102 cases. Eur J Gynaecol Oncol 2002;23:457-9
- Dodge J.A., Eltabbakh G.H., Mount S.L., Walker R.P., Morgan A.: Clinical features and risk of recurrence among patients with vaginal intraepithelial neoplasia. Gynecol Oncol 2001;83:363-9
- Sopracordevole F., Parin A., Scarabelli C., Guaschino S.: Laser surgery in the management of vaginal intraepithelial neoplasms. Min Gin 1998;50:507-12
- Sopracordevole F.: La neoplasia intraepiteliale vaginale nelle donne in età fertile”. Comunicazione al XIII° Congresso della Società Italiana di Colposcopia e Patologia Cervico Vaginale. Padova, 15-17 Ottobre 1998. Dati non pubblicati.
- Rome R.M., Engalnd P.G.:Management of intraepithelial neoplasia: a series of 132 cases with long term follow-up. Int J Gynecol Cancer 2000;10:382-90
- Sillman F.H., Fruchter R.G., Chen Y:s:, Camilien L., Sedlis A., McTigue E.: Vaginal intraepithelial neoplasia: risk factors for persistence, recurrence, and invasion and its management. Am J Obstet Gynecol 1997;176:93-9
- Cardosi R.J., Bomalaski J.J., Hoffman M.S.: Diagnosis and management of vulvar and vaginal intraepithelial neoplasia. Obstet Gynecol Clin North Am 2001;28:685-702
- Sopracordevole F., Parin A., Campagnutta E., Quaranta M., Scarabelli C.: Laser chirurgia nel management della VaIN. In: Colposcopia e patologia cervicovaginale, M.Peroni, R Piccoli, G Modana, G De Palo Eds, CIC Edizioni Internazionali Roma 1997, p 251-2
- Murta EF., Neves Junior MA., Sempionato LR., Costa MC., Maluf PJ.: Vaginal intraepithelial neoplasia: clinical therapeutic analysis of 33 cases. Arch Gynecol Obstet 2005;272(4):261-4
- Kalogirou D., Antoniou G., Karakitsos P Botsis D., Papadimitriou A., Giannikos L.: Eur J Gynaecol Oncol 1997;18:188-9113.
- Coronel-Brizio P., Olivares Nowak J., Palafox Sanchez F.: Recurrence of high grade squamous intraepithelial lesions following hysterectomy. Ginecol Obstet Mex 1999;67:415-8
- 14. Schneider A., de Villiers E.M., Schneider V.: Multifocal squamous neoplasia of the female genital tract. Significance of uman papillomavirus infection of the vagina after hysterectomy. Obstet Gynecol 1987;70:294-8
- Sugase M., Matsukura T.: Distinct manifestations of human papillomaviruses in teh vagina. Int J Cancer 1997;72:412-5
- Srodon M., Stoler MH., Baber GB., Kurman R.J.: The distribution of low and high-risk HPV types in vulvar and vaginal intreapithelial neoplasia (VIN and VaIN). Am J Surg Pathol 2006;30(12):1513-8
- Hampl M., Sarajuuri H., Wentsen N., Bender H.G., Keuppers V.: Effect of human papillomavirus vaccines on vulvar, vaginal and anal intraepithelial lesions and vulvar cancer. Obstet Gynecol 2006;108(6):1361-8
- Logani S., Lu D., Quint W.G., Ellenson L.H., Pirog E.C.: Low grade vulvar and vaginal intraepithelial neoplasia: correlation of histologic features with human papillomavirus DNA detection and MIB1 immunostaining. Mod Pathol 2003;16:735-41
- Castle P.E., Rodriguez A.C., Porras C., Herrero R., Schiffman M., Gonzalez P., Hildesheim A., Burk R.D.: A comparison of cervical and vaginal human Papillomavirus. Sex Transm Dis 2007;34(11):849-55
- Barzon L., Pizzighella S., Corti L., Mengoli C., Palu G.: vaginal dysplastic lesions in women with hysterectomy and receving radiotherapy are linked to high-risk human papillomavirus. J Med Virol 2002;67:401-5
- Simpkins P.B., Chir B., Hull M.G.R.: Intraepithelial vaginal neoplasia following immuno-soppressive therapy treated with topical 5Fu. Obstet Gynecol 1975;46:360-4
- Sopracordevole F., Parin A.: Multifocalità delle lesioni squamose intraepiteliali del basso tratto anogenitale in donne HIV positive. In: Colposcopia e patologia cervico-vaginale,
- M.Peroni, R Piccoli, G Modana, G De Palo Eds, CIC Edizioni Internazionali Roma 1997, p 101-4
- Sopracordevole F.:Management delle lesioni preneoplastiche del tratto genitale inferiore in donne HIV positive. a P12-20_Articolo02.indd 18 8-08-2008 Gior It Ost Gin 2001;5:231–5
- Jamieson DJ., Paramsothy P., Cu-Uvin S., Duerr A., and HIV Epidemiology Research Study Group. Vulvar vaginal and perianal intraepithelial neoplasia in women with or at risk for human immunodeficiency virus. Obstet Ginecol 2006;107(5):1023-8
- Robboy S.J., Noller K.L., O’Brien P.: Increased incidence of cervical and
vaginal dysplasia in 3980 diethylstilbestrol-exposed young women. JAMA 1984;252:2979-83 - Hatch E.E., Herbst A.L., Hoover R.N., Noller K.L., Adam E., Kaufman R.H., Palmer J.R., Titus-Ernstoff L., Hyer M., Hartage P., Robboy S.J.: Incidence of squamous neoplasia of the cervix and vagina in women exposed prenatally to diethylstilbestrol.. Cancer Causes Control 2001;12:837-45
- Piscitelli J.T., Bastian L.A., Wilkes A., Simel D.L.: Cytologic screening after hysterectomy for benign disease. Am J Obstet Gynecol 1995;173:424-32 28. Massad LS: Outcomes after diagnosis of vaginal intraepithelial neoplasia. J Low Genit Tract Dis 2008;12(1):16-9
- Fanning J., Manahan K.J., McLean S.A.: Loop electrosurgical excision procedure for partial upper vaginectomy. Am J Obstet Gynecol 1999;181:1382-5
- Indermauer MD., Martino MA., Fiorica JV., Roberts WS., Hoffman MS.: Upper vaginectomy for the treatment of vaginal intraepithelial neoplasia. Am J Obstet Gynecol 2005;193(2):577-80
- Hoffman M.S., De Cesare S.L., Roberts W.S., Fiorica J.V., Finan M.A., Cavanagh D.: Upper vaginectomy for in situ and occult, superficially invasive carcinoma of the vagina. Am J Obstet Gynecol 1992;166:30-3
- Gonzales Sanchez J.L., Flores Murrieta G., Chavez Brambila J., Deolarte manzano J.M., Andrade Manzano A.F.: Topical 5-Fluorouracil for treatment of vaginal intraepithelial sms. Ginecol Obstet Mex 2002;70:244-7
- Yalcin O.T., Rutherford T.J., mChambers S.K., Chambers J.T., Schwartz P.E.: Vaginal intraepithelial neoplasia: treatment by carbon dioxe laser and risk factors for failure. Eur J Obstet Gynecol Reprod Biol 2003;106:64-8
- Hoffman M.S., Roberts W.S., La Polla J.P., Sterghos S., Cavanagh D.: Neoplasia in vaginal cuff epithelial inclusion cysts after hysterectomy. J Reprod Med 1989;34:412-414
- Noller K.L.: Screening for vaginal cancer. N Engl J Med 1996;335:1599-600
- Pearce K.F., Haefner H.K., Sarwar S.F., Nolan T.E.: Cytopathological findings on vaginal Papanicolaou smears after hysterectomy for benign gynecological disease. N Engl J Med 1996;335:1559-62
- Mouithys P., Papadopoulos C., Allier G., Lanta S., Delpierre C., Najas S., Boulanger J.C.: Is it necessary to make screening pap smears after hysterectomy? Gynecol Obstet Fertil 2003;31:620-3
- Coughlan C., McAuliffe F., Bermingham N., Glees N.: Vaginal cytology followiong primary hysterectomy for cervical cancer:is it useful? Ir J Med Sci 2006;175(1):45-9
- Davila R.M., Miranda M.C..: Vaginal intraepithelial neoplasia and the Pap smear. Acta Cytol 2000;44:13740
- Cheng D., Ng T.Y., Ngan H.Y., Wong L.C.: Wide local excision (WLE) for vaginal intraepithelial neoplasia (VaIN). Acta Obstet Gynecol Scand 1999;78:648-52
- Benedet J.L., Wilson P.S., Matisic J.P.: Epidermal thickness measurements in vaginal intraepithelial neoplasia: a basis for optimal CO2 laser vaporization. J Reprod Med 1992;37:809-12
- Powell J.L., Asbery D.S.: Treatment of vaginal dysplasia: just a simple loop electrosurgical excision procedure? Am J Obstet Gynecol 2000;182:731-2
- Hoffman M.S., Roberts W.S., La Polla J.P., Fiorica J.V., Cavanagh D.: Laser vaporization of grade three vaginal intraepithelial neoplasia. Am J Obstet Gynecol 1991;165:1342-4
- Sopracordevole F., Parin A.: Laser management of grade 2 and 3 vaginal intraepithelial neoplasia (VaIN). First European Congress of Colposcopy and Cervical Pathology, 1998, Dublin–Ireland. Book of Abstract, p 72
47. - Sillman F.H., Sedlis A., Boyce J.: 5-Fu/chemosurgery for difficult lower genital intraepithelial neoplasia. Contemp Obstet Gynecol 1985;27:79-101
- Lin H., Huang EY., Chang HY., ChangChien CC.: Therapeutic effect of topical applications of trichloroacetic acid for vaginal intraepithelial neoplasia after hysterectomy. Jpn J Clin Oncol 2005;35(11):651-4
- Sillman F.H., Sedlis A., Boyce J.: A review of lower genital intraepithelial neoplasia and the use of topical 5-fluorouracil. Obstet Gynecol Surv 1985;40:190-220
- Georgiev D, Karagozov I., Velev M., Makaveeva V.: Three cases of vaginal adenosis after topical 5 fluorouracil therapy for vaginal HPV asociated lesions. Akush Ginekol 2006;45:59-61
- Ogino I., Kitamura T., Okajima H., Matsubara S.: High-dose-rate intracavitary brachytherapy in the management of cervical and vaginal intraepithelial neoplasia. Int J Radiat Oncol Biol Phys 1998;40:881-7
- Fine BA., Piver MS., Mcauley M., Driscoll D.: The curative potential of radiation in the treatment of primary vaginal carcinoma. Am J Clin Oncol 1996;19:39-44
- Rock J.A.: Surgical condition of vagina and urethra. In Thompson J.D., Rock J.A. (Ed) Te Linde’s Opeerative Gynecology. Seventh Recurrence of high grade squamous intraepithelial neoplasia in neovagina: case report and review of the literature. Int J Gynecol Cancer 2005;15(6):1179-82
- Curtis P., Shepherd J.H., Lowe D.G., Jobling T.: Br J ObstetGynaecol edition. J.B. Lippincott Company 1989, p 1125-40.
54. Woodman C.B.J., Joran J.A., Wade-Evans T.: The management of vaginal intraepithelial neoplasia after hysterectomy. Br J Obstet Gynaecol
1984;91:707-11 - Monaghan J.M.: Vaginal Cancer. In: Surgical Gynecologic Onocology Burghardt E. Ed. Thieme Verlag, Berlin 1993, pag 171-84
- Graham K., Wright K., Cadwallader B., Reed NS., Symonds R.P.: 20-year retrospective reiew of medium dose rate intracavitary brachytherapy in VaIN3. Gynecol Oncol 2007;106(1):105-11
- Miller R.L., Gerster J.F., Owens M.L., Slade H.B., Tomai M.A.: Imiquimod
applied topically: a novel immune response modifier and new class of drug. Int J Immunopharmacol 1999;21:1-14 - Buck H.W., Guth K.J.: Treatment of vaginal intraepithelial neoplasia (primarily low grade) with imiquimod 5% cream. J Low Genit Tract Dis
2003;7(4):290-3 - Diakomanolis E., Haidopoulos D., Stefanidis K.: Treatment of high grade vaginal intraepithelial neoplasia with imiquimod cream. N Engl J Med 2002;347:374
- Haidopoulos D., Diakomanolis E., Rodolakis A., Voulgaris Z., Vlachos G., Intsaklis A.: Can local application of imiquimod cream be an alternative mode of therapy for patients with high grade intraepithelial lesions of the vagina? Int J Gynecol Cancer 2005;18:898-902
- Iavazzo C., Pitsouni E., Athanasiou S., Falagas ME: Imiquimod for treatment of vulvar and vaginal intraepithelial neoplasia. Int J Gynaecol Obstet 2008;101(1):3-10
- Robinson J.B., Sun C.C., Bodurka-Bevers D., Im D.D., Rosenshein N.B.: Cavitational ultrasonic surgical aspiration for treatment of vaginal intraepithelial neoplasia. Gynecol Oncol 2000;78:235-41
- von Gruenigen VE., Gibbons HE., Gibbins K., Jenison EL., Hopkins MP.: Surgical treatments for vulvar and vaginal dysplasia: a randomized controlled trial. Obstet Gynecol 2007;109(4):942-7
- Fehr M.K., Hornung R., Degen A., Schwarz V.A., Fink D., Haller U., Wyss P.: Photodynamic therapy of vulvar and vaginal condyloma and intraepithelial neoplasia using topically applied 5-aminolevulinic acid. Laser Surg Med 2002;30:273-9
- Joura EA, Leodalter S., Hernandez-Avila M., Wheeler CM, Perez G., Koutsky LA. et al.: Efficacy of quadrivalent prophylactic human papillomavirus (types 6,11,16,and 18) L1 virus like particle vaccine against high grade vulval and vaginal lesions: a combined analysis of three randomized clinical trias. Lancet 2007;369:1693-702
- Sopracordevole F., Parin A., Gardonio V., Quaranta M., Giorda G., De Piero G., Campagnutta E.: Laser terapia della neoplasia intraepiteliale genitale in donne HIV positive. In “Colposcopia e Patologia Cervico Vaginale S. Shonauer Ed, CIC Edizioni Internazionali Ed, Roma 1997, p 262-263
- Ait Menguellet S., Collinet P., Debarge V.H., Nayama M., Vinatier D., Leroy J.L. : Management of multicentric lesions of the lower genital tract. Eur J Obstet Gynecol Reprod Biol 2007;132(1):116-20
- Diakomanolis E., Rodolakis A., Boulgaris Z., Blachos G., Michalas S.: Treatment of vaginal intraepithelial neoplasia with laser ablation and upper vaginectomy. Gynecol Obstet Invest 2002;54:17-20
- Frega A., French D., Piazza J., Cereria A., Vetrano G., Moscarini M.: Prediction of persistent vaginal intraepithelial neoplasia in previously hysterectomized women by high risk HPV DNA detection. Cancer Lett 2007;249:(2)235-41
-
Youn Jn Choi, Soo Young Hur, Jong Sun Park, Keun Ho Iee: laparoscopic upper vaginectomy for post-hysterectomy high risk vaginal intraepithelial neoplasia and superficially invasive vaginal carcinoma. World J Surgical Oncol 2013;126,11
-
Stokes-Lampard H, Wilson S, Waddell C, Ryan A, Holder R, Kehoe S: Vaginal vault smears after hysterectomy for reasons other than malignancy: a systematic review of the literature. BJOG. 2006, 113: 1354-1365.
-
Fleisch MC, Hatch KD: Laparoscopic assisted parametrectomy/upper vaginectomy (LPUV)-technique, applications and results. Gynecol Oncol. 2005, 98: 420-426.
-
Geisler JP, Orr C, Manahan KJ: Robotically-assisted laparoscopic radical parametrectomy and radical vaginectomy. Eur J Gynaecol Oncol. 2011, 32: 674-676.
-
Mahdavi A, Shamshirsaz AA, Peiretti M, Zakashansky K, Idrees MT, Nezhat F: Laparoscopic management of vaginal clear cell adenocarcinoma arising in pelvic endometriosis: Case report and literature review. J Minim Invasive Gynecol. 2006, 13: 237-241.
-
Dodge JA, Eltabbakh GH, Mount SL, Walker RP, Morgan A. Clinical features and risk of recurrence among patients with vaginal intraepithelial neoplasia. Gynecol Oncol. 2001 Nov;83(2):363-9.
-
Risk factors for recurrence of vaginal intraepithelial neoplasia in the vaginal vault after laser vaporization. Kim HS, Park NH, Park IA, Park JH, Chung HH, Kim JW, Song YS, Kang SB.Lasers Surg Med. 2009 Mar; 41(3):196-202.
-
Kim HS, Park NH, Park IA, Park JH, Chung HH, Kim JW, Song YS, Kang SB.Lasers Surg Med. 2009 Mar; 41(3):196-202.
-
Robinson JB, Sun CC, Bodurka-Bevers D, Im DD, Rosenshein NB .Cavitational ultrasonic surgical aspiration for the treatment of vaginal intraepithelial neoplasia. Gynecol Oncol. 2000 Aug;78(2):235-41.
-
Li Z, Barron S, Hong W, Karunamurthy A, Zhao C. Surveillance for recurrent cancers and vaginal epithelial lesions in patients with invasive cervical cancer after hysterectomy: are vaginal cytology and high-risk human papillomavirus testing useful? Am J Clin Pathol. 2013;140(5):708–14.
-
Sopracordevole F, Mancioli F, Clemente N, De Piero G, Buttignol M, Giorda G, et al. Abnormal Pap smear and diagnosis of high-grade vaginal intraepithelial neoplasia: a retrospective cohort study. Medicine. 2015;94(42):e1827.
-
JT, Bastian LA, Wilkes A, Simel DL. Cytologic screening after hysterectomy for benign disease. Am J Obstet Gynecol. 1995;173(2):424–30.
-
Mouithys P, Papadopoulos C, Allier G, Lanta S, Delpierre C, Najas S, et al. Is it necessary to make screening Pap smears after hysterectomy? Gynecol Obstet Fertil. 2003;31(7–8):620–3.
-
Davila RM, Miranda MC. Vaginal intraepithelial neoplasia and the Pap smear. Acta Cytol. 2000;44(2):137–40.
-
CC, Nugent EK, Elfrink SH, Gold MA, Moore KN. A contemporary analysis of epidemiology and management of vaginal intraepithelial neoplasia. Am J Obstet Gynecol. 2013;208(5):410.e1–6.
-
Kalogirou D, Antoniou G, Karakitsos P, Botsis D, Papadimitriou A, Giannikos L. Vaginal intraepithelial neoplasia (VAIN) following hysterectomy in patients treated for carcinoma in situ of the cervix. Eur J Gynaecol Oncol. 1997;18(3):188–91.
-
Schockaert S, Poppe W, Arbyn M, Verguts T, Verguts J. Incidence of vaginal intraepithelial neoplasia after hysterectomy for cervical intraepithelial neoplasia: a retrospective study. Am J Obstet Gynecol. 2008;199(2):113.e1–5.
-
MacLeod C1, Fowler A, Dalrymple C, Atkinson K, Elliott P, Carter J.: High-dose-rate brachytherapy in the management of high-grade intraepithelial neoplasia of the vagina. Gynecol Oncol. 1997 Apr;65(1):74-7.
-
Graham K, Wright K, Cadwallader B, Reed NS, Symonds RP.Gynecol Oncol. 2007 Jul; 106(1):105-11. 20-year retrospective review of medium dose rate intracavitary brachytherapy in VAIN3.
-
Beriwal S, Heron DE, Mogus R, Edwards RP, Kelley JL, Sukumvanich P. High-dose rate brachytherapy (HDRB) for primary or recurrent cancer in the vagina. Radiat Oncol. 2008 Feb 13; 3:7. Epub 2008 Feb 13.
-
Blanchard P, Monnier L, Dumas I, Morice P, Pautier P, Duvillard P, Azoury F, Mazeron R, Haie-Meder C. Low-dose-rate definitive brachytherapy for high-grade vaginal intraepithelial neoplasia. Oncologist. 2011; 16(2):182-8. Epub 2011 Jan 24.