La mammografia è una radiografia per individuare la presenza di formazioni potenzialmente neoplastiche. L’indicazione alla mammografia può seguire alla palpazione di un nodulo in una mammella  o a segnali che richiedono un approfondimento diagnostico.
o a segnali che richiedono un approfondimento diagnostico.
La mammografia è inoltre effettuata come test di screening ogni 2 anni per le donne di 50-70 anni per evidenziare eventuali neoplasie prima che si manifestino clinicamente e che se inferiori a 1 cm sfuggono alla palpazione. Il vantaggio di una diagnosi precoce è evidente dal fatto che il 98% dei carcinomi mammari diagnosticati in fase precoce si risolva positivamente nei 5 anni successivi (1)
Prima dell’esame non occorre nessuna particolare preparazione. Alcuni studi suggeriscono che l’indagine potrebbe essere più efficace se effettuata nella prima fase (fase follicolare) del ciclo mestruale.
TECNICA DI ESECUZIONE
La compressione permette di uniformare il tessuto mammario per aumentare la qualità dell’immagine, in quanto la riduzione dello spessore del tessuto che i raggi X devono penetrare fa diminuire la quantità di radiazione diffusa, responsabile della degradazione del risultato. Questo comporta inoltre la diminuzione della dose necessaria di radiazioni e degli artefatti da movimento. In mammografia di screening, vengono realizzate due proiezioni della mammella: una cranio-caudale (CC) e una angolata (obliqua medio-laterale, OML). La mammografia diagnostica può includere queste e altre proiezioni, comprese quelle ingrandite per lo studio e l’approfondimento di particolari. 
A) MAMMOGRAFIA TRADIZIONALE – I mammografi tradizionali utilizzano una normale pellicola radiografica che viene impressionata dal passaggio dei raggi X attraverso la mammella.
Oggi è invece possibile trovare mammografi che sfruttano la tecnica digitale (DM) per ottenere una valutazione più precisa, più sicura ed affidabile e riducono notevolmente la quantità di radiazione necessaria.
B) MAMMOGRAFIA DIGITALE – La mammografia digitale (DM) detta anche mammografia digitale a campo pieno, full-field digital mammography (DMFF) è una tecnica di imaging non invasiva che presenta una relativamente bassa esposizione alla radiazione ionizzante, utilizzata in ambito medico per lo screening e la diagnosi dei tumori alla mammella. E’ un sistema mammografico in cui la pellicola a raggi X viene sostituita da rilevatori a stato solido che convertono i raggi X in segnali elettrici. Questi rilevatori sono simili a quelli che si trovano nelle fotocamere digitali. I segnali elettrici vengono utilizzati per produrre immagini della mammella che possono essere visualizzate sullo schermo di un computer o stampate su una pellicola speciale simile alle mammografie convenzionali.
Tuttavia la natura bidimensionale della mammografia evidenzia alcuni problemi; in particolare del tessuto ghiandolare denso sopra o sotto una lesione può ridurne la visibilità nella proiezione (aumentando il numero di falsi negativi). Inoltre due regioni normali separate solo verticalmente possono risultare sovrapposte nella proiezione apparendo come una lesione (aumentando il numero di falsi positivi). La mammografia infatti acquisisce una proiezione 2D di un oggetto tridimensionale [16]. Per tale motivo si va sempre più utilizzando la tomosintesi digitale.
C) MAMMOGRAFIA 3D CON TOMOSINTESI – La mammografia 3D con tomosintesi è una tecnica di tomografia radiologica in grado di rilevare con una significativa accuratezza diagnostica, lesioni neoplastiche mammarie anche di dimensioni assai ridotte con un’efficacia doppia rispetto alla consueta mammografia tradizionale. La mammografia con tomosintesi 3D combina immagini convenzionali acquisite a due dimensioni con immagini tridimensionali multistrato rilevate da una apparecchiatura – la tomosintesi – che, anziché restare statica, ruota intorno alla mammella della paziente (2-17). 
Fig. 1 . (AB) Le viste CC e (CD) MLO per DM mostrano tessuti mammari eterogenei con lesione di massa arrotondata mal definita del seno destro nella zona posteriore profonda della regione retro-areolare evidente solo nella vista CC con il seno sinistro che mostra un ispessimento cutaneo diffuso [BI-RADS 0] – (EF) CC e (GH) MLO Le viste DBT che mostrano il seno destro due lesioni di massa ben definite circondate da alone radiotrasparente evidente sia in CC che in MLO con il seno sinistro mostrano un ispessimento cutaneo diffuso con l’area del quadrante esterno superiore di distorsione architettonica [BI -RADS V] – (I) US che mostra il seno destro 8:00 cisti semplice senza eco a parete sottile (J) uno simile è visto alle 6:00 – (K) seno sinistro 2:00 lesione di massa alta ipodensa spicolata [ BI-RADS V].
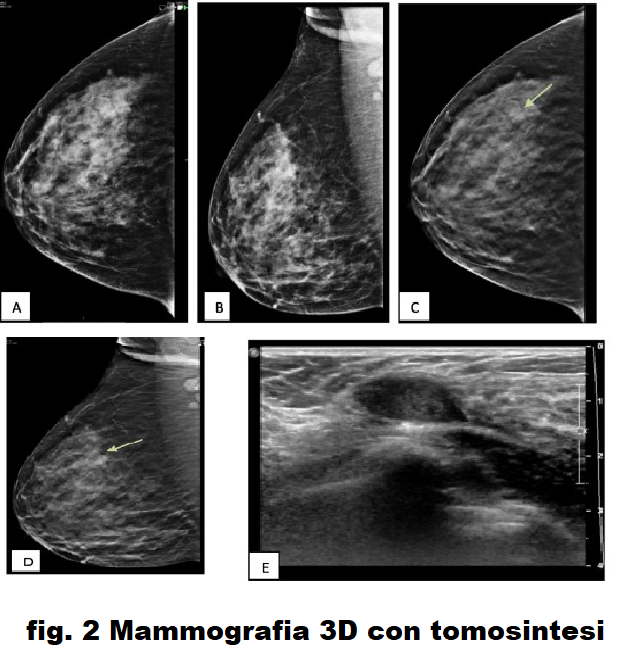
Fig. 2 . [AB] CC e MLO DM del seno destro che mostra tessuti mammari eterogenei [BI-RADS 0], [CD] CC e MLO di DBT della mammella destra mostrano una massa ben definita nel quadrante esterno superiore circondato da alone radiotrasparente [BI -RADS II], [E] US che mostra una massa ovale ben definita parallela alla pelle alle 9:00 [BI-RADS II].
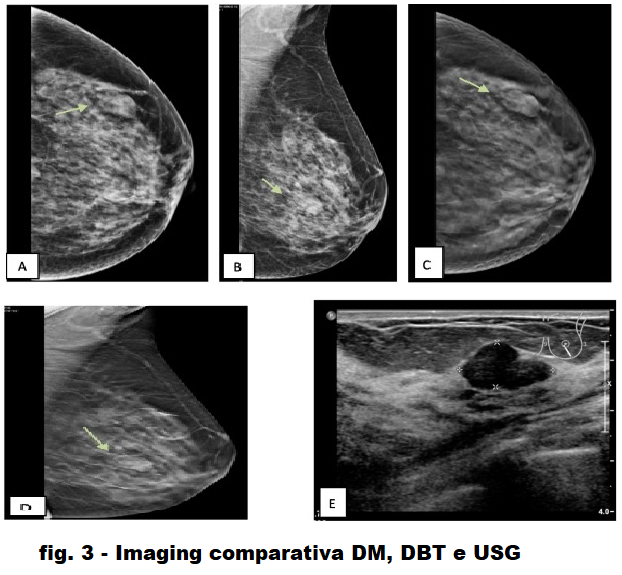
Fig. 3 . [AB] CC & MLO DM della mammella sx che mostra una massa ovale ad alta densità nel quadrante esterno inferiore con margine posteriore indistinto BI-RADS III], [CD] CC & MLO DBT mostra una massa ben definita circondata da alone radiotrasparente [BI- RADS II], [E] US che mostra una massa macrolobolata ben definita alle 5:00 in punto [BI-RADS II].
MODALITA’ DI IMAGING: VALUTAZIONE COMPARATIVA – confrontando l’accuratezza della mammografia digitale (DM), della tomosintesi mammaria digitale (DBT), dell’ecografia (USG) e della risonanza magnetica (MRI) per la valutazione preoperatoria delle dimensioni del cancro al seno. Il coefficiente di correlazione di Pearson è stato calcolato per ciascuna modalità di imaging. Conclusioni: DBT e MRI sono superiori a DM e USG nella valutazione preoperatoria delle dimensioni del tumore al seno. La DBT sembra migliorare l’accuratezza del DM, sebbene la risonanza magnetica rimanga la modalità di imaging più accurata per l’estensione del cancro al seno.
References:
- O.Olsen, P.Gøtzsche e Peter C Gøtzsche, Cochrane review on screening for breast cancer with mammography, in The Lancet, vol. 358, n. 9290, 2000, pp. 1340–134
-
Pisano ED, Yaffe MJ. Breast cancer screening: should tomosynthesis replace digital mammography? JAMA. 2014;311(24):2488-2489.
-
Faris O, Shuren J. An FDA viewpoint on unique considerations for medical-device clinical trials. N Engl J Med. 2017;376(14):1350-1357.
-
Morrison TM, Dreher ML, Nagaraja S, Angelone LM, Kainz W. The role of computational modeling and simulation in the total product life cycle of peripheral vascular devices. J Med Device. 2017;11(2):024503.
-
Van Metter R, Dillon PLP, Huff KE, Rabbani M. Computer simulation of radiographic screen-film images. Paper presented at: Application of Optical Instrumentation in Medicine XIV and Picture Archiving and Communication Systems (PACS IV) for Medical Applications; 1986; Newport Beach, CA.
-
Burgess AE, Wagner RF, Jennings RJ, Barlow HB. Efficiency of human visual signal discrimination. Science. 1981;214(4516):93-94.
-
Jafroudi H, Muntz EP, Bernstein H, Jennings RJ. Multiparameter optimization of mammography: an update. In: Fullerton GD, Mulvaney JA, Haus AG, Properzio WS, eds. SPIE Proceedings Vol 0347: Application of Optical Instrumentation in Medicine X. Bellingham, WA: SPIE; 1982.
-
Sturgeon GM, Park S, Segars WP, Lo JY. Synthetic breast phantoms from patient based eigenbreasts. Med Phys. 2017;44(12):6270-6279.
-
de Sisternes L, Brankov JG, Zysk AM, Schmidt RA, Nishikawa RM, Wernick MN. A computational model to generate simulated three-dimensional breast masses. Med Phys. 2015;42(2):1098-1118.
-
Fang Y, Badal A, Allec N, Karim KS, Badano A. Spatiotemporal Monte Carlo transport methods in x-ray semiconductor detectors: application to pulse-height spectroscopy in a-Se. Med Phys. 2012;39(1):308-319.
-
Young S, Bakic PR, Myers KJ, Jennings RJ, Park S. A virtual trial framework for quantifying the detectability of masses in breast tomosynthesis projection data. Med Phys. 2013;40(5):051914.
-
Abbey CK, Barrett HH. Human- and model-observer performance in ramp-spectrum noise: effects of regularization and object variability. J Opt Soc Am A Opt Image Sci Vis. 2001;18(3):473-488.
-
Gong X, Glick SJ, Liu B, Vedula AA, Thacker S. A computer simulation study comparing lesion detection accuracy with digital mammography, breast tomosynthesis, and cone-beam CT breast imaging. Med Phys. 2006;33(4):1041-1052.
-
Zeng R, Park S, Bakic P, Myers KJ. Evaluating the sensitivity of the optimization of acquisition geometry to the choice of reconstruction algorithm in digital breast tomosynthesis through a simulation study. Phys Med Biol. 2015;60(3):1259-1288.
-
Badal A, Badano A. Accelerating Monte Carlo simulations of photon transport in a voxelized geometry using a massively parallel graphics processing unit. Med Phys. 2009;36(11):4878-4880.
-
Zhao B, Zhou J, Hu YH, Mertelmeier T, Ludwig J, Zhao W. Experimental validation of a three-dimensional linear system model for breast tomosynthesis. Med Phys. 2009;36(1):240-251.
-
Mackenzie A, Marshall NW, Hadjipanteli A, Dance DR, Bosmans H, Young KC. Characterisation of noise and sharpness of images from four digital breast tomosynthesis systems for simulation of images for virtual clinical trials. Phys Med Biol. 2017;62(6):2376-2397.