Sarcoma mammario indotto da radioterapia
di Tatjana Volpicelli
Il sarcoma mammario indotto da radiazioni (RIS) è una rara e aggressiva neoplasia con prognosi infausta,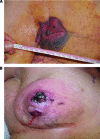 che quasi sempre insorge in giovani donne precedentemente trattate con chirurgia non demolitiva e radioterapia adiuvante per ca. mammario primitivo (1,2). I criteri generalmente accettati di RIS sono quelli proposti da Cahan (3) e modificati da Arlen et al (4):
che quasi sempre insorge in giovani donne precedentemente trattate con chirurgia non demolitiva e radioterapia adiuvante per ca. mammario primitivo (1,2). I criteri generalmente accettati di RIS sono quelli proposti da Cahan (3) e modificati da Arlen et al (4):
- trattamento con irradiazione terapeutica almeno tre anni prima dello sviluppo del sarcoma
- sarcoma che si manifesta nel campo della precedente irradiazione terapeutica
- istologia differente tra il RIS e il tumore primario trattato con radioterapia.
Il periodo di tempo che intercorre tra l’esposizione alle radiazioni e la formazione del sarcoma è il criterio principale che è stato modificato dalla maggior parte degli investigatori. È stato recentemente (2010) suggerito dal team del sarcoma al Memorial Sloan Kettering Cancer Center (MSKCC) che una latenza di sei mesi è sufficiente per affermare la diagnosi di RIS (5) in contrasto con il periodo generalmente accettato di diversi anni.
FREQUENZA: il tasso di sarcoma della mammella precedentemente irradiata è 0,02-0.5% dopo 10 anni. La loro incidenza è in aumento grazie all’aumentata sopravvivenza delle pazienti affette da sarcoma primario dopo trattamento di radioterapia; ciò costituisce una vera e propria sfida terapeutica. Si sviluppano, in genere, dopo un periodo medio di latenza (6,7).
ETIOLOGIA E FATTORI DI RISCHIO: Il fattore di rischio principale è la radioterapia con effetto dose-risposta tra la quantità di radiazioni e il rischio di RIS. Tuttavia, il rischio complessivo per RIS è accettabile rispetto al potenziale beneficio della radioterapia. Altri fattori di rischio è la concomitante somministrazione di chemioterapia con agenti alchilanti. Altri fattori di rischio sono costituiti da giovane età (età media 30 anni), mutazioni della proteina p53 (Li-Fraumeni Syndrome, LFS), mutazioni BRCA, e familiarità (8-31).
CLASSIFICAZIONE ISTOLOGICA: i RIS comprendono diversi sottotipi istologici; il più frequente è l’angiosarcoma della mammella post-irradiazione e trattamento conservativo per il cancro mammario (breast angiosarcoma post-radiation and breast-conserving therapy, BAPBCT), raro e aggressivo tumore dell’endotelio vascolare. L’angiosarcoma può insorgere spontaneamente o essere secondario a radioterapia (32-43). L’associazione di linfedema e angiosarcoma costituisce la Sindrome di Stewart-Treves; recentemente, questa dizione si riserva ad angiosarcomi secondario a linfedema cronico di varia natura (57-59). Altri sottotipi istologici sono l’Istiocitoma Fibroso Maligno (IFM), una entità controversa che raggruppa sarcomi pleomorfi indifferenziati non altrimenti specificati, il leiomiosarcoma e il fibrosarcoma. Alcune pazienti sviluppano aree di proliferazione vascolare atipica (AVP) che non soddisfano i criteri patologici per porre diagnosi di angiosarcoma, ma possono rappresentare lesioni precancerose o angiosarcomi incipienti. Queste alterazioni vascolari usualmente si manifestano come papule color carne o placche eritematose, che insorgono sulla cute irradiata. L’attuale raccomandazione è che tali lesioni siano completamente asportate e la paziente sottoposto a prolungato monitoraggio (44-47).
PROGNOSI: La sopravvivenza a 5 anni dei RIS varia dal 17 al 58% (38-40). le grandi dimensioni e la positività dei margini di resezione, dopo l’asportazione chirurgica, sono responsabili di un alto indice di recidiva e bassa sopravvivenza (48-56).
DIAGNOSI:
- Esame obiettivo: come per altre neoplasie mammarie, il RIS viene diagnosticato mediante esame fisico della paziente. Nell’area mammaria, precedentemente (7-10 anni) trattata per ca. mammario, si evidenziano una o più masse del diametro di 1-30 cm (media 8 cm), a rapido accrescimento, di
 consistenza fibrosa, scarsamente mobile sulla sua sede di impianto. La cute si presenta ispessita e con chiazze di colore rosso-viola (17-27). Tuttavia, le alterazioni cutanee e la fibrosi non sono patognomoniche essendo tipiche di tutte le aree cutanee irradiate (49-51).
consistenza fibrosa, scarsamente mobile sulla sua sede di impianto. La cute si presenta ispessita e con chiazze di colore rosso-viola (17-27). Tuttavia, le alterazioni cutanee e la fibrosi non sono patognomoniche essendo tipiche di tutte le aree cutanee irradiate (49-51). - RMN, TAC: la Risonanza Magnetica Nucleare e la Tomografia Assiale Computerizzata (TAC) rappresentano le metodiche di scelta per valutare e monitorare i RIS, o per identificare l’eventuale diffusione a distanza della malattia. Le caratteristiche radiologiche dei RIS però non sono patognomoniche e possono comportare difficoltà di interpretazione fra RIS o semplice recidiva della precedente lesione neoplastica (52,53,60).
- Biopsia escissionale: è obbligatoria per confermare la diagnosi di RIS; essa permetterà di distinguere un nuovo sarcoma dalla recidiva della precedente neoplasia o da esiti post-chirurgici o post-attinici. Il campione bioptico deve essere prelevato dall’area più scura e più infiltrata.
TERAPIA:
- La chirurgia rimane il trattamento di prima scelta nelle forme localizzate e richiede spesso un approccio aggressivo con margini (2-4 cm) istologicamente negativi (R0). La precedente irradiazione altera i piani anatomici ostacolando il chirurgo nella definizione dei margini reali. Questo rinforza ulteriormente la necessità di una chirurgia precoce, aggressiva e ampia, specialmente se si considera che margini chirurgici positivi possono ridurre la sopravvivenza di circa il 50% (38-50).
- Radioterapia: Nuove tecnologie, come la radioterapia ad intensità modulata (IMRT), comportano l’utilizzo di più campi e, conseguentemente, espongono i tessuti normali a basse dosi di radiazioni. Per erogare una dose specifica al centro del tumore, la IMRT richiede una più lunga esposizione, con maggiore dosaggio di radiazioni. E’ stato pertanto stimato che l’incidenza di RIS possa aumentare dello 0,5% con la IMRT. I tumori BAPBCT hanno un alto tasso di crescita, che li rende più propensi a ripopolare tra le frazioni giornaliere di radioterapia. L’uso di più frazioni giornaliere potrebbe quindi impedire il verificarsi del ripopolamento. Inoltre occorre notare che la radioterapia è spesso impossibile a causa della limitata funzionalità del midollo osseo (61,62).
- Chemioterapia: il ruolo della chemioterapia rimane ambiguo per la discordanza dei risultati riportati in letteratura. Per la malattia metastatica, una chemioterapia palliativa, con il singolo agente doxorubicina, rimane il trattamento di scelta per la maggior parte dei RIS. Il paclitaxel e farmaci antiangiogenetici come il sorafenib e il sunitinib hanno mostrato qualche efficacia negli angiosarcomi (39). La trabectedina (ET-743) è un nuovo composto che agisce inibendo il passaggio del ciclo cellulare dalla fase G2 alla fase M. Rappresenta un’opzione interessante nei RIS, particolarmente per i pazienti che hanno ricevuto un trattamento con antracicline per la neoplasia primaria, come ad esempio nel caso di linfomi e carcinoma mammario.La chemioterapia può essere somministrata con intento neoadiuvante, prima del trattamento chirurgico, per migliorare il controllo locale ed eradicare eventuali micrometastasi (40-47).
- Prevenzione RIS: i programmi di screening di massa per il cancro della mammella hanno permesso, in molti casi, di diagnosticare il tumore in fase precoce così da evitare del tutto la terapia radiante o almeno limitarla a dosi <14 Gy. La radioterapia adiuvante nella terapia del ca. mammario dovrebbe essere evitata nei casi in cui l’efficacia è dubbia.
Dr. Tatjana Volpicelli
References:
- Fisher ER, Anderson S, Redmond C, et al. Ipsilateral breast tumor recurrence and survival following lumpectomy and irradiation: Pathological findings from NSABP protocol B-06. Semin Surg Oncol. 1992;8:161–166.
- Yap J, Chuba PJ, Thomas R, et al. Sarcoma as a second malignancy after treatment for breast cancer. Int J Radiat Oncol Biol Phys. 2002;52:1231–1237.
- Cahan, W. G., Woodard, H. Q., and et al. Sarcoma arising in irradiated bone; report of 11 cases. Cancer, 1: 3-29, 1948.
- Arlen, M., Higinbotham, N. L., Huvos, A. G., Marcove, R. C., Miller, T., and Shah, I. C. Radiation-induced sarcoma of bone. Cancer, 28: 1087-1099, 1971.
- Gladdy, R. A., Qin, L. X., Moraco, N., Edgar, M. A., Antonescu, C. R., Alektiar, K. M., Brennan, M. F., and Singer, S. Do radiation-associated soft tissue sarcomas have the same prognosis as sporadic soft tissue sarcomas? J Clin Oncol, 2010;28:2064-2069.
- Penel N, Grosjean J, Robin YM, et al. Frequency of certain established risk factors in soft tissue sarcomas in adults: A prospective descriptive study of 658 cases. Sarcoma. 2008;2008:459386.
- Zucali R, Merson M, Placucci M, et al. Soft tissue sarcoma of the breast after conservative surgery and irradiation for early mammary cancer. Radiother Oncol. 1994;30:271–273.
- Virtanen, A., Pukkala, E., and Auvinen, A. Incidence of bone and soft tissue sarcoma after radiotherapy: a cohort study of 295,712 Finnish cancer patients. Int J Cancer, 118: 1017-1021, 2006.
- Barrow BJ, Janjan NA, Gutman H, et al. Role of radiotherapy in sarcoma of the breast—a retrospective review of the M.D. Anderson experience. Radiother Oncol. 1999;52:173–178.
- Menu-Branthomme, A., Rubino, C., Shamsaldin, A., Hawkins, M. M., Grimaud, E., Dondon, M. G., Hardiman, C., Vassal, G., Campbell, S., Panis, X., Daly-Schveitzer, N., Lagrange, J. L., Zucker, J. M., Chavaudra, J., Hartman, O., and de Vathaire, F. Radiation dose, chemotherapy and risk of soft tissue sarcoma after solid tumours during childhood. Int J Cancer, 110: 87-93, 2004.
- Hawkins, M. M., Wilson, L. M., Burton, H. S., Potok, M. H., Winter, D. L., Marsden, H. B., and Stovall, M. A. Radiotherapy, alkylating agents, and risk of bone cancer after childhood cancer. J Natl Cancer Inst, 88: 270-278, 1996.
- Moppett, J., Oakhill, A., and Duncan, A. W. Second malignancies in children: the usual suspects? Eur J Radiol, 37: 95-108, 2001.
- Rubino C, Shamsaldin A, Lê MG, et al. Radiation dose and risk of soft tissue and bone sarcoma after breast cancer treatment. Breast Cancer Res Treat. 2005;89:277–288.
- Holt GE, Thomson AB, Griffin AM, et al. Multifocality and multifocal postradiation sarcomas. Clin Orthop Relat Res. 2006;450:67–75.
- Karlsson P, Holmberg E, Samuelsson A, et al. Soft tissue sarcoma after treatment for breast cancer—a Swedish population-based study. Eur J Cancer. 1998;34:2068–2075.
- Tahir M, Hendry P, Baird L, et al. Radiation induced angiosarcoma a sequela of radiotherapy for breast cancer following conservative surgery. Int Semin Surg Oncol. 2006;3:26.
- Fisher B, Anderson SJ. The breast cancer alternative hypothesis: Is there evidence to justify replacing it? J Clin Oncol. 2010;28:366–374.
- Smith BD, Pan IW, Shih YC, et al. Adoption of intensity-modulated radiation therapy for breast cancer in the United States. J Natl Cancer Inst. 2011;103:798–809.
- Krueger EA, Fraass BA, McShan DL, et al. Potential gains for irradiation of chest wall and regional nodes with intensity modulated radiotherapy. Int J Radiat Oncol Biol Phys. 2003;56:1023–1037.
- Pignol JP, Olivotto I, Rakovitch E, et al. A multicenter randomized trial of breast intensity-modulated radiation therapy to reduce acute radiation dermatitis. J Clin Oncol. 2008;26:2085–2092.
- Li FP, Fraumeni JF Jr: Soft-tissue sarcomas, breast cancer, and other neoplasms. A familial syndrome? Ann Intern Med 1969, 71: 747-752.
- Gonzalez KD, Noltner KA, Buzin CH, et al.: Beyond Li Fraumeni Syndrome: clinical characteristics of families with p53 germline mutations. J Clin Oncol 2009, 27: 1250-1256. 10.1200/JCO.2008.16.6959
- Varley JM: Germline TP53 mutations and Li-Fraumeni syndrome. Hum Mutat 2003, 21: 313-320. 10.1002/humu.10185
- Olivier M, Goldgar DE, Sodha N, et al.: Li-Fraumeni and related syndromes: correlation between tumor type, family structure, and TP53 genotype.
- Varley J, Haber DA: Familial breast cancer and the hCHK2 1100delC mutation: assessing cancer risk. Breast Cancer Res 2003, 5: 123-125. 10.1186/bcr582
- Bollet MA, Sigal-Zafrani B, Mazeau V, et al.: Age remains the first prognostic factor for loco-regional breast cancer recurrence in young ( < 40 years) women treated with breast conserving surgery first. Radiother Oncol 2007, 82: 272-280. 10.1016/j.radonc.2007.01.001View ArticlePubMedGoogle Scholar
- Prise en charge du cancer du sein infiltrant de la femme non ménopausée Oncologie 2009, 11: 507-532. 10.1007/s10269-009-1818-6Google Scholar
- Livasy CA, Karaca G, Nanda R, et al.: Phenotypic evaluation of the basal-like subtype of invasive breast carcinoma. Mod Pathol 2006, 19: 264-271. 10.1038/modpathol.3800528
- Delia D, Goi K, Mizutani S, et al.: Dissociation between cell cycle arrest and apoptosis can occur in Li-Fraumeni cells heterozygous for p53 gene mutations. Oncogene 1997, 14: 2137-2147. 10.1038/sj.onc.1201050
- Mitchel RE, Jackson JS, Carlisle SM: Upper dose thresholds for radiation-induced adaptive response against cancer in high-dose-exposed, cancer-prone, radiation-sensitive Trp53 heterozygous mice. Radiat Res 2004, 162: 20-30. 10.1667/RR3190
- owble BL, Schultz DJ, Overmoyer B, et al.: The influence of young age on outcome in early stage breast cancer. Int J Radiat Oncol Biol Phys 1994, 30: 23-33.
- Mitchel RE, Jackson JS, Carlisle SM: Upper dose thresholds for radiation-induced adaptive response against cancer in high-dose-exposed, cancer-prone, radiation-sensitive Trp53 heterozygous mice. Radiat Res 2004, 162: 20-30. 10.1667/RR3190
- Strobbe LJ, Peterse HL, van Tinteren H, et al. Angiosarcoma of the breast after conservation therapy for invasive cancer, the incidence and outcome. An unforseen sequela. Breast Cancer Res Treat. 1998;47:101–109.
- Sessions SC, Smink RD., Jr Cutaneous angiosarcoma of the breast after segmental mastectomy and radiation therapy. Arch Surg. 1992;127:1362–1363.
- Tahir M, Hendry P, Baird L, et al. Radiation induced angiosarcoma a sequela of radiotherapy for breast cancer following conservative surgery. Int Semin Surg Oncol. 2006;3:26.
- Bolin DJ, Lukas GM. Low-grade dermal angiosarcoma of the breast following radiotherapy. Am Surg. 1996;62:668–672.
- West JG, Qureshi A, West JE, et al. Risk of angiosarcoma following breast conservation: A clinical alert. Breast J. 2005;11:115–123.
- Moore A, Hendon A, Hester M, et al. Secondary angiosarcoma of the breast: Can imaging findings aid in the diagnosis? Breast J. 2008;14:293–298.
- Hanasono MM, Osborne MP, Dielubanza EJ, et al. Radiation-induced angiosarcoma after mastectomy and TRAM flap breast reconstruction. Ann Plast Surg. 2005;54:211–214.
- Rao J, Dekoven JG, Beatty JD, et al. Cutaneous angiosarcoma as a delayed complication of radiation therapy for carcinoma of the breast. J Am Acad Dermatol. 2003;49:532–538.
- Deutsch M, Rosenstein MM. Angiosarcoma of the breast mimicking radiation dermatitis arising after lumpectomy and breast irradiation: A case report. Am J Clin Oncol. 1998;21:608–609.
- Majeski J, Austin RM, Fitzgerald RH. Cutaneous angiosarcoma in an irradiated breast after breast conservation therapy for cancer: Association with chronic breast lymphedema. J Surg Oncol. 2000;74:208–212. discussion 212–213.
- Roukema JA, Leenen LP, Kuizinga MC, et al. Angiosarcoma of the irradiated breast: A new problem after breast conserving therapy? Neth J Surg. 1991;43:114–116.
- Autio P, Kariniemi AL. Angiosarcoma. A rare secondary malignancy after breast cancer treatment. Eur J Dermatol. 1999;9:118–121
- Bjerkehagen, B., Smeland, S., Walberg, L., Skjeldal, S., Hall, K. S., Nesland, J. M., Smastuen, M. C., Fossa, S. D., and Saeter, G. Radiation-induced sarcoma: 25-year experience from the Norwegian Radium Hospital. Acta Oncol, 47: 1475-1482, 2008.
- Wiklund, T. A., Blomqvist, C. P., Raty, J., Elomaa, I., Rissanen, P., and Miettinen, M. Postirradiation sarcoma. Analysis of a nationwide cancer registry material. Cancer, 68: 524-531, 1991.
- Patton, K. T., Deyrup, A. T., and Weiss, S. W. Atypical vascular lesions after surgery and radiation of the breast: a clinicopathologic study of 32 cases analyzing histologic heterogeneity and association with angiosarcoma. Am J Surg Pathol, 32: 943-950, 2008.
- Gengler, C., Coindre, J. M., Leroux, A., Trassard, M., Ranchere-Vince, D., Valo, I., Michels, J. J., and Guillou, L. Vascular proliferations of the skin after radiation therapy for breast cancer: clinicopathologic analysis of a series in favor of a benign process: a study from the French Sarcoma Group. Cancer, 109: 1584-1598, 2007.
- Penel, N., Marreaud, S., Robin, Y. M., and Hohenberger, P. Angiosarcoma: State of the art and perspectives. Crit Rev Oncol Hematol.
- Rosen PP, Kimmel M, Ernsberger D. Mammary angiosarcoma. The prognostic significance of tumor differentiation. Cancer. 1988;62:2145–2151.
- Marchal C, Weber B, de Lafontan B, et al. Nine breast angiosarcomas after conservative treatment for breast carcinoma: A survey from French Comprehensive Cancer Centers. Int J Radiat Oncol Biol Phys. 1999;44:113–119.
- Murray EM, Werner D, Greeff EA, Taylor DA. Postradiation sarcomas: 20 cases and a literature review. Int J Radiat Oncol Biol Phys. 1999;45:951–961.
- Yap J, Chuba PJ, Thomas R, Aref A, Lucas D, Severson RK, et al. Sarcoma as a second malignancy after treatment for breast cancer. Int J Radiat Oncol Biol Phys. 2002;52:1231–1237.
- Sheth GR, Cranmer LD, Smith BD, Grasso-Lebeau L, Lang JE. Radiation-induced sarcoma of the breast: a systematic review. Oncologist. 2012;17:405–418.
- Jung YS, Na KY, Kim KS, Ahn SH, Lee SJ, Park HK, et al. Nation-wide Korean breast cancer data from 2008 using the breast cancer registration program. J Breast Cancer. 2011;14:229–236.
- Sheppard DG, Libshitz HI. Post-radiation sarcomas: a review of the clinical and imaging features in 63 cases. Clin Radiol. 2001 Jan; 56(1):22-9.
- Fayette, J., Martin, E., Piperno-Neumann, S., Le Cesne, A., Robert, C., Bonvalot, S., Ranchere, D., Pouillart, P., Coindre, J. M., and Blay, J. Y. Angiosarcomas, a heterogeneous group of sarcomas with specific behavior depending on primary site: a retrospective study of 161 cases. Ann Oncol, 18: 2030-2036, 2007.
- Abbott, R. and Palmieri, C. Angiosarcoma of the breast following surgery and radiotherapy for breast cancer. Nat Clin Pract Oncol, 5: 727-736, 2008.
-
Bianchi L, Iraci S, Hagman J, Campione E, Soda R, Orlandi A, Nini G:Sindrome di Stewart-Treves. Descrizione di un caso. Giorn. It di Derm e Vener. 1999;134(6):635-638
- Sheppard, D. G. and Libshitz, H. I. Post-radiation sarcomas: a review of the clinical and imaging features in 63 cases. Clin Radiol, 56: 22-29, 2001.
- Abbott, R. and Palmieri, C. Angiosarcoma of the breast following surgery and radiotherapy for breast cancer. Nat Clin Pract Oncol, 5: 727-736, 2008.
- Kasperts, N., Slotman, B. J., Leemans, C. R., de Bree, R., Doornaert, P., and Langendijk, J. A. Results of postoperative reirradiation for recurrent or second primary head and neck carcinoma. Cancer, 106: 1536-1547, 2006.

