S. dell’ipoplasia ovarica congenita o acquisita (46,XX): è un evento raro con una frequenza sconosciuta. La nostra conoscenza di questa anomalia dello sviluppo è limitata e si basa principalmente su casi clinici.
DIAGNOSTICA – L’ipoplasia ovarica è generalmente asintomatica; è più comunemente diagnosticata in corso di laparoscopia eseguita per altre indicazioni.
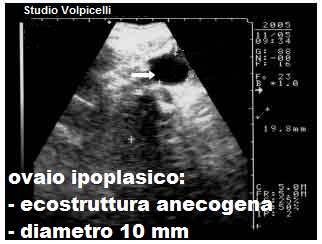
USG: l’ovaio congenitamente ipoplasico presenta un diametro longitudinale <1,5 cm, diametri trasverso e anteroposteriore <1 cm e volume <2. 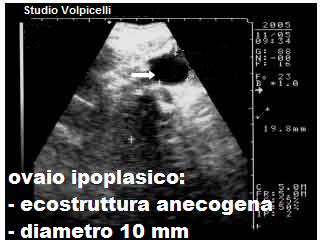 cm3, con assenza di follicoli o un numero di follicoli molto ridotto rispetto alla norma (nell’ovaio normale, in fase follicolare precoce, si evidenziano 4-6 follicoli secondari del diametro di 4-6 mm). Ma possono anche riscontrarsi follicoli terziari e pre-ovulatori. Spesso l’ovaio ipoplasico si presenta come una cisti del Morgagni, una piccola formazione rotondeggiante a superficie liscia e contenuto prevalentemente acquoso con scarso connettivo fibrillare. L’ovaio ipoplasico acquisito in genere presenta diametri ai limiti inferiori della norma, ecostruttura normo/iperecogenica, piatta, senza follicoli, corpi lutei o albicans. Talora le ovaie possono presentarsi, oltre che ipoplasiche, sclerocistiche con un pattern microscopico simile a quello delle “ovaie di Stein-Leventhal“, con follicoli, cisti follicolari e ipertecosi perifollicolare. L’ipoplasia ovarica congenita spesso si associa ad ipoplasia della tuba omolaterale (1-3).
cm3, con assenza di follicoli o un numero di follicoli molto ridotto rispetto alla norma (nell’ovaio normale, in fase follicolare precoce, si evidenziano 4-6 follicoli secondari del diametro di 4-6 mm). Ma possono anche riscontrarsi follicoli terziari e pre-ovulatori. Spesso l’ovaio ipoplasico si presenta come una cisti del Morgagni, una piccola formazione rotondeggiante a superficie liscia e contenuto prevalentemente acquoso con scarso connettivo fibrillare. L’ovaio ipoplasico acquisito in genere presenta diametri ai limiti inferiori della norma, ecostruttura normo/iperecogenica, piatta, senza follicoli, corpi lutei o albicans. Talora le ovaie possono presentarsi, oltre che ipoplasiche, sclerocistiche con un pattern microscopico simile a quello delle “ovaie di Stein-Leventhal“, con follicoli, cisti follicolari e ipertecosi perifollicolare. L’ipoplasia ovarica congenita spesso si associa ad ipoplasia della tuba omolaterale (1-3).
I livelli sierici di estradiolo in genere sono bassi mentre alti sono quelli delle gonadotropine (3-5). Il cariotipo è sempre 46,XX ma se si estende l’analisi della metafase ad un numero di cellule superiore a quello normalmente esaminato per il cariotipo di routine, può ritrovarsi un anello autosomico, interessato alla differenziazione sessuale, nel cromosoma 15.
SINTOMATOLOGIA – Il quadro clinico è molto variabile in rapporto al grado di ipoplasia e deplezione follicolare: altezza normale, lievi alterazioni displastiche ossee e/o osteoporosi, debole sviluppo dei caratteri sessuali secondari, oligomenorrea ed amenorrea primaria o secondaria, infertilità, hot flush, irritabilità e sbalzi di umore, secchezza vaginale, diminuzione della libido (6).
EZIOLOGIA – L’eziologia dell’ipoplasia ovarica acquisita è da ricercare in un trauma annessiale prepuberale come la torsione dell’ovaio sul suo asse o fenomeni tromboembolici con conseguente arresto dello sviluppo o atresia. In genere interessa un solo ovaio (6-8). Anche le infezioni della sfera genitale (HIV) e l’endometriosi di III° e IV° grado in epoca prepuberale possono essere alla base dell’ipoplasia ovarica secondaria.
Escludendo le sindromi turneriane, la S. dell’ipoplasia ovarica congenita si riscontra in pazienti affette da Sindrome Leopard o lentigginosi cardiomiopatica (7-9), nella Sindrome di Noonan (10-11), deficit congenito dell’ormone della crescita (GH), e tireopatie congenite.
TERAPIA – La terapia varia in rapporto al danno anatomo-funzionale presente. Se è interessato un solo ovaio non sarà necessaria nessuna terapia. Induttori dell’ovulazione saranno utili in caso di infertilità da ridotta popolazione follicolare. L’assenza di follicoli in entrambe le ovaie richiederà una terapia sostitutiva estro-progestinica per ripristinare le mestruazioni e contrastare la sintomatologia pre-menopausale; l’ovodonazione è l’unica alternativa per ottenere una gravidanza.
References:
-
Eustace, D.L.S. (1992) Congenital absence of fallopian tube and ovary. European Journal of Obstetrics & Gynecology and Reproductive Biology, 46, 157-159.
-
Haydardedeoglu, B., Simsek, E., Kilicdag, E.B., Tarim, E., Aslan, E. and Bagis, T. (2006) A case of unicornuate uterus with ipsilateral ovarian and renal agenesis. Fertility and Sterility, 85, 750.e1-750.e
-
Mylonas, I., Hansch, S., Markmann, S., Bolz, M. and Friese, K. (2003) Unilateral Ovarian agenesis: Report of three cases and review of the literature. Archives of Gynecology and Obstetrics, 268, 57-60.
-
Kives, S.L., Bond, S.J. and Lara-Torre, E. (2005) Mullerian agenesis and ovarian torsion. A case report and review of literature. Journal of Pediatric Surgery, 40, 1326-1328
-
Gökhan Akkoyunlu, Filiz Tepekoy, Aydın Bebiş, Fatma Uysal: total ovarian hypoplasia in a Holstein Friesian heifer. Acta Histochemica Volume 116, Issue 8, October 2014, Pages 1519-152
-
Baron J, Hyla R: “The syndrome of ovarian hypoplasia”. .Zentralbl Gynakol. 1976;98(24):1491
- Sivanesaratnam, V. (1986) Unexplained unilateral absence of ovary and fallopian tube. European Journal of Obstetrics & Gynecology and Reproductive Biology, 22, 103-105.
- Silva, P.D., Glasser, K.E. and Virata, R.L. (1995) Spontaneously acquired unilateral absence of the adnexa. A case report. Journal of Reproductive Medicine, 40, 63-64.
- Acien, P. (1997) Incidence of Mullerian defects in fertile and infertile women. Human Reproduction, 12, 1372- 1376.
- Haydardedeoglu, B., Simsek, E., Kilicdag, E.B., Tarim, E., Aslan, E. and Bagis, T. (2006) A case of unicornuate uterus with ipsilateral ovarian and renal agenesis. Fertility and Sterility, 85, 750.e1-750.e4.
- Georgy, F.M. and Viechnicki, M.B. (1974) Absence of an ovary and uterine tube. Obstetrics & Gynecology, 44, 441- 442
- Laux D, Kratz C, Sauerbrey A. Common acute lymphoblastic leukemia in a girl with genetically confirmed LEOPARD syndrome. J Pediatr Hematol Oncol. Aug 2008;30(8):602-4
- Angelo Selicorni, Colli, A.M., Menni F., Brambillasca F, D’Arrigo S., Pantaloni C., Il cardiologo e le malattie rare, Vicenza, Hippocrates, 2008, ISBN 978-88-89297-24-7.
- Chen PC, Yin J, Yu HW, Yuan T, Fernandez M, Yung CK, Trinh QM, Peltekova VD, Reid JG, Tworog-Dube E, Morgan MB, Muzny DM, Stein L, McPherson JD, Roberts AE, Gibbs RA, Neel BG, Kucherlapati R. Next-generation sequencing identifies rare variants associated with Noonan syndrome. Proc Natl Acad Sci U S A. 2014 Aug 5;111(31):11473-8.
- Cordeddu V, Yin JC, Gunnarsson C, Virtanen C, Drunat S, Lepri F, De Luca A, Rossi C, Ciolfi A, Pugh TJ, Bruselles A, Priest JR, Pennacchio LA, Lu Z, Danesh A, Quevedo R, Hamid A, Martinelli S, Pantaleoni F, Gnazzo M, Daniele P, Lissewski C, Bocchinfuso G, Stella L, Odent S, Philip N, Faivre L, Vlckova M, Seemanova E, Digilio C, Zenker M, Zampino G, Verloes A, Dallapiccola B, Roberts AE, Cavé H, Gelb BD, Neel BG, Tartaglia M. Activating Mutations Affecting the Dbl Homology Domain of SOS2 Cause Noonan Syndrome. Hum Mutat. 2015 Nov;36(11):1080-7.