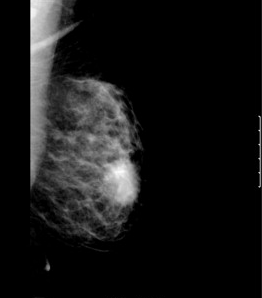
Sarcoma mammario radio-indotto
di Tatjana Volpicelli
I sarcomi mammari primari (PBS) costituiscono un raro ed eterogeneo gruppo di tumori maligni derivanti dalle cellule mesenchimali della mammella. Essi non superano l’1% dei tumori maligni della mammella (1-5).
DIAGNOSI:
- Clinicamente la paziente presenta una tumefazione mammaria rotondeggiante, di consistenza dura, del diametro medio di 4 cm (range 0.1-30 cm). Solo nel 3% dei casi si apprezzano tumefazioni ai linfonodi ascellari.
- L’ecografia, la mammografia ed anche la RMN presentano una scarsa sensibilità, al fine di stabilire la natura sarcomatosa di una neoformazione mammaria essendo, almeno nella fase iniziale, molto simile ai fibroadenomi. FDG-PET (Fludeoxyglucose-Positron Emission Tomography) sembra rappresentare un significativo progresso nella diagnosi e stadiazione di queste lesioni (15-17).
- Anche l’esame citologico non offre garanzie. La diagnosi definitiva è offerta soltanto dalla biopsia core o escissionale con esame istologico per inclusione (11-14).
ASPETTI ISTOLOGICI DEL PBS: da un punto di vista istologico le neoplasie connettivali maligne della mammella sono rappresentate dall’angiosarcoma (il sarcoma più frequente), dal cistosarcoma filloide o tumore filloide maligno. dal fibrosarcoma, dal liposarcoma, dal sarcoma osteogenico, dal condrosarcoma, dal leiorabdomiosarcoma, dall’istiocitoma fibroso maligno. Solo nel 3% dei casi i linfonodi ascellari sono infiltrati e metastasi a distanza nell’8% dei casi.
CUP syndrome (Carcinoma of Unknown Primary): situazione clinica in cui sono presenti metastasi, in genere ai linfonodi ascellari, senza che sia stato evidenziato il tumore primitivo alla mammella. La RMN ha mostrato livelli elevati di sensibilità, visualizzando la lesione primitiva nel 50% circa dei casi, Se la RMN è negativa, considerato l’elevato valore predittivo negativo nei confronti del carcinoma infiltrante, si conferma l’attuale orientamento chirurgico a non intervenire sulla mammella in presenza di clinica e imaging negativi. In tale caso può essere indicato un follow-up a lungo termine sia con imaging convenzionale che con RMN.
TERAPIA DEL SARCOMA MAMMARIO: nel caso dei sarcomi della mammella non sono indicate radioterapia, nè la chemioterapia, per la scarsa sensibilità delle cellule tumorali sarcomatose a questi trattamenti. Il “gold standard” terapeutico è costituito dalla terapia chirurgica.
L’intervento di scelta è costituito dalla mastectomia totale, tranne nei casi in cui la neoplasia presenti dimensioni limitate ed un intervento conservativo permetta quindi di asportare una sufficiente quantità di tessuto mammario sano circostante il tumore. Il successo della terapia chirurgica primaria è influenzato da due fattori: la dimensione del tumore primario (5 cm) e la quantità di tessuto marginale sano intorno al pezzo asportato con una sopravvivenza del 44-75% a 5 anni dall’intervento (18-21).
L’intervento chirurgico su una mammella affetta da un sarcoma non prevede l’esecuzione di una dissezione linfoghiandolare ascellare, in quanto i sarcomi tendono a diffondere per via ematogena e non per via linfatica, per cui non si osservano metastasi linfoghiandolari. Solo nel caso di rarissime forme tumorali miste (carcino-sarcomi) la linfoadenectomia può trovare una giustificazione biologica e clinica. In tutti gli altri casi la linfadenectomia comporta solo aumento della morbilità senza alcun beneficio in termini di sopravvivenza (22-25).
Particolare attenzione deve essere posta per i tumori filloidi, in quanto tendono a recidivare dopo l’escissione.
TERAPIA ADIUVANTE: Recenti studi hanno segnalato un miglioramento della sopravvivenza dopo terapia adiuvante con radioterapia (60 gy su campo tumorale) in pazienti con dimensioni del tumore >5 cm, ma non in pazienti con dimensioni del tumore ≤5 cm (26-28).
Dr. Tatjana Volpicelli
BIBLIOGRAFIA:
- Pencavel TD, Hayes A: Breast sarcoma – a review of diagnosis and management
- A.M. Pluchinotta et al.: “Iconografia e metodologia clinica delle lesioni mammarie”, Edizioni Sorbona 1994.
- Forza Operativa Nazionale sul Carcinoma Mammario: “I tumori della mammella. Linee guida sulla diagnosi, il trattamento e la riabilitazione”, Marzo 2001.
- G. Bonadonna et al.: “Manuale di Oncologia Medica”, Masson, 1987
- May D. S. & Stroup N. E. The incidence of sarcomas of the breast among women in the United States, 1973–1986. Plastic and reconstructive surgery 87, 193–194 (1991).
- Y.M. Kirova, L. Gambotti, Y. de Rycke, J.R. Vilcoq, B. Asselain, A. Fourquet Risk of second malignancies after adjuvant radiotherapy for breast cancer: a large-scale, single-institution review Int J Radiat Oncol Biol Phys, 68 (2) (2007), pp. 359–363
- R. Zucali, M. Merson, M. Placucci, S. Di Palma, U. Veronesi Soft tissue sarcoma of the breast after conservative surgery and irradiation for early mammary cancer Radiother Oncol, 30 (1994), pp. 271–273
- A. Taghian, F. de Vathaire, P. Terrier, M. Le, A. Auquier, H. Mouriesse, et al. Long-term risk of sarcoma following radiation treatment for breast cancer Int J Radiat Oncol Biol Phys, 21 (2) (1991), pp. 361–367
- C.D. Callery, P.P. Rosen, D.W. Kinne Sarcoma of the breast: a study of 32 patients with reappraisal of classification and therapy Ann Surg, 201 (4) (1985), pp. 527–532
- S.A. Vorburger, Y. Xing, K.K. Hunt, G.E. Lakin, R.S. Benjamin, B.W. Feig, et al. Angiosarcoma of the breast Cancer, 104 (12) (2005), pp. 2682–2688
- J. Fodor, Z. Orosz, E. Szabo, Z. Sulyok, C. Polgar, Z. Zaka, et al. Angiosarcoma after conservation treatment for breast carcinoma: our experience and a review of the literature J Am Acad Dermatol, 54 (3) (2006), pp. 499–504
- L.M. Foxcroft, E.B. Evans, A.J. Porter Difficulties in the pre-operative diagnosis of phyllodes tumours of the breast: a study of 84 cases Breast, 16 (1) (2007), pp. 27–37
- M.P. Moore, D.W. Kinne Breast sarcoma Surg Clin North Am, 76 (2) (1996), pp. 383–392
- S.J. Parker, S.A. Harries Phyllodes tumours Postgrad Med J, 77 (2001), pp. 428–435
- W.T. Yang, M. Muttarak, L.W. Ho Nonmammary malignancies of the breast: ultrasound, CT, and MRI Semin Ultrasound CT MR, 21 (5) (2000), pp. 375–394
- M. Shahbahang, D. Franchesci, M. Sundaram, M.H. Castillo, F.L. Moffat, D.S. Frank, et al.Surgical management of primary breast sarcoma Am Surg, 68 (8) (2002), pp. 673–677
- S.M. Bakheet, J. Powe, A. Ezzat, H.A. Suhaibani, A. Tulbah, A. Rostom F-18 FDG whole-body positron emission tomography scan in primary breast sarcoma Clin Nucl Med, 23 (9) (1998), pp. 604–608
- Som P, Atkins HL, Bandoypadhyay D, Fowler JS, MacGregor RR, Matsui K, Oster ZH, Sacker DF, Shiue CY, Turner H, Wan CN, Wolf AP, Zabinski SV (1980). “A fluorinated glucose analog, 2-fluoro-2-deoxy-D-glucose (F-18): Nontoxic tracer for rapid tumor detection”. J Nucl Med 21 (7): 670–675.
- W.K. De Roos, P. Kaye, D.M. Dent Factors leading to local recurrence or death after surgical resection of phyllodes tumours of the breast Br J Surg, 86 (8) (1999), pp. 1094–1095
- S. Ciatto, R. Bonardi, L. Cataliotti, G. Cardona Sarcomas of the breast: a multicenter series of 70 cases Neoplasma, 39 (6) (1992), pp. 375–379
- M.L. Telli, K.C. Horst, A.E. Guardino, F.M. Dirbas, R.W. Carlson Phyllodes tumours of the breast: natural history, diagnosis, and treatment J Natl Compr Canc Netw, 5 (3) (2007), pp. 324–330
- G.I. McGregor, M.A. Knowling, F.A. Este Sarcoma and cystosarcoma phyllodes tumors of the breast—a retrospective review of 58 cases Am J Surg, 167 (5) (1994), pp. 477–480
- T. Sher, B.T. Hennessy, V. Valero, K. Broglio, W.A. Woodward, J. Trent, et al. Primary angiosarcomas of the breast Cancer, 110 (1) (2007), pp. 173–178
- Y. Fong, D.G. Coit, J.M. Woodruff, M.F. Brennan Lymph node metastasis from soft tissue sarcoma in adults: analysis of data from a prospective database of 1772 sarcoma patients Ann Surg, 217 (1) (1993), pp. 72–77
- H. Gutman, R.E. Pollock, M.I. Ross, R.S. Benjamin, D.A. Johnston, N.A. Janjan, et al. Sarcoma of the breast: implications for extent of therapy. The MD Anderson experience Surgery, 116 (3) (1994), pp. 505–509
- T.S. McGowan, B.J. Cummings, B. O’Sullivan, C.N. Catton, N. Miller, T. Panzarella An analysis of 78 breast sarcoma patients without distant metastases at presentation Int J Radiat Oncol Biol Phys, 46 (2) (2000), pp. 383–390
- H. Gutman, R.E. Pollock, M.I. Ross, R.S. Benjamin, D.A. Johnston, N.A. Janjan, et al. Sarcoma of the breast: implications for extent of therapy. The MD Anderson experience Surgery, 116 (3) (1994), pp. 505–509
- T.S. McGowan, B.J. Cummings, B. O’Sullivan, C.N. Catton, N. Miller, T. Panzarella An analysis of 78 breast sarcoma patients without distant metastases at presentation Int J Radiat Oncol Biol Phys, 46 (2) (2000), pp. 383–390
- P.A. Johnstone, L.J. Pierce, M.J. Merino, J.C. Yang, A.H. Epstein, T.F. De Laney Primary soft tissue sarcomas of the breast: local-regional control with post-operative radiotherapy Int J Radiat Oncol Biol Phys, 27 (3) (1993), pp. 671–675
- Fletcher CDM, U. K., Mertens F Pathology and genetics of tumours of soft tissue and bone. Lyon: IARC Press, 2002.
- Gladdy, R. A., Qin, L. X., Moraco, N., Edgar, M. A., Antonescu, C. R., Alektiar, K. M., Brennan, M. F., and Singer, S. Do radiation-associated soft tissue sarcomas have the same prognosis as sporadic soft tissue sarcomas? J Clin Oncol, 28: 2064-2069.
- Bjerkehagen, B., Smeland, S., Walberg, L., Skjeldal, S., Hall, K. S., Nesland, J. M., Smastuen, M. C., Fossa, S. D., and Saeter, G. Radiation-induced sarcoma: 25-year experience from the Norwegian Radium Hospital. Acta Oncol, 47: 1475-1482, 2008.
- Cha, C., Antonescu, C. R., Quan, M. L., Maru, S., and Brennan, M. F. Long-term results with resection of radiation-induced soft tissue sarcomas. Ann Surg, 239: 903-909; discussion 909-910, 2004.
- Wiklund, T. A., Blomqvist, C. P., Raty, J., Elomaa, I., Rissanen, P., and Miettinen, M. Postirradiation sarcoma. Analysis of a nationwide cancer registry material. Cancer, 68: 524-531, 1991.
- Virtanen, A., Pukkala, E., and Auvinen, A. Incidence of bone and soft tissue sarcoma after radiotherapy: a cohort study of 295,712 Finnish cancer patients. Int J Cancer, 118: 1017-1021, 2006.
- Menu-Branthomme, A., Rubino, C., Shamsaldin, A., Hawkins, M. M., Grimaud, E., Dondon, M. G., Hardiman, C., Vassal, G., Campbell, S., Panis, X., Daly-Schveitzer, N., Lagrange, J. L., Zucker, J. M., Chavaudra, J., Hartman, O., and de Vathaire, F. Radiation dose, chemotherapy and risk of soft tissue sarcoma after solid tumours during childhood. Int J Cancer, 110: 87-93, 2004.
- Hawkins, M. M., Wilson, L. M., Burton, H. S., Potok, M. H., Winter, D. L., Marsden, H. B., and Stovall, M. A. Radiotherapy, alkylating agents, and risk of bone cancer after childhood cancer. J Natl Cancer Inst, 88: 270-278, 1996.
- Moppett, J., Oakhill, A., and Duncan, A. W. Second malignancies in children: the usual suspects? Eur J Radiol, 37: 95-108, 2001.
- Gladdy, R. A., Qin, L. X., Moraco, N., Edgar, M. A., Antonescu, C. R., Alektiar, K. M., Brennan, M. F., and Singer, S. Do radiation-associated soft tissue sarcomas have the same prognosis as sporadic soft tissue sarcomas? J Clin Oncol, 28: 2064-2069.
- Patton, K. T., Deyrup, A. T., and Weiss, S. W. Atypical vascular lesions after surgery and radiation of the breast: a clinicopathologic study of 32 cases analyzing histologic heterogeneity and association with angiosarcoma. Am J Surg Pathol, 32: 943-950, 2008.
- Yap, J., Chuba, P. J., Thomas, R., Aref, A., Lucas, D., Severson, R. K., and Hamre, M. Sarcoma as a second malignancy after treatment for breast cancer. Int J Radiat Oncol Biol Phys, 52: 1231-1237, 2002.
- Gengler, C., Coindre, J. M., Leroux, A., Trassard, M., Ranchere-Vince, D., Valo, I., Michels, J. J., and Guillou, L. Vascular proliferations of the skin after radiation therapy for breast cancer: clinicopathologic analysis of a series in favor of a benign process: a study from the French Sarcoma Group. Cancer, 109: 1584-1598, 2007.
- Gladdy, R. A., Qin, L. X., Moraco, N., Edgar, M. A., Antonescu, C. R., Alektiar, K. M., Brennan, M. F., and Singer, S. Do radiation-associated soft tissue sarcomas have the same prognosis as sporadic soft tissue sarcomas? J Clin Oncol, 28: 2064-2069.
- Holt, G. E., Thomson, A. B., Griffin, A. M., Bell, R., Wunder, J., Rougraff, B., and Schwartz, H. S. Multifocality and multifocal postradiation sarcomas. Clin Orthop Relat Res, 450: 67-75, 2006.
- Penel, N., Marreaud, S., Robin, Y. M., and Hohenberger, P. Angiosarcoma: State of the art and perspectives. Crit Rev Oncol Hematol.