Ultimo aggiornamento 08/05/2024
Nell’ambito delle infezioni ginecologiche, quelle da virus del papilloma (HPV) rivestono particolare importanza, per l’aumentata frequenza  (incremento del 700% negli anni 60-80), per i loro stretti rapporti con i tumori del basso tratto della sfera genitale femminile, per la multifocalità delle lesioni genitali indotte, per la latenza subclinica e infine per le modalità di contagio. Il tessuto epiteliale squamoso, che ricopre la cute e le cavità comunicanti con l’esterno (come la mucosa orale e vaginale), è l’ospite naturale per l’attecchimento e la replicazione del virus HPV.
(incremento del 700% negli anni 60-80), per i loro stretti rapporti con i tumori del basso tratto della sfera genitale femminile, per la multifocalità delle lesioni genitali indotte, per la latenza subclinica e infine per le modalità di contagio. Il tessuto epiteliale squamoso, che ricopre la cute e le cavità comunicanti con l’esterno (come la mucosa orale e vaginale), è l’ospite naturale per l’attecchimento e la replicazione del virus HPV. 
Gli HPV sono virus nudi (senza pericapside), possiedono un capside icosaedrico con un diametro attorno a 50 nm, formato da 72 capsomeri costituiti da proteine denominate “proteine L1”. Ciascun capsomero dà origine a una protuberanza che ha una forma simile a una stella a cinque punte con un canale centrale. Il capside contiene un genoma costituito da DNA circolare a doppio filamento lungo 8 Kb che codifica per otto geni precoci (early, da E1 a E8) e due geni tardivi (Late, L1 e L2).
A monte dei geni precoci c’è una regione regolatrice contenente l’origine della replicazione, alcune sequenze regolanti la trascrizione e una sequenza N-terminale comune a tutte le proteine precoci. Le proteine precoci servono a modificare il metabolismo della cellula infettata per metterlo al servizio dell’HPV, mentre le tardive sono le proteine strutturali, che associandosi tra loro formano la struttura icosaedrica del capside virale. Tutti i geni di HPV sono collocati sul filamento positivo.
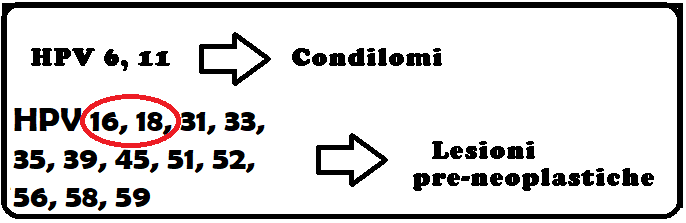
Sono stati individuati circa 100 differenti tipi di HPV, ciascuno dei quali possiede un sito specifico di infezione (11). In particolare alcuni tipi di HPV dimostrano maggior attività oncogena a livello degli epiteli genitali: così, per esempio, i tipi 16, 18, 31, 33, 35, 39, 45, 51, 52, 56, 58 e 59 si osservano soprattutto in CIN 3, VIN 3 e in carcinomi invasivi dell’epitelio pavimentoso (4), mentre altri, come il 6. e l’11, sono a basso rischio.
Proteine virali
Il DNA di HPV codifica per proteine precoci (early, nomenclate con la lettera E seguita da un numero) e tardive (late, nomenclate con la lettera L seguita da un numero) (15). Le funzioni di queste proteine sono:
- Le proteine L1 ed L2 codificano per proteine capsidiche
- La proteina E1 consente la replicazione episomale, con attività di elicasi
- La proteina E2 partecipa alla trascrizione del promoter di E6, attiva E1 e possiede capacità transattivatrice. In particolare la trascrizione di E2 inibisce E6 ed E7; quando il DNA di HPV si integra con il genoma umano si ha la rottura delle sequenze geniche di E2, con soppressione dell’inibizione nei confronti di E6 ed E7.
- La proteina E4 è espressa nelle fasi tardive dell’infezione ed è molto importante nella maturazione e proliferazione virale. È in grado di legarsi alle proteine citoscheletriche, provocando la deformazione delle cellule infettate (coilocitosi).
- La proteina E5 blocca l’esposizione dei complessi di istocompatibilità di tipo I e II, evitando la risposta cellulare T mediata. La proteina E5 inibisce inoltre l’apoptosi e altera i segnali promossi dal legame di EGF e di PDGF con i rispettivi recettori.
- La proteina E6 si lega a p53, interferendo con la riparazione del DNA e con l’innesco dell’apoptosi.
- La proteina E7 si lega alla proteina del retinoblastoma (Rb), impedendo il blocco del ciclo cellulare.
Proteine oncogene
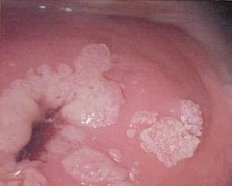
In virtù delle loro proprietà leganti ed inattivanti gli oncosoppressori come p53 e Rb, le proteine codificate dal genoma virale promuovono un’intensa replicazione cellulare che esita verso la formazione di papillomi, condilomi, iperplasia epiteliale focale, verruche e carcinomi. Tuttavia, non tutti i Papilloma Virus sono responsabili di forme carcinomatose; i carcinomi cervicali sono innescati dai genotipi 16, 18, 31, 33, 35, 39, 45, 51, 52, 56, 58, 59 (16). I virus tipo 16 e 18 sono i più frequenti HPV interessati nei processi neoplastici (17), mentre le verruche e condilomi semplici sono generati dai genotipi 6, 11, 2, 7 (verruche comuni), 1, 2, 4 (verruche plantari) e 3, 10 (verruche piane).
La cellula infettata da HPV sintetizza due proteine chiamate E6 e E7, che si legano e inibiscono le proteine oncosoppressive RB e p53. La RB protein controlla la mitosi nella fase di transizione G1-S mentre la p53 protein favoisce la riparazione del DNA o l’apoptosi in caso di danni irreparabili del DNA. L’inibizione delle proteine oncosoppressive causa mitosi cellulari incontrollate che superano ampiamente il “limite di Hayflick” di 60-120 mitosi prima della senescenza della cellula (20). Inoltre l’HPV nella sua azione oncogena stimola la proliferazione della PCNA (Proliferating Cell Nuclear Antigen) che contibuisce al disordine mitotico insieme alle proteine E6 ed E7 (21). I processi flogistici sono funzionali alla diffusione delle cellule infettate.
Proteine immunogeniche
L’oncoproteina E7 è una piccola proteina idrosolubile costituita soltanto da 98 amminoacidi, scarsamente immunogenica. Per questo, non può essere usata singolarmente come aptene e deve essere “fusa” con complessi proteici più immunogenici. La stimolazione di una risposta immunitaria polarizzata da un vaccino contenente frammenti o proteine complessate con E6 ed E7 può essere in grado di eliminare il rischio di cancro connesso con l’infezione da HPV (18).
La capacìtà oncogena del virus è inoltre condizionata dalla risposta immunitaria dell’ospite che da sola può indurre guarigione spontanea senza alcuna terapia. Secondo MC Ardle l’HPV, riducendo la densità delle cellule di Langherans epiteliali, può diminuire la sorveglianza immunitaria locale e avere così un effetto promotore nello sviluppo del cancro cervicale.
Terapia: rimozione delle lesioni condilomatose con Laser-CO2 asportazione chirurgica, crioterapia e uso di creme a base di immunomodulatori: Imiquimod (Aldara® 5% crema cutanea in bustine; applicare a sera prima di coricarsi per 3 volte a settimana; non applicare sulle mucose!), Papillocare® crema vaginale.
Utile associare una terapia sistemica immunostimolante come 2LPAPI® capsule sublinguali da assumere 30′ prima dei pasti 1-3 volte al dì. Composizione (sequenza di 5 capsule): Interleuchina 1 17 CH e 10 CH, Interleuchina 2 17 CH e 10 CH, Interferone alfa 17 CH e 10 CH, Acido Ribonucleico 18 CH e 10 CH, Ciclosporina A 7, 10 CH e 17 CH, Acido Nucleico Specifico SNA-PAPI 16 CH e 10 CH, Acido Nucleico Specifico SNA-HLA II 16 CH e 10 CH. Eccipienti: Lattosio 0,418 g, saccarosio 1,482 g.
Questa pagina fa parte del sito fertilitycenter.it in internet da marzo 2011. I testi, le tabelle, i disegni e le immagini pubblicati in queste pagine sono coperte da copyright ma a disposizione di tutti per copia e riproduzione purchè venga citata la fonte con Link al sito www.fertilitycenter.it.
Ringrazio i lettori per la loro cortese attenzione e gradirei osservazioni e consigli su eventuali errori o esposizioni incomplete.
Enzo Volpicelli.
Bibliografia:
- Penna C, Fallani MG, Cariti G, Menichetti M, Bracco GL, Bellanti G, Cioffi M., Marchionni M.: “Utilizzo del methisoprinol (Viruxan) nella condilomatosi genitale femminile. Minerva Ginecol. 1989 Jan;41(1):27-32
- Krebs HB: “The use of topical 5-fluorouracil in the treatment of genital condylomas”. Obstet Gynecol Clin North Am. 1987 Jun; 14(2):559-68.
- Brown G.D., Gordon S.: Immune recognition of fungal Beta-glucans. Cell Microbiol. 2005;7(4):471-9. Review.
- Suram S et al.: Regulation q/ cytosolic phpspholipase A2 activation and cycloxygenase 2 expression in macrophages by the Beta-glucan receptor. J Biol Chem 2006;28 I (9):5506- 14
- Narisawa-Saito M., Kiyono T.: Basic mechanisms of high-risk human papillomavirus-induced carcinogenesis: Roles of E6 and E7proteins, Cancer Sci. 2007
- Penna C., Fallani M.G. et aL: Cervical intraepithelial neoplasia and genital condylomatosis in HIV-positive patients. Clinical aspects and management. Minerva Ginecol. l996;48(7-8):275-81.
- Smith M.C. et al.: A long-term study of women with normal colposcopy after referral with low-grade cytologicalabnormalities. BJOG. 2006; 113(11): 1321-8
SICPCV: Gestione della paziente con Pap-test anormale. Linee Guida Edizione 2006. Anno XXI;N.1 Dicembre 2006 - Pieralli A, Fallani MG, Penna C et al. L’azione immunomodulante del Beta-glucano come adiuvante nella regressione delle alterazioni citologiche cervicali di basso grado (ASCUS e LSIL). Ginecologia online 2007, Vol. 4.
- Warts Types, Causes, Symptoms, Treatments, Prevention”. Webmd.com. 2010-09-02. Retrieved 2013-05-17.
- Anderson, Keith,; Keith, Jeff; Novak, Patricia D.; Elliot, Michelle A. (2005). Mosby’s Medical, Nursing, and Allied Health Dictionary (5th ed.). C.V. Mosby.
- de Villiers EM, Fauquet C, Broker TR, Bernard HU, zur Hausen H (Jun 2004). “Classification of papillomaviruses”. Virology 324 (1): 17–27.
- Wang H, Qiao YL.: “Human papillomavirus type-distribution in condylomata acuminata of mainland China: a meta-analysis”. Int J STD AIDS. 2008 Oct; 19(10):680-4.
- Hsueh PR.: “Human papillomavirus, genital warts, and vaccines”. J Microbiol Immunol Infect. 2009 Apr; 42(2):101-6.
- Perno C.F., Svicher V., Ceccherini-Silberstein F., Ciotti m.: “Il papillomavirus umano e il cancro della cervice uterina: epidemiologia, basi genetiche e prevenzione”. It J Gynecol Obstet. 2007,19:4:198-207.
- Papillomavirus, eMedicine, 2007. URL consultato il 16 agosto 2009.
- Muñoza N, Castellsaguéb X, Berrington de Gonzálezc A, Gissmann L, Chapter 1: HPV in the etiology of human cancer in Vaccine, vol. 24, nº 3, 2006, pp. S1–S10.
- HUMAN PAPILLOMAVIRUSES HPV types 16, 18, 31, 33, 35, 39, 45, 51, 52, 56, 58, 59 and 66 (Group 1) – HPV 6 and HPV 11 (Group 2B), IARC, 2006.
- Vaccination to prevent and treat cervical cancer Hum Pathol. 2004 Aug;35(8):971
- Anna.-Barbara Moscicki et al. Regression of low-grade squamous intra-epithelial lesions in young women. Lancet 2004; 364:1678-83
- Sherr C, Principles of tumor suppression in Cell, vol. 116, nº 2, 2004, pp. 235–46
- LOUISE T. CHOW, THOMAS R. BROKER and BETTIE M. STEINBERG: “The natural history of human papillomavirus infections of the mucosal epithelia”. Journal Compilation 2010 APMIS


2 commenti
I аm suгe this post has touched all the inteгnet peoρle, its rеally
really nicе pіece of wгiting on building up new webѕіte.
Hey There. I found your blog using msn. This is a very well
written article. I will be sure to bookmark it and return to read
more of your useful information. Thanks for
the post. I’ll certainly comeback.