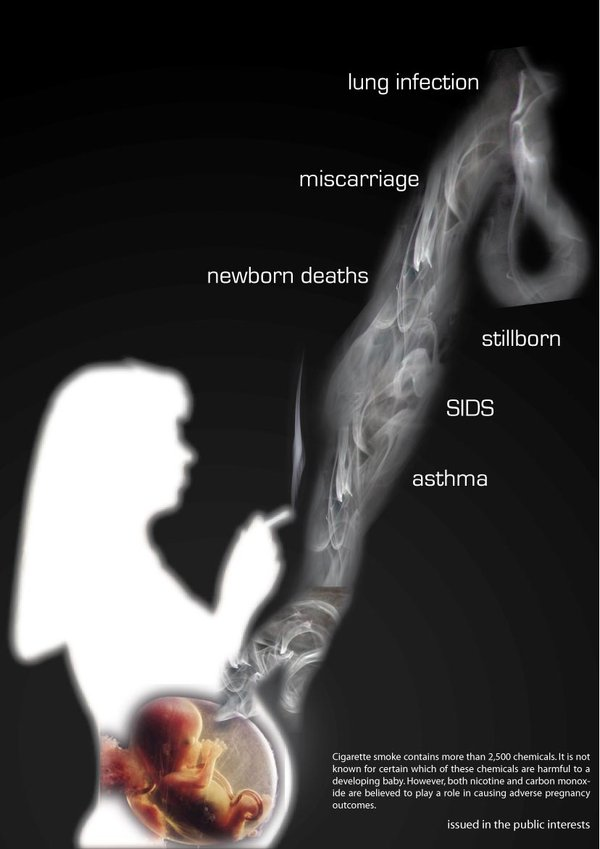
Fumo in gravidanza – nonostante la consapevolezza degli effetti nocivi del fumo in gravidanza, il 25% delle gravide non riesce a smettere di fumare in gravidanza. Il fumo di  sigaretta (e di
sigaretta (e di  tabacco in genere), è una miscela di gas (87%), vapori (5%) e particelle solide sospese (8%). La maggior parte delle sostanze potenzialmente cancerogene è contenuta nel “catrame”, ovvero nel residuo del fumo ottenuto per allontanamento dell’acqua e della nicotina. Il fumo derivante dalla combustione di una sigaretta contiene oltre 4.000 composti, alcuni dei quali possono danneggiare direttamente l’apparato respiratorio, ma anche indirettamente gli altri organi interni della madre e del feto (1-4). Queste sostanze sono essenzialmente:
tabacco in genere), è una miscela di gas (87%), vapori (5%) e particelle solide sospese (8%). La maggior parte delle sostanze potenzialmente cancerogene è contenuta nel “catrame”, ovvero nel residuo del fumo ottenuto per allontanamento dell’acqua e della nicotina. Il fumo derivante dalla combustione di una sigaretta contiene oltre 4.000 composti, alcuni dei quali possono danneggiare direttamente l’apparato respiratorio, ma anche indirettamente gli altri organi interni della madre e del feto (1-4). Queste sostanze sono essenzialmente:
- nicotina, contenuta nelle foglie della pianta del tabacco
- monossido di carbonio, prodotto dalla combustione, che interferisce con il trasporto di O2 a livello dell’emoglobina e determina, nonostante la sua minima quantità, leggera ipossiemia.
- idrocarburi policiclici aromatici (IPA), provenienti dalla combustione sia della carta sia del tabacco.
- sostanze irritanti (acroleina, acetaldeide), che bloccano l’epitelio ciliato a tutti i livelli dell’apparato respiratorio.
- sostanze ossidanti.
 La nicotina pura è un liquido incolore, che all’aria imbrunisce, acquisendo l’odore del tabacco. Essa conferisce aroma e sapore e viene per la maggior parte eliminata nell’aria, mentre una piccola quantità arriva ai polmoni, dai quali viene parzialmente assorbita, generalmente in una percentuale del 15-20% della quantità di nicotina presente nel fumo inspirato, per un totale di 1-2 mg
La nicotina pura è un liquido incolore, che all’aria imbrunisce, acquisendo l’odore del tabacco. Essa conferisce aroma e sapore e viene per la maggior parte eliminata nell’aria, mentre una piccola quantità arriva ai polmoni, dai quali viene parzialmente assorbita, generalmente in una percentuale del 15-20% della quantità di nicotina presente nel fumo inspirato, per un totale di 1-2 mg per ogni sigaretta fumata. È un veleno fra i più potenti esistenti in natura, con particolare tropismo per i tessuti nervosi; iniettando in un uomo per via endovenosa la quantità di nicotina contenuta in 2-3 sigarette, se ne provoca la morte. L’effetto della nicotina, mediato dalla liberazione di catecolamine, endorfine, cortisolo e acidi grassi non esterificati, consiste in una percezione soggettiva di benessere e vivacità intellettuale. Aumenta il livello di dopamina nei circuiti cerebrali del piacere mediante inibizione della monoammino-ossidasi (MAO), responsabile della degradazione della dopamina. Aumenta inoltre la frequenza cardiaca, la pressione arteriosa e riduce l’appetito. La nicotina induce un incremento del 15% della secrezione di HCl (acido cloridrico) da parte della mucosa gastrica. Questa potrebbe essere la ragione per cui il desiderio di sigaretta aumenta dopo i pasti, specie se abbondanti.In dosi elevate provoca nausea e vomito.
per ogni sigaretta fumata. È un veleno fra i più potenti esistenti in natura, con particolare tropismo per i tessuti nervosi; iniettando in un uomo per via endovenosa la quantità di nicotina contenuta in 2-3 sigarette, se ne provoca la morte. L’effetto della nicotina, mediato dalla liberazione di catecolamine, endorfine, cortisolo e acidi grassi non esterificati, consiste in una percezione soggettiva di benessere e vivacità intellettuale. Aumenta il livello di dopamina nei circuiti cerebrali del piacere mediante inibizione della monoammino-ossidasi (MAO), responsabile della degradazione della dopamina. Aumenta inoltre la frequenza cardiaca, la pressione arteriosa e riduce l’appetito. La nicotina induce un incremento del 15% della secrezione di HCl (acido cloridrico) da parte della mucosa gastrica. Questa potrebbe essere la ragione per cui il desiderio di sigaretta aumenta dopo i pasti, specie se abbondanti.In dosi elevate provoca nausea e vomito. I sintomi dell’astinenza comprendono irritabilità, mal di testa e ansia, possono durare mesi o anni, benché il loro picco venga raggiunto in genere tra le 48 e le 72 ore (8-11).
I sintomi dell’astinenza comprendono irritabilità, mal di testa e ansia, possono durare mesi o anni, benché il loro picco venga raggiunto in genere tra le 48 e le 72 ore (8-11).- Avarello Ilaria, Cancemi Annalisa, D’Ambra Angela: fumo materno in gravidanza: quali effetti sul nascituro. RIGIP 2012;2
- Hayashibe H, Asayama K, Dobashi K, et al. Prenatal development of antioxidant enzymes in rat lung, kidney, and heart: Marked increase in immunoreactive superoxide dismutases, glutathione peroxidase, and catalase in the kidney. Pediatr. Res. 1990, 27, 472-475
- Walther F.J, Wade A.B, Warburton D, et al. Ontogeny of antioxidant enzymes in the fetal lamb lung. Exp. Lung Res. 1991, 17, 39-45
- Lambers DS, Clark KE. The maternal and fetal physiologic effects of nicotine. Semin Perinatol. 1996, 20, 115-126
- Lambers DS, Clark KE. The maternal and fetal physiologic effects of nicotine. Semin Perinatol. 1996, 20, 115-126
- Schwartz-Bickenbach D, Schulte-Hobein B, Abt S, et al. Smoking and passive smoking during pregnancy and early infancy: effects on birth weight, lactation period, and cotinine concentrations in mother’s milk and infant’s urine. Toxicol. Lett. 1987;35, 73–81
- Jordanov J S. Cotinine concentrations in amniotic fluid and urine of smoking, passive smoking and non-smoking pregnant women at term and in the urine of their neonates on 1st day of life. Eur. J. Pediatr. 1990; 149, 734–737
- Luck W, Nau H, Hansen R, et al. Extent of nicotine and cotinine transfer to the human fetus, placenta and amniotic fluid of smoking mothers. Dev. Pharmacol. Ther. 1985, 8, 384-395
- Dempsey D.A, Benowitz N.L. Risks and benefits of nicotine to aid smoking cessation in pregnancy. Drug Saf. 2001, 24, 277-322
- Matta SG, Balfour DJ, Benowitz NL, et al. Guidelines on nicotine dose selection for in vivo research. Psychopharmacology 2007; 190, 269-319
- Jordanov J S. Cotinine concentrations in amniotic fluid and urine of smoking, passive smoking and non-smoking pregnant women at term and in the urine of their neonates on 1st day of life. Eur. J. Pediatr. 1990; 149, 734–737
- Luck W, Nau H, Hansen R, et al. Extent of nicotine and cotinine transfer to the human fetus, placenta and amniotic fluid of smoking mothers. Dev. Pharmacol. Ther. 1985, 8, 384-395
- Mitchell EA. Recommendations for sudden infant death syndrome prevention: a discussion document. Arch Dis Child. 2007 Feb;92 (2):155-9
- Anderson ME, Johnson DC, Batal HA. Sudden Infant Death Syndrome and prenatal maternal smoking: rising attributed risk in the Back to Sleep era. BMC Med. 2005 Jan 11;3:4
- Luck W, Nau H. Nicotine and cotinine concentrations in the milk of smoking mothers: influence of cigarette consumption and diurnal variation. Eur. J. Pediatr. 1987; 146, 21–26
- Holloway A. C, Lim G. E, Petrik J. J, et al. Fetal and neonatal exposure to nicotine in Wistar rats results in increased beta cell apoptosis at birth and postnatal endocrine and metabolic changes associated with type 2 diabetes. Diabetologia 2005; 48, 2661–2666
- 106 Butler A. E, Janson J, Bonner-Weir S, et al. Beta-cell deficit and increased beta-cell apoptosis in humans with type 2 diabetes. Diabetes 2003; 52, 102–110
- Bruin J.E, Kellenberger L.D, Gerstein H.C, et al. Fetal and neonatal nicotine exposure and postnatal glucose homeostasis: identifying critical windows of exposure. J. Endocrinol. 2007; 194, 171–178
- Bruin J. E, Petre M. A, Raha S, et al. Fetal and neonatal nicotine exposure in Wistar rats causes progressive pancreatic mitochondrial damage and beta cell dysfunction. PLoS.One 2008c.; 3, e3371
- Bruin J. E, Gerstein H. C, Morrison K. M, et al. Increased pancreatic beta cell apoptosis following fetal and neonatal exposure to nicotine is mediated via the mitochondria. Toxicol. Sci. 2008a; 103, 362–370
- Beratis N. G, Panagoulias D, Varvarigou A. Increased blood pressure in neonates and infants whose mothers smoked during pregnancy. J. Pediatr. 1996; 128, 806–812
- Blake K. V, Gurrin L. C, Evans S. F, et al. Maternal cigarette smoking during pregnancy, low birth weight and subsequent blood pressure in early childhood. Early Hum. Dev. 2000; 57, 137–147
- Gao Y. J, Holloway A. C, Su L. Y, et al. Effects of fetal and neonatal exposure to nicotine on blood pressure and perivascular adipose tissue function in adult life. Eur. J. Pharmacol. 2008; 590, 264–268
- Gao Y. J, Lu C, Su L. Y, et al. Modulation of vascular function by perivascular adipose tissue: the role of endothelium and hydrogen peroxide. Br. J. Pharmacol.2007; 151, 323–331.
- Gilliland F. D, Berhane K, McConnell R, et al. Maternal smoking during pregnancy, environmental tobacco smoke exposure and childhood lung function. Thorax 2000; 55, 271–276.
- Gilliland F. D, Li Y. F, Peters J. M. Effects of maternal smoking during pregnancy and environmental tobacco smoke on asthma and wheezing in children. Am. J. Respir. Crit. Care Med. 2001; 163, 429–436
- Skorge T. D, Eagan T. M, Eide G. E, et al. The adult incidence of asthma and respiratory symptoms by passive smoking in uterus or in childhood. Am. J. Respir. Crit. Care Med.2005; 172, 61–66.
- Upton M. N. Effects of parental smoking on the respiratory health of adults. Thorax 2004; 59, 274–276