Ultimo aggiornamento 2022-03-17 22:34:14
Gli androgeni sono un gruppo di ormoni di natura steroidea che stimolano lo sviluppo in senso maschile degli organi sessuali e dei caratteri sessuali secondari. Nella donna gli androgeni hanno, rispetto ai maschi, un ruolo molto minore principalmente legato allo sviluppo dell’apparato pilifero in epoca puberale. Un eccesso di androgeni provoca irsutismo e virilizzazione nei casi in cui l’iperproduzione è più spiccata e interessa gli ormoni biologicamente più attivi.
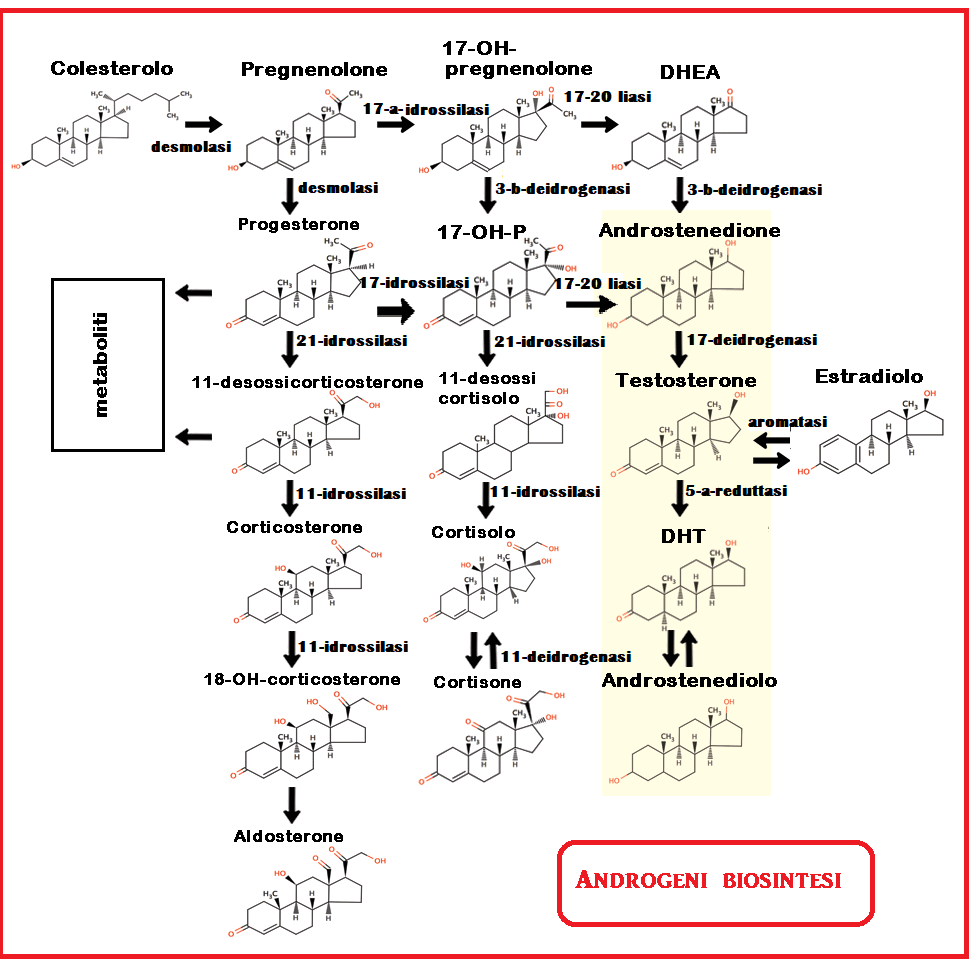
Gli ormoni androgeni presenti in circolo nella donna sono principalmente: testosterone, diidrotestosterone, δ4-androstenedione (δ4-A) e deidroepiandrosterone (DHEA). Androstenedione e DHEA (definiti anche pre-androgeni) sono gli androgeni principali nella donna da un punto di vista quantitativo. Dotati di un’attività androgenica intrinseca minima, sono convertiti, negli organi periferici, in testosterone e diidrotestosterone.
L’androstenedione (Δ4-A) nella donna è prodotto in quantità pressoché equivalenti dal surrene e dall’ovaio. Deriva dalla trasformazione del DHEA ad opera dell’enzima deidorgenasi e dal 17-OH-P ad opera della 17-20 liasi. Si converte in testosterone ad opera della 17-ß-deidrogenasi.
Il valore m edio sierico del Δ4-A è 300-800 ng/dl. La maggior parte del Δ4-A è legato all’albumina (85%), alla SHBG (8%) o circola libero (7%). E’ trasformato in testosterone sotto l’azione della 11-OH-deidrogenasi. nel tessuto adiposo, fegato e milza.
edio sierico del Δ4-A è 300-800 ng/dl. La maggior parte del Δ4-A è legato all’albumina (85%), alla SHBG (8%) o circola libero (7%). E’ trasformato in testosterone sotto l’azione della 11-OH-deidrogenasi. nel tessuto adiposo, fegato e milza.
Il DHEA è prodotto invece quasi esclusivamente dal surrene. Il suo valore medio sierico è 3-8 ng/ml. Diminuisce bruscamente con l’inizio della menopausa precoce.
DHEA-s: è prodotto quasi esclusivamente dal surrene in percentuale del 90% e solo per il 10% dall’ovaio. E’ l’unico steroide esattamente dosabile con un unico campione perché le sue variazioni sono minime e lunga è la sua emivita. I suoi valori costituiscono una misura diretta dell’attività androgenica del surrene. Nella donna in età fertile ha una concentrazione plasmatica di 4-9 nmol/L (<700 mg/dl).  In caso di elevati livelli sierici di DHEA-s occorre impostare una diagnosi differenziale fra ca. del surrene, iperplasia surrenalica congenita, PCOS e iperprolattinemia. Un DHEA-S lievemente aumentato é un reperto costante nelle p/ti anovulatorie e iperprolattinemiche. In caso di valori elevati di DHEA-s occorre eseguire un test di inibizione con desametasone (2 mg/die x 7 gg) e dosaggio DHEA-S a giorni 0 e 6. La mancata soppressione del DHEA-S é indicativa della presenza di un tumore surrenale, mentre una completa soppressione si rileva nell’iperplasia surrenalica congenita.
In caso di elevati livelli sierici di DHEA-s occorre impostare una diagnosi differenziale fra ca. del surrene, iperplasia surrenalica congenita, PCOS e iperprolattinemia. Un DHEA-S lievemente aumentato é un reperto costante nelle p/ti anovulatorie e iperprolattinemiche. In caso di valori elevati di DHEA-s occorre eseguire un test di inibizione con desametasone (2 mg/die x 7 gg) e dosaggio DHEA-S a giorni 0 e 6. La mancata soppressione del DHEA-S é indicativa della presenza di un tumore surrenale, mentre una completa soppressione si rileva nell’iperplasia surrenalica congenita.
Invece, in presenza di iperandrogenismo, Valori normali di DHEA-S indicano che l’iperandrogenismo è da ricercarsi in alterazioni secretive dell’ovaio. 
Il testosterone (T): è il principale androgeno biologicamente attivo presente in circolo, deriva in quantità approssimativamente equivalenti dalla secrezione ghiandolare di ovaio e surrene (25% + 25%) e per il 50% dalla conversione periferica di androstenedione a livello di fegato, milza e tessuto adiposo. Il suo valore sierico medio è di 35 ng/dl. E’ l’unico androgeno ad essere legato ad una proteina specifica, la SHBG (69%). Il testosterone libero è costituito dal free-testosterone (1%) e dal testosterone legato all’albumina (30%). 
DHT: Il diidrotestosterone deriva quasi esclusivamente dalla conversione periferica del testosterone ad opera della 5-α-reduttasi, essendo trascurabile la secrezione diretta ghiandolare. Il DHT è l’ormone direttamente responsabile dell’accrescimento pilifero.
testosterone ad opera della 5-α-reduttasi, essendo trascurabile la secrezione diretta ghiandolare. Il DHT è l’ormone direttamente responsabile dell’accrescimento pilifero.
17-OH-Progesterone: In caso di deficit della 21-idrossilasi si assiste ad un aumento sierico del 17-OH-progesterone (>2 ng/ml in fase follicolare precoce), da mancata trasformazione del 17-OH-P in desossicortisolo, che caratterizza la iperplasia surrenalica non classica (NCAH) (26). Test all’ACTH: 25 μg in flebo; in caso di NCAH da deficit di 21-idrossilasi si avrà un valore sierico di 17-OH-P >10 ng/ml. Un tasso di > 5 ng/ml fa sospettare un deficit di 21-idrossilasi. Se i valori sierici oscillano tra 2 e 5 ng/ml si ricorrerà al test all’ACTH: in caso di risposta esagerata (> 10 ng/ml dopo 60’) si porrà diagnosi di deficit di 21-idrossilasi; se invece il tasso è <10 ng/ml si doserà il T e se questi è >2 ng/ml si sospetterà un ca. ovarico, se <2 ng/ml si sospetterà una PCOS (tab. 19). Nelle forme di iperplasia surrenale congenita da deficit della 21-idrossilasi a insorgenza tardiva non é comunque sufficiente dosare il 17-OH progesterone plasmatico in condizioni basali, ma é necessario eseguire un test di stimolo con ACTH che induce in queste pazienti un esagerato incremento dei valori di 17-OH-progesterone. Nelle pazienti con irsutismo senza virilizzazione i dati ottenibili con i comuni esami ormonali sono in genere scarsamente indicativi. Nelle pazienti con ovaio policistico si può osservare incostantemente un aumento modesto di DHEA-S o del testosterone o di entrambi. Nelle pazienti in cui si sospetta una policistosi ovarica é utile dosare anche LH e FSH in almeno 3 campioni di sangue prelevati a distanza di 20-30 minuti. I livelli di LH tendono a essere superiori alla norma con rapporto LH/FSH aumentato. Comunque, data la grande variabilità dei tassi delle gonadotropine nel plasma, questi dati devono essere interpretati con cautela. Una sindrome di Cushing può essere facilmente esclusa in base alla valutazione dei dati clinici e a un test di inibizione con desametazone. Nella maggior parte dei casi di irsutismo da aumentata utilizzazione periferica degli androgeni solo studi di ordine metabolico, non eseguibili nella pratica clinica, possono dimostrare l’esistenza dell’iperandrogenismo, mentre la misura dei livelli plasmatici o il dosaggio dei metaboliti urinari, possono risultare del tutto normali.
17-alfa-OH-Progesterone é elevato nei casi di deficit della 21-idrossilasi (CAH). Può essere moderatamente elevato nei casi di PCOS.
SHBG (Sex Hormone Binding Globulin): gli androgeni T e DHT circolano legati a una globulina prodotta dal fegato nota come SHBG ed in minor misura all’albumina. Nelle donne solo l’1% del testosterone presente in circolo é libero e biologicamente attivo. Quando si dosa il testosterone si misura abitualmente il testosterone totale, vale a a dire quello legato e quello libero. In alcune condizioni morbose, la produzione di SHBG da parte del fegato può essere ridotta o aumentata. Se la sintesi di SHBG é ridotta, per es. in una paziente con ipotiroidismo primitivo, per mantenere costante la quota di testosterone libero la clearance metabolica del testosterone tende ad aumentare e i livelli di testosterone totale circolante risultano ridotti. L’inverso avviene quando la sintesi di SHBG é stimolata come in caso di ipertiroidismo, la cirrosi epatica, la gravidanza, terapia estrogenica. Le SHBG hanno un’altissima affinità per il T, DHT, T, E2 e DHEA. Solo l’1% del T circola libero; ma nell’iperandrogenismo la quantità di T che circola libero aumenta. Così pure nella dnna irsuta aumenta la clearance del T e quindi si può aver iperandrogenismo nonostante normali livelli di T. L’androstenedione ha una scarsissima affinità per la SHBG e circola soprattutto libero e solo in parte legato debolmente all’albumina. Ha un tasso di produzione, metabolismo, concentrazione sierica sempre uguale in uomini e donne normali ed irsute.
SHBG: produzione intraepatica. In caso di epatopatie la sua produzione diminuisce e quindi aumenta la quota libera di testosterone circolante cioè la quota che é subito disponibile per essere usata.
FAI (Free Androgen Index): si calcola con la formula {(T) x (6.11-2.38 x log 10 [SHBG])}. Gli androgeni liberi aumentano in circolo nelle pazienti PCOS.
Il 3-β-androstendiolo è il metabolita ultimo della via degli androgeni e spesso il suo aumento è l’unico dato rilevabile in una donna irsuta, deriva dalla riduzione del DHT a livello epatico e cutaneo di DHT. I dosaggi vanno effettuati entro i primi 7 giorni del ciclo e al mattino entro le ore 10.00. I livelli di androgeni nel sangue sono pulsatili quindi occorre ripetere diverse volte i dosaggi.
test al Gn-RH: esagerata produzione di 17-α-OH-P per una disregolazione della 17-20 desmolasi, enzima costituente del citocromo P450 a sua volta controllato dal gene CYP 11 e conseguente mancata trasformazione del 17-OH-P in Androstenedione.
g) Prolattina: di origine ipofisaria, va dosata solo in caso di iperandrogenismo associato a galattorrea.
h) Cortisolo: é di origine esclusivamente surrenalica. Il dosaggio del cortisolo libero urinario è indispensabile se si sospetta un ipercortisocismo.
References list:
- Speroff L., Glass R.H., Kase N. G.: “Clinical gynecologie endocrinology and infertility”. Williams & Wilkins Co. USA 1993
- Cato A, Nestl A, and Mink S. 2002. Rapid actions of steroid receptors in cellular signaling pathways. Science’s STKE 2002:
- Gray L, Ostby J, Furr J, Wolf C, Lambright C, Parks L, Veeramachaneni D, Wilson V, Price M, Hotchkiss A, Orlando E, and Guillette L. 2001. Effects of environmental antiandrogens on reproductive development in experimental animals. Human Reproduction Update 7:248-264.
- Gray Jr. LE, Ostby J, Monosson E, and Kelce WR.1999. Environmental antiandrogens: Low doses of the fungicide vinclozolin alter sexual differentiation of the male rat. Toxicology and Industrial Health 15:48-64.
- Hadley M. 2000. Endocrinology. Upper Saddle River, NJ:Prentice Hall.
- Thompson CJ, Ross SM, and Gaido KW. 2004. Di(n-butyl) phthalate impairs cholesterol transport and steroidogenesis in the fetal rat testis through a rapid and reversible mechanism. Endocrinology 145:1227-1237.
- Cortet-Rudelli C. Et Dewally D.: “Hyperandrogènie de l’adolescente”. Encycl Méd Chir (Elsevier, Paris), Gynécologie, 802-A-36, 1996,3p.
- Ferriman D , Gallway JD: “Clinical assessment of body air in women”. J Clin Endocrinol Metab 1961,24:1440-1448.
- Peillon F. et al. ; J. Clin. Endocrinol. Metabol. 73:1008-1015, 1991.
- Volpicelli V, Lauda N, Maisto V. Renzi C., Ferrari A.A.: “Endocrinologia dell’allattamento; breve rassegna e contributo casistico”. Panorama Sanitario 1981;6, 23-37.
- Del Basso F., Volpicelli V., Maisto V., Tomasillo G., Nista L.A., Piedimonte A. e Stozzetti A.: “Prolattina ed oligomenorree secondarie”. (1980; Idelson Ediz., Napoli)
- Genazzani A.: “Endocrinologia Ginecologica”. Ediz. Editeam sas, Cento (Fe); 2004.
Queste pagine fanno parte del sito fertilitycenter.it in internet da marzo 2011. I testi, le tabelle, i disegni e le immagini pubblicati in queste pagine sono coperte da copyright ma a disposizione di tutti per copia e riproduzione purchè venga citata la fonte con link al sito www.fertilitycenter.it.
Ringrazio i lettori per la loro cortese attenzione e li prego di voler comunicare le loro osservazioni e consigli su eventuali errori o esposizioni incomplete.
Enzo Volpicelli




2 commenti
Interesting articles on information like this is a great find. It’s like finding a treasure. I appreciate how you express your many points and share in your views. Thank you.
I used to be able to find good info from your articles.