1,7K
Ultimo aggiornamento 2022-01-31 20:20:47
La funzione riproduttiva, la funzione sessuale e lo sviluppo sessuale è controllata da un meccanismo endocrinologico a sua volta strettamente legato a stimolazioni di quasi tutte le strutture del sistema nervoso centrale (encefalo + tronco encefalico + midollo) mediante neuro-trasmettitori e neuromodulatori.
Tutto il meccanismo si può rappresentare come un asse longitudinale che parte da stimoli periferici che vengono raccolti dalla corteccia cerebrale da cui partoni stimoli neurormonali costituiti da adrenalina, noradrenalina, dopamina, serotonina, aceticolina e peptidi oppioidi che stimolano ipotalamo, e ipofisi da cui partono fattori corticotropinici che stimolano gli organi endocrini della riproduzione. Gli ormoni prodotti da questi ultimi esercitano a loro volta un retro-controllo (feed-back) su ipofisi e ipotalamo teso a regolarne la funzione.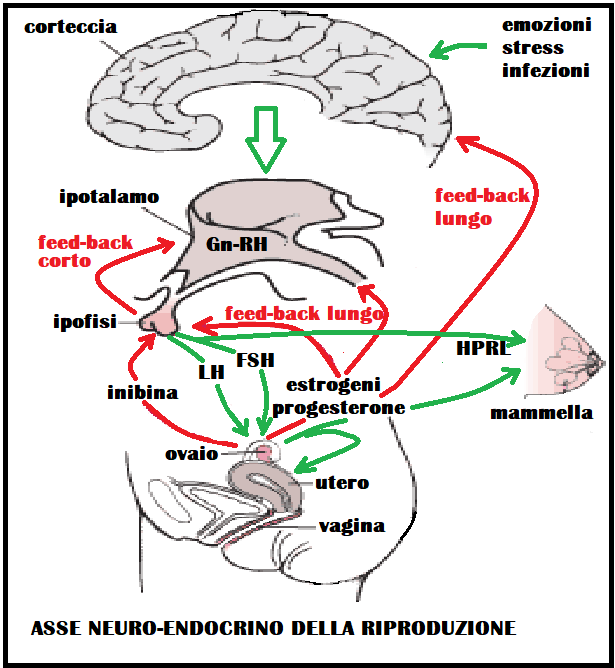

IPOTALAMO:
L’ipotalamo appartiene al sistema nervoso centrale, ma da un punto di vista funzionale i suoi neuroni sono capaci di ricevere sia i segnali che arrivano dalle strutture nervose superiori (Corteccia cerebrale, epifisi, sistema libico) sia quelli che provengono dalle varie ghiandole endocrine (gonadi, ipofisi, ecc.). Stress di vario tipo arrivano alla corteccia cerebrale che risponde con la secrezione di oppioidi (in particolare b-endorfine), neuropeptide Y, dopamina, serotonina, noradrenalina che agiscono sull’ipotalamo che a sua volta produce corticotropine che stimolano la ghiandola ipofisaria a secernere ACTH, Gh, vasopressina, prolattina e gonadotropine ipofisarie.
Gli ormoni prodotti dall’ipotalamo hanno prevalentemente una struttura polipeptidica ed agiscono sulla sottostante ghiandola ipofisaria che é situata nella sella turcica dell’osso sfenoide. 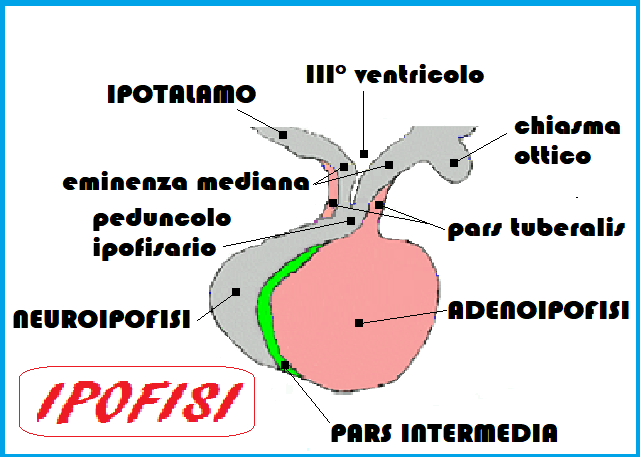

L’ipofisi anteriore o adenoipofisi é collegata all’ipotalamo da un sistema circolatorio (sistema portale) nel quale vengono immessi, ad opera di sinapsi neuro-vascolari, gli ormoni ipotalamici, che arrivano così all’ipofisi; attraverso questo stesso sistema per via retrograda gli ormoni prodotti dall’ipofisi possono giungere all’ipotalamo ed influenzarne le funzioni (feed-back corto). 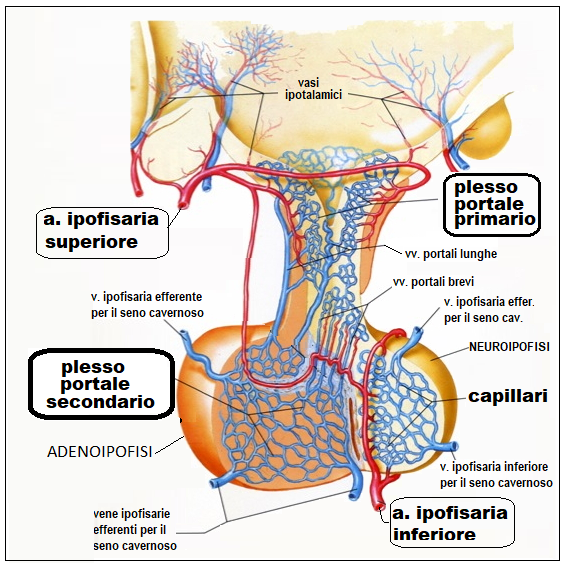

Gli ormoni ipotalamici determinano a livello dell’adenoipofisi la sintesi, l’accumulo e, quindi, la dismissione nel sangue di una serie di prodotti che, come é noto, vengono chiamati tropine in quanto agiscono su altre ghiandole endocrine nell’ambito di funzioni dipendenti da quella ipofisaria (ovaio, testicolo, surrene, accrescimento, funzione cortico-surrenalica, funzione mammaria ecc.). I polipeptidi ipotalamici sono indicati come Releasing Hormone (R.H.). Il termine releasing indica chiaramente che si tratta di ormoni che stimolano la dismissione, il rilascio, l’ingresso nel circolo ematico di altri ormoni come quelli della ghiandola ipofisaria. E’ probabile che esista un RH per ogni tropina ipofisaria; a tutt’oggi si sono potuti isolare e/o sintetizzare soltanto:
- Gn-RH – un Releasing Hormone per le due gonadotropine ipofisarie e cioè il Gn-RH che stimola la secrezione sia della gonadotropina LH sia della FSH e sono secreti a livello dei nn. Sovraottico e Paraventricolare dell’ipotalamo..
- TRH – un Releasing Hormone per la tireostimolina ipofisaria TRH (Thyreotropin Releasing Hormone);
- GH-RH – un Releasing Hormone per l’ormone ipofisario della crescita: GH-RH (Growth Hormone Releasing Hormone);
- ACTH-RH o CRH – un Releasing Hormone per la tropina che stimola il corticosurrene [1] (Corticotropin Releasing Hormone o ACTH Releasing Hormone).

L’ipotalamo produce anche ormoni o fattori che inibiscono la secrezione ipofisaria (Inhibiting Hormones o Inhibiting Factors). Sono stati isolati finora:
- ’inibitore ipotalamico dell’ACTH (Adrenocorticotropin Inhibiting Hormone);
- il fattore o uno dei fattori ipotalamici che inibiscono a livello ipofisario la secrezione di Prolattina (HPRL), cioè la Dopamina (DA);
- ormone ipotalamico che inibisce l’ormone ipofisario della crescita (Growth Hormone Inhibiting Factor) o Somatostatina che inibisce anche la secrezione della prolattina ed è prodotto anche dalle cellule del sistema neuroendocrino APUD (Amine Precursor Uptake and Decarboxylation) diffuso in tutti gli organi.
Feed-back:
Le strutture ipotalamiche e sottoipotalamiche si influenzano a vicenda, ma la loro funzione viene anche modulata da quegli stessi ormoni periferici la cui produzione era stata stimolata dagli ormoni ipotalamici. Questo significa che l’ipotalamo é l’area funzionalmente più importante nel collegare le azioni dei vari neurotrasmettitori e neuromodulatori corticali e sopraipotalamici alle strutture sottoipotalamiche e ciò attraverso le influenze ormonali che giungono al suo territorio attraverso il circolo ematico. Queste ultime provengono dall’ipofisi (ad opera della variazioni che si verificano nei livelli di gonadotropine e prolattina ecc.) e dall’ovaio (estrogeni e progesterone – androgeni – inibina ecc.). L’ipotalamo cioè viene influenzato nella sua capacità di produrre RH dalla quantità di ormoni ipofisari ed ovarici presenti nel sangue nei vari momenti del ciclo. Questo retrocontrollo da parte dei prodotti di una ghiandola endocrina sulla ghiandola o struttura che in una fase precedente l’ha stimolata viene chiamata feed-back e di solito é di tipo inibitorio o negativo. Ciò significa, nel caso specifico, che quanto più aumenta la produzione di estrogeni a livello dell’ovaio tanto più i livelli ematici di questi steroidi (soprattutto estradiolo) frenano la produzione ipotalalmica di Gn-RH e quella ipofisaria di LH e FSH (feed-back lungo negativo). Inoltre quanto più aumentano i livelli ematici di FSH ed LH ipofisari, tanto più aumenta l’azione di freno da parte di queste gonadotropine sulla produzione di Gn-RH (feed-back corto negativo) e sulla stessa ipofisi (feed-back ultracorto). Tutto questo intrecciarsi di stimoli e inibizioni tra ipotalamo, ipofisi, ovaio e di feed-back che, partendo dalla periferia (ovaio) controllano le funzioni ipotalamo-ipofisarie, é caratteristico della donna e imprime una ciclicità alla sua funzione riproduttiva.
Nell’uomo, sia a livello della spermatogenesi sia a livello della steroidogenesi testicolare, non esistono grosse variazioni per cui si può dire che nel sesso maschile queste funzioni, dalla pubertà in poi (pur con un declinare progressivo verso la senilità variabile da soggetto a soggetto), si mantengono costanti. La produzione di milioni di cellule gametiche (spermatozoi) é continua nell’uomo mentre nella donna, nella quale viene liberato ad ogni ciclo un solo ovocita, la capacità riproduttiva è contenuta nell’età compresa tra la pubertà e la menopausa, ed il periodo fecondo nei pochi giorni che precedono e seguono l’ovulazione.
La ciclicità della funzione riproduttiva nella donna, predeterminatasi a livello ipotalamo-ipofisario già durante lo sviluppo embrionale a causa dell’assenza di testosterone (presente invece nel feto maschio), si manifesta solo dopo la pubertà. A partire da quest’epoca della vita infatti il feed-back negativo che l’estradiolo, prodotto in quantità crescente dal follicolo, esercita sull’ipofisi e l’ipotalamo, si trasforma ad un certo momento (12º-13º giorno del ciclo), in feed-back positivo. Questo provoca un picco di gonadotropina LH molto elevato ed una elevazione dell’FSH di minoro grado. Il picco di LH unitamente ad altri meccanismi che agiscono localmente nella gonade, porta alla rottura del follicolo (ovulazione) verso il 14º-16º giorno del ciclo.
NEUROIPOFISI:
Il lobo posteriore dell’ipofisi è a struttura nervosa (neuroipofisi) e può essere considerato un prolungamento dell’ipotalamo. Alla neuroipofisi arrivano direttamente dall’ipotalamo, tramite i prolungamenti neuronali e non per via ematica, una serie di sostanze secrete dai neuroni di determinate aree ipotalamiche. Queste sostanze vengono poi immesse nel sangue e assumono azioni sistemiche. Fra queste si devono ricordare l’ormone antidiuretico (ADH) o vasopressina e l’ossitocina (OT) che stimola la contrazione della muscolatura liscia uterina durante il parto e le cellule mioepiteliali della ghiandola mammaria durante la suzione del neonato, favorendo l’eiezione del latte.
Vasopressina (ormone antidiuretico, ADH): e l’ossitocina vengono sintetizzate, insieme con le neurofisine, polipeptidi con funzioni di trasporto, nei neuroni dei nuclei sopraottico e paraventricolare, appartenenti al sistema magnocellulare dell’ipotalamo. Si conoscono due tipi di neurofisine: la neurofisina 1 o neurofisina estrogeno-stimolata, specificamente deputata al trasporto dell’ossitocina, e la neurofisina 2 o neurofisina nicotino-stimolata, specifica per la vasopressina. Dai nuclei dove vengono sintetizzati, questi neuroormoni raggiungono l’ipofisi posteriore e neuroipofisi e poi vengono immessi nel sangue. Tramite il terzo ventricolo, la vasopressina e l’ossitocina raggiungono anche il liquido cerebrospinale, attraverso il quale si distribuiscono in aree del SNC distanti da quella di origine. Infine possono portarsi alla base del cervello ed al midollo spinale, dove integrano la risposta neuronale allo stress ed al riflesso della lattazione.
La vasopressina e l’ossitocina sono state recentemente ritrovate anche nell’ovaio, nel liquido follicolare e nella tuba, in concentrazioni più elevate rispetto a quelle presenti nel sangue periferico. E’ pertanto giustificato pensare ad una sintesi locale di questi ormoni che potrebbero svolgere un ruolo importante nella regolazione funzionale e nel controllo del tratto riproduttivo.
La secrezione degli ormoni neuroipofisari é regolata da impulsi centrali e periferici. Il controllo centrale coinvolge le vie colinergiche, noradrenergiche ed i neuropeptidi.
Tra gli stimoli periferici esplicano un’azione stimolante sul rilascio della vasopressina e dell’ossitocina gli estrogeni e l’angiotensina II, mentre il progesterone, il TSH, gli ormoni tiroidei ed i glico-corticoidi hanno un’azione inibente.
Vasopressina – Dal punto di vista funzionale la vasopressina esplica esclusivamente un’azione antidiuretica e partecipa, quindi, alla regolazione dell’ osmolarità e del volume plasmatico; inoltre esplica effetti cardiovascolari, stimola la secrezione di ACTH, interviene nel controllo dei processi di memorizzazione e di alcune funzioni comportamentali.
Ossitocina: viene secreta massivamente in risposta a stimoli specifici, ed, in particolare, durante il parto, quando l’ormone svolge una importante azione come stimolante della contrazione del miometrio e durante l’allattamento, quando l’ossitocina completa l’arco riflesso che origina dal capezzolo e porta all’eiezione del latte.
Al di fuori di queste situazioni, qualunque stimolazione della sfera genitale, ed in particolare la distensione cervicale e vaginale (riflesso di Ferguson), é in grado di indurre la secrezione di ossitocina. Con questo meccanismo si spiega l’eiezione di latte che può verificarsi nella donna durante il rapporto sessuale.
Oltreché nella contrazione uterina e nella lattazione, l’ossitocina sembra intervenire, con meccanismi non ancora ben chiariti, in alcuni processi metabolici e nella secrezione degli ormoni pancreatici. Anche i processi di apprendimento ed il comportamento sembrano influenzati dall’ossitocina che agisce in associazione con la vasopressina; si suppone infine che questo neuroormone possa agire sul trasporto dello sperma nelle vie genitali femminili e sulla contrattilità ovarica (del follicolo ovarico) al momento dell’ovulazione
LOBO INTERMEDIO IPOFISARIO: MSH
L’MSH (ormone stimolante i melanociti) é secreto dai lobi anteriore ed intermedio dell’ipofisi ed é costituito dai primi 13 aminoacidi della catena peptidica dell’ACTH, da cui deriva per scissione enzimatica della molecola. Il precursore é la propiomelanocortina.
La secrezione di MSH presenta strette analogie con quella della PRL: su entrambe agisce il sistema tubero-infundibolare (dopamina, ecc.).
Anche gli steroidi ovarici influenzano la sintesi ed il rilascio di MSH agendo sul turnover di dopamina nel sistema tubero-infundibolare.
ADENOIPOFISI:
Sotto lo stimolo o l’inibizione dell’ipotalamo (Releasing ed Inhibiting Hormone o Factors) l’adenoipofisi produce una serie di ormoni (tropine) di natura proteica.
|
Tab. 2 Ormoni adenoipofisari:
|
|
|
gonadotropine: agiscono sulle gonadi (ovaio e testicolo), si distinguono in:
|
FSH (Follicle Stimulating Hormone = Ormone Stimolante il Follicolo);
|
|
LH (Luteinizing Hormone = Ormone luteinizzante) o ICSH = Interstitial Cell Stimolating Hormone come da molti é indicato l’LH nell’uomo;
|
|
|
Prolattina (PRL)
|
Importante nella preparazione della ghiandola mammaria durante la gravidanza e nella sua funzione durante l’allattamento. Al di fuori dello stato gravidico livelli di PRL non fisiologici possono influenzare negativamente i meccanismi riproduttivi
|
TSH (Thyroid Stimulating Hormone o Thyreotropin) |
|
|
ACTH (Adrenocorticotropin Hormone)
|
|
GH (Growth Hormone): |
|
Nei primati e in altre specie di mammiferi il controllo della funzione gonadica e riproduttiva viene esercitato principalmente da tre ormoni secreti dall’ipofisi anteriore.
Due di questi (le gonadotropine) hanno natura glicoproteica e vengono denominati ormone stimolante il follicolo (FSH = Follicle Stimulating Hormone) ed ormone luteinizzante (LH = Luteinizing Hormone); l’altro ormone, di natura polipeptidica, prende il nome di prolattina (PRL).
L’FSH agisce regolando i processi che controllano lo sviluppo delle cellule germinali nelle gonadi femminili e maschili e stimolando la steroidogenesi.
L’LH agisce sulle cellule steroidogenetiche delle ovaie e del testicolo e regola le concentrazioni locali e periferiche degli steroidi sessuali ovarici, essenziali per un normale svolgimento della funzione riproduttiva. Inoltre l’LH controlla la rottura del follicolo e la liberazione dell’ovocita ed, in linea generale, l’ovulazione e la formazione del corpo luteo.
La prolattina ha caratteristiche strutturali e funzionali completamente diverse dalle gonadotropine. Nei mammiferi la PRL agisce stimolando l’accrescimento della ghiandola mammaria e la produzione di latte, ed esercitando un’azione trofica sulle ovaie, sui testicoli e sui tessuti accessori. Diversamente dall’LH e dall’FSH, la PRL non agisce esclusivamente sulla funzione riproduttiva, ma ha un’azione più generale, potendo influenzare molti processi metabolici ed il ricambio idro-salino.
Struttura chimica delle gonadotropine:
FSH e LH hanno una struttura chimica molto simile: sono entrambe delle glicoproteine contenenti 20% di carboidrati e risultano formate da due catene aminoacidiche, subunità a e b, unite da un legame non covalente ad elevata affinità. La subunità a é uguale per entrambe le gonadotropine, mentre varia la subunità b, in cui la sequenza degli aminoacidi é diversa per LH ed FSH.
Pur essendo la subunità b la sola dotata di specificità di azione, é necessario che essa si combini con la subunità a perché l’azione si manifesti. Probabilmente due sono le ragioni:
a) la presenza nella catena a di alcuni o di tutti i siti deputati al riconoscimento dei recettori, oppure
b) l’acquisizione, da parte della subunità b di una conformazione attiva solo dopo combinazione con la subunità a.
Sintesi ed accumulo delle gonadotropine
La produzione di gonadotropine da parte dell’ipofisi é controllata dall’ipotalamo mediante il GnRH. Questo polipeptide stimola la sintesi e la secrezione di FSH ed LH legandosi ai recettori specifici situati sulla superficie esterna della membrana delle cellule gonadotrope basofile ipofisarie.
Le moderne metodiche immunoistochimiche e immunologiche hanno permesso di stabilire che nella specie umana le cellule gonadotrope sono presenti nella pars distalis dell’ipofisi anteriore e sono di misura medio-piccola. Queste cellule contengono due tipi di granulazione, una del diametro di circa 200 nm (contenente LH), l’altra del diametro di 400-500 nm (contenente FSH). In alcune cellule sono riscontrabili entrambi i tipi di granuli mentre in altre si può riscontrare solo una delle due gonadotropine. La presenza di LH ed FSH nella stessa popolazione cellulare e contemporaneamente in diverse popolazioni cellulari spiega la sincronicità di secrezione pulsatile per FSH ed LH in fase follicolare e la diversità di secrezione in fase luteale. Sembra che la secre zione di FSH dipenda quasi esclusivamente dal Gn-RH mentre la secrezione di LH sembra influenzata molto da altri fattori come ad esempio da inibina, attivina e follistatina tutti ormoni polipeptidici prodotti soprattutto dall’ovaio ed in parte dal surrene.
Meccanismo d’azione delle gonadotropine:
Le gonadotropine, come le altre tropine dell’ipofisi, posseggono la proprietà di agire su recettori situati sulla membrana plasmatica della cellula-bersaglio. L’FSH agisce sulle cellule della granulosa.
Sia alterazioni delle membrane recettoriali, sia modificazioni della molecola della gonadotropina possono interferire con la capacità di legame e con l’attività fisiologica dell’ormone. E’ sufficiente che l’ormone si leghi all’1% dei recettori presenti per innescare il processo di attivazione dell’AMPc (Adenosin Monofosfato ciclico).
Il susseguirsi delle varie reazioni provoca diversi tipi di effetti a livello delle gonadi, a breve ed a lungo termine. Gli effetti a breve termine consistono essenzialmente nella induzione della steroidogenesi, e la produzione di armatasi da parte delle cellule della granulosa mentre quelli a lungo termine comprendono la sintesi di DNA e la divisione cellulare, la stimolazione dell’RNA-polimerasi a livello nucleare (trascrizione) e quindi la sintesi di nuove proteine e l’accrescimento cellulare. La risposta delle cellule-bersaglio alle gonadotropine é facilitata dalle prostaglandine intracellulari.
Un altro importante mediatore intracellulare della risposta agli ormoni gonadotropi é il calcio, la cui attività biologica é possibile solo in presenza di una proteina regolatrice della calciomodulina la quale partecipa, con il calcio e l’AMPc, alla regolazione dell’attività metabolica intracellulare.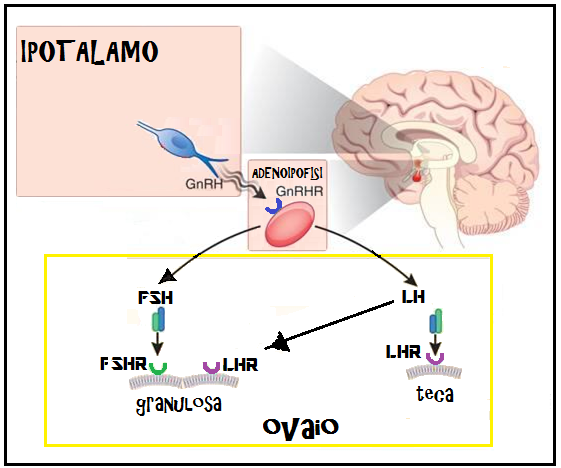

Rilascio delle gonadotropine:
La secrezione nell’ipofisi anteriore delle gonadotropine LH ed FSH come si é detto é stimolata da un peptide ipotalamico denominato GnRH (Gonadotropin-Releasing Hormone) oppure LH-RH (Releasing Hormone) oppure Gonadoliberina. Fino ad ora non é stato possibile identificare un releasing hormone separato per l’FSH, e la secrezione dell’FSH sembra essere, almeno in parte, regolata dal Gn-RH.
La risposta delle cellule gonadotrope ipofisarie al Gn-RH varia in maniera evidente durante le varie fasi del ciclo mestruale, con modificazioni sia sulla sensibilità sia sulla riserva gonadotropinica. Queste modificazioni sono attribuibili in parte all’effetto nodulante sulla sensibilità e sulla riserva ipofisaria esercitato dagli steroidi ovarici, in parte dell’effetto sensibilizzante (self priming) dello stesso Gn-RH nel processo di liberazione delle gonadotropine da parte dell’ipofisi. La modalità di rilascio delle gonadotropine da parte dell’ipofisi e pulsatile ed é la diretta conseguenza della secrezione pulsatile del Gn-RH ipotalamico nel circolo portale; le pulsazioni o polsi (pulse) di LH ed FSH aumentano della sensibilità e della riserva ipofisaria, come si avvicina il periodo ovulatorio.
Modificazioni nella frequenza e nell’ampiezza della stimolazione ipofisaria da parte del Gn-RH alterano profondamente sia le concentrazioni plasmatiche di LH ed FSH sia il rapporto LH/FSH, provocando quindi irregolarità nella maturazione follicolare e nell’ovulazione. Durante il ciclo mestruale le modificazioni nella pulsatilità dell’LH sono dipendenti da corrispondenti variazioni nella frequenza e nell’ampiezza della pulsatilità del Gn-RH e dalla azione modulante, a livello ipotalamico ed ipofisario, dei meccanismi di feed-back steroidei. Infatti l’estradiolo causa un aumento nella frequenza delle pulsazioni di Gn-RH con conseguente aumento della sua concentrazione media nel sistema portale, e provoca un corrispondente aumento nelle pulsazioni di LH plasmatico. Al contrario il progesterone sembra indurre le pulsazioni di LH, probabilmente attraverso una riduzione della frequenza di quelle del Gn-RH.
In definitiva i dati fin qui raccolti dimostrano che durante il ciclo riproduttivo l’estradiolo e il progesterone agiscono in senso opposto nel modulatore la frequenza delle pulsazioni del Gn-RH, ed in maniera sinergica sulla responsività dell’ipofisi alla stimolazione del Gn-RH.
Le gonadotropine presenti nel plasma possono essere misurate sia con metodiche radioimmunologiche, che sono quelle oggi più usate, sia con metodiche biologiche.
Le tecniche biologiche, ed in particolare quella radiorecettoriale, sono più specifiche ma meno sensibili rispetto a quelle radioimmunologiche.
Concentrazioni plasmatiche delle gonadotropine nelle varie epoche della vita della donna:
I livelli plasmatici delle gonadotropine non sono costanti, ma variano in relazione alle ore della giornata, al periodo del ciclo mestruale ed all’età.
La modalità pulsatile di secrezione delle gonadotropine é un fenomeno comune sia all’uomo sia alla donna, che compare alla fine della pubertà. Tuttavia nell’uomo la secrezione gonadotropinica come la steroidogenesi ha carattere piuttosto continuo (tonico), mentre nella donna esistono variazioni più appariscenti che danno ciclicità alla funzione riproduttiva. Le pulsazioni sono caratterizzate da un incremento rapido delle gonadotropine della durata di 10-15 minuti, seguito da una caduta più lenta. I pulses dell’FSH sono quantitativamente più piccoli di quelli dell’LH, con i quali sovente, ma non obbligatoriamente, coincidono. La frequenza dei polses varia in relazione all’epoca del ciclo mestruale: i polses intervengono ogni 1-2 ore in fase follicolare e ogni 4 ore circa in fase luteinica. A metà ciclo si verifica un aumento della frequenza e dell’ampiezza dei polses, coincidente con la maggiore sensibilità dell’ipofisi al Gn-RH in questa fase.
Durante il ciclo mestruale la secrezione delle gonadotropine viene regolata dagli steroidi ovarici attraverso i vari meccanismi di feed-back. I livelli plasmatici di LH aumentano in modo lento e graduale durante tutta la fase follicolare e si innalzano poi bruscamente, talora in modo bifasico, raggiungendo valori di picco in fase preovulatoria, quindi declinano nel corso di tutta la fase luteinica. Le concentrazioni plasmatiche dell’FSH presentano un incremento nell’ultima parte del periodo luteinico ed all’inizio della fase follicolare del ciclo successivo, quindi una diminuzione costante, interrotta a metà ciclo da un piccolo picco, coincidente con quello molto più accentuato dell’LH.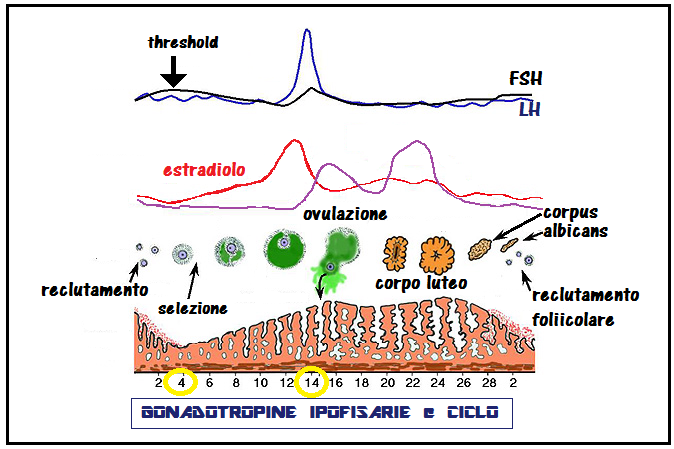

Accanto alle fluttuazioni mensili, che caratterizzano il ciclo mestruale, modificazioni a breve termine a variazioni episodiche nella secrezione delle gonadotropine si verificano nelle varie epoche dello sviluppo.
Alla nascita e nell’infanzia le concentrazioni plasmatiche di LH ed FSH sono basse.
All’inizio della pubertà i livelli plasmatici dell’FSH aumenta più rapidamente rispetto a quelli dell’LH. Inoltre, in coincidenza con l’inizio della pubertà, si manifesta la modalità pulsatile di secrezione delle gonadotropine, in un primo momento evidente solo durante il sonno. Man mano che la pubertà avanza, la risposta dell’LH a Gn-RH aumenta notevolmente e supera quella dell’FSH; inoltre il pattern pulsatile di secrezione si manifesta non solo durante il sonno ma anche durante le ore di veglia In climaterio, infine, si assiste ad un graduale cambiamento della secrezione gonadotropinica, caratterizzata soprattutto dalla perdita della ciclicità, e da un tipo di secrezione tonica con valori plasmatici di gonadotropine nettamente più elevati di quelli riscontrabili in età fertile.
L’emivita in circolo delle gonadotropine dipende essenzialmente dal loro contenuto in acido sialico: così l’emivita dell’FSH (5% di acido sialico) é di soli 30/60 minuti. Il catabolismo delle gonadotropine si realizza soprattutto a livello epatico, dove le glicoproteine precedentemente privata dell’acido sialico vengono dismesse dalla circolazione mediante legame con i recettori epatici per le glicoproteine desializzate.
L’escrezione delle gonadotropine avviene prevalentemente per via renale, ed é proporzionale alla quantità prodotta.
Effetti biologici delle gonadotropine:
L’FSH e l’LH stimolano, come si é detto, la maturazione e la funzione delle gonadi e regolano i processi di gametogenesi e di steroidogenesi.
FSH – L’azione biologica dell’FSH si esplica sulla maturazione e sulla replicazione delle cellule deputate ad influenzare la gametogenesi: le cellule della granulosa dell’ovaio e le cellule si Sertoli del testicolo. Per il tramite di questi recettori l’FSH, agendo sinergicamente con l’estradiolo e l’LH, stimola l’accrescimento follicolare e la maturazione del follicolo oltre lo stadio della formazione dell’antro. L’estradiolo aumenta la responsività delle cellule della granulosa all’FSH; inoltre provoca un aumento dei recettori per l’FSH nel follicolo in via di sviluppo.
L’FSH stimola un marcato aumento dei recettori per l’LH, e dell’attività 3-á-idrossisteroidodeidrogenasica nelle cellule della granulosa, senza comunque provocarne la luteinizzazione.
La comparsa dei recettori per l’LH nelle cellule della granulosa del follicolo preovulatorio si accompagna alla perdita dei recettori per l’FSH. Pertanto le cellule della granulosa inizialmente contengono recettori per l’FSH e proliferano fino a determinare un netto aumento dei recettori per l’FSH nel follicolo. Successivamente, continuando la proliferazione delle cellule della granulosa fino a raggiungere lo stadio di follicolo antrale, si verifica la formazione, sotto l’influenza dell’FSH, dei recettori per l’LH. La maturazione del follicolo si associa quindi con la comparsa dei recettori per l’LH nelle cellule della granulosa e, probabilmente, é con il legame dell’LH sul recettore che iniziano i processi che portano alla luteinizzazione.
Un’altra importante azione dell’FSH a livello ovarico consiste nello stimolare, nelle cellule della granulosa, l’aromatizzazione degli androgeni in 17-ß-estradiolo. Questo effetto é analogo a quello dell’FSH sulle cellule di Sertoli del testicolo ed ha importanti implicazioni per il controllo della steroidogenesi nel follicolo ovarico.
LH – L’LH agisce sulle cellule della teca e su quelle della granulosa. L’azione sulle cellule tecali si esercita per tutto il tempo della maturazione follicolare. L’effetto meglio conosciuto di questa stimolazione é la produzione di androgeni. Allorché il follicolo ha raggiunto la maturazione l’improvvisa elevazione preovulatoria dell’LH (surge dell’LH) provoca, dopo un periodo di stimolazione, un effetto inibitore sulla steroidogenesi, che si manifesta allorché i tassi plasmatici di LH non hanno ancora raggiunto i valori massimi, e si traduce a livello del follicolo in una brusca caduta preovulatoria della secrezione di androgeni ed estrogeni.
L’azione dell’LH sulle cellule della granulosa si manifesta alla fine della fase follicolare, dopo la comparsa di recettori specifici per questa gonadotropina. L’LH provoca un arresto della proliferazione delle cellule della granulosa, una diminuzione del numero dei recettori per l’FSH e l’inizio della secrezione intrafollicolare di progesterone, cui segue l’inizio della luteinizzazione, anche se questa non può che essere estremamente parziale prima dell’ovulazione per l’azione inibitoria di sostanze presenti nel liquido follicolare, in particolare l’estradiolo e l’inibitore della luteinizzazione.
Il picco preovulatorio (surge) dell’LH é essenziale per l’ovulazione; inoltre il surge dell’LH provoca anche la maturazione dell’ovocita, con conseguente ripristino della divisione meiotica arrestatasi durante la via fetale.
L’LH controlla la secrezione endocrina del corpo luteo, per la cui normale funzione é necessaria la costante presenza di questa gonadotropina. Infine l’LH controlla l’attività del tessuto stromale ovarico la cui capacità steroidogenetica (produzione di androgeni) risulta notevolmente potenziata dalla presenza di tassi elevati di LH.
Questi risultati indicano che l’LH non è necessario per la produzione ovarica di E2; le cellule della granulosa, in assenza di LH, possono utilizzare gli androgeni prodotti dal surrene o dalle cellule tecali stimolate dall’FSH per produrre l’E2 intrafollicolare (1).
EPIFISI (o ghiandola pineale): melatonina, arginina-vasotocina,
- La melatonina viene secreta dall’epifisi o ghiandola pineale, la cui attività viene fondamentalmente regolata dalla luce e dai meccanismi endogeni responsabili dei vari ritmi. Anche l’esercizio fisico e gli steroidi sessuali possono influenzare l’attività della ghiandola pineale: Il primo provoca un aumento dei livelli plasmatici di melatonina e questo effetto potrebbe avere un qualche ruolo nell’eziopatogenesi dell’amenorrea delle atlete; i secondi sembra possano inibire la secrezione di melatonina. La secrezione di melatonina ha un andamento ciclico, con un picco notturno nelle ore del sonno. Sembra infatti che il sonno sia una conseguenza del surge della melatonina. Infatti negli anziani il deficit di melatonina nelle ore notturne sembra essere responsabile dell’insonnia degli anziani. L’azione della melatonina sulla funzione riproduttiva nell’uomo è controversa e non ben conosciuta; é stata ipotizzata un’attività antigonadica della melatonina. Quello che é certo é che la ghiandola pineale non é essenziale per la funzione riproduttiva, dal momento che la sua rimozione non ha alcun effetto duraturo né nel maschio né nella donna.
- Arginina-vasotocina: un peptide isolato dall’epifisi, a struttura simile a quella dell’ossitocina e della vasopressina, é stata ipotizzata un’azione antigonadica. Tuttavia le conoscenze delle azioni sull’apparato riproduttivo di queste sostanze sono ancora molto limitate.
articoli correlati:
Ovulazione
GH (Growth Hormone)
Endorfine (Peptidi oppioidi) e fattori che influenzano il fegato ed il pancreas.
References:
- Enrico Carmina, Rogerio A. Lobo, in Yen and Jaffe’s Reproductive Endocrinology (Eighth Edition), 2019
- Bernard Corenblum, Jessica Boyd, Endocrinology and disorders of the reproductive system in Endocrine Biomarkers, 2017
- Ben-Chetrit A; Gotlieb L; Wong PY; Casper RF: “Ovarian response to recombinant human follicle-stimulating hormone in luteinizing hormone-depleted women: examination of the two cell, two gonadotropin theory”. Fertil Steril. 1996 Apr. 65(4). P 711-7.
[1] La CRH sembra, tra l’altro, responsabile della depressione post-partum.



18 commenti
I do agree with all the concepts you have offered for your post.
They are very convincing and will certainly work.
Still, the posts are too quick for beginners. May you please
lengthen them a little from subsequent time? Thank
you for the post.
yes iou do!
thank you!
enzo volpicelli
Everything is very open with a precise clarification of the challenges.
It was really informative. Your website is very useful. Many thanks for
sharing!
Hello, Neat post. There is an issue with your website in internet explorer, may test this?
IE nonetheless is the marketplace leader and a huge section of people will miss
your magnificent writing due to this problem.
I am extremely impressed with your writing skills
as smartly as with the structure in your weblog.
Is this a paid subject matter or did you customize it your self?
Anyway stay up the nice quality writing, it’s rare to see a nice weblog like this one these days..
Terrific work! This is the kind of information that are supposed to be shared around the web.
Shame on the seek engines for not positioning this publish upper!
Come on over and consult with my web site . Thank you =)
Link exchange is nothing else however it is only placing the other person’s weblog link on your page at proper place and other person will also do same for you.
You actually make it seem so easy with your presentation but I find this matter to be really something that I think I would never understand.
It seems too complicated and very broad for me. I am looking forward for your next post, I will try to
get the hang of it!
Awesome issues here. I am very glad to peer your article.
Thanks a lot and I am taking a look forward to contact you.
Will you please drop me a e-mail?
Very great post. I just stumbled upon your blog and wished
to say that I have truly enjoyed surfing around your blog posts.
In any case I will be subscribing in your feed and I’m hoping you write once more soon!
You should take part in a contest for one of the greatest blogs on the internet.
I will highly recommend this site!
bookmarked!!, I really like your blog!
Attractive section of content. I just stumbled upon your
weblog and in accession capital to assert that I get in
fact enjoyed account your blog posts. Anyway I’ll be subscribing to your feeds and even I achievement you access consistently fast.
Greate article. Keep writing such kind of
information on your site. Im really impressed by your blog.
Hey there, You have done an excellent job. I will certainly digg
it and in my view recommend to my friends. I’m confident they’ll be benefited from this web site.
I am regular reader, how are you everybody? This paragraph posted at
this website is really good.
Magnificent web site. Lots of useful info here. I am sending it to some friends ans also
sharing in delicious. And of course, thanks to your sweat!
Article writing is also a excitement, if
you know then you can write otherwise it is complex to write.
Grazie veramente per tutte le informazioni dettagliate!
Vorrei sapere in merito alla patologia del morbo di Basedow se vi risulta che ci
siano precisi legami con gli ormoni responsabili della crescita dei capelli.
Un anno prima di assumere farmaci per la tiroide ho notato che i capelli
sono diventati più sottili, crespi e con crescita lentissima fino a bloccarsi.
Questa situazione dura da 3 anni. Esistono cure specifiche?
C’è correlazione tra questo ‘rallentamento-blocco’ nella crescita dei capelli e la
difficoltà di concepimento?
Grazie
Virginia