 Placental Lactogen) e, soprattutto con l’ormone somatotropo GH (Growth Hormone) perchè i geni che codificano questi tre ormoni risultano dalla duplicazione di un gene ancestrale comune.
Placental Lactogen) e, soprattutto con l’ormone somatotropo GH (Growth Hormone) perchè i geni che codificano questi tre ormoni risultano dalla duplicazione di un gene ancestrale comune. Le macromolecole di PRL, che si riscontrano circa nel 20% delle risposte dei laboratori clinici, causando spesso problemi nell’interpretazione dei risultati, hanno però una ridotta attività biologica. Infatti le grandi dimensione delle molecole di BigPRL e di BigBigPRL non consentono un rapido passaggio attraverso i capillari, riducendo la possibilità di interagire con i recettori tessutali per la PRL (35).
Inoltre le macroprolattinemie non rispondono all’azione inibitoria della dopamina e della bromocriptina (34). La prevalenza di macroprolattinemia in pazienti con iperprolattinemia varia tra il 15 ed il 45%, ed il rapporto femmine/maschi è di 16:1. Vallette-Kasic in 42 pazienti con macroprolattinemia seguite per almeno 5 anni ha verificato che i livelli di PRL rimangono pressocchè invariati nel tempo (36). Le big-prolattine sembrano aver un effetto stimolante sulle cellule secernenti l’ormone GH (17, 22-25).
 “lattotrope”, acidofile, dell’adenoipofisi da dove la prolattina viene immessa in circolo mediante un processo di esocitosi. Le cellule lattotrope costituiscono il 15-25% delle cellule ipofisarie. La secrezione ha un ritmo pulsatile con 13-14 picchi giornalieri ogni 90 minuti, sincroni con i picchi di LH, probabilmente per azione diretta del Gn-RH sulle cellule lattotrope o mediata da un fattore paracrino prodotto dalle cellule gonadotrope.
“lattotrope”, acidofile, dell’adenoipofisi da dove la prolattina viene immessa in circolo mediante un processo di esocitosi. Le cellule lattotrope costituiscono il 15-25% delle cellule ipofisarie. La secrezione ha un ritmo pulsatile con 13-14 picchi giornalieri ogni 90 minuti, sincroni con i picchi di LH, probabilmente per azione diretta del Gn-RH sulle cellule lattotrope o mediata da un fattore paracrino prodotto dalle cellule gonadotrope.  L’HPRL, nelle donne in età fertile, oltre che nell’adenoipofisi, viene secreta nella placenta, nella decidua e nell’endometrio di tipo secretivo. Il significato della produzione endometriale ed il suo eventuale ruolo nel processo di annidamento dell’embrione non sono per ora conosciuti (1,2,16).
L’HPRL, nelle donne in età fertile, oltre che nell’adenoipofisi, viene secreta nella placenta, nella decidua e nell’endometrio di tipo secretivo. Il significato della produzione endometriale ed il suo eventuale ruolo nel processo di annidamento dell’embrione non sono per ora conosciuti (1,2,16).
In condizioni fisiologiche il tasso sierico di HPRL ha dei picchi ogni 90 minuti (sincrono con quello dell’LH) e segue un ritmo circadiano con valori massimi durante il sonno REM, corrispondente in genere alle ore 4 del mattino, e valori minimi al risveglio. A livello plasmatico si osserva anche un picco di PRL 45′ dopo un pasto. Valori sierici normali sono in media:
- Nelle donne NON in gravidanza: < 25 ng/mL
- Nelle donne gravide: 34-386 ng/mL
- Negli uomini: < 15 ng/mL
Effetti biologici della prolattina: due sono i principali organi bersaglio: mammella ed ovaio. Dopo il parto agisce sull’inizio e sul mantenimento della lattazione (galattogenesi e galattopoiesi, rispettivamente). Sull’ovaio esercita un’azione permissiva nei riguardi delle gonadotropine ipofisarie (FSH e LH) per quanto si riferisce all’azione di queste ultime sull’ovaio. Non si conoscono gli effetti sugli altri organi in cui pure è presente.
1. Lattazione– La mammella è l’organo “target” della prolattina che insieme agli estrogeni, progesterone, GH, hPL, insulina, steroidi surrenalici e tiroxina, determina l’iperplasia e l’ipertrofia della ghiandola mammaria ed è responsabile dell’inizio della lattazione e del suo mante nimento. La prolattina si lega ai recettori specifici delle cellule alveolari mammarie ed attiva l’enzima protein-kinase e la biosintesi di numerosi tipi di RNA e conseguentemente la sintesi delle proteine del latte, come la caseina e la lattoalbumina, la produzione di enzimi per la sintesi del lattosio come la galattosiltransferasi e e la N-acetilattosemia sintetasi. Gli acidi grassi e i fosfolipidi hanno anch’essi una produzione più elevata promossa dalla prolattina. L’HPRL, inoltre, potenzia la responsività dei suoi stessi recettori a livello mammario (11). I livelli sierici di HPRL si mantegono elevati nelle prime fasi del travaglio per poi abbassarsi progressivamente fino a raggiungere un minimo a 2 ore prima del parto; nell’immediato post-partum cominciano a risalire, per tornare ad abbassarsi in modo progressivo entro 4-6 settimane. La suzione scatena un meccanismo riflesso autonomo “milk let-down reflex” o “milk ejection reflex” consistente nel rilascio di ossitocina da parte della neuroipofisi; che provoca la eiezione del latte grazie alla contrazione delle miocellule perialveolari mammarie. La suzione dei capezzoli inoltre incrementa la secrezione dell’HPRL dall’ipofisi anteriore e quindi la prosecuzione della lattazione (21).
nimento. La prolattina si lega ai recettori specifici delle cellule alveolari mammarie ed attiva l’enzima protein-kinase e la biosintesi di numerosi tipi di RNA e conseguentemente la sintesi delle proteine del latte, come la caseina e la lattoalbumina, la produzione di enzimi per la sintesi del lattosio come la galattosiltransferasi e e la N-acetilattosemia sintetasi. Gli acidi grassi e i fosfolipidi hanno anch’essi una produzione più elevata promossa dalla prolattina. L’HPRL, inoltre, potenzia la responsività dei suoi stessi recettori a livello mammario (11). I livelli sierici di HPRL si mantegono elevati nelle prime fasi del travaglio per poi abbassarsi progressivamente fino a raggiungere un minimo a 2 ore prima del parto; nell’immediato post-partum cominciano a risalire, per tornare ad abbassarsi in modo progressivo entro 4-6 settimane. La suzione scatena un meccanismo riflesso autonomo “milk let-down reflex” o “milk ejection reflex” consistente nel rilascio di ossitocina da parte della neuroipofisi; che provoca la eiezione del latte grazie alla contrazione delle miocellule perialveolari mammarie. La suzione dei capezzoli inoltre incrementa la secrezione dell’HPRL dall’ipofisi anteriore e quindi la prosecuzione della lattazione (21).
2. endocrinologia della riproduzione: le alterazioni riscontrate nel corso di stati ipo/iperprolattininemici dimostrano con certezza che la prolattina svolge un ruolo importante nella fisiopatologia della riproduzione. Durante il ciclo mestruale i livelli sierici di HPRL (range di normalità: 5-20 ng/ml) presentano variazioni, anche se non molto pronunciate e sopra specificate; tassi più elevati si riscontrano a metà ciclo e durante la fase luteale. Per quanto riguarda l’azione della prolattina nella steroidogenesi ovarica sembra che minime quantità di questo ormone siano indispensabili per assicurare la maturazione follicolare e, soprattutto, la formazione ed il mantenimento del corpo luteo. La presenza di quantità fisiologiche di prolattina nel corpo luteo é essenziale per la produzione del progesterone (perciò la prolattina è chiamata anche ormone luteotropo, LTH).
Al contrario una iperprolattinemia induce innanzitutto un’insufficienza del corpo luteo e conseguentemente LDP, oligo-amenorrea, anovulazione, isterometria inferiore alla norma, iperecogenicità del parenchima uterino, IUS sottile, ovaie ipoplasiche e ad ecostruttura piatta, ACF inferiore alla norma; molto rara la presenza di idrometra (12,13,37-42).
Il meccanismo con cui si realizza l’effetto luteolitico sembra ricondursi essenzialmente ad attivazione dopaminergica e conseguente riduzione e blocco del rilascio di Gn-RH e quindi riduzione e blocco della secrezione ipofisaria di gonadotropine (20).
EZIOLOGIA DELLA IPERPROLATTINEMIA: l’iperprolattinemia può avere cause fisiologiche, farmacologiche e patologiche.
a) condizioni fisiologiche: che possono determinare un aumento di produzione di prolattina da parte dell’ipofisi rientrano il sonno, la gravidanza, la suzione del capezzolo, l’orgasmo, l’esercizio fisico e lo stress. Diete iperproteiche ricche di arginina, tirosina e triptofano stimolano la secrezione di HPRL.
b) cause patologiche che più frequentemente determinano un’eccessiva e persistente secrezione di prolattina, vanno menzionati gli adenomi ipofisari prolattino-secernenti (prolattinomi). Anche i tumori ipotalamici e le patologie infiltrative della regione ipotalamo-ipofisaria possono essere causa di iperprolattinemia. Altre cause comprendono l’ipotiroidismo, l’insufficienza renale cronica, la cirrosi epatica, leiomiomi, e le lesioni della regione toraco-mammaria. L’iperprolattinemia si riscontra, inoltre, in altre patologie di ambito endocrinologico (come l’acromegalia e l’obesità) o ginecologico (sindrome dell’ovaio policistico, PCOS).
c) Farmaci – Valori elevati di prolattina possono essere indotti, infine, dall’assunzione di determinati farmaci (iperprolattinemia iatrogena), soprattutto:
- Antipertensivi, antagonisti della dopamina (α-metil-dopa, Aldomet®): agiscono impedendo l’attività della L-dopa-decarbossilasi che catalizza la trasformazione della L-dopa in dopamina,
- antidepressivi e tranquillanti come le Benzodiazepine, fenotiazine, butirrofenoni, ecc..
- Anche i contraccettivi orali estroprogestinici possono indurre aumenti di prolattina.
3. funzione sessuale: La prolattina contribuisce al senso di soddisfazione dopo l’atto sessuale. Ma, sia nell’uomo che nella donna, l’iperprolattinemia si accompagna ad alterazioni della funzione sessuale, che consistono principalmente in una riduzione o nella perdita della libido, che nella donna si associa a frigidità. Sulle cellule del Leydig ha un’azione depressiva riducendo la sintesi del testosterone, della potenza erettiva e della libido. La normalizzazione dei livelli di PRL é seguita per lo più da un notevole miglioramento del comportamento sessuale (15). La ginecomastia nel maschio fa sempre sospettare un’iperprolattinemia.
5. Durante la gravidanza, a partire dal primo trimestre, le concentrazioni della HPRL si elevano parallelamente a quelle degli estrogeni (7), fino a r
 aggiungere, a termine di gravidanza, livelli 10 volte superiori a quelli presenti in una donna non gravida (tab. 1).
aggiungere, a termine di gravidanza, livelli 10 volte superiori a quelli presenti in una donna non gravida (tab. 1). 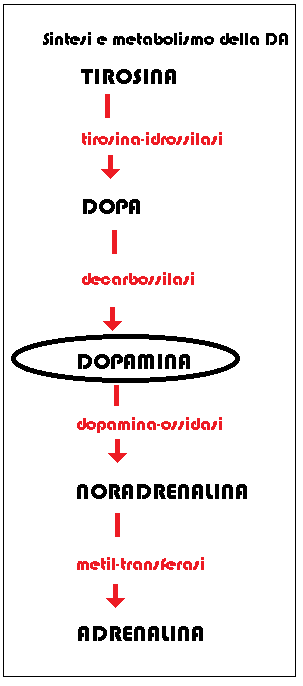 mediana, nel telencefalo e nella midollare del surrene.
mediana, nel telencefalo e nella midollare del surrene. Ad ulteriore conferma della sede ipotalamica come principale sito di secrezione dopaminergica è la constatazione sperimentale su animali che la resezione del peduncolo ipofisario e quindi la disconnessione funzionale tra ipotalamo ed ipofisi, porta ad un marcato incremento della secrezione prolattinica.
Tra le varie vie dopaminergiche descritte due sono le più importanti:
A) Via Tubero-Infundibulare Dopaminergica (TIDA): è formata da neuroni producenti dopamina situati nel nucleo arcuato dell’ipotalamo e da assoni che raggiungono l’eminenza mediana dello stesso ipotalamo e da quì i vasi del sistema portale ipotalamo-ipofisario.
B) Via Tubero-Ipofisaria Dopaminergica (THDA): origina da un gruppo di neuroni situati a livello del nucleo arcuato e del nucleo periventricolare dell’ipotalamo. Gli assoni hanno un decorso più lungo di quelli della via TIDA e, passando attraverso l’eminenza mediana, raggiungono le cellule adenoipofisarie.
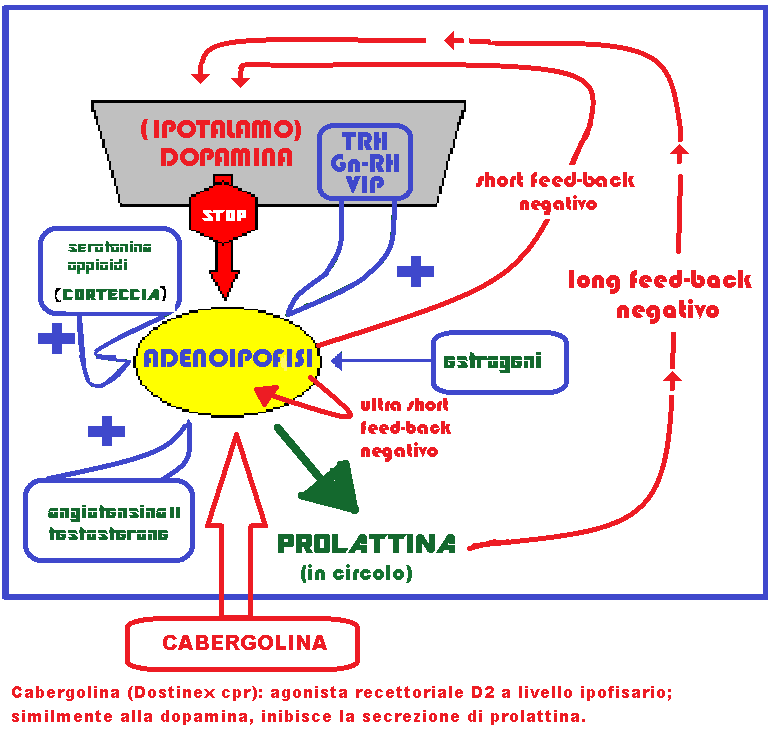
La dopamina esercita il suo potere inibitorio legandosi ai recettori DA e gabaergici responsabili dell’attivazione del GABA (ac. amino-γ-butirrico), potente neurotrasmettitore inibitorio (8-10). La secrezione della DA è attivata dagli oppioidi endogeni e dalla prolattina stessa. La prolattina, secreta in elevata quantità, raggiunge, mediante il flusso retrogrado della circolazione portale, i neuroni dopaminergici, stimolando la produzione di dopamina (short feed-back prolattinemico).
- Maslar IA, Ansbaker R: Effects of progesterone on decidual prolactin production by organ cultures of human endometrium. Endocrinology 118:2102, 1986.
- Daly DC, Kuslis S, Riddick DH: Evidence of short-loop inhibition of decidual prolactin syntesis by decidual proteins. Part I, Am J Obstetr Gynecol 155:363,1986.
- Peillon F. et al. ; J. Clin. Endocrinol. Metabol. 73:1008-1015, 1991.
- Crosignani et. Al.: Effect of prolactin on dopamine synthesis in media…J Clin Endocrinol Metab. 2005; 90: 3927-32
- Volpicelli V, Lauda N, Maisto V. Renzi C., Ferrari A.A.: “Endocrinologia dell’allatamento; breve rassegna e contributo casistico”. Panorama Sanitario 1981;6, 23-37.
- Chen K., Lia H.Z., Yea N., Zhanga J., and Wang J.J.: “Role of GABAB receptors in GABA and baclofen-induced inhibition of adult rat cerebellar interpositus nucleus neurons in vitro”. Brain Research Bulletin, 2005;67(4), 310-318.
- Martin I.L., and Dunn S.M.J. GABA recepors 2002 Tocris Cookson Ltd
- Siegel G.J., Agranoff B.W., Fisher S.K., Albers R.W., and Uhler M.D. 1999. Basic Neurochemistry: Molecular, Cellular and Medical Aspects, Sixth Edition. GABA Receptor Physiology and Pharmacology. American Society for Neurochemistry. Lippincott Williams and Wilkins.
- De Leo F, Lauda N, Scala S, Volpicelli V.: “Variazioni della lattosemia in puerpere con ipogalattia trattate con prolattina”. Rassegna internazionale di Clinica e Terapia, n. 2 , 1979.
- Del Basso F., Volpicelli V., Maisto V., Tomasillo G., Nista L.A., Piedimonte A. e Stozzetti A.: “Prolattina ed oligomenoree secondarie”. (1980; Idelson Ediz., Napoli)
- Kauppila A et al.: “Effects of metoclopramide-induced hyperprolactinemia during early follicular development on human ovarian function”. J Clin Endocr Metab 1984, 59:875-881
- Kulick R, Chaiseha Y, Kang S, Rozenboim I, El Halawani M (2005). “The relative importance of vasoactive intestinal peptide and peptide histidine isoleucine as physiological regulators of prolactin in the domestic turkey”. Gen Comp Endocrinol 142 (3): 267–73.
- New Scientist article on prolactin function relating to sex – University of Paisley and the ETH Zürich
- Evans AM, Petersen JW, Sekhon GS, DeMars R (May 1989). “Mapping of prolactin and tumor necrosis factor-beta genes on human chromosome 6p using lymphoblastoid cell deletion mutants”. Somat. Cell Mol. Genet. 15 (3): 203–13.
- Krown KA et al: “Prolactin isoform 2 as an autocrine growth factor for GH3 cells. Endocrinology 131: 595-602 (1992);
- Fletcher-Chiappini SE et al: “Glucocorticoid-prolactin interactions in Nb2 lymphoma cells: antiproliferative versus anticytolytic effects. Proceedings of the Society for Experimental Biology and Medicine 202: 345-352 (1993);
- Murata T and Ying SY: “Transforming growth factor-beta and activin inhibit basal secretion of prolactin in a pituitary monolayer culture system”. Proceedings of the Society for Experimental Biology and Medicine 198: 599-605 (1991);
- Daniel R. and Mishell Jr.: “Atlas of gynecology reproductive endocrinology”; 1999; Current Medicine Inc., Philadelphia,U.S.A.
- Bartholomew, Edwin F.; Martini, Frederic; Ober, William B. (2007). “Essentials of anatomy & Physiology”. San Francisco: Pearson/Benjamin Cummings. pp. 340.
- Sabharwal, P.; Glaser, R.; Lafuse, W.; Varma, S.; Liu, Q.; Arkins, S.; Kooijman, R.; Kutz, L. et al. (1992). “Prolactin synthesized and secreted by human peripheral blood mononuclear cells: an autocrine growth factor for lymphoproliferation”. Proceedings of the National Academy of Sciences of the United States of America 89 (16): 7713–7716.
- Kiefer, K. A. & Malarkey, W. B. (1978) J. Clin. Endocrinol. Metab. 46, 119-124.
- Garnier, P. E.; Aubert, M. L.; Kaplan, S. L.; Grumbach, M. M. (1978). “Heterogeneity of Pituitary and Plasma Prolactin in Man: Decreased Affinity of “Big” Prolactin in a Radioreceptor Assay and Evidence for Its Secretion”. Journal of Clinical Endocrinology & Metabolism 47 (6): 1273–1281.
- Lelte, Valerlano; Cosby, Helle; Sobrinho, Luis G.; Fresnoza, Agnes; Santos, M. Amparo; Frlesen, Henry G. (1992). “Characterization of big, big prolactin in patients with hyperprolactinaemia”. Clinical Endocrinology 37 (4): 365–372.
- Goto T, Narita O, Suganuma N, Suzuki M, Tomoda Y, Kuwayama A, Kageyama N. : “Successful pregnancies in patients with hyperprolactinemia–clinical and endocrinological studies on mothers and babies”. Nihon Sanka Fujinka Gakkai Zasshi 1983 Apr; 35(4):550-8.
- Gangemi M, Meneghetti G, Benato M, Ferruzzi E, Guacci AM, Marchesoni D.: “Hyperprolactinemia and pregnancy. Clinical series”. Clin Exp Obstet Gynecol. 1983; 10(2-3):108-14.
- Mohammad E Parsanezhad et al: Hyperprolactinemia after laparoscopic ovarian drilling: An unknown phenomenon. Reproductive Biology and Endocrinology20053:31
- Glick SM, Roth J, Yalow RS: The regulation of growth hormone secretion, Recent Prog. Horm Res. 1965, 21: 241-244.
- Frantz AG, Lienberg DL, Noel GL: Studies on prolactin in man. Recent Prog Horm Res. 1972, 28: 527-590.
- Newsome HH, Rose JC: The response of human adrenocorticotrophic hormone and growth hormone to surgical stress. J Clin Endocrinol Metab. 1971, 33: 481-487.
- Charters AC, Odell WD, Thompson JC: Anterior pituitary function during surgical stress and convalescence. Radioimmunoassay measurement of blood TSH, LH, FSH and growth hormone. J Clin Endocrinol Metab. 1969, 29: 63-71.
- Soules MR, Sutton GP, Hammond CB, Haney AF: Endocrine changes at operation under general anesthesia: Reproductive hormone flactuations in young women. Fertil Steril. 1980, 33: 364-371.
- Tolis G, Hickey J, Guyda H: Effects of morphine on serum growth hormone, cortisol, prolactin and thyrid stimulating hormone in man. J Clin Endocrinol Metab. 1975, 41: 797-800.
- Noel GL, Suh HK, Stone JG, Frantz AG: Human prolactin and growth hormone release during surgery and other conditions of stress. Clin Endocrinol Metab. 1972, 35: 840-851.
- Vallette-Kasic S, Morange-Ramos I, Selim A, Gunz G, Morange S, Enjalbert A, Martin PM, Iaquet P, Brue T. Macroprolactinemia revisited: a study on 106 patients. J Clin Endocrinol Metab. 87:581-588, 2002.
- Suliman AM, Smith TP, Gibney J, McKenna TJ. Frequent misdiagnosis and mismanagement of hyperprolactinemic patients before the introduction of macroprolactin screening. Application of a new strict laboratory definition of macroprolactinemia. Clinical Chemistry 49:1504-1509, 2003.
- Leanos-Miranda A, Pascoe-Lira D, Chavez-Rueda KA, Blanco-Favela F. Persistence of macroprolactinemia due to antiprolactin antibody before, during and after pregnancy in a women with systemic lupus erythematosus. J Clin Endocrinol Metab 86: 2619-24, 2001.
-
Işik A.Z. · Gülekli B. · Zorlu C.G. · Ergin T. · Gökmen O.: Endocrinological and Clinical Analysis of Hyperprolactinemic Patients with and without Ultrasonically Diagnosed Polycystic Ovarian Changes
- Endocrinological, ultrasonographic and clinical findings in adolescent and adult polycystic ovary patients: a comparative study. Gülekli B, Turhan NO, Senöz S, Kükner S, Oral H, Gökmen O.Gynecol Endocrinol. 1993 Dec; 7(4):273-7.
- Polycystic ovaries and associated clinical and biochemical features among women with infertility in a tertiary hospital in Tanzania. Pembe AB, Abeid MS.Tanzan J Health Res. 2009 Oct; 11(4):175-80.
- [Relation between hyperprolactinemia and polycystic ovary syndrome]. Hámori M, Szendei G, Kovács I, Somos P.Zentralbl Gynakol. 1987; 109(8):481-6.
- The prevalence of polycystic ovaries on ultrasound scanning in a population of randomly selected women. Farquhar CM, Birdsall M, Manning P, Mitchell JM, France JT.Aust N Z J Obstet Gynaecol. 1994 Feb; 34(1):67-72
- Polycystic ovary syndrome and hyperprolactinemia. Bracero N, Zacur HA.Obstet Gynecol Clin North Am. 2001 Mar; 28(1):77-84
- Mohammad E Parsanezhad et al: Hyperprolactinemia after laparoscopic ovarian drilling: An unknown phenomenon. Reproductive Biology and Endocrinology20053:31
- Charters AC, Odell WD, Thompson JC: Anterior pituitary function during surgical stress and convalescence. Radioimmunoassay measurement of blood TSH, LH, FSH and growth hormone. J Clin Endocrinol Metab. 1969, 29: 63-71.
- Soules MR, Sutton GP, Hammond CB, Haney AF: Endocrine changes at operation under general anesthesia: Reproductive hormone flactuations in young women. Fertil Steril. 1980, 33: 364-371.
- Tolis G, Hickey J, Guyda H: Effects of morphine on serum growth hormone, cortisol, prolactin and thyrid stimulating hormone in man. J Clin Endocrinol Metab. 1975, 41: 797-800.
- Noel GL, Suh HK, Stone JG, Frantz AG: Human prolactin and growth hormone release during surgery and other conditions of stress. Clin Endocrinol Metab. 1972, 35: 840-851.









5 commenti
Thanks for some other great article. Where else could anyone get that type of info in such a perfect means of writing?
I’ve a presentation subsequent week, and I’m on the search for such information.
It’s actually a great and useful piece of info. I am happy that you shared this useful information with us. Please keep us up to date like this. Thank you for sharing.
This web site is really a walk-through for all of the info you wanted about this and didn’t know who to ask. Glimpse here, and you’ll definitely discover it.
Hmm it appears like your website ate my first comment (it was super long) so I guess I’ll just sum it up what I submitted and say, I’m thoroughly enjoying your blog. I too am an aspiring blog blogger but I’m still new to the whole thing. Do you have any suggestions for first-time blog writers? I’d certainly appreciate it.
I am not sure where you’re getting your info, but good topic.
I needs to spend some time learning much more or understanding more.
Thanks for magnificent information I was looking for
this information for my mission.