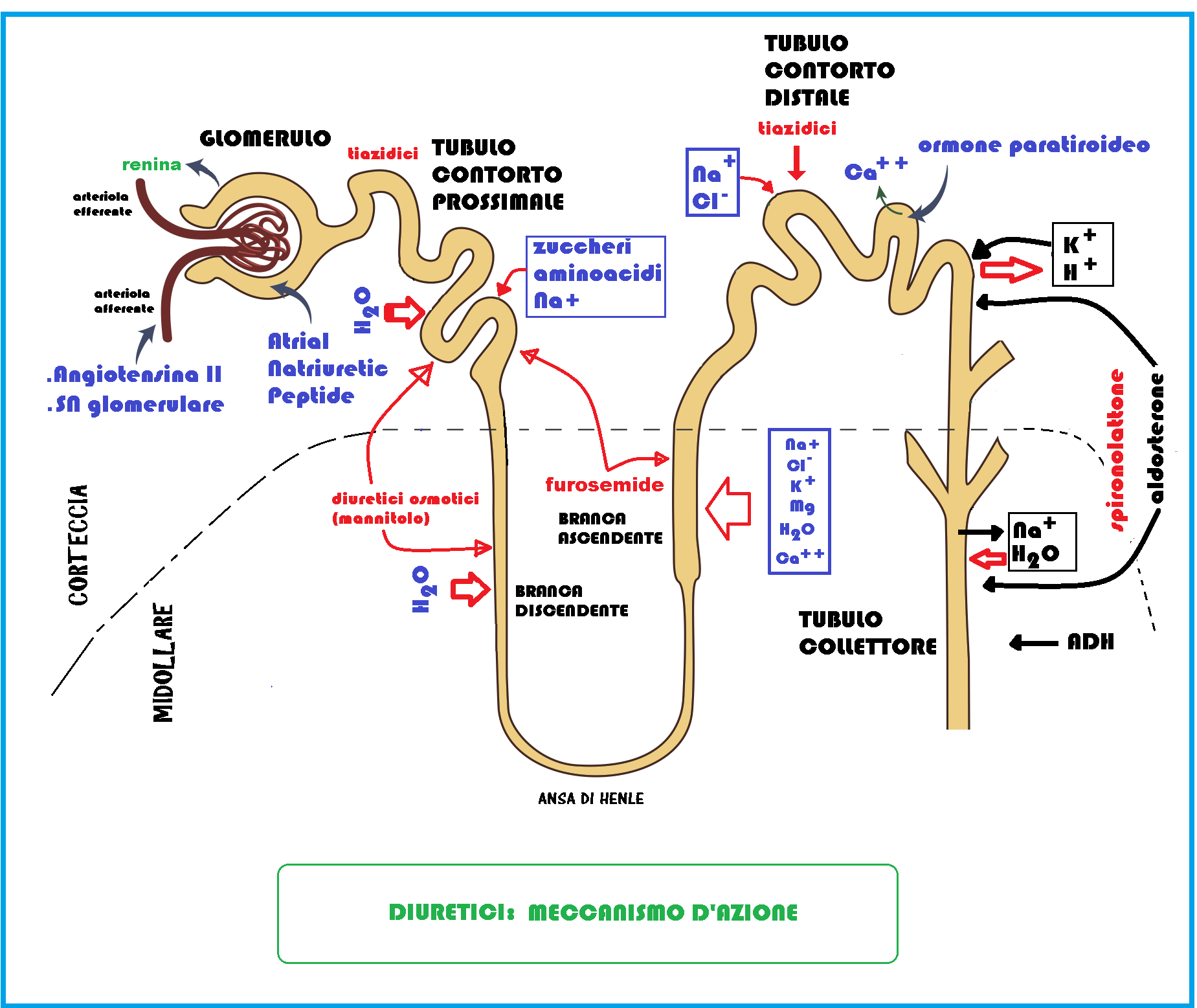
I diuretici sono farmaci che agiscono incrementando il volume delle urine attraverso la riduzione, più o meno accentuata, del riassorbimento di sodio ed acqua in vari livelli del nefrone. In tal modo riducono la volemia e la pressione sanguigna.
Consideriamo, in rapporto al sito d’azione, 5 tipi di diuretici: tiazidici, diuretici dell’ansa, diuretici risparmiatori di potassio, diuretici inibitori dell’anidrasi carbonica, diuretici osmotici.
-
- Diuretici tiazidici: sono quelli più comunemente impiegati. Essi agiscono come inibitori del riassorbimento di sodio e cloro; bloccando il trasportatore contemporaneo di sodio e cloro a livello distale, riducono il riassorbimento di acqua e sodio a livello del tubulo contorto distale. Ne deriva una riduzione della ritenzione idro-salina, della gittata cardiaca e delle resistenze periferiche e incremento del volume di urina espulsa (minor volemia sanguigna). I farmaci tiazidici sono efficaci antiipertensivi ma, proprio in virtù del loro meccanismo d’azione, inducono gravi squilibri ionici, come ipopotassemia ed ipokalemia. I farmaci tiazidici introdotti per via orale sono metabolizzati e condotti a livello del tubulo contorto prossimale per ultrafiltrazione o secrezione attiva, giungono al tubulo contorto distale dove esplicano la loro funzione. Vengono definiti “diuretici a limite massimo”, in quanto hanno un effetto dose-dipendente; tuttavia esiste un valore soglia oltre il quale l’effetto dei diuretici tiazidici non può essere ulteriormente potenziato. È stato dimostrato che parte dell’azione diuretica di questi farmaci è mediata dalle prostaglandine, per cui esiste un’interferenza farmacologica dei tiazidici con i FANS, che ne riducono l’effetto inibendo la sintesi delle prostaglandine. Gli usi terapeutici di questi farmaci riguardano il trattamento cronico dell’ipertensione lieve o moderata. Gli effetti collaterali, come già detto, inducono squilibri ionici, soprattutto ipopotassemia, pericolosa per anziani con problemi cardiaci ed in terapia digitalica; in tal caso si deve intervenire con integratori potassici o alimenti ricchi di potassio, oppure ancora associare ai tiazidici farmaci risparmiatori di potassio.
-
- Diuretici dell’Ansa. Agiscono favorendo l’escrezione di sodio, potassio e cloro nell’ansa ascendente di Henle; il gradiente osmotico, così, non è abbastanza elevato da permettere il riassorbimento di acqua. Lo squilibrio ionico modifica il potenziale di membrana impedendo il riassorbimento di ioni potassio, magnesio e calcio. Sono farmaci rapidi ed efficaci, ma anche in questo caso si rischia di incappare in gravi squilibri ionici non solo di potassio, ma anche di magnesio e di calcio (da ciò la necessità di integrare questi minerali); inoltre sono farmaci ototossici, ovvero tossici per i nervi dell’apparato acustico (per la presenza di acido etacrinico). Questo effetto collaterale è potenziato dagli aminoglicosidi, comuni antibiotici; l’uso terapeutico, vista la loro potente e rapida azione, è comune in caso di emergenze come edemi cardiaci, epatici e renali.
-
- Diuretici risparmiatori di potassio (così denominati perché sono gli unici a non provocare ipopotassemia), detti anche antialdosteronici, agiscono nella parte terminale del tubulo distale e nel dotto collettore. L’aldosterone consente fisiologicamente il riassorbimento di sodio ed acqua; viene inibito attraverso l’uso di antialdosteronici come: lo Spironolattone, antagonista vero e proprio del recettore dell’aldosterone, il triamterene e l’amiloride, che esplicano un antagonismo indiretto nei confronti dell’aldosterone per il blocco dei canali del sodio. In ogni caso trattasi di farmaci che impediscono il riassorbimento di sodio ed acqua senza provocare squlibri ionici e perdita di potassio, in quanto agiscono inibendo il trasportatore deputato all’entrata di ioni sodio e all’uscita di ioni potassio. L’effetto farmacologico è meno efficace dei precedenti, perciò vengono impiegati in associazione con i tiazidici e con i diuretici dell’Ansa per ridurne l’effetto di ipopotassemia. Per il loro effetto antagonista nei confronti dell’aldosterone, possono anche essere impiegati in caso di iperaldosteronismo.
-
- Diuretici inibitori dell’anidrasi carbonica, enzima localizzato a livello renale ed oculare; quando questo enzima viene inibito a livello renale, viene bloccato il riassorbimento dei bicarbonati nel tubulo contorto prossimale, con conseguente riduzione del volume di urina; quando, invece quest’enzima viene inibito a livello oculare viene ridotta la secrezione carbonica da parte della muscolatura ciliare, con conseguente riduzione dell’humor acqueo.
- Diuretici osmotici, come il mannitolo, non agiscono su un livello preciso ma sull’intero nefrone incrementando il volume delle urine; possono essere somministrati per via parenterale od orale, ma in tal caso si presenta un effetto secondario lassativo. Gli usi terapeutici riguardano la riduzione della pressione intracranica ed intraoculare, e la possibilità di eliminare le tossine per via renale.
Il mannitolo è un carboidrato semplice appartenente alla categoria dei polialcoli esaidrici. Analizzando la sua formula di struttura, notiamo infatti la presenza di sei gruppi idrossilici (OH), distribuiti lungo una catena alifatica composta da altrettanti atomi saturi di carbonio. Il mannitolo è ampiamente diffuso nel mondo vegetale. Le concentrazioni più significative si rinvengono nella manna del frassino (30-60%), nel tallo delle laminarie e del fucus (alghe marine), nelle foglie e nelle drupe dell’olivo, nel fico, nel sedano ed in funghi eduli come Lactarius spp. e Agaricus spp. A  livello industriale il mannitolo viene prodotto a partire dal saccarosio. Incidendo la corteccia del frassino fuoriesce una linfa densa contenente il 30-60% di mannitolo, che essicca all’aria aperta. Stiamo appunto parlando della manna, un rimedio tutto naturale utilizzato come blando lassativo, specie nell’infanzia. Sempre per via orale, il mannitolo può essere utilizzato come dolcificante alternativo al tradizionale saccarosio. Il suo potere edulcorante è infatti pari a circa il 50% di quello dello zucchero da cucina, con il vantaggio di essere ipocalorico ed acariogeno, e con un metabolismo indipendente dall’insulina (caratteristica particolarmente utile in presenza di diabete); tuttavia, questo suo effetto lassativo ne limita l’impiego in tal senso. Per via parenterale – tramite infusione endovenosa di una soluzione acquosa al 20%, in ragione di 0,5-1 grammo di mannitolo per kg di peso corporeo, in 15-30 minuti – il mannitolo viene utilizzato come diuretico osmotico, per la dimostrata capacità di richiamare acqua all’interno dei tubuli renali. Ha inoltre la capacità di diminuire la pressione intracranica ed intraoculare, tanto da rappresentare per tradizione il farmaco di scelta per diminuire l’edema cerebrale. Il mannitolo presente nei vasi sanguigni del cervello richiama acqua dagli interstizi cerebrali verso il lume dei vasi stessi, riducendo appunto l’edema; tuttavia, quando se ne somministra troppo o vi sono ampie soluzioni di continuo a livello vascolare, l’effetto osmotico cambia direzione, aggravando l’edema (anche l’emoconcentrazione conseguente ad eccessiva diuresi si rivelerebbe pericolosa in tal senso).
livello industriale il mannitolo viene prodotto a partire dal saccarosio. Incidendo la corteccia del frassino fuoriesce una linfa densa contenente il 30-60% di mannitolo, che essicca all’aria aperta. Stiamo appunto parlando della manna, un rimedio tutto naturale utilizzato come blando lassativo, specie nell’infanzia. Sempre per via orale, il mannitolo può essere utilizzato come dolcificante alternativo al tradizionale saccarosio. Il suo potere edulcorante è infatti pari a circa il 50% di quello dello zucchero da cucina, con il vantaggio di essere ipocalorico ed acariogeno, e con un metabolismo indipendente dall’insulina (caratteristica particolarmente utile in presenza di diabete); tuttavia, questo suo effetto lassativo ne limita l’impiego in tal senso. Per via parenterale – tramite infusione endovenosa di una soluzione acquosa al 20%, in ragione di 0,5-1 grammo di mannitolo per kg di peso corporeo, in 15-30 minuti – il mannitolo viene utilizzato come diuretico osmotico, per la dimostrata capacità di richiamare acqua all’interno dei tubuli renali. Ha inoltre la capacità di diminuire la pressione intracranica ed intraoculare, tanto da rappresentare per tradizione il farmaco di scelta per diminuire l’edema cerebrale. Il mannitolo presente nei vasi sanguigni del cervello richiama acqua dagli interstizi cerebrali verso il lume dei vasi stessi, riducendo appunto l’edema; tuttavia, quando se ne somministra troppo o vi sono ampie soluzioni di continuo a livello vascolare, l’effetto osmotico cambia direzione, aggravando l’edema (anche l’emoconcentrazione conseguente ad eccessiva diuresi si rivelerebbe pericolosa in tal senso).
L’utilizzo di diuretici abbinato all’attività fisica è molto pericoloso, dato che con lo sport si perdono già con la sudorazione notevoli quantità di liquidi e sali.
Diuretici e dieta: In natura ci sono molti cibi dotati di spiccata proprietà diuretiche
-
- anguria: composto per il 95 per cento di acqua, combinata con il licopene, antiossidante tipico del pomodoro. La polpa dell’anguria contiene inoltre vitamine A e C, potassio, fosforo e magnesio. La presenza di vitamina C e potassio in particolare avrebbe un’azione depurativa e detossificante che rende l’anguria un frutto ideale per contrastare in maniera naturale la ritenzione dei liquidi, il gonfiore alle gambe e l’ipertensione.
-
- finocchi: oltre al discreto contenuto vitaminico e minerale sono ricchi di princìpi attivi che li rendono indicati per problemi gastrointestinali e gli conferiscono proprietà emmenagoghe, galattogene, antisettiche e diuretiche. Costituiscono il top player per il controllo glicemico e le diete dimagranti.
-
- sedano (Apium graveolens): conosciuta come pianta medicinale già nell’antica Grecia, il sedano è composto per circa il 90% da acqua; per questo motivo e per il suo olio essenziale, che svolge un’azione vasodilatatoria sulle arteriole renali, svolge un’efficace azione diuretica, antiedemigena, antipertensiva, anticellulite e depurativa. Inoltre ha una discreta azione afrodisiaca e antimeteorism e le sue calorie sono scarse (16 KCal/100 gr), per cui si tratta di un alimento leggero e ad alto indice di sazietà (21-36). Il suo olio essenziale contiene Monoterpeni (limonene e saliene), Cumarine, Furocumarine (apiumetina), Ftalidi (es. Seciunolide sedanedolifi, cnidilide, e, soprattutto, 3-n-butilftalide), Flavonoidi e Alcaloidi.
- sedano (Apium graveolens): conosciuta come pianta medicinale già nell’antica Grecia, il sedano è composto per circa il 90% da acqua; per questo motivo e per il suo olio essenziale, che svolge un’azione vasodilatatoria sulle arteriole renali, svolge un’efficace azione diuretica, antiedemigena, antipertensiva, anticellulite e depurativa. Inoltre ha una discreta azione afrodisiaca e antimeteorism e le sue calorie sono scarse (16 KCal/100 gr), per cui si tratta di un alimento leggero e ad alto indice di sazietà (21-36). Il suo olio essenziale contiene Monoterpeni (limonene e saliene), Cumarine, Furocumarine (apiumetina), Ftalidi (es. Seciunolide sedanedolifi, cnidilide, e, soprattutto, 3-n-butilftalide), Flavonoidi e Alcaloidi.
-
- cetriolo: ll cetriolo è composto per lo più d’acqua (circa 95%) per questo motivo vengono ritenuti particolarmente rinfrescanti e depurativi. Ha un apporto energetico ridottissimo: 12 KCal/100 gr, Contiene una importantissima sostanza predominante: l’Acido tartarico che impedisce ai carboidrati di trasformarsi in grassi.
- carciofo: questa pianta ha la capacità di stimolare la funzionalità epatica e renale
-
- asparago: Alimento ipocalorico (15 KCal/100 gr) e ipoglicidico (3,63 gr/100 gr di alimento) dotato di proprietà diuretiche e ricco di cromo e soprattutto di glutatione (o GSH, tripeptide naturale, costituita da tre amminoacidi (acido glutammico, cisteina e glicina), il più potente antiossidante presente nell’organismo umano capace di rallentare l’invecchiamento, contrastare l’insorgenza di diabete II, cancro, aterosclerosi, cardiopatie, ipoacusia e impotenza. Affinché il glutatione possa espletare la sua azione è fondamentale che esso sia supportato da adeguate quantità di selenio – un minerale che abbonda negli alimenti di origine marina e nelle frattaglie – di riboflavina (Vit. B2) e di niacina (Vit. PP).
-
- caffè (3-5 tazzine al dì): riduzione del rischio di diabete di tipo 2 pari al 25%. La caffeina è una sostanza capace di prevenire l’occlusione delle arterie coronariche e renali. L’alta percentuale di caffeina, teobromina, acido caffeico, acido clorogenico e asparagina assicura una forte azione diuretica che rende il caffè una bevanda ideale per combattere la ritenzione idrica anche nelle diete ipocaloriche.
-
- tè: il tè verde: non è ossidato ed è quello che contiene più teina, escluso il tè bianco difficile da trovare e costoso. Il tè previene l’aterosclerosi e le neoplasie grazie all’elevato contenuto di lifenoli.
-
- ananas: ha un effetto anoressante e favorisce la diuresi grazie all’elevato contenuto di bromelina. Il frutto fresco sviluppa 42 KCal/100 gr; ha un indice glicemico medio che aumenta nel caso del succo d’ananas o dell’ananas confezionato (8-20).
-
- cipolla: Le cipolle contengono: enzimi che stimolano la digestione e il metabolismo; oligoelementi (zolfo, ferro, potassio, magnesio, fluoro, calcio, manganese e fosforo); vitamine (A, complesso B, C, E); flavonoidi dall’azione diuretica; glucochinina, un ormone vegetale dall’azione antidiabetica.
-
- acqua iposodica: San Bernardo, Sant’Anna, Flavia, Levissima, Recoaro, Vera, Lauretana, Monterosa,
-
- uva: ha proprietà antiossidanti e anticancro, dovute soprattutto al contenuto di polifenoli e di resveratrolo, presente nella buccia dell’uva nera; ha inoltre proprietà antivirali, grazie al contenuto di acido tannico e di fenolo. Deve essere consumata con moderazione in caso di diabete e obesità.
- mela: anche questo comunissimo frutto nasconde spiccate proprietà diuretiche grazie all’elevato contenuto (85%) di acqua. La pectina contribuisce anche a ridurre la glicemia. Lavate bene le mele, ma evitate di sbucciarle.
References:
- Abreu, O. A. and A. Cuellar. 2008. Estrategia en la selección de las plantas medicinales a
investigar. Rev. Cubana Plant Med.13(3): - Arteche, A., B. Vanaclocha, J. I. Güenechea. Fitoterapia. (3ª ed.). Vademécum de prescripción. Plantas medicinales.Barcelona: Masson; 1998.
- Beyra, A., M. C. León, and E. Iglesias. 2008.Estudios etnobotánicos sobre plantas
medicinales en la provincia de Camagüey (Cuba). Anales del Jardín Botánico de Madrid, 61(2):185-204. - Boffill, M. A. 2008. Plantas medicinales usadas en cuba con efecto diurético comprobado experimentalmente. Medicentro, 11(2):
- Iglesias, E., J. E. Turiño, D. Fernandiz and R. Herrera. 2002. Efecto diurético y toxicología oral aguda de la decocción de Peperomia pellucida L H.B.K. Rev. Cubana Farm. 36:97.
- “NexoBrid: concentrate of proteolytic enzymes enriched in bromelain”. European Medicines Agency. January 7, 2013.
- “Vicente Marcano (in Spanish) Quote from Google translate: “New theory about the phenomenon of fermentation”: “See also the bromeliad (for Annana Bromelia L.) pineapple, which is responsible for many phenomena of fermentation of the fruit. This finding, while not making Marcano, was actually made by him, as later confirmed by Dr. RH Chittenden, of Yale University, who argues that “the bromeliad was discovered by a Venezuelan scholar named Vicente Marcano. Pioneers of Venezuela, PDVSA-Intevep. 1997. Archived from the original on 2007-03-30. Retrieved 2007-03-04.
- Chittenden RH, Joslin EP, Meara FS (1892). “On the ferments contained in the juice of the pineapple (Ananassa sativa): together with some observations on the composition and proteolytic action of the juice”. Transactions of the Connecticut Academy of Arts and Sciences. 8: 281–308.
- Arshad ZI, Amid A, Yusof F, Jaswir I, Ahmad K, Loke SP (September 2014). “Bromelain: an overview of industrial application and purification strategies”. Applied Microbiology and Biotechnology. 98 (17): 7283–97.
- Ketnawa S, Chaiwut P, Rawdkuen S (2012). “Pineapple wastes: A potential source for bromelain extraction”. Food and Bioproducts Processing. 90 (3): 385–91.
- Jutamongkon R, Charoenrein S (2010). “Effect of Temperature on the Stability of Fruit Bromelain from Smooth Cayenne Pineapple” (PDF). Kasetsart Journal: Natural Science. 44: 943–8.
- Hale LP, Greer PK, Trinh CT, James CL (April 2005). “Proteinase activity and stability of natural bromelain preparations”. International Immunopharmacology. 5 (4): 783–93.
- Chaurasiya RS, Sakhare PZ, Bhaskar N, Hebbar HU (June 2015). “Efficacy of reverse micellar extracted fruit bromelain in meat tenderization”. Journal of Food Science and Technology. 52 (6): 3870–80.
- “Bromelain”. National Center for Complementary and Integrative Health, US National Institutes of Health. 24 September 2017. Retrieved 17 December 2018.
- Raison-Peyron N, Roulet A, Guillot B, Guilhou JJ (October 2003). “Bromelain: an unusual cause of allergic contact cheilitis”. Contact Dermatitis. 49 (4): 218–9.
- Walker AF, Bundy R, Hicks SM, Middleton RW (December 2002). “Bromelain reduces mild acute knee pain and improves well-being in a dose-dependent fashion in an open study of otherwise healthy adults”. Phytomedicine. 9 (8): 681–6.
- Bruneton J. Pharmacognosie et phytochimie plantes medicinales. Ed. Lavoisier, Paris, 1993.
- Sannia A. Formulario pratico di fitoterapia. Ed. Tecniche nuove, Milano, 1994.
- Lotz-Winter H. On the pharmacology of bromelaine: an update with special regard to animal studies on dose dependent effects. Planta Med. 56, 249-253, 1990.
- Taussig S.J. et al. Bromelain, the enzyme complex of pineapple (Ananas comosus) and its clinical application. An update. J. Ethnopharmacol. 22, 191-203, 1988.
- Hostetler G, Riedl K, Cardenas H et al. Flavone deglycosylation increases their anti-inflammatory activity and absorption. Mol Nutr Food Res. 2012 Apr;56(4):558-69. doi: 10.1002/mnfr.201100596. Epub 2012 Feb 20.
- Hostetler GL, Riedl KM, and Schwartz SJ. Endogenous enzymes, heat, and pH affect flavone profiles in parsley (Petroselinum crispum var. neapolitanum) and celery (Apium graveolens) during juice processing. J Agric Food Chem. 2012 Jan 11;60(1):202-8. Epub 2011 Dec 30.
- Kolarovic J, Popovic M, Zlinska J et al. Antioxidant activities of celery and parsley juices in rats treated with doxorubicin. Molecules. 2010 Sep 3;15(9):6193-204.
- Ovodova RG, Golovchenko VV, Popov SV et al. Chemical composition and anti-inflammatory activity of pectic polysaccharide isolated from celery stalks. Food Chemistry, Volume 114, Issue 2, 15 May 2009, Pages 610-615.
- Page V and Schwitzguebel JP. Metabolism of sulphonated anthraquinones in rhubarb, maize and celery: the role of cytochromes P450 and peroxidases. Plant Cell Rep. 2009 Nov;28(11):1725-35. Epub 2009 Sep 19.
- Paglan K, Gotz-Zbikowska M, Tykwinska M et al. Celery–cause of severe anaphylactic shock. Postepy Hig Med Dosw (Online). 2012 Mar 14;66:132-4.
- Prisacaru AI, Andritoiu CV, Priscaru C et al. Protective effect of phthalides from apium graveolens in acrylamide intoxication. European Journal of Internal Medicine, Volume 22, Supplement 1, October 2011, Page S77.
- Rizzo V and Muratore G. Effects of packaging on shelf life of fresh celery. Journal of Food Engineering, Volume 90, Issue 1, January 2009, Pages 124-128.
- Shiraga T. P104 specific inhibitory effect of celery extract on peptide transporter PEPT1 expression in the human intestinal caco-2 cells. Clinical Nutrition Supplements, Volume 4, Issue 2, 2009, Page 69.
- Tsi D and Tan BKH. The mechanism underlying the hypocholesterolaemic activity of aqueous celery extract, its butanol and aqueous fractions in genetically hypercholesterolaemic rico rats. Life Sciences, Volume 66, Issue 8, 14 January 2000, Pages 755-767.
- Vina SZ and Chaves AR. Respiratory activity and phenolic compounds in pre-cut celery. Food Chemistry, Volume 100, Issue 4, 2007, Pages 1654-1660.
- Vina SZ and Chaves AR. Antioxidant responses in minimally processed celery during refrigerated storage. Food Chemistry, Volume 94, Issue 1, January 2006, Pages 68-74.
- Yao Y and Ren G. Effect of thermal treatment on phenolic composition and antioxidant activities of two celery cultivars. LWT – Food Science and Technology, Volume 44, Issue 1, January 2011, Pages 181-185.
- Yao Y, Sang W, Zhou M et al. Phenolic composition and antioxidant activities of 11 celery cultivars. J Food Sci. 2010 Jan-Feb;75(1):C9-13.
- Zhang Y, Li Y, Cao C et al. Dietary flavonol and flavone intakes and their major food sources in Chinese adults. Nutr Cancer. 2010;62(8):1120-7.
- Zhou K, Wu B, Zhuang Y, Ding L et al. [Chemical constituents of fresh celery]. Zhongguo Zhong Yao Za Zhi. 2009 Jun;34(12):1512-5. Chinese.