MIOMECTOMIA ISTEROSCOPICA
La miomectomia isteroscopica è una tecnica chirurgica minimamente invasiva, praticata mediante resettoscopio e particolarmente indicata per i miomi sottomucosi. I miomi sottomucosi si operano in caso di menometrorragia resistente alla terapia medica ed in caso di  poliabortività. In caso di miomi sottomucosi asintomatici è opportuno non operare. Prima di operare un mioma sottomucoso è indispensabile praticare un’isteroscopia diagnostica, USG ed eventualmente RMN per stabilire: la dimensione del mioma, la sede, il numero dei miomi, lo sviluppo intramurale, la distanza dalla sierosa uterina, la presenza di altre patologie concomitanti.
poliabortività. In caso di miomi sottomucosi asintomatici è opportuno non operare. Prima di operare un mioma sottomucoso è indispensabile praticare un’isteroscopia diagnostica, USG ed eventualmente RMN per stabilire: la dimensione del mioma, la sede, il numero dei miomi, lo sviluppo intramurale, la distanza dalla sierosa uterina, la presenza di altre patologie concomitanti.
Timing: per le pazienti in età fertile è opportuno intervenire nella fase follicolare precoce. In questo momento infatti lo spessore dell´endometrio, nella sua curva ciclica di crescita, è al punto più basso (5 mm. circa). Mentre nelle pazienti in menopausa, l’intervento può essere effettuato in qualsiasi giorno.
Posizione della paziente sul letto operatorio: la paziente viene posta nella tradizionale posizione ginecologica, con le gambe sufficientemente divaricate, rette da appositi reggigambe e in lieve anti-Trendelenburg (15°).
E’ importante portare molto avanti il bacino della paziente, in modo tale che il piano vulvo-perineale sporga di qualche centimetro dal bordo del lettino operatorio; in tal modo si facilitano i movimenti di brandeggio del resettoscopio. Questa posizione, inoltre, rende più difficile che parte del liquido di distensione, che defluisce dal canale cervicale, possa invadere la superficie di contatto della piastra dell’elettrobisturi, posizionata generalmente sotto i glutei della paziente. Il verificarsi di una simile eventualità creerebbe il rischio di ustione della paziente nella zona di applicazione della placca.
Il piano del letto operatorio non deve essere posizionato troppo in alto, in maniera da consentire all’operatore di mantenere nel corso dell’intervento una posizione ergonomica, con le braccia distese lungo il corpo e gli avambracci piegati a 90°. E’ evidente che una situazione, in cui si realizza una eccessiva differenza di altezza fra operatore e paziente, costringe l’isteroscopista ad operare con le braccia sollevate, in posizione innaturale e stancante, soprattutto negli interventi di maggior durata.
Introduzione del resettoscopio: occorre effettuare una dilatazione con Hegar fino al n. 10 in modo da ottenere una facile introduzione e mobilità del resettoscopio, e la possibilità di fuoriuscita dal canale cervicale del liquido in caso di eccessiva pressione endocavitaria.
In caso di fibromi sottomucosi di diametro <2 cm, si può utilizzare il Versapoint, strumento meno invasivo del resettoscopio, dotato di generatore elettrico specifico a bassa intensità ed elettrodi bipolari.
Valutazione della cavità uterina: L’intervento inizia con la valutazione della cavità uterina, del suo contenuto, e l’identificazione dei riferimenti intracavitari (osti tubarici, posizione dell’istmo, sede, volume e consistenza della patologia da trattare). In questo modo si può decidere quale strategia chirurgica adottare, scelta dell’ansa, orientamento dello strumento.
Tecnica chirurgica –
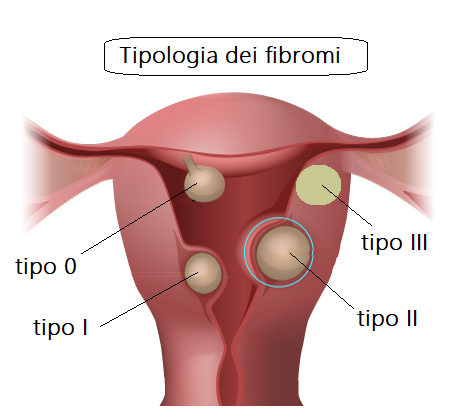
Resezione miomi tipo 0 – se <2 cm, si può trattare con una procedura a singolo passaggio. Il mioma viene resecato alla base con resettoscopio o Versapoint e quindi il mioma viene estratto con una pinza isteroscopica o alla cieca con una curette.
Per i fibromi tipo 0 di dimensioni superiori a 2 cm, si procede a “slicing” progressiva dalla superficie del mioma verso l’endometrio. La maggior parte dei miomi di tipo 0 può essere rimossa in una sola procedura chirurgica, indipendentemente dalle dimensioni perchè non esiste componente intramurale.
Resezione miomi tipo 1 o tipo 2 –
La resezione in “slicing” viene eseguita dallo strato intracavitario del mioma fino al miometrio. Il miometrio è riconoscibile come rosa e sanguina più facilmente del tessuto fibroso. In casi difficili, la procedura può essere interrotta e ultimata con un secondo intervento. In caso di fibroma >2 cm si può procedere con le lame fredde per enucleare il fibroma e quindi resecare la base con pinza bipolare.
Per il mioma sottomucoso del corno uterino, è necessario prestare particolare attenzione per evitare lesioni dell’ostio tubarica o perforazione dell’utero.
Per quanto riguarda i miomi di tipo 1 e di tipo 2, la necessità di una procedura multipla si è verificata principalmente nei miomi di tipo 2. I miomi con sviluppo intramurale sono stati trattati con la tecnica dell’anello freddo. Recentemente la miomectomia isteroscopica a ciclo freddo è stata descritta come una procedura sicura ed efficace per la rimozione di miomi sottomucosi con sviluppo intramurale, rispettando l’integrità anatomica e funzionale del miometrio.
La miomectomia a ciclo freddo è stata eseguita per prevenire danni al miometrio che circonda il mioma. L’enucleazione meccanica della parte intramurale del mioma è più sicura ed efficace se confrontata con l’affettatura e previene complicazioni come la perforazione uterina del circuito termico. Inoltre, la procedura a freddo evita il rischio di danni termici, che possono aumentare la formazione di aderenze intrauterine.
Diversi autori supportano l’uso dell’energia bipolare perché può prevenire la sindrome da intravasazione.
COMPLICAZIONI
Complicazioni meccaniche
La perforazione uterina si verifica più spesso durante la dilatazione cervicale specialmente in caso di stenosi cervicale, utero retroverso e in donne nullipare o in postmenopausa. La perforazione durante l’elettro-resezione può causare lesioni intestinali, alla vescica o ai vasi. Questa complicazione è rara ma la sua frequenza aumenta nel caso di fibromi con componente intramurale. In questi casi si raccomanda una laparoscopia concomitante per ridurre il rischio di tali complicanze [2].
Sepsi
L’endometrite postoperatoria si verifica nell’1-5% delle pazienti. Si raccomanda una antibiotico-profilassi (Rocefin 2 gr e.v.) immediatamente pre-operatoria per limitare il numero di infezioni [2].
Emorragia
In caso di sanguinamento grave, un catetere di Foley riempito con 30 ml di soluzione salina isotonica può essere inserito nella cavità uterina [2].
Complicanze metaboliche
L’intravasazione del fluido utilizzato per distendere la cavità uterina è la complicazione più pericolosa. Il sovraccarico di glicina provoca uno squilibrio elettrolitico (iponatriemia, ipoproteinemia e basso ematocrito). I pazienti lamentano nausea, vomito, mal di testa e confusione. Può verificarsi edema polmonare e cerebrale. Il sovraccarico di liquidi è possibile anche con soluzione salina isotonica, ma i suoi effetti sono meno gravi di quelli con un mezzo glicinico. Le linee guida indicano che l’intravasazione di 750 ml richiede la conclusione programmata dell’intervento chirurgico. Un saldo superiore a 1000-2000 ml richiede la conclusione immediata dell’intervento [2].
Embolie gassose
Le embolie gassose possono verificarsi con gas dall’elettrochirurgia o con gas dall’aria ambiente. Con l’energia bipolare, il rischio doveva essere estremamente basso. Tuttavia, uno degli studi randomizzati mostra che l’embolia gassosa venosa (VGE) è frequente durante la resezione del mioma isteroscopico. L’embolia gassosa è stata ugualmente osservata indipendentemente dal tipo di diatermia. Non è stato necessario alcun intervento per l’instabilità cardiovascolare. VGE più gravi sono stati osservati se l’intravasazione ha superato i 1000 ml. L’embolia aerea è una complicazione pericolosa. I chirurghi e gli anestesisti dovrebbero essere consapevoli di questo e devono saperlo gestire [2, 6].
Aderenze
Un tasso del 35-45% di aderenze post-operatorie è stato riportato nelle miomectomie effettuate utilizzando energia monopolare e il 7,5% con energia bipolare. Molti metodi di barriera sono stati tentati per evitare la formazione di aderenze. Alcuni di essi hanno un’efficacia limitata (dispositivo intrauterino, terapia ormonale) mentre altri sembrano promettenti (palloncino con catetere di Foley e gel ialuronico). Si raccomanda un’isteroscopia diagnostica di controllo 6-8 settimane dopo l’intervento per garantire l’assenza di aderenze postoperatorie (10% dei casi) [2, 7].
Emorragia
Quando non c’è più alcun desiderio di gravidanza, una concomitante ablazione endometriale ha provocato amenorrea fino al 95,5% dei pazienti [2].
OUTCOME
Un tasso di successo del 70-99% è stato riportato da diversi studi ma le percentuali di successo sembrano diminuire con l’aumentare del periodo di follow-up ed in rapporto alla presenza di fattori predittivi di fallimento come il numero di fibromi, dimensione dei fibromi, dimensione dell’utero.
Miomectomia ISC e fertilità
I fibromi sottomucosi hanno un impatto negativo sui tassi di gravidanza. La resezione chirurgica mediante isteroscopia migliora i tassi di gravidanza nei fibromi sottomucosi mentre la miomectomia per il mioma intramurale è ancora oggetto di discussione (8).
References:
- Lasmar RB, Barrozo PR, Dias R, Oliveira MA. Submucous myomas: a new presurgical classification to evaluate the viability of hysteroscopic surgical treatment–preliminary report. J Minim Invasive Gynecol 2005; 12:308.
- Munro MG, Critchley HO, FIGO Working Group on Menstrual Disorders FIGO classification system (PALM-COEIN) for causes of abnormal uterine bleeding in nongravid women of reproductive age. Int J Gynaecol Obstet. 2011;113:1–2.
- Keltz MD, Greene AD, Morrissey MB, et al. Sonohysterographic predictors of successful hysteroscopic myomectomies. JSLS 2015; 19:e2014.00105.
- Capma P, Levaillant JM, Fernandez H. Surgical techniques and outcome in the management of submucous fibroids. Curr Opin Obstet Gynecol. 2013;25:332–338.
- Mazzon I, Favilli A. Predicting success of single step hysteroscopic myomectomy: A single centre large cohort study of single myomas. Int J Surg. 2015;22:10–14.
- Betjes HE, Hanstede MM, Emanuel MH, Stewart EA. Hysteroscopic myomectomy and case volume hysteroscopic myomectomy performed by high- and low-volume surgeons. J Reprod Med 2009; 54:425.
- Litta P, Leggieri C, Conte L, et al. Monopolar versus bipolar device: safety, feasibility, limits and perioperative complications in performing hysteroscopic myomectomy. Clin Exp Obstet Gynecol. 2014;41:335–338
- Marziani R, Mossa B, Ebano V, et al. Transcervical hysteroscopic myomectomy: long-term effects on abnormal uterine bleeding. Clin Exp Obstet Gynecol 2005; 32:23..
- Bahar R, Shimonovitz M, Benshushan A, et al. Case-control study of complications associated with bipolar and monopolar hysteroscopic operations. J Minim Invasive Gynecol. 2013;20:376–380
- Dyrbye BA, Overdijk LE, van Kesteren PJ, et al. Gas embolism during hysteroscopic surgery using bipolar or monopolar diathermia: a randomized controlled trial. Am J Obstet Gynecol. 2012;207:271e1–271e6.
- Touboul C, Fernandez H, Deffieux X, et al. Uterine synechiae after bipolar hysteroscopic resection of submucosal myomas in patients with infertility. Fertil Steril. 2009;92:1690–1693.
- Casini ML, Rossi F, Agostini R, et al. Effects of the position of fibroids on fertility. Gynecol Endocrinol. 2006;22:106–109.
- Lasmar RB, Barrozo PR, Dias R, Oliveira MA. Submucous myomas: a new presurgical classification to evaluate the viability of hysteroscopic surgical treatment–preliminary report. J Minim Invasive Gynecol 2005; 12:308.
- Varma R, Soneja H, Clark TJ, Gupta JK. Hysteroscopic myomectomy for menorrhagia using Versascope bipolar system: efficacy and prognostic factors at a minimum of one year follow up. Eur J Obstet Gynecol Reprod Biol 2009; 142:154.
- Emanuel MH, Wamsteker K. The Intra Uterine Morcellator: a new hysteroscopic operating technique to remove intrauterine polyps and myomas. J Minim Invasive Gynecol 2005; 12:62.
- Haber K, Hawkins E, Levie M, Chudnoff S. Hysteroscopic morcellation: review of the manufacturer and user facility device experience (MAUDE) database. J Minim Invasive Gynecol 2015; 22:110.
- Rubino RJ, Lukes AS. Twelve-month outcomes for patients undergoing hysteroscopic morcellation of uterine polyps and myomas in an office or ambulatory surgical center. J Minim Invasive Gynecol 2015; 22:285.
- Loffer FD. Removal of large symptomatic intrauterine growths by the hysteroscopic resectoscope. Obstet Gynecol 1990; 76:836.
- Van Dongen H, Emanuel MH, Smeets MJ, et al. Follow-up after incomplete hysteroscopic removal of uterine fibroids. Acta Obstet Gynecol Scand 2006; 85:1463.
- Touboul C, Fernandez H, Deffieux X, et al. Uterine synechiae after bipolar hysteroscopic resection of submucosal myomas in patients with infertility. Fertil Steril 2009; 92:1690.
- Jansen FW, Vredevoogd CB, van Ulzen K, et al. Complications of hysteroscopy: a prospective, multicenter study. Obstet Gynecol 2000; 96:266.
- Taskin O, Sadik S, Onoglu A, et al. Role of endometrial suppression on the frequency of intrauterine adhesions after resectoscopic surgery. J Am Assoc Gynecol Laparosc 2000; 7:351
- Mencaglia L, Tantini C. GnRH agonist analogs and hysteroscopic resection of myomas. Int J Gynaecol Obstet 1993; 43:285.
- Hobo R, Netsu S, Koyasu Y, Tsutsumi O. Bradycardia and cardiac arrest caused by intramyometrial injection of vasopressin during a laparoscopically assisted myomectomy. Obstet Gynecol 2009; 113:484.