Ultimo aggiornamento 2020-11-08 3:49:14 PM
Valutazione preoperatoria – Valutazione delle condizioni generali e di quelle locali per eventuali patologie associate. L’ eventuale anemia, sopratutto se importante, deve essere corretta preventivamente. La via di accesso e la tecnica chirurgica devono avere come obiettivo la minor invasività possibile, privilegiando la procedura più semplice, con meno complicanze e sequele, oltre che la meno costosa.
- E’ importante l’esecuzione di una dettagliata ecografia pelvica (1) e del viscere uterino in particolare, con una completa mappatura di tutti i miomi, da eseguirsi prima dell’intervento da parte di ecografisti che collaborano con i chirurghi . L’ecografia transvaginale è utile anche per valutare l’endometrio,
- talvolta può essere necessaria la biopsia endometriale per escludere una patologia endometriale maligna.
- Nelle donne con miomi sottomucosi, candidate ad un trattamento resettoscopico, la valutazione isteroscopica preoperatoria permette una corretta strategia chirurgica. Può essere sufficiente anche la sola isterosonografia.
- RMN – è preferibile la risonanza magnetica preoperatoria del bacino nei seguenti scenari:
- utero maggiore di 12 settimane (280 g) all’esame clinico
- identificazione di più fibromi attraverso gli Stati Uniti
- storia suggestiva di adenomiosi.
La risonanza magnetica facilita la pianificazione preoperatoria delineando accuratamente la dimensione e la posizione dei fibromi e distinguendo tra adenomioma e fibroma nella maggior parte dei casi.
Controindicazioni alla laparoscopia: gravi patologie associate (ASA III), gravi patologie della coagulazione, l’insufficienza respiratoria grave, la broncopneumopatia cronica ostruttiva (BPCO) severa, le malattie cardiache gravi, l’ipertensione endocranica.
Un problema di non facile attuazione è l’eventuale predeposito di sangue autologo, auspicabile in vista di un intervento laparotomico impegnativo con probabilità di discrete perdite ematiche.
1. Isterectomia totale/subtotale: va riservata alle donne che hanno concluso il periodo di vita riproduttiva, con malattia molto estesa e che concordano per un’intervento demolitore, oppure nei casi in cui il trattamento chirurgico conservativo non dia adeguate garanzie di risultato, per l’elevato rischio di recidive. Nella decisione di un intervento demolitore deve trovare ampio spazio il coinvolgimento psicologico ed il successivo consenso della donna, che talvolta ha bisogno di tempo per determinarsi. Devono essere discussi e chiariti con la donna anche gli aspetti relativi alla rimozione degli annessi ed all’eventuale conservazione della cervice uterina (miglior conservazione della sessualità!).
2. Miomectomia laparotomica: Gli obiettivi della miomectomia sono la rimozione dei miomi ed il mantenimento della fertilità. I rischi della miomectomia sono la perdita ematica, le aderenze pelviche post-intervento e la recidiva/persistenza (10–20 %) .
Le aderenze possono influenzare il tasso di fertilità ed indurre dolore cronico pelvico (CPP). Per limitare le conseguenze è necessario eseguire l’intervento in modo tecnicamente corretto e con la minor invasività possibile (manipolazione delicata dei tessuti, riduzione del sanguinamento intraoperatorio, emostasi ottimale, materiale di sutura più tollerato, limitazione dell’uso di garze emostatiche e laparotomiche, irrigazione continua del campo operatorio).
L’uso routinario pre-operatorio degli analoghi del Gn-RH è stato pressoché abbandonato nella miomectomia laparotomica per il rischio di una riduzione volumetrica e quindi di una mancata evidenziazìone di miomi intramurali di piccole dimensioni e per l’effetto di sclerosi sulla pseudocapsula del mioma con possibile difficoltà al reperimento del corretto piano di clivaggio (19).
MIOMECTOMIA LAPAROTOMICA TECNICA: Una laparotomia trasversale sovrapubica secondo Pfannenstiel è nella quasi totalità dei casi adeguata a rendere disponibile un campo operatorio di sufficiente ampiezza, solo in casi eccezionali è necessario ricorrere ad un laparotomia longitudinale mediana ombelico-pubica.
Incisione isterotomica: è lineare, raramente ellissoidale in caso di miomi di grandi dimensioni che distendano il perimetrio in misura tale che quest’ultimo possa risultare sovrabbondante nella fase di ricostruzione. Viene eseguita in senso longitudinale in sede mediana sia sulla parete anteriore che su quella posteriore per la relativamente scarsa vascolarizzazione di tale zona. In sede paramediana viene eseguita in senso trasversale, nell’ ottica di rispettare il più possibile il decorso dei vasi. L’incisione viene approfondita fino alla pseudocapsula del mioma. Su quest’ultimo viene quindi applicata una trazione mediante una pinza (Bernhard, Martin, Museux), oppure con un punto, eventualmente divaricando i lembi dell’incisione isterotomica con pinze di Allis posizionate avendo cura di non coinvolgere nella prensione la sierosa perimetriale.
Enucleazione del mioma: Viene condotta rimanendo all’interno della pseudocapsula, e può essere eseguita per via combinata smussa e tagliente, oppure mediante perimiotomia elicoidale con bisturi elettrico, procedendo contestualmente a diatermocoagulazione bipolare delle bocche vascolari. Nell’ottica di ridurre il rischio di aderenze post-chirurgiche, si tende a praticare il minor numero possibile di incisioni sul viscere uterino, cercando di enucleare tutti i miomi aggredirli attraverso la stessa breccia isterotomica.
Ricostruzione: enucleato il mioma, si passa alla fase di ricostruzione della parete. Il numero degli strati di sutura dipende dalla profondità della breccia isterotomica, che a sua volta è collegata alle dimensioni e alla sede del mioma (sottosieroso/intramurale/sottomucoso). Lo scopo fondamentale è quello di assicurare una solida cicatrizzazione della parete uterina, indispensabile per una buona evoluzione di eventuali successive gravidanze: a tal fine, si deve accuratamente evitare di lasciare spazi morti ove possano raccogliersi ematomi, che a loro volta potrebbero dare esito a “loci minoris resistentiae” della cicatrice definitiva. Eventuali bocche vascolari di entità significativa, peraltro rare se la dissezione è stata condotta correttamente, è opportuno vengano clampate e legate separatamente. Se durante l’asportazione del mioma si è verificata l’apertura della cavità uterina, il primo strato di sutura viene eseguito a punti staccati, con filo riassorbibile sottile, a livello sottomucoso, accostando i lembi endometriali senza trapassarli. Per la sutura del miometrio si utilizza sempre materiale riassorbibile, in uno più strati, in continua o a punti staccati. In quest’ultimo caso, un utile accorgimento può essere rappresentato dal posizionare i punti senza stringerli per evitare di ridurre la piena accessibilità alla profondità della breccia isterotmica, annodandoli poi tutti alla fine dello strato. I lembi del perimetrio vengono accostati con una sutura introflettente, in continua o a punti staccati, in monofilamento riassorbibile. In caso di apertura della cavità endometriale, sono suggeriti il posizionamento intrauterino di un catetere di Foley e la somministrazione postoperatoria di una terapia sequenziale estroprogestinica per 2 o 3 cicli nell’intento di evitare la formazione di sinechie. Il tasso di recidive a 5 anni è del 30% circa anche nei casi in cui si è riusciti a rimuovere tutti i fibromi.
3. Miolisi mediante elettrodo monopolare trancutanea o laparoscopica – determina necrosi coagulativa del mioma con riduzione del volume della lesione. La tecnica si effettua in sedazione generale con un ricovero di 48 ore. Un elettrodo a forma di ago è inseriti all’interno del mioma sotto guida ecografica o per via laparoscopica L’ago è connesso ad un generatore di corrente che emette delle onde a frequenza variabile inducenti all’interno del mioma una temperatura variabile tra 40 e 99 °C che porta alla necrosi coagulativa dello stesso. Il trattamento della lesione continua fino alla distruzione di circa il 90% del mioma con un meccanismo che autolimita la temperatura e il danno ai tessuti circostanti. Controindicazioni: gravidanza in atto, sospetta neoplasia maligna ginecologica, infezioni uterine o annessiali in atto, coagulopatie (2,3).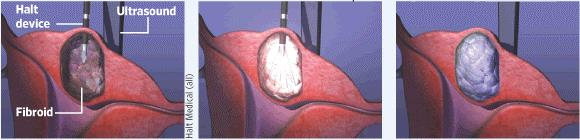
4. Miolisi laparoscopica mediante Yag-laser per via laparoscopica
5. HIFU (High Intensity Focused Ultrasound): è una procedura terapeutica ambulatoriale ad alta precisione che utilizza ultrasuoni ad elevata intensità che focalizzati sulla massa determinano ipertermia localizzata (65-85 °C) e necrosi del tessuto target. L’energia ottimale per la sonicazione viene stabilita per ciascun paziente determinando l’impostazione minima trovata per produrre bolle all’interno della lesione come osservato sull’ecografia B-mode in tempo reale.
Questa tecnologia consente l’esecuzione di un’ablazione precisa e non invasiva del mioma e perciò è nota anche come “Chirurgia HIFU non invasiva”. Un’importante differenza tra HIFU e molte altre forme di energia concentrata, quali per esempio la radioterapia o la radiochirurgia, è che il passaggio dell’energia a ultrasuoni sul tessuto target non ha apparentemente effetto di carattere cumulativo su quel tessuto e non interessa i tessuti adiacenti. Lo sviluppo della terapia HIFU ha conosciuto un enorme avanzamento grazie all’utilizzo dell’imaging in 3D offerto dalla risonanza magnetica (MRI) o dall’ecografia per guidare con precisione il fascio di ultrasuoni e monitorare l’efficacia del trattamento in tempo reale. Questa variante viene definita più precisamente MRgFUS (MR guided Focused UltraSound). Durante la procedura la paziente, sedata con tranquillanti e analgesici oppure in anestesia generale, è sdraiata prona su un tavolo per scanner MRI standard o lettino ecografico. Si rilasciano una serie di impulsi della durata di 15” ognuno su diversi punti del fibroma fino ad ottenere una necrosi completa del fibroma. La paziente è informata della progressione e dei risultati del trattamento in tempo reale. La paziente proverà un senso di caldo in sede pelvica ed avrà a disposizione un pulsante per interrompere la terapia in qualsiasi momento. Dopo l’intervento la paziente sarà trattenuta per alcune ore in osservazione. Quindi potrà ritornare a casa e riprendere le sue normali attività. Dopo alcuni mesi l’organismo avrà rimosso il tessuto necrotico.
I risultati sono estremamente soddisfacenti per fibromi di piccole e medie dimensioni. La tecnica non può essere utilizzata nel caso di fibromi di grosse dimensioni, >8 centimetri e in quelli peduncolati. Purtroppo le recidive ad 1 anno sono del 20% circa.
Questa tecnica è utilizzata anche per fibroadenomi mammari, tumori epatici, tumori del pancreas localmente avanzato, noduli tiroidei, tumori dell’osso, sulle masse retroperitoneali (25-36).
I sostanziali dimostrati vantaggi rispetto alla chirurgia laparotomica sono: il miglior decorso postoperatorio con minor dolore, il più rapido recupero delle normali attività fisiche, la minore degenza ospedaliera e la mancanza di cicatrici estese ed antiestetiche. Per contro, obiezioni sono state sollevate rispetto: alla difficoltà tecnica della fase di enucleazione e sutura. Inoltre l’impossibilità della palpazione manuale dell’utero, facile con la tecnica laparoscopica, potrebbe inoltre determinare l’omissione di piccoli miomi intramurali con conseguente più elevato rischio di recidiva. E’ stata osservata una più alta incidenza di rottura d’utero durante una gravidanza postuma all’intervento di miomectomia laparoscopica, 60% circa di tutte le rotture d’utero in gravidanza, seguita a distanza (22%) dalle rotture d’utero delle gravide già cesarizzate (19-22).
L’introduzione in chirurgia ginecologica del resettoscopio, ha permesso di trattare per via transcervicale i miomi sottomucosi. La resezione isteroscopica dei miomi uterini sottomucosi si è rivelata una tecnica efficace e sicura. Il limite di tale tecnica è rappresentato principalmente dalla cicatrice endometriale e aderenze endometriali post-chirurgiche (S. di Ascherman), dalle dimensioni e dal grado di estensione intramurale dei miomi.
9. Embolizzazione delle aa. uterine: è una procedura di radiologia interventistica introdotta alla fine degli anni ’80 per i casi di metrorragie inoperabili. Tecnica mininvasiva che provoca un’ischemia uterina transitoria bloccando il flusso dell’a. uterina. Nel tempo il circolo arterioso uterino si ripristina ma il tessuto fibromatoso non sopravvive al momento ischemico e quindi va incontro a necrosi con diminuzione di volume nell’85% dei casi e spesso scompare del tutto. Il meccanismo per cui il tessuto miometriale integro sopravvive all’ischemia transitoria contrariamente al tessuto fibromatoso sembra essere identico a quello che interviene nell’immediato post-partum per cui il tessuto deciduale va incontro a necrosi mentre l’endometrio non deciduale si rigenera senza alcun problema. I fattori chiamati in causa sono la velocità del flusso arterioso, i fattori della coagulazione e il collassamento dei vasi della neoformazione (triade di Winslow). Attualmente rappresenta una scelta terapeutica non di routine, praticata da radiologi interventisti in casi limitati e in pochi centri specialistici (19-40).
Tecnica: la valutazione strumentale pre-operatoria è attuata mediante ecografia o RMN per stabilire sede, numero e dimensioni dei miomi e per escludere gravidanza, neoplasie maligne o infezioni pelviche. La preparazione della paziente prevede copertura antibiotica (cefalosporine), profilassi antidolorifica (FANS), profilassi della trombosi venosa profonda (TVP) con eparina a basso peso molecolare, idratazione, digiuno e cateterismo vescicale. L’embolizzazione si esegue in sala angiografica con paziente sveglia, ma sedata (ipnovel, atropina, fentanyl); si può ricorrere all’anestesia epidurale.
L’accesso arterioso è femorale. Dopo aver eseguito un’angiografia pelvica panoramica per valutare l’anatomia vascolare, si cateterizzano selettivamente entrambe le arterie uterine (catetere C2 4-5 fr, eventulamente microcatetere). L’embolizzazione si effettua con materiale particolato permanente (Particelle di alcool polivinilico (PVA) del diametro di 150-500 micron o microsfere acriliche imbevute di gelatina di origine suina o particelle di spugna di gelatina). L’arteria è parzialmente occlusa e successivamente il processo trombotico produrrà la chiusura completa del vaso. Quando il radiologo interventista riterrà che l’embolizzazione sia completa, verrà iniettato altro mezzo di contrasto e saranno acquisite immagini per verificare che il flusso di sangue diretto alla malformazione sia stato effettivamente bloccato e quindi si potrà rimuovere Il catetere. Dopo la procedura la paziente deve restare a letto con adeguata terapia per il controllo della sindrome post-embolizzazione che prevede dolore intenso (100% dei casi) che aumenta progressivamente fino a due ore dopo l’intervento e può essere accompagnato a febbre, nausea e malessere generale che possono perdurare fino ad una settimana dall’intervento. il dolore va dominato con analgesici e Fans iniettati in microinfusione continua mediante micropompa. La somministrazione intraarteriosa di lidocaina per il controllo del dolore post-embolizzazione produce vasospasmo senza nessun vantaggio sulla gestione della sintomatologia dolorosa. A livello locale inizialmente si avrà edema dei tessuti e quindi necrosi del fibroma con sostituzione di tessuto cicatriziale. In caso di miomi sottomucosi si può verificare un’espulsione spontanea del fibroma ridotto di volume. La ricanalizzazione dei vasi avverrà a distanza di mesi. Il follow-up prevede rivalutazione clinica e strumentale (ecografia o RMN) della paziente dopo 1, 6 e 12 mesi (4-20).
 L’embolizzazione, oltre ad essere offerta come un’alternativa all’isterectomia, trova indicazioni in donne con recidiva dopo miomectomia e/o con gravi fattori di rischio chirurgico.
L’embolizzazione, oltre ad essere offerta come un’alternativa all’isterectomia, trova indicazioni in donne con recidiva dopo miomectomia e/o con gravi fattori di rischio chirurgico.
Sono state descritte gravidanze con decorso regolare in donne che sono state sottoposte a questa procedura (4-6).
La dimissione avviene dopo 24-48 ore dall’intervento.
Risultati dell’embolizzazione delle aa. uterine: percentuale di successo compresa tra l’80% ed il 96% nella risoluzione della sintomatologia (senso di peso ipogastrico, menorragia, disturbi urinari) con una riduzione di volume dell’utero del 50% (7-9). Il fallimento della tecnica è legato alla vascolarizzazione secondaria dei fibromi ad opera di rami arteriosi secondari provenienti dalle arterie ovariche, tubariche, vaginali (11-20).
Complicanze dell’embolizzazione delle aa. uterine (1% circa):
-
-
sono riportati in letteratura tre decessi di cui 2 da embolia polmonare massiva ed uno da sepsi.
-
PES (Sindrome post-embolizzazione)
-
reazioni allergiche, edema facciale e della laringe
-
insufficienza renale,
-
broncospasmo
-
edema polmonare
-
Shock ipotensivo
-
ipertensione severa
-
Convulsioni
-
ematoma e pseudoaneurisma in sede di accesso vascolare;
-
embolizzazione periferica
-
trombosi arteriosa
-
perforazione uterina (0,1%), espulsione del mioma (5%),
-
aderenze periuterine,
-
amenorrea transitoria (3-5%); Il reflusso di materiale embolizzante nell’arteria ovarica può determinare un deficit funzionale delle ovaie
-
Deficit funzionale ovarico da irradiazione durante UAE; ad oggi non sono note le dosi responsabili di danni permanenti alle gonadi.
-
Insufficienza placentare da deficit vascolare
-
rischio aumentato di rottura d’utero in successive gravidanze
-
menopausa precoce (15%),
-
sciatalgia,
-
ischemia vescicale o intestinale,
-
trombosi venosa pelvica (17-25).
-
Indicazioni:
– pazienti con alti fattori di rischio chirurgico
– pazienti che desiderano conservare la fertilità
–
– recidiva dopo miomectomia
– alternativa all’isterectomia.
Controindicazioni:
– è sconsigliata alle donne in età fertile e ancora senza prole
– gravidanza
– sepsi pelviche
– allergie al m.d.c.
– insufficienza renale
– disturbi della coagulazione
References:
- La Torre R, Scarpellini F, Fusaro P, Silvestri A, Coacci F, Cosmi EV.: “Transvaginal ultrasonographic diagnosis of adenomyosis in female patients suffering from uterine fibromatosis”. Clin Exp Obstet Gynecol. 1996;23(4):195-7.
- Yin, G., Chen, M., Yang, S., Li, J., Zhu, T., & Zhao, X. (2015). Treatment of uterine myomas by radiofrequency thermal ablation: A 10-year retrospective cohort study. Reproductive Sciences, 22(5), 609–614.
- Iversen, H., & Dueholm, M. (2017). Radiofrequency Thermal Ablation for Uterine Myomas: Long-term Clinical Outcomes and Reinterventions. Journal of Minimally Invasive Gynecology, 24(6), 1020–1028.
- Jaroslav J. Marik: “Follow-up after uterine artery embolization versus myomectomy”. (2006). Article Outline
- Goodwin SC, Bradley LD, Lipman JC, Stewart EA, Nosher JL, Sterling KM, et al.. “Uterine artery embolization versus myomectomy: a multicenter comparative study”. Fertil Steril.2006;85:14–21
- Paul B. Marshburn, Michelle L. Matthews, Bradley S. Hurst: “Uterine Artery Embolization as a Treatment Option for Uterine Myomas”. Obstetrics & Gynecology Clinics of North America 2006; Vol. 33, Issue 1, Pages 125-144.
- LeAnn S. Stokes, Michael J. Wallace, Robbie B. Godwin, Sanjoy Kundu, et al: “Quality Improvement Guidelines for Uterine Artery Embolization for Symptomatic Leiomyomas”. Journal of Vascular and Interventional Radiology 2010; Vol. 21, Issue 8, Pages 1153-1163.
- James B. Spies, John H. Rundback, Susan Ascher, Linda Bradley et al.: “Development of a Research Agenda for Uterine Artery Embolization: Proceedings from a Multidisciplinary Research Consensus Panel”. Journal of Vascular and Interventional Radiology 2006;. 17, Issue 12, Pages 1871-1879
- Gaylene Pron, John Bennett, Andrew Common, Jane Wall et al.: “The Ontario Uterine Fibroid Embolization Trial. Part 2. Uterine fibroid reduction and symptom relief after uterine artery embolization for fibroids”. Fertility and Sterility 2003; Vol. 79, Issue 1, Pages 120-127.
- Scott C. Goodwin, Linda D. Bradley, John C. Lipman, Elizabeth A. Stewart et al.: “Uterine artery embolization versus myomectomy: a multicenter comparative study”. Fertility and Sterility 2006; Vol. 85, Issue 1, Pages 14-21
- Li-Ying Huang, Yu-Fan Cheng, Hsueh-Wen Chang, Shiuh-Young Chang et al:: “Quantified short-term outcome of uterine artery embolization with gelatin sponge particles and lipiodol for symptomatic myoma”. Fertility and Sterility 2004;Vol. 81, Issue 5, Pages 1375-1382.
- Joyce H.S. You, Daljit Singh Sahota, Pong Mo Yuen: “Uterine artery embolization, hysterectomy, or myomectomy for symptomatic uterine fibroids: a cost-utility analysis”. Fertility and Sterility 2009;Vol. 91, Issue 2, Pages 580-588.
- Paul N.M. Lohle, Jolanda De Vries, Caroline A.H. Klazen, Peter F. Boekkooi et al.: “Uterine Artery Embolization for Symptomatic Adenomyosis with or without Uterine Leiomyomas with the Use of Calibrated Tris-acryl Gelatin Microspheres: Midterm Clinical and MR Imaging Follow-up”. Journal of Vascular and Interventional Radiology 2007; Vol. 18, Issue 7, Pages 835-841.
- Sanne M. van der Kooij, Shandra Bipat, Wouter J.K. Hehenkamp, Willem M. Ankum et al: “Uterine artery embolization versus surgery in the treatment of symptomatic fibroids: a systematic review and metaanalysis”. American Journal of Obstetrics & Gynecology 2011; Vol. 205, Issue 4, Pages 317-18.
- Noémie Butori, Hervé Tixier, Laurence Filipuzzi, William Mutamba et al.: “Interest of uterine artery embolization with gelatin sponge particles prior to myomectomy for large and/or multiple fibroids”. European Journal of Radiology 2011; Vol. 79, Issue 1, Pages 1-6.
- Gary P. Siskin, Richard D. Shlansky-Goldberg, Scott C. Goodwin, Keith Sterling et al.: “A Prospective Multicenter Comparative Study between Myomectomy and Uterine Artery Embolization with Polyvinyl Alcohol Microspheres: Long-term Clinical Outcomes in Patients with Symptomatic Uterine Fibroids”. Journal of Vascular and Interventional Radiology 2006;Vol. 17, Issue 8, Pages 1287-1295.
- Burbank F: “Childbirth and Myoma Treatment by Uterine Artery Occlusion: Do They Share a Common Biology”. Journal of the American Association of Gynecologic Laparoscopists 2004; Vol. 11, Issue 2, Pages 138-152.
- Bo Zhang, Zai-Bo Jiang, Ming-Sheng Huang, Shou-Hai Guan et al.: “Uterine Artery Embolization Combined with Methotrexate in the Treatment of Cesarean Scar Pregnancy: Results of a Case Series and Review of the Literature”. Journal of Vascular and Interventional Radiology 2012;Vol. 23, Issue 12, Pages 1582-1588.
- Lupattelli T., Basile A., Garaci F.G., Simonetti G.: “Percutaneous uterine artery embolization for the treatment of symptomatic fibroids: current status”. European Journal of Radiology 2005;Vol. 54, Issue 1, Pages 136-147.
- M.J. Bratby, A.-M. Belli: “Radiological treatment of symptomatic uterine fibroids”. Best Practice & Research Clinical Obstetrics & Gynaecology 2008; Vol. 22, Issue 4, Pages 717-734.
- Chao AS, Chang YL, Yang LY, Chao A Chang WY, Su SY, Wang CJ .Laparoscopic uterine surgery as a risk factor for uterine rupture during pregnancy. PLoS One. 2018 May 22;13(5):e0197307. doi: 10.1371/journal.pone.0197307. eCollection 2018.
- [Current status of uterine rupture: a multi-center survey in China]. Liu Z, Yang HX, Xin H, Cui SH, Qi HB, Zhang WS.Zhonghua Fu Chan Ke Za Zhi. 2019 Jun 25; 54(6):363-368
- [Is vaginal delivery possible for patients with myomectomy? Results of a monocentric study]. Villot A, Cheret-Benoist A, Creveuil C, Turck M, Dreyfus M, Benoist G.Gynecol Obstet Fertil. 2015 Jul-Aug; 43(7-8):496-501. Epub 2015 May 16.
- Uterine rupture in pregnancy: two case reports and review of literature. Pontis A, Prasciolu C, Litta P, Angioni S.Clin Exp Obstet Gynecol. 2016; 43(2):304-9.
- Larsen TK, Faurschou JP, Bak M, et al. Fibroadenoma of the breast–modern strategy of treatment. Ugeskr Laeger. 2003;165:1979–1983.
- Fine RE, Staren ED. Percutaneous radiofrequency-assisted excision of fibroadenomas. Am J Surg. 2006;192:545–547.
-
Hahn M. et al: “High intensity focused ultrasound (HIFU) for the treatment of symptomatic breast fibroadenoma”. International Journal of Hyperthermia 2018;35(1):1-8
-
Greenberg R, Skornick Y, Kaplan O. Management of breast fibroadenomas. J Gen Intern Med. 1998;13:640–645.
- Croce S, Bretz-Grenier MF, Mathelin C. Most common benign epithelial breast diseases: diagnosis, treatment and cancer risk. Gynecol Obstet Fertil. 2008;36:788–799.
- Hahn M, Krainick U, Peisker U, et al. Eignet sich das Hand Held Mammotome zur kompletten Entfernung benigner Läsionen der Brust? Geburtshilfe Frauenheilkd. 2004;64:719–722. doi: 10.1055/s-2004-821006.
- Whitworth PW, Rewcastle JC. Cryoablation and cryolocalization in the management of breast disease. J Surg Oncol. 2005;90:1–9. doi: 10.1002/jso.20201.
- Kaufman CS, Bachman B, Littrup PJ, et al. Cryoablation treatment of benign breast lesions with 12-month follow-up. Am J Surg. 2004;188:340–348.
- Golatta M, Harcos A, Pavlista D, et al. Ultrasound-guided cryoablation of breast fibroadenoma: a pilot trial. Arch Gynecol Obstet. 2015;291:1355–1360. doi: 10.1007/s00404-014-3553-5.
- Hahn M, Pavlista D, Danes J, et al. Ultrasound guided cryoablation of fibroadenomas. Ultraschall in Med. 2012;34:64–68. doi: 10.1055/s-0032-1325460.
- Gage AA, Baust JG. Cryosurgery for tumors – a clinical overview. Technol Cancer Res Treat. 2004;3:187–199.
- Simmons RM, Ballman KV, Cox C, et al. A phase ii trial exploring the success of cryoablation therapy in the treatment of invasive breast carcinoma: results from ACOSOG (Alliance) Z1072. Ann Surg Oncol. 2016;23:2438–2445.


