Ultimo aggiornamento 2020-02-02 4:20:19 PM
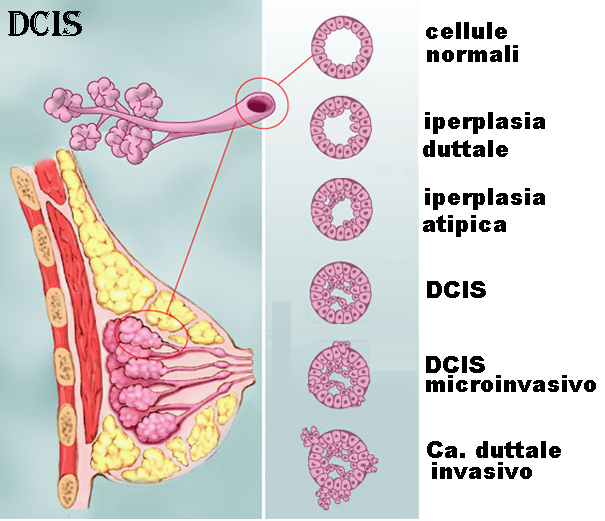
CARCINOMA DUTTALE IN SITU (DCIS) – Il DCIS è una forma iniziale di cancro mammario, stadio 0, detto anche precancerosi, carcinoma pre-invasivo intraduttale. Le cellule neoplastiche si sviluppano all’interno dell’unità dotto-lobulare rimanendo “in situ” cioè non si estendono al di fuori della membrana basale del sistema duttulo-lobulare. Interessa i dotti nel 96% dei casi, i lobuli nel 3% e sono misti nell’1% dei casi. Se non trattato, può regredire spontaneamente ma spesso può assumere un atteggiamento invasivo e trasformarsi in cancro mammario.
EPIDEMIOLOGIA – Il DCIS un tempo era una patologia poco conosciuta, una diagnosi molto rara. Durante la prima metà del 20° secolo rappresentava solo l’1-2% delle neoplasie mammarie e di solito veniva rilevato quando formava una grande massa palpabile: La mastectomia divenne la terapia standard con discreti risultati. Nell’ultimo ventennio la diagnosi precoce è cresciuta notevolmente grazie alle migliorate tecniche diagnostiche, apparecchiature più sofisticate e aumentati protocolli di screening ecografici e mammografici di massa. Paradossalmente il riscontro di aumentata in assoluto e in percentuale (20%) fra tutte le neoplasie mammarie è da considerare in senso positivo. Significa che un maggior numero di cancro mammario è stato scoperto in fase iniziale prima di poter produrre danni irreparabili.
DIAGNOSI
Nella maggior parte dei casi la patologia è asintomatica, indolore e la paziente scopre casualmente la presenza di un nodulo mammario  per autopalpazione occasionale oppure ne viene a conoscenza durante una visita di routine anche per altre indicazioni o durante una normale visita senologica e mammografia di screening oncologico come quelle che recentemente si stanno diffondendo in Italia a cura del SSN. I noduli, a differenza delle cisti sierose, sono indolori tranne una lieve tensione dolorosa durante la fase luteale tardiva nelle pazienti in età fertile. I noduli sono localizzati nel quadrante supero-esterno nel 50% dei DCIS. In alcuni casi la paziente può notare una secrezione dal capezzolo, più raramente un arrossamento dell’areola e/o capezzolo (malattia di Paget).
per autopalpazione occasionale oppure ne viene a conoscenza durante una visita di routine anche per altre indicazioni o durante una normale visita senologica e mammografia di screening oncologico come quelle che recentemente si stanno diffondendo in Italia a cura del SSN. I noduli, a differenza delle cisti sierose, sono indolori tranne una lieve tensione dolorosa durante la fase luteale tardiva nelle pazienti in età fertile. I noduli sono localizzati nel quadrante supero-esterno nel 50% dei DCIS. In alcuni casi la paziente può notare una secrezione dal capezzolo, più raramente un arrossamento dell’areola e/o capezzolo (malattia di Paget).
Esame citologico: si pratica come completamento dell’esame clinico, mammografico ed ecografico; è semplice, poco costoso e minimamente invasivo. La sensibilità dell’esame citologico per carcinoma è del 90%. Si pratica, con varie modalità, su  noduli, cisti e secrezioni (vedi agoaspirazione). Una tecnica che si applica peculiarmente per la citologia del DCIS è la cosiddetta biopsia liquida o lavaggio duttale. Consiste nell’introduzione di liquido nei dotti galattofori attraverso i pori lattiferi presenti sul capezzolo. Il liquido raccolto contiene alcune cellule della parete dei dotti stessi che possono essere studiate al microscopio alla ricerca di eventuali atipie. In caso di m. di Paget si ricorre alla shave-biopsy (biopsia da barba).
noduli, cisti e secrezioni (vedi agoaspirazione). Una tecnica che si applica peculiarmente per la citologia del DCIS è la cosiddetta biopsia liquida o lavaggio duttale. Consiste nell’introduzione di liquido nei dotti galattofori attraverso i pori lattiferi presenti sul capezzolo. Il liquido raccolto contiene alcune cellule della parete dei dotti stessi che possono essere studiate al microscopio alla ricerca di eventuali atipie. In caso di m. di Paget si ricorre alla shave-biopsy (biopsia da barba).
Ecografia mammaria: presenza di aree ipoecogene, rotodeggianti, ad ecostruttura disomogenea, a margini sfumati (noduli). Spesso si osservano microscopiche formazioni iperecogene riunite in cluster o diffuse nel parenchima mammario, da attribuire a microcalcificazioni.
Mammografia: spesso sono presenti micro-calcificazioni come segno caratteristico di DCIS ma, soprattutto nelle donne >65 anni, la presenza di microcalcificazioni rientra nel fisiologico fenomeno di senescenza tissutale. In caso di micro-calcificazioni si esegueun mammotome (biopsia stereotattica). Recentemente è stato immesso in commercio un mammografo 3D a tomosintesi capace di acquisire immagini tridimensionali e scoprire noduli della dimensione di 1 mm.
RMN: è utile per definire meglio l’estensione delle alterazioni e programmare in modo adeguato il trattamento successivo soprattutto nelle mammelle dense giovanili.
Biopsia: necessaria per una diagnosi definitiva; si adottano, a secondo dei casi, varie metodiche: biopsia escissionale, Core needle-biopsy su guida ecografica, Mammotome® (Vacuum assisted biopsy, VABB) stereotassica guidata da un sistema computerizzato (vedi Agoaspirazione).
ISTOLOGIA: l’esame istologico mostra usualmente una diffusa iperplasia duttale, fenomeni necrotici e di papillomatosi.
Grading: le atipie cellulari possono essere di vario grado per cui si classificano in:
- Grado 1: ben differenziato (30%)
- Grado 2: moderatamente differenziato (45%)
- Grado 3: scarsamente differenziato (25%)
Quindi il DCIS viene classificato come CDIS-G1/DIN1 o CDIS-G2/DIN2 o CDIS-G3/DIN3.
In base alla modalità di crescita all’interno del dotto, il DCIS viene suddiviso in:
- “comedonico” quando è composto da grandi cellule di forma irregolare, con elevata proliferazione e cellule necrotiche presenti nella parte centrale del dotto.
- “non-comedonico”:
- a sua volta suddiviso in cribriforme, papillare, micropapillare e solido composto da cellule più piccole, di forma regolare; aree di necrosi assenti.
- Mixed
L’esame istologico di un DCIS si completa con
- la ricerca dei recettori ormonali a cui si legano gli ormoni femminili (estrogeni/progesterone) che stimolano le cellule tumorali a crescere. L’assetto recettoriale presenta il seguente diagramma: ER+/PR+ nel 65% dei casi; ER-/PR- nel 25%; ER+/PR- nel 10%.
- i recettori HER2
- l’indice di proliferazione Ki67 o MIB1
TERAPIA
Lo scopo del trattamento è asportare chirurgicamente in modo completo il DCIS per evitare che si riformi o possa diventare un tumore duttale invasivo se non viene curato. In ogni caso, a volte da un DCIS non si sviluppa un tumore invasivo o la crescita è così lenta da non rappresentare un problema per tutto il resto della vita. Questo è particolarmente importante nelle persone anziane. È impossibile attualmente prevedere nella singola paziente quale sarà il comportamento futuro: il tipo di DCIS (comedonico), il grado (Grado 3) e le dimensioni (>5 cm) hanno una prognosi sfavorevole.
TERAPIA CHIRURGICA:
- mastectomia nel 25% dei casi,
- quadrantectomia o tumorectomia nel 40%,
- trattamento conservativo nel 35% dei casi,
- biopsia del linfonodo satellite (20-80%).
Quadrantectomia o tumorectomia: è l’intervento di routine per la rimozione della neoplasia. Si rimuove la porzione di tessuto mammario sede della lesione compresa una porzione limitrofa di 2 cm di tessuto indenne.
Prima dell’intervento, sotto rx-scopia, viene inserito un filo radiopaco molto sottile nell’area da asportare. La procedura viene effettuata in anestesia locale, il giorno prima o il giorno stesso dell’intervento, e dura circa 30 minuti. Il filo viene fissato e coperto con una medicazione e viene tolto durante l’intervento chirurgico.
Dopo quadrantectomia occorre praticare radioterapia allo scopo di evitare recidive.
Nelle forme iniziali di cancro (stadio I e II), la quadrantectomia seguita da radioterapia è altrettanto efficace della mastectomia totale.
Mastectomia: Se viene proposta una mastectomia di solito si discute sulla possibilità di una ricostruzione del seno. L’intervento di ricostruzione può essere eseguito contemporaneamente alla mastectomia oppure in un secondo tempo.
Biopsia del linfonodo sentinella indicazioni nel DCIS: Non è una procedura standard, non vi è indicazione assoluta alla biopsia del l.s. Nei casi in cui il sospetto di microinvasione sia elevato, ossia grading alto, pattern mammografico ad alto rischio ed estensione >5 cm, necessità di un’esatta definizione del ” T ” per la sottostadiazione, la metodica è consigliata, mentre può essere considerata discrezionale negli altri casi. In caso di mastectomia è utile procedere direttamente all’analisi del linfonodo sentinella: dopo una mastectomia infatti tecnicamente non è più possibile eseguire una biopsia del linfonodo sentinella. In caso di positività netta occore procedere alla linfadenectomia ascellare.
Radioterapia
La radioterapia è di solito raccomandata dopo un intervento conservativo per ridurre il rischio di recidive. La radioterapia è inutile dopo una mastectomia in caso di DCIS. La radioterapia dura pochi minuti e va ripetuta per cinque giorni la settimana per 5-6 settimane di seguito.
Terapia endocrina
I benefici della terapia endocrina nel DCIS sono molto meno consistenti che nel tumore duttale invasivo.
Tamoxifene (Nolvadex® cpr 10 mg, 20 mg) è l’unica terapia endocrina precauzionale che ha dimostrato di essere efficace nel DCIS. Il Tamoxifene blocca i recettori estrogenici delle cellule bersaglio suscettibili di degenerazione neoplastica. Viene prescritto sia alle pazienti in premenopausa che a quelle in menopausa. La durata del trattamento è di almeno 5 anni. Nelle donne in età fertile il TMX viene spesso associato a LH-RH-a in preparazione retard (Decapeptyl®, Gonapeptyl® 3.65 mg fiale s.c.) che viene somministrato mensilmente e induce una menopausa iatrogena.
Se nel DCIS non sono stati trovati i recettori ormonali, la terapia endocrina non viene consigliata perché non porterebbe alcun beneficio.
Inibitori dell’aromatasi: si sono dimostrati efficaci e sono prescritti solo in caso di cancro mammario invasivo.
HER2 (o Cerb-B2): Nel DCIS possono essere presenti sulla superficie delle cellule tumorali i recettori HER2 (o Cerb-B2). Nelle forme non invasive di tumore mammario come il DCIS al momento non vi è alcun dato che suggerisca un beneficio con una terapia biologica mirata (terapia a bersaglio) precauzionale. Mentre in caso di cancro si propone, alle donne positive per questo esame, una terapia con trastuzumab, una sostanza che blocca i recettori e impedisce la crescita del tumore e le recidive.
DIAGNOSI ISTOLOGICA:
1) DCIS PURI
2) DCIS “mic”
3) DCI
PROGNOSI: la sopravvivenza a cinque anni nelle donne trattate è del 98% anche se le ricadute variano tra il 9 e il 30% dei casi, a seconda della terapia effettuata. La mortalità per tumore al seno a 20 anni dalla diagnosi di un DCIS è bassa: si stima che sia in media del 3,3%. Però i DCIS presentano una grande variabilità, anche in termini di prognosi e di rischio di recidiva o ischio di insorgenza di un tumore invasivo. Alcuni fattori che aumenterebbero il rischio di mortalità sono la comparsa del tumore in giovane età, l’etnia (le donne di colore), le nullipare, le pazienti PCOS e le donne che non hanno allattato al seno sembrano essere a maggior rischio.
Bibliografia:
- Forza Operativa Nazionale sul Carcinoma Mammario: “I tumori della mammella. Linee guida sulla diagnosi, il trattamento e la riabilitazione”, Marzo 2001.
- Abdel-Fatah TM, Powe DG, Hodi Z, Lee AH, Reis-Filho JS, Ellis IO. High frequency of coexistence of columnar cell lesions, lobular neoplasia, and low grade ductal carcinoma in situ with invasive tubular carcinoma and invasive lobular carcinoma. Am J Surg Pathol. 2007;31:417–426.
- Allred DC. Biological characteristics of ductal carcinoma in situ. In: Silverstein ML, editor. Ductal Carcinoma In Situ of the Breast. 2nd ed. Philadelphia, PA: Lipincott: Williams and Wilkins; 2002. pp. 37–48.
- Wellings RR, Jensen HM. On the origin and progression of ductal carcinoma in the human breast. J Natl Cancer Inst. 1973;50(5):1111–1118. [PubMed] [Google Scholar]
- Allred DC. Biological features of human premalignant breast disease and the progression to cancer. In: Harris JR, Lippman ME, Morrow M, Osborne CK, editors. Diseases of the Breast. 4th ed. Philadelphia, PA: Lippincott Williams and Wilkins; 2009. pp. 323–334. [Google Scholar]
- Cheatle GL, Cutler M. Malignant epithelial neoplasia. Carcinoma. The precancerous or potentially carcinomatous state. In: Cheatle GL, Cutler M, editors. Tumours of the Breast. 1st ed. Philadelphia, PA: Lippincott; 1926. pp. 161–332. [Google Scholar]
- Foote FW, Stewart FW. Comparative studies of cancerous versus noncancerous breasts. Ann Surg. 1945;121(1):6–53. 197–222.
- Page DL, Rogers LW. Carcinoma in situ (CIS) In: Page DL, Anderson TJ, editors. Diagnostic Histopathology of the Breast. 1st ed. New York, NY: Churchill Livingston; 1987. pp. 157–174.
- Wellings SR, Jensen HM, Marcum RG. An atlas of subgross pathology of the human breast with special reference to possible precancerous lesions. J Natl Cancer Inst. 1975;55(2):231–273.
- Muir R. The evolution of carcinoma of the mamma. J Pathol Bacteriol. 1941;LII(2):155–172.
- Fechner RE. History of ductal carcinoma in situ. In: Silverstein ML, editor. Ductal Carcinoma In Situ of the Breast. 2nd ed. Philadelphia, PA: Lippincott Williams and Wilkins; 2002. pp. 3–16.
- Morrow M, Harris JR. Ductal carcinoma in situ and microinvasive carcinoma. In: Harris JR, Lippman ME, Morrow M, Osborne CK, editors. Diseases of the Breast. 3rd ed. Philadelphia, PA: Lippincott Williams and Wilkins; 2004. pp. 521–537.
- Allred DC, Mohsin SK, Fuqua SA. Histological and biological evolution of human premalignant breast disease. Endocr Relat Cancer. 2001;8(1):47–61.
- Dalgin GS, Alexe G, Scanfeld D, et al. Portraits of breast cancer progression. BMC Bioinformatics. 2007;8:291.
- Erbas B, Provenzano E, Armes J, Gertig D. The natural history of ductal carcinoma in situ of the breast: a review. Breast Cancer Res Treat. 2006;97(2):135–144.
- Kuerer HM, Albarracin CT, Yang WT, et al. Ductal carcinoma in situ: state of the science and roadmap to advance the field. J Clin Oncol. 2009;27(2):279–288. [
- Polyak K. Breast cancer: origins and evolution. J Clin Invest. 2007;117(11):3155–3163.
- Schnitt SJ, Silen W, Sadowsky NL, Connolly JL, Harris JR. Ductal carcinoma in situ (intraductal carcinoma) of the breast. N Engl J Med. 1988;318(14):898–903.
- Ernster VL, Barclay J. Increases in ductal carcinoma in situ (DCIS) of the breast in relation to mammography: a dilemma. Natl Cancer Inst Monogr. 1997;22:151–156.
- Silverstein MJ, Lagios MD, Groshen S, et al. The influence of margin width on local control of ductal carcinoma in situ of the breast. N Engl J Med. 1999;340(19):1455–1461.
- Solin LJ, Kurtz J, Forquet A, et al. Fifteen-year results of breast-conserving surgery and definitive breast irradiation for the treatment of ductal carcinoma in situ of the breast. J Clin Oncol. 1996;14(3):754–763.
- Allred DC, Wu Y, Mao S, et al. Ductal carcinoma in situ and the emergence of diversity during breast cancer evolution. Clin Cancer Res. 2008;14(2):370–378.
- Shoker BS, Sloane JP. DCIS grading schemes and clinical implications. Histopathology. 1999;35(5):393–400.
- Tavassoli FA, Schitt SJ, Hoefler H, et al. Intraductal proliferative lesions. In: Tavassoli FA, Devillee P, editors. Pathology & Genetics. Tumours of the Breast and Female Genital Organs. Lyon, France: IARC Press; 2003. pp. 63–73. [
- Elston EW, Ellis IO. Method for grading breast cancer. J Clin Pathol. 1993;46(2):189–190.
- Rakha EA, El-Sayed ME, Lee AH, et al. Prognostic significance of Nottingham histologic grade in invasive breast carcinoma. J Clin Oncol. 2008;26(19):3153–3158.
- Bernstein L. The epidemiology of breast carcinoma in situ. In: Silverstein ML, editor. Ductal Carcinoma In Situ of the Breast. 2nd ed. Philadelphia, PA: Lippincott Williams and Wilkins; 2002. pp. 22–34.
- Dupont WD, Page DL. Risk factors for breast cancer in women with proliferative breast disease. N Engl J Med. 1985;312(3):146–151.
- Page DL. Cancer risk assessment in benign breast biopsies. Human Pathol. 1986;17(9):871–874.
- Sanders ME, Schuyler PA, Dupont WD, Page DL. The natural history of low-grade ductal carcinoma in situ of the breast in women treated by biopsy only revealed over 30 years of long-term follow-up. Cancer. 2005;103(12):2481–2484.
- O’Connell P, Pekkel V, Fuqua SAW, Osborne CK, Allred DC. Loss-of-heterozygosity analysis in 399 premalignant breast lesions at 15 genetic loci. J Natl Cancer Inst. 1998;(90):697–703.
- Allred DC, Medina D. The relevance of mouse models to the development and progression of human breast cancer. J Mammary Gland Biol Neoplasia. 2008;(13):279–288.
- Miller FR. Xenograft models of premalignant breast disease. J Mammary Gland Biol Neoplasia. 2000;5(4):379–391.
- Bobrow LG, Happerfield LC, Gregory WM, Springall RD, Millis RR. The classification of ductal carcinoma in situ and its association with biological markers. Semin Diag pathol. 1994;11(3):199–207.
- Gupta SK, Douglas-Jones AG, Morgan JM, Mansel RE. The clinical behavior of breast carcinoma is probably determined at the preinvasive stage (ductal carcinoma in situ) Cancer. 1997;80(9):1740–1745.
- Moreno A, Lloveras B, Figueras A, et al. Ductal carcinoma in situ of the breast: correlation between histologic classifications and biologic markers. Mod Pathol. 1997;10(11):1088–1092.
- Poller DN, Silverstein MJ, Galea M, et al. Ductal carcinoma in situ of the breast: a proposal for a new simplified histological classification association between cellular proliferation and c-erbB-2 protein expression. Mod Pathol. 1994;7(2):257–262.
- Ma XJ, Salunga R, Tuggle JT, et al. Gene expression profiles of human breast cancer progression. Proc Natl Acad Sci U S A. 2003;100(10):5974–5979.
- Porter D, Lahti-Domenici J, Keshaviah A, et al. Molecular markers in ductal carcinoma in situ of the breast. Mol Cancer Res. 2003;1(5):362–375.
- Castro NP, Osorio CA, Torres C, et al. Evidence that molecular changes in cells occur before morphological alterations during the progression of breast ductal carcinoma. Breast Cancer Res. 2008;10(5):R87. [PMC free article]
- Hannemann J, Velds A, Halfwerk JB, Kreike B, Peterse JL, van de Vijver MJ. Classification of ductal carcinoma in situ by gene expression profiling. Breast Cancer Res. 2006;8(5):R61. [PMC free article]
- Allinen M, Beroukhim R, Cai L, et al. Molecular characterization of the tumor microenvironment in breast cancer. Cancer Cell. 2004;6(1):17–32.
- Kalluri R, Zeisberg M. Fibroblasts in cancer. Nat Rev Cancer. 2006;6(5):392–401.
- Park CC, Bissell MJ, Barcellos-Hoff MH. The influence of the microenvironment on the malignant phenotype. Mol Med Today. 2000;6(8):324–329.
- Polyak K, Hu M. Do myoepithelial cells hold the key for breast tumor progression? J Mammary Gland Biol Neoplasia. 2005;10(3):231–247.
- Bestill WL, Jr, Rosen PP, Lieberman PH, Robbins GF. Intraductal carcinoma: long-term follow-up after treatment by biopsy alone. JAMA. 1978;239(18):1863–1867.
- Eusebi V, Feudale E, Foschini MP, et al. Long-term follow-up of in situ carcinoma of the breast. Sem Diag Pathol. 1994;11:223–235.
- Page DL, Dupont WD, Rogers LW, Landenberger M. Intraductal carcinoma of the breast: follow-up after biopsy only. Cancer. 1982;49(4):751–758.
- Rosen PP, Braun DW, Jr, Kinne DE. The clinical significance of preinvasive breast carcinomas. Cancer. 1980;46:919–925.
- O’Sullivan MJ, Morrow M. Ductal carcinoma in situ—current management. Surg Clin North Am. 2007;87(2):333–351.