La Candidiasi Vulvo-Vaginale ricorrente (CVVR) interessa circa il 5-15% 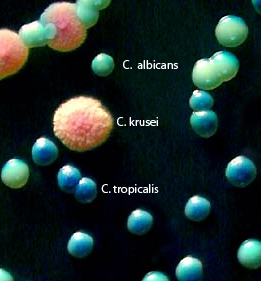 delle donne in età fertile e rappresenta, nell’ambito delle infezioni vulvo-vaginali, un problema emergente e di difficile soluzione.
delle donne in età fertile e rappresenta, nell’ambito delle infezioni vulvo-vaginali, un problema emergente e di difficile soluzione.
I miceti interessati sono la C. albicans nell’80% dei casi, la C. glabrata nel 15%, C. tropicalis, C. krusei, C. lusitaniae e parapsilosi nel restante 5% dei casi.
La CVVR interessa soprattutto le donne diabetiche ed immunodepresse. Necessita di una terapia lunga ed articolata basata su antimicotici, antinfiammatori e probiotici.
EZIOLOGIA – la CVVR è classicamente caratterizzata da pervicace persistenza e ricorrenza della patologia e da una particolare resistenza alla terapia con i comuni farmaci antimicotici. Diversi i fattori e i meccanismi eziopatologici interessati:
- mutazioni nel gene ERG11, che codifica per 14-α-demetilasi. Queste mutazioni impediscono al farmaco azolico di legarsi, pur consentendo il legame con il substrato naturale dell’enzima, il lanosterolo. Lo sviluppo di questo tipo di resistenza a un farmaco azolico conferisce resistenza a tutti i farmaci della classe.
- aumentata velocità di efflusso del farmaco azolico dalla cellule micotiche, grazie alla attività della superfamiglia dei grandi trasportatori.
- dismicrobismo intestinale: l’intestino rappresenta la cronica fonte di contagio (72) dove, a causa del deficit di biotina e/o della riduzione della flora saprofitica fisiologica in seguito a terapia antibiotica e/o per patologia intestinale si assiste al viraggio della candida dalla forma sporigena a fungo patogeno.
- sviluppo di specie non-albicans (C. tropicalis, C. glabrata, C. parapsilosis ecc.) più resistenti alle terapie imidazoliche;
- trasmissione sessuale ripetuta da parte di partner maschili non trattati (effetto ping-pong). L’incidenza della trasmissione sessuale è però solo del 20%;
- Stimoli flogogeni cronici in cui è coinvolta l’attivazione dei mastociti. L’infiltrazione mastocitaria, è il denominatore comune in tutte le patologie pelviche caratterizzate dal dolore (sindrome della vescica dolorosa, vestibulite vulvare/vulvodinia, endometriosi, colon .irritabile), che concorrono al dolore pelvico cronico. La prolungata attivazione mastocitaria produce un’attivazione continua, prolungata e recidivante delle infezioni vaginali resistenti a tutte le terapie antibiotiche seppure mirate.
- depressione dell’attività immunitaria cellulo-mediata locale della mucosa vaginale e/o sistemica;
- diabete mellito: il diabete moltiplica l’aggressività micotica creando un ambiente vaginale favorevole alla crescita e sopravvivenza dei miceti.
- reazione di ipersensibilità locale provocata dalle PGE prodotte in eccesso dai macrofagi stimolati dagli antigeni della candida;
- alterazione della normale flora batterica vaginale.
DIAGNOSI CVVR:
la diagnosi si ottiene mediante valutazione della sintomatologia in atto, esame obiettivo e ricerca dei miceti in cultura in vitro.
- la sintomatologia pruriginosa è presente, seppur meno intensa rispetto alla forma acuta. Il bruciore e la dispareunia rivestono maggior importanza rispetto alle candidosi vulvovaginali acute.
- Il quadro clinico può essere rappresentato da un eritema diffuso del vestibolo vaginale, piccole labbra e solco interlabiale, con erosioni confluenti nelle piccole labbra, microvescicolazioni delimitate da un “orletto” biancastro, parzialmente desquamante, lateralmente al confine con le grandi labbra. La leucorrea, quando presente, non è particolarmente abbondante ed è acquosa o finemente densa ed omogenea.
- l’esame a fresco del vetrino sotto microscopio ottico e l’aggiunta sullo striscio di idrossido di potassio (KOH) al 10% o colorazione del vetrino con blu di metilene. Il KOH dissolve le altre cellule e rende più evidenti le ife e le spore della candida. Nel classico pap-test la colorazione di Papanicolau non evidenzia molto la candida per cui è necessario ricorrere alla
- cultura in vitro di campioni di secreto vaginale ottenuti mediante tampone.
Terapia: la prevenzione e la cura della candidosi vulvovaginale ricorrente deve prevedere una strategia multimodale di lunga durata (6-12 mesi), finalizzata a correggere i fattori predisponenti, precipitanti e di mantenimento. Attualmente la CVVR è da collocare, oltre che tra le infezioni vulvo-vaginali, soprattutto tra le patologie immunoallergiche causate dalla Candida.
- Fluconazolo cpr 200 mg a giorni alterni per 3 giorni; quindi una volta a settimana per 3 mesi. Associare probiotici tutti i giorni per 3 mesi (69).
- Amfotericina B : (Fungizone® fl 50 mg in soluzione elettrolitica per infusione endovena lentissima (H); Talsutin® crema vaginale = tetraciclina + amfotericina B).
- Acido borico: AB-300® capsule vaginali o AB 300 plus crema vaginale crema vaginale (Ac. borico + ß-glucano + Policarbophil); (Ac. borico + beta glucano + policarbophil); Acido borico è micostatico mentre il ß-glucano sviluppa le difese immunitarie e il policarbophil è mucoadesivo ed acidificante.
- Micostop® flac P (ac. borico + clorexidina + clotrimazolo); Boracid plus® schiuma vaginale (ac. Borico + ac. Benzoico).
- Micostop crema vaginale (ac. borico + clorexidina + clotrimazolo)
- Deltavagin (Betametasone 2 mg +Tirotricina 10 mg + Acido Alfa aminovalerianico (Norvalina) 100 mg): 1 ovulo ogni sera prima di coricarsi, introdotto profondamente in vagina. Iniziare il trattamento subito dopo il mestruo, ripetendo, se necessario, un ciclo dopo il successivo periodo mestruale. Nei giorni seguenti si può passare al componente ritenuto necessario.Il Betametasone è un glucocorticoide sintetico che esercita un’azione antiflogistica locale, riducendo l’essudazione antinfiammatoria e l’iperemia locale. La Tirotricina assicura un ampio spettro d’azione antibatterica. Inoltre la Tirotricina agisce bene anche in presenza di essidati o di materiale necrotico. L’acido alfa aminovalerianico, riportando verso l’acidità il pH vaginale, favorisce il ristabilimento della normale flora vaginale. In gravidanza somministrare solo in caso di effettiva necessità.
- Biotina (Diathynil® cpr 5 mg: 2 cpr/die per 6 settimane , fl im/ev 5 mg: 1-2 fl tre volte a settimana per 6 settimane): è una vitamina del gruppo B ed un potente inibitore della virulentazione della candida a livello intestinale. Durante la terapia si consiglia l’esclusione dalla dieta dell’albume d’uovo crudo, nel quale è contenuta una proteina chiamata avidina che si lega con la D(+) biotina inibendone l’assorbimento intestinale. La Biotina è denominata vitamina H nella letteratura tedesca e vitamina B7 in quella anglo-sassone. La biotina è presente nel latte e latticini, nel tuorlo d’uovo e nei frutti di mare, ma per essere disponibile occore che gli alimenti che la contengono siano ben digeriti; per tale motivo c’è carenza di biotina nei soggetti enteropatici. Il meccanismo di assorbimento intestinale è ancora poco conosciuto ma è plausibile che la sua captazione avvenga per gradiente di concentrazione grazie al sodio; ciò costituisce il rationale della terapia con bicarbonato di sodio (1 cucchiano/die disciolto in acqua. .
La biotina è prodotta in elevate quantità anche dai batteri intestinali. Il farmaco può essere impiegato durante la gravidanza e l’allattamento. La D(+) biotina costituisce il gruppo prostetico degli enzimi di carbossilazione essenziali per il metabolismo dei carboidrati, dei lipidi e delle purine della flora intestinale saprofitica.
Prebiotici e probiotici per somministrazione orale e per applicazione locale: nonostante la tendenza delle case farmaceutiche ad esagerane le qualità terapeutiche, queste sostanze sembrano abbassare il pH locale, inibire la crescita dei batteri non saprofitici per competizione nell’adesione epiteliale e mediante la produzione di antibiotici naturali e favorire la crescita della flora saprofitica fisiologica (72-78).
- Vitagyn C® ovuli e crema vaginale (vit C + lattobacilli)
- Dicoflor 60® bustine (maltodestrine, fruttosio, probiotici liofilizzati, lattobacilli rhamnosus): 1 bustina x 2/die durante i pasti, disciolta in acqua o direttamente in bocca.
- Dicoflor Elle® capsule: 2-3 cps/die lontano dai i pasti
- Se il dolore vestibolare è intenso, sono indicate le associazioni di farmaci antinfiammatori (Voltadvance®, Enantyum® cpr 25 mg) con la palmitoiletanolamide (PEA: Normast®, Peacist® bustine orosolubili 600 mg), che riducono l’iperattività del mastocita.
- Diflumax flac P: a base di acqua termale salsobromoiodica, estratti di calwndula, salvia, malva e olio essenziale di timo
- olii detergenti (olio di germe di grano, olio di iberico, olio di canapa, Melaleuca alternifolia) che rispettano il film lipidico cutaneo e forniscono sostanze ad azione antiossidante.
Misure dietetiche e altre precauzioni per evitare le recidive
- La dieta deve essere ipoglicidica, ipolipidica e ricca di verdure, legumi, carne e yogurt e distribuita in 3 pasti principali leggeri e 2 spuntini. Preferire lo yogurt greco ricco di fermenti lattici vivi.
- Diminuire o abolire il consumo di zucchero raffinato che fermentado favorisce la crescita dei miceti: anche una modesta diminuzione del consumo di zucchero apporta notevole riduzione della frequenza della CVVR
- evitare i prodotti raffinati
- preferire i prodotti bio, a chilometro zero
- evitare gli alcoolici: l’alcool fomisce elementi utili per la crescita della candida.
- evitare i latticini
- diminuire il consumo di lardo o alimenti grassi animali
- evitare i prodotti contenenti glutine
- Non bere molto durante i pasti
- Includete nella dieta, quanto più vi è possibile, zenzero, cinnamomo, aglio ed altre erbe aromatiche (ad esempio l’origano) – sono tutte fungicide e aiutano la digestione.
- Per favorire le funzioni intestinali, è utile assumere quotidianamente prodotti a base di fibre ((Benefibra® bustine).
- per le prime settimane, evitare anche la frutta troppo dolce come melone e uva.
- Eliminare i formaggi stagionati, la frutta secca e ogni cibo che sia derivato o contenga del lievito
- biofeedback di rilassamento, una tecnica fisioterapica che aiuta a rilassare il muscolo elevatore ipercontratto, e analgesia elettrica transcutanea (TENS)
- Proteggere la delicata mucosa vestibolare già infiammata: preferire leggings morbidi, evitando pantaloni attillati, cyclette o spinning, e i rapporti in fase di infiammazione, per evitare i microtraumatismi del vestibolo vaginale.
- Biancheria intima non colorata e di puro cotone
- Slip di tessuto DermaSilk®, fibroina di seta nobilitata con una protezione antimicrobica permanente (35)
References:
- Holland J, Young ML, Lee O, et al; Vulvovaginal carriage of yeasts other than Candida albicans. Sex Transm Infect. 2003 Jun;79(3):249-50.
- Foxman B, Muraglia R, Dietz JP, et al; Prevalence of recurrent vulvovaginal candidiasis in 5 European countries and the United States: results from an internet panel survey. J Low Genit Tract Dis. 2013 Jul;17(3):340-5. doi: 10.1097/LGT.0b013e318273e8cf.
- Lindner JG, Plantema FH, Hoogkamp-Korstanje JA; Quantitative studies of the vaginal flora of healthy women and of obstetric and gynaecological patients. J Med Microbiol. 1978 Aug;11(3):233-41.
- Nyirjesy P, Sobel JD; Genital mycotic infections in patients with diabetes. Postgrad Med. 2013 May;125(3):33-46. doi: 10.3810/pgm.2013.05.2650.
- Kelekci S, Kelekci H, Cetin M, et al; Glucose tolerance in pregnant women with vaginal candidiasis. Ann Saudi Med. 2004 Sep
- Sobel JD; Vulvovaginal candidosis. Lancet. 2007 Jun 9;369(9577):1961-71.
- Candida – female genital; NICE CKS, August 2012 (UK access only)
- Pereira Da Silva D. Martinez De Oliveira J. Negreiro F. : “Studio osservazionale del pH vaginale in donne Portoghesi sane” Minerva Ginecologica 2011 Aprile;63(2):203-1
- Dodgson AR, Pujol C, Denning DW, Soll DR, Fox AJ. Multilocus sequence typing of Candida glabrata reveals geographically enriched clades. J Clin Microbiol. 2003 Dec;41(12):5709-17.
- E. K.; Carver, B. J.; Montedonico, A. E.; Reynolds, T. B. (2009). “The inositol regulon controls viability in Candida glabrata”. Microbiology 156 (2): 452–462.
- Fidel F, Vazquez J, Sobel J. (1999). “Candida glabrata: Review of Epidemiology, Pathogenesis, and Clinical Disease with Comparison to C. albicans“. Clinical Microbiology Reviews 12 (1): 80–96.
- Paul L. Fidel, Jr., Jose A. Vazquez, and Jack D. Sobel Candida glabrata: Review of Epidemiology, Pathogenesis, and Clinical Disease with Comparison to C. albicans Clin Microbiol Rev. 1999 Jan; 12(1): 80–96.
- Barns S M, Lane D J, Sogin M L, Bibeau C, Weisburg W G. Evolutionary relationships among pathogenic Candida species and relatives. J Bacteriol. 1991;173:2250–2255
- Beck-Sague C M, Jarvis T R. Secular trends in the epidemiology of nosocomial fungal infections in the United States. J Infect Dis. 1993;167:1247–1251.
- Bodey G P. Candidiasis in cancer patients. Am J Med. 1986;77:13–19
- Bross J, Talbot G H, Maislin G, Hurwitz S, Strom B L. Risk factors for nosocomial candidemia: a case control study in adults without leukemia. Am J Med. 1989;87:614–620.
- Horn R, Wong B, Kiehn T E, Armstrong D. Fungemia in a cancer hospital: changing frequency, earlier onset, and results of therapy. Rev Infect Dis. 1985;7:646–655.
- Komshian S V, Uwaydah A K, Sobel J D. Fungemia caused by Candida species and Torulopsis glabrata in the hospitalized patient: frequency, characteristics, and evaluation of factors influencing outcome.Rev Infect Dis. 1989;11:379–390.
- Wey S B, Motomi M, Pfaller M A, Wolsen R F, Wenzel R P. Risk factors for hospital-acquired candidemia: a matched case control study. Arch Intern Med. 1989;149:2249–2253.
- Vazquez J A, Dembry L M, Sanchez V, Vazquez M A, Sobel J D, Dmuchowski C, Zervos M J. Nosocomial Candida glabrata colonization: an epidemiologic study. J Clin Microbiol. 1998;36:421–426.
- Vazquez J A, Sanchez C, Dmuchowski C, Dembry L, Sobel J D, Zervos M J. Nosocomial acquisition of Candida albicans: an epidemiologic study. J Infect Dis. 1993;168:195–201.
- Isenberg H D, Tucci V, Cintron F, Singer C, Weinstein G S, Tyras D. Single source outbreak ofCandida tropicalis complicating coronary bypass surgery. J Clin Microbiol. 1989;27:2426–2428.
- Vazquez J A, Sanchez C, Dmuchowski C, Dembry L, Sobel J D, Zervos M J. Nosocomial acquisition of Candida albicans: an epidemiologic study. J Infect Dis. 1993;168:195–201.
- DeBernardis F, Chiani P, Ciccozzi M, Pellegrini G, Ceddia T, D’Offizzi G, Quinti I, Sullivan P, Cassone A. Elevated aspartic proteinase secretion and experimental pathogenicity of Candida albicans isolates from oral cavities of subjects infected with human immunodeficiency virus. Infect Immun. 1996;64:466–471.
- Fidel P L, Jr, Cutright J L, Tait L, Sobel J D. A murine model of Candida glabrata vaginitis. J Infect Dis. 1996;173:425–431.
- Shakir B S, Martin M V, Smith C J. Relative effectiveness of various yeasts, Candida spp. andTorulopsis glabrata, for inducing palatal infection in the Wistar rat. Arch Oral Biol. 1983;28:1069–1071.
- Cassone A, DeBernardis F, Mondello F, Ceddia T, Agatensi L. Evidence for a correlation between proteinase secretion and vulvovaginal candidosis. J Infect Dis. 1987;156:777–783.
- Ross I K, DeBernardis F, Emerson G W, Cassone A, Sullivan P A. The secreted aspartate proteinase ofCandida albicans: physiology of secretion and virulence of a proteinase-deficient mutant. J Gen Microbiol.1990;136:687–694.
- Barret-Bee K, Hayes Y, Wilson R G, Ryley J F. A comparison of phospholipase activity, cellular adherence and pathogenicity of yeasts. J Gen Microbiol. 1985;131:1217–1221.
- Ibrahim A S, Mirbod F, Filler S G, Yoshiko B, Cole G, Kitajima Y, Edwards J E, Jr, Nosawa Y, Ghannoum M A. Evidence implicating phospholipase as a virulence factor of Candida albicans. Infect Immun. 1995;63:1993–1998.
- Odds F C. In Candida and candidosis. Baltimore, Md: University Park Press; 1988. Chronic mucocutaneous candidiosis; pp. 104–110.
- Sobel J D, Muller G, Buckley H R. Critical role of germ tube formation in the pathogenesis of candidal vaginitis. Infect Immun. 1984;44:576–580.
- Soll D R. High-frequency switching in Candida albicans. Clin Microbiol Rev. 1992;5:183–203.
- Schuman, P., J. D. Sobel, S. Ohmit, K. H. Mayer, A. Rompalo, A. Duerr, D. K. Smith, D. Warren, and R. S. Klein. Mucosal Candida colonization and candidiasis in women with or without at-risk for HIV infection. Clin. Infect. Dis., in press.
- Capparelli R., Iannaccone M., Palumbo D., Medaglia C., Moscariello E., Russo A., Iannelli D. (2009). Role played by human mannose-binding lectin polymorphisms in pulmonary tuberculosis. J. Infect. Dis., 199 (5): 666-72.
- Iobst S.T., Wormald M. R., Weis W. I., Dwek R. A., Drickamer K. (1994). Binding of sugar ligands to Ca(2+)-dependent animal lectins. I. Analysis 68 of mannose binding by site-directed mutagenesis and NMR. J. Biol. Chem., 269 (22): 15505-11.
- Chen C.B. e Wallis R. (2004). Two mechanisms for mannose-binding protein modulation of the activity of its associated serine proteases. J. Biol. Chem., 279 (25): 26058-65.
- Schwaeble W., Dahl M.R., Thiel S., Stover C., Jensenius J.C. (2002). The mannan-binding lectin-associated serine proteases (MASPs) and MAp19: four components of the lectin pathway activation complex encoded by two genes. Immunobiology, 205 (4-5): 455-66.
- Turner M.W. (1996). Mannose-binding lectin: the pluripotent molecule of the innate immune system. Immunology Today, 17 (11): 532-40.
- Fraser IP, Koziel H, Ezekowitz RA (1998). “The serum mannose-binding protein and the macrophage mannose receptor are pattern recognition molecules that link innate and adaptive immunity.”. Semin. Immunol. 10 (5): 363–72
- Worthley DL, Bardy PG, Mullighan CG (2005). “Mannose-binding lectin: biology and clinical implications.”. Internal medicine journal 35 (9): 548–55.
- Sheriff S, Chang CY, Ezekowitz RA (November 1994). “Human mannose-binding protein carbohydrate recognition domain trimerizes through a triple alpha-helical coiled-coil”. Nat. Struct. Biol. 1 (11): 789–94
- Guo N, Mogues T, Weremowicz S, Morton CC, Sastry KN (March 1998). “The human ortholog of rhesus mannose-binding protein-A gene is an expressed pseudogene that localizes to chromosome 10”. Mamm. Genome 9 (3): 246–9.
- Seyfarth J, Garred P, Madsen HO (2005). “The ‘involution’ of mannose-binding lectin”. Human Molecular Genetics 14 (19): 2859–69
- Jensen PH, Laursen I, Matthiesen F, Højrup P (2007). “Posttranslational modifications in human plasma MBL and human recombinant MBL”. Biochim. Biophys. Acta – Proteins & Proteomics. 1774: 335–44.
- Bradley, D. T.; Bourke, T. W.; Fairley, D. J.; Borrow, R.; Shields, M. D.; Young, I. S.; Zipfel, P. F.; Hughes, A. E. (2012). “Genetic susceptibility to invasive meningococcal disease: MBL2 structural polymorphisms revisited in a large case-control study and a systematic review”. International Journal of Immunogenetics: no. doi:10.1111/j.1744-313X.2012.01095.
- Zeya HI, Spitznagel JK. Antimicrobial specificity of leukocyte lysosomal cationic proteins. Science. 1966 Nov 25;154(752):1049-51
- Wang G, Li X, Wang Z. APD2: The updated antimicrobial peptide database and its application in peptide design. (2009) Nucleic acids Res.;37:D933– D937.
- Boman HG. Innate immunity and the normal microflora. Immunol Rev. 2000 Feb; 173:5-16. Review.
- Vizioli, J. & Salzet, M. Antimicrobial peptides from animals: focus on invertebrates. (2002) Trends Pharmacol. Sci. 23, 494–496
- Thevissen K, Osborn RW, Acland DP, Broekaert WF. Specific binding sites for an antifungal plant defensin from Dahlia (Dahlia merckii) on fungal cells are required for antifungal activity.(2000) Mol Plant Microbe Interact. Jan;13(1):54- 61.
- Levy F, Rabel D, Charlet M, Bulet P, Hoffmann JA, Ehret-Sabatier L. Peptidomic and proteomic analyses of the systemic immune response of Drosophila. Biochimie.2004 ;86(9-10):607-16.
- Papagianni M (2003) Ribosomally synthesized peptides with antimicrobial properties: biosynthesis, structure, function, and applications. Biotechnol Adv 21: 465–499.
- Tomasinsig L, Skerlavaj B, Papo N, Giabbai B, Shai Y, Zanetti M.- Mechanistic and functional studies of the interaction of a proline-rich antimicrobial peptide with mammalian cells. (2006) J Biol Chem. 6;281(1):383- 91.
- Jerala R, Porro M. Endotoxin neutralizing peptides. (2004) Curr Top Med Chem.;4(11):1173-84. Review.
- McPhee JB, Hancock RE. Function and therapeutic potential of host defence peptides. J Pept Sci. 2005 Nov;11(11):677-87. Review.
- Sweetman S, editor. Martindale: The complete drug reference. 34th ed. London: Pharmaceutical Press; 2004.
- Pfizer Australia Pty Ltd. Diflucan (Australian Approved Product Information). West Ryde (NSW): Pfizer Australia; 2004.
- Nurbhai M, Grimshaw J, Watson M, et al; Oral versus intra-vaginal imidazole and triazole anti-fungal treatment of Cochrane Database Syst Rev. 2007 Oct 17;(4):CD002845.
- Watson MC, Grimshaw JM, Bond CM, et al; Oral versus intra-vaginal imidazole and triazole Management of vulvovaginal candidiasis; British Association for Sexual Health and HIV (2007)
- Nicky Longley, Conrad Muzoora, Kabanda Taseera, James Mwesigye, Joselyne Rwebembera, Ali Chakera, Dose Response Effect of High‐Dose Fluconazole for HIV‐Associated Cryptococcal Meningitis in Southwestern Uganda in Clinical Infectious Diseases, vol. 47, nº 12, 2008, pp. 1556–1561
- FDA Alert: Diflucan (fluconazole): Drug Safety Communication – Long-term, High-dose Use During Pregnancy May Be Associated With Birth Defects, DDrugs.com, 03/08/2011.
- Bertholf ME, Stafford MJ: “Colonization of candida albicans in vagina, rectum and mouth”. J Fam Pract 1983;15:919-924.
- Sekhavat L, Tabatabaii A, Tezerjani FZ Oral fluconazole 150 mg single dose versus intra-vaginal clotrimazole treatment of acute vulvovaginal candidiasis. J Infect Public Health. 2011 Sep;4(4):195-9.
- WÃchtler B, Wilson D, Hube B. Candida albicans adhesion to and invasion and damage of vaginal epithelial cells: stage-specific inhibition by clotrimazole and bifonazole. Antimicrob Agents Chemother. 2011 Sep;55(9):4436-39
- Czaika VA, Siebenbrock J, Czekalla F, Zuberbier T, Sieber MA.: “Reactive oxygen species and the bacteriostatic and bactericidal effects of isoconazole nitrate”. Mycoses. 2013 May;56 Suppl 1:16-22. doi: 10.1111/myc.12055.
- Niwa T1, Shiraga T, Takagi A. “Effect of antifungal drugs on cytochrome P450 (CYP) 2C9, CYP2C19, and CYP3A4 activities in human liver microsomes”. Biol Pharm Bull. 2005 Sep;28(9):1805-8.
- Murayama N1, Imai N, Nakane T, Shimizu M, Yamazaki H.Roles of CYP3A4 and CYP2C19 in methyl hydroxylated and N-oxidized metabolite formation from voriconazole, a new anti-fungal agent, in human liver microsomes. Biochem Pharmacol. 2007 Jun 15;73(12):2020-6. Epub 2007 Mar 19.
- F. Murina, A. Graziottin, R. Felice, G. L. Radici and S. Di Francesco The Recurrent Vulvovaginal Candidiasis: Proposal of a Personalized Therapeutic Protocol Obstet Gynecol. 2011; 2011: 806065.
- Sobel JD. Vulvovaginal candidiasis. The Lancet. 2007;369(9577):1961–1971.
- 2. Sobel JD. Candida vulvovaginitis. Seminars in Dermatology. 1996;15(1):17–28.
- Miles MR, Olsen L, Rogers A. Recurrent vaginal candidiasis. Importance of an intestinal reservoir.Journal of the American Medical Association. 1977;238(17):1836–1837.
- Reid G, Bruce AW. Urogenital infections in women: can probiotics help? Postgraduate Medical Journal.2003;79(934):428–432
- Reid G, Millsap K, Bruce AW. Implantation of Lactobacillus casei var rhamnosus into the vagina.Lancet. 1994;344:1229.
- Cadieux P, Burton J, Kang CY, et al. Lactobacillus strains and vaginal ecology. JAMA. 2002;287:1940–1941. Abstract.
- Baerheim A, Larsen E, Digranes A. Vaginal application of lactobacilli in the prophylaxis of recurrent lower urinary tract infection in women. Scand J Prim Health Care. 1994;12:239–243. Abstract.
- Kontiokari T, Sundqvist K, Nuutinen M, et al. Randomised trial of cranberry-lingonberry juice and Lactobacillus GG drink for the prevention of urinary tract infections in women. BMJ. 2001;322:1571.
- Chlebecek J, Reich I. [Fermalac Vaginal (Rougier Inc.) in the prevention of colpitis in pregnancy] Cesk Gynekol. 1993;58:237–238.
- KA. Walker, AC. Braemer; S. Hitt; RE. Jones; TR. Matthews, 1-[4-(4-Chlorophenyl)-2-(2,6-dichlorophenylthio)-n-butyl]-1H-imidazole nitrate, a new potent antifungal agent. in J Med Chem, vol. 21, nº 8, Ago 1978, pp. 840-3,
- JP. Latge, A. Beauvais; M. Montaonakil; M. Diarin; JN. Fracchia, [Action of 2 new imidazole derivatives (butoconazole and sulconazole) on Candida, Trichophyton and Aspergillus]. in Ann Dermatol Venereol, 116 Suppl 1, 1989, pp. 20-3,
- P. Bourée, C. Issoire, [In vitro evaluation of the activity of butoconazole against Trichomonas vaginalis]. in Pathol Biol (Paris), vol. 40, nº 5, Mag 1992, pp. 492-4,
- LZ. Heng, Y. Chen; TC. Tan, Treatment of recurrent vulvo-vaginal candidiasis with sustained-released butoconazole pessary in Singapore Med J, vol. 53, nº 12, Dic 2012, pp. e269-71,
- RH. Kaufman, MR. Henzl; D. Brown; DS. Horner; RH. Krauss; DR. Mehlisch; DE. Moore; RL. Prentice, Comparison of three-day butoconazole treatment with seven-day miconazole treatment for vulvovaginal candidiasis. in J Reprod Med, vol. 34, nº 7, Lug 1989, pp. 479-83,
- W. Droegemueller, DG. Adamson; D. Brown; L. Cibley; F. Fleury; ME. LePage; MR. Henzl, Three-day treatment with butoconazole nitrate for vulvovaginal candidiasis. inObstet Gynecol, vol. 64, nº 4, Ott 1984, pp. 530-4,
- D’Antuono A., Bellavista S., Gaspari V., Filippini A., Patrizi A.: “DermaSilk® briefs in recurrent vulvovaginal candidosis. An alternative option in long-lasting disease”. Minerva Ginecologica 2013; 65:697-705.
- Fischer G; Chronic vulvovaginal candidiasis: what we know and what we have yet to learn. Australas J Dermatol. 2012 Nov;53(4):247-54.
- Wächtler B, Wilson D, Hube B.: Antimicrob Agents Chemother. 2011 Sep;55(9):4436-9. doi: 10.1128/AAC.00144-11. Epub 2011 Ju

