Ultimo aggiornamento 27/07/2023
Fibroadenoma mammario: è un tumore benigno della mammella, solido. Si presenta quasi sempre come lesione singola e monolaterale più frequentemente situato nel quadrante supero-esterno; solo nel 10-20% dei casi è multiplo o bilaterale. È alquanto improbabile che possa trasformarsi in un tumore maligno, tuttavia, per precauzione, deve essere tenuto sotto controllo costante per valutarne le variazioni nella forma, nelle dimensioni e nella consistenza.
Epidemiologia – si sviluppa, soprattutto nelle donne giovani, di età compresa tra i 15 e i 30 anni.
Eziologia – Le cause del fibroadenoma sono ancora sconosciute. Si ritiene che il suo sviluppo possa dipendere da una risposta anomala agli estrogeni Il fibroadenoma, infatti, è più comune nelle donne in età fertile ed anche nelle donne ovariectomizzate o in pre-menopausa che però fanno uso della terapia ormonale sostitutiva (HRT). Al contrario, è più raro nelle donne in menopausa, periodo in cui le concentrazioni plasmatiche degli estrogeni si riduce sensibilmente. Infatti il fibroadenoma deriva dalle cellule del tessuto connettivo stromale ed epiteliale che sono funzionalmente e meccanicamente importanti nel seno. Questi tessuti contengono recettori sia per gli estrogeni che per il progesterone. Per questo motivo i fibroadenomi tendono a proliferare durante la gravidanza a causa dell’eccessiva produzione di ormoni riproduttivi femminili. La sensibilità ormonale provoca un’eccessiva proliferazione del tessuto connettivo mammario.
ANATOMIA PATOLOGICA: all’osservazione macroscopica il fibroadenoma appare come una lesione ben circoscritta, non capsulata, con bordi spinti che non si infiltra nel parenchima mammario adiacente. Istologicamente sono caratterizzati da una proliferazione cellulare di stroma e ghiandole (dotti mammari benigni). Il rapporto tra stroma e ghiandole è relativamente costante durante l’intera lesione. Alterazioni benigne come iperplasia duttale, metaplasia apocrina, metaplasia squamosa, alterazioni cistiche e adenosi sclerosante possono coinvolgere l’epitelio. Le calcificazioni possono essere presenti anche nelle ghiandole.
CLASSIFICAZIONE:
§ Fibroadenoma classico
§ Fibroadenoma gigante giovanile: Ø >5 cm; si osserva un aumento della cellularità stromale e un maggior grado di iperplasia epiteliale,
§ Fibroadenoma complesso: di aspetto variegato, tende a svilupparsi in età più avanzata. Presenta adenosi sclerosante, calcificazioni epiteliali o alterazioni apocrine papillari ed è di dimensioni >3 mm.
§ Fibroadenoma mixoide: ha prominenti alterazioni mixoidi con sfumature blu nello stroma. Sebbene non comuni, alcuni pazienti con fibroadenomi mixoidi possono avere il complesso di Carney (una malattia autosomica dominante caratterizzata da tumori endocrini, mixomi, iperpigmentazione cutanea e nevi blu).
DIAGNOSTICA –
- Sintomatologia: in genere è il fibroadenoma è asintomatico.
- Palpazione: Alla palpazione il fibroadenoma appare come una massa rotondeggiante dalla superficie liscia, simile ad una biglia, mobile, indolente; può avere una consistenza duro-elastica e contorni netti e regolari. Le dimensioni possono essere estremamente variabili: in genere 1-3 cm di diametro ma, in alcuni casi, la massa può raggiungere i 5-6 cm e, nel caso del fibroadenoma gigante, tipico dell’età adolescenziale, anche i 10-15 cm di diametro.
 Il fibroadenoma può aumentare di volume, in special modo durante la gravidanza. A volte, invece, si riduce spontaneamente fino a scomparire del tutto, come spesso accade dopo la menopausa.
Il fibroadenoma può aumentare di volume, in special modo durante la gravidanza. A volte, invece, si riduce spontaneamente fino a scomparire del tutto, come spesso accade dopo la menopausa. - mammografia – Alle donne al di sopra dei 40 anni, nelle quali il tessuto adiposo è prevalente, c’è indicazione per la mammografia.
- ecografia mammaria – Alle donne al di sotto dei 40 anni, normalmente, è consigliata l’ecografia mammaria, soprattutto in caso di mammella densa, tipica dell’età giovanile, caratterizzato dalla prevalenza del tessuto ghiandolare rispetto al tessuto adiposo. Il fibroadenoma appare come un nodulo ovoidale a maggior asse trasversale, solido, ad ecostruttura omogenea, a bassa ecogenicità ma lievemente iperecogeno rispetto al tessuto adiposo circostante, con rinforzo della parete posteriore modesto o assente, a margini netti e regolari. A volte si può osservare un rinforzo periferico che può mimare una pseudocapsula. Tuttavia, questo aspetto non è caratteristico di tutti i fibroadenomi. Al color-doppler assenza di neovascolarizzazione intra e perinodulare. Tessuto adiacente normale. Cisti e carcinomi si distinguono meglio dal fibroadenoma mediante l’ecografia; tuttavia, fibroadenomi non omogenei insieme a calcificazioni occasionali e margini non circoscritti possono imitare molti altri tipi di masse mammarie ed particolarmente ardua risulta la diagnosi differenziale con il tumore filloide benigno o intermedio. La dimensione della lesione è misurata in 3 dimensioni: latero-laterale e antero-posteriore nelle scansioni longitudinali e diametro antero-posteriore massimo nelle scansioni trasversali. Il volume della lesione è calcolato sulla base di queste misurazioni utilizzando la formula per gli elissoidi (π/6 x diametro longitudinale x diametro anteroposteriore x diametro trasversale) (1-10).
Le microcalcificazioni globalmente sono visibili nel 10% dei casi. Ricordo che le microcalcificazioni appaiono nel 23% di tutte le ecografie mammarie e nel 69% dei casi in cui è presente un nodulo (11-22).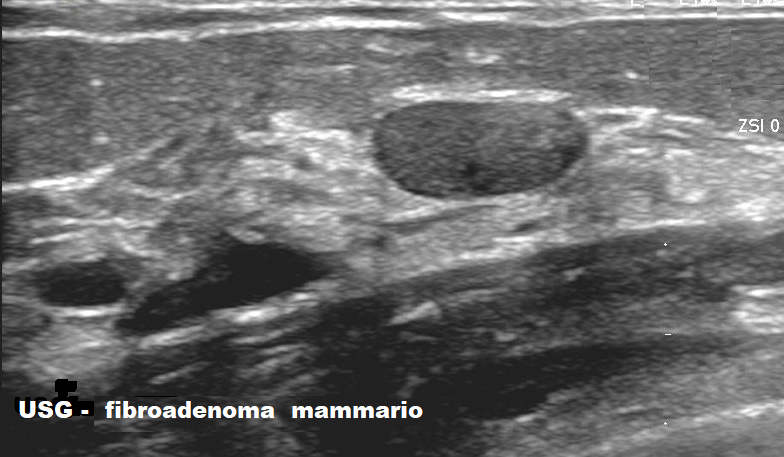
RMN – fornisce immagini dettagliate del corpo umano utilizzando campi magnetici e onde radio.
- T1: tipicamente ipointenso o isointenso rispetto al tessuto mammario adiacente
- T2: può essere ipo o iperintenso
- T1 C + (Gd): può essere variabile ma la maggioranza mostrerà un lento aumento del contrasto iniziale seguito da una fase persistente ritardata ( curva di miglioramento di tipo I ); Si possono vedere settazioni interne non miglioranti
ago-aspirato con ago sottile (FNA), per esame citologico
biopsia: è necessaria per una conferma istologica.
COMPLICAZIONI: Nel 99% dei casi il fibroadenoma nasce come tumore benigno, non si trasforma in maligno e tende a regredire con il tempo.
TERAPIA: fibroadenomi classici, omogenei alla scansione ecografica, non palpabili, di dimensioni limitate e invariate nel tempo non necessitano di alcuna terapia ed è sufficiente un follow-up periodico ogni 6-12 mesi.
Invece, in caso di fibroadenoma complesso o dimensioni >3 cm, rapido accrescimento, dolore ed ecografia dubbia è opportuno procedere a rimozione chirurgica (nodulectomia o lumpectomia detta anche biopsia escissionale), senza intaccare il tessuto mammario circostante, e successivo esame istologico. L’intervento chirurgico può essere effettuato anche su richiesta esplicita della donna qualora la presenza del fibroadenoma provochi problemi estetici o disagio psicologico.
Aspirazione con cannula dentata – Dopo un’iniezione di anestetico locale, viene praticato un piccolo taglio cutaneo. Attraverso di esso viene inserita una sonda cava collegata a un dispositivo per il vuoto. Utilizzando un’ecografia come guida, il fibroadenoma viene aspirato e raccolto in provetta per l’esame istologico.
Una procedura alternativa alla chirurgia è la crioablazione indicata per la cura di fibroadenomi di dimensioni contenute. Attraverso una sonda dotata di microaghi, introdotta sotto la pelle del seno con una lieve anestesia locale, la crioablazione permette di congelare il fibroadenoma, provocando la morte delle cellule tumorali per shock termico, senza danneggiare le cellule sane.
Termoablazione HIFU – recentemente è stato proposto anche il sistema HIFU (High Intensity Focused Ultrasound) che consiste nell’applicazione, mediante un apposito strumento, di ultrasuoni focalizzati e ad alta intensità per coagulare le cellule anomale di una neoformazione. Il fascio di ultrasuoni è guidato da MRI o ecografia B-mode in tempo reale. ad una temperatura di 65-85 °C a livello della lesione. L’energia ottimale per la sonicazione viene stabilita per ciascun paziente determinando l’impostazione minima trovata per produrre bolle all’interno della lesione come osservato sull’ecografia B-mode in tempo reale. dopo 2-3 mesi il tessuto coagulato sarà completamente assorbito. La paziente è sdraiata in posizione prona e sedata oppure, se necessario, anestetizzata. L’intervento richiede ricovero precauzionale molto breve. Questa tecnica è utilizzata anche per fibromi uterini, tumori epatici, tumori del pancreas localmente avanzato, noduli tiroidei, tumori dell’osso, sulle masse retroperitoneali (23-34).
Se asportato completamente, il fibroadenoma non tende a riformarsi, ma è possibile, soprattutto nelle giovani, che insorgano ulteriori lesioni in altri quadranti della mammella o in un posto adiacente alla sede dell’intervento.
References:
- Chung EM, Cube R, Hall GJ et-al. From the archives of the AFIP: breast masses in children and adolescents: radiologic-pathologic correlation. Radiographics. 29 (3): 907-31.
- Feliciano YZ, Freire R, Net J, Yepes M. Ductal and lobular carcinoma in situ arising within an enlarging biopsy proven fibroadenoma. BMJ Case Rep. 2021 Jan 19;14(1)
- Fornage BD, Lorigan JG, Andry E. Fibroadenoma of the breast: sonographic appearance. Radiology. 1989;172 (3): 671-5. Radiology
- Malur S, Wurdinger S, Moritz A, Michels W, Schneider A. Comparison of written reports of mammography, sonography and magnetic resonance mammography for preoperative evaluation of breast lesions, with special emphasis on magnetic resonance mammography. Breast Cancer Res. 2001;3:55–60.
- Devolli-Disha E, Manxhuka-Kërliu S, Ymeri H, Kutllovci A. Comparative accuracy of mammography and ultrasound in women with breast symptoms according to age and breast density. Bosn J Basic Med Sci. 2009;9:131–6.
- Borecky N, Rickard M. Preoperative diagnosis of carcinoma within fibroadenoma on screening mammograms. J Med Imaging Radiat Oncol. 2008;52:64–7.
- Berg WA, Blume JD, Cormack JB, Mendelson EB, Lehrer D, Böhm-Vélez M, et al. Combined screening with ultrasound and mammography vs mammography alone in women at elevated risk of breast cancer. JAMA. 2008;299:2151–63.
- Pengelly S, Lambert AW, Khan M, Groome J. Breast lumps in service women. J R Nav Med Serv. 2014;100:174–8.
- Houssami N, Cheung MN, Dixon JM. Fibroadenoma of the breast. Med J Aust. 2001;174:185–8.
- Prasad SN, Houserkova D. A comparison of mammography and ultrasonography in the evaluation of breast masses. Biomed Pap Med Fac Univ Palacky Olomouc Czech Repub. 2007;151:315–22.
- Elverici E, Zengin B, Nurdan Barca A, Didem Yilmaz P, Alimli A, Araz L. Interobserver and intraobserver agreement of sonographic BIRADS lexicon in the assessment of breast masses. Iran J Radiol. 2013;10:122–7.
- Namazi A, Adibi A, Haghighi M, Hashemi M. An Evaluation of Ultrasound Features of Breast Fibroadenoma. Adv Biomed Res. 2017;6:153.
- Rjosk-Dendorfer D, Reu S, Deak Z, Hetterich H, Kolben T, Reiser M, et al. High resolution compression elastography and color doppler sonography in characterization of breast fibroadenoma. Clin Hemorheol Microcirc. 2014;58:115–25.
- Fornage BD, Lorigan JG, Andry E. Fibroadenoma of the breast: Sonographic appearance. Radiology. 1989;172:671–5.
- Jackson VP, Rothschild PA, Kreipke DL, Mail JT, Holden RW. The spectrum of sonographic findings of fibroadenoma of the breast. Invest Radiol. 1986;21:34–40.
- Smith GE, Burrows P. Ultrasound diagnosis of fibroadenoma – Is biopsy always necessary? Clin Radiol. 2008;63:511–5.
- Liu H, Yeh ML, Lin KJ, Huang CK, Hung CM, Chen YS. Bloody nipple discharge in an adolescent girl: Unusual presentation of juvenile fibroadenoma. Pediatr Neonatol. 2010;51:190–2.
- Arora R, Abou-Bakr A, Al Taleb A. Fine needle aspiration diagnosis of a spontaneously infarcted fibroadenoma mimicking carcinoma: A case report. Anal Quant Cytopathol Histpathol. 2013;35:57–60.
- Shi A, Li S, Xu N, Nie G, Li X, Zhang T, et al. Clinical features and prognosis of a unilateral fibroadenoma of the breast in a 16-month-old female. Jpn J Clin Oncol. 2011;41:260–4.
- Wirtzfeld LA, Nam K, Labyed Y, Ghoshal G, Haak A, Sen-Gupta E, et al. Techniques and evaluation from a cross-platform imaging comparison of quantitative ultrasound parameters in an in vivo rodent fibroadenoma model. IEEE Trans Ultrason Ferroelectr Freq Control. 2013;60:1386–400. [PMC free article]
- Limite G, Esposito E, Sollazzo V, Ciancia G, Formisano C, Di Micco R, et al. Lobular intraepithelial neoplasia arising within breast fibroadenoma. BMC Res Notes. 2013;6:267. [PMC free article]
- Zaitsev AN, Vesnin AG, Semiglazov VF, Orlov AA, Chernomordikova MF, Chebykin IA, et al. Ultrasound differentiation of fibroadenoma and diagnosis of minimal carcinoma of the breast. Vopr Onkol. 1998;44:198–202.
- Asirvatham JR, Shah A, Carreon CK, Bhuiya TA, Kahn LB, Kostroff K, et al. Ossifying fibromyxoid tumor of the breast mimicking fibroadenoma: A case report and differential diagnoses. Arch Pathol Lab Med. 2014;138:1098–100.
- Gatta G, Iaselli F, Parlato V, Di Grezia G, Grassi R, Rotondo A. Differential diagnosis between fibroadenoma, giant fibroadenoma and phyllodes tumour: Sonographic features and core needle biopsy. Radiol Med. 2011;116:905–18.
- Larsen TK, Faurschou JP, Bak M, et al. Fibroadenoma of the breast–modern strategy of treatment. Ugeskr Laeger. 2003;165:1979–1983.
- Fine RE, Staren ED. Percutaneous radiofrequency-assisted excision of fibroadenomas. Am J Surg. 2006;192:545–547.
-
Hahn M. et al: “High intensity focused ultrasound (HIFU) for the treatment of symptomatic breast fibroadenoma”. International Journal of Hyperthermia 2018;35(1):1-8
-
Greenberg R, Skornick Y, Kaplan O. Management of breast fibroadenomas. J Gen Intern Med. 1998;13:640–645.
- Croce S, Bretz-Grenier MF, Mathelin C. Most common benign epithelial breast diseases: diagnosis, treatment and cancer risk. Gynecol Obstet Fertil. 2008;36:788–799.
- Hahn M, Krainick U, Peisker U, et al. Eignet sich das Hand Held Mammotome zur kompletten Entfernung benigner Läsionen der Brust? Geburtshilfe Frauenheilkd. 2004;64:719–722. doi: 10.1055/s-2004-821006.
- Whitworth PW, Rewcastle JC. Cryoablation and cryolocalization in the management of breast disease. J Surg Oncol. 2005;90:1–9. doi: 10.1002/jso.20201.
- Kaufman CS, Bachman B, Littrup PJ, et al. Cryoablation treatment of benign breast lesions with 12-month follow-up. Am J Surg. 2004;188:340–348.
- Golatta M, Harcos A, Pavlista D, et al. Ultrasound-guided cryoablation of breast fibroadenoma: a pilot trial. Arch Gynecol Obstet. 2015;291:1355–1360. doi: 10.1007/s00404-014-3553-5.
- Hahn M, Pavlista D, Danes J, et al. Ultrasound guided cryoablation of fibroadenomas. Ultraschall in Med. 2012;34:64–68.
- Gage AA, Baust JG. Cryosurgery for tumors – a clinical overview. Technol Cancer Res Treat. 2004;3:187–199.
- Simmons RM, Ballman KV, Cox C, et al. A phase ii trial exploring the success of cryoablation therapy in the treatment of invasive breast carcinoma: results from ACOSOG (Alliance) Z1072. Ann Surg Oncol. 2016;23:2438–2445.

