La FIVET (Fecondazione in vitro e trasferimento dell’embrione) è la più nota e diffusa fra le tecniche PMA. Si tratta di una tecnica di II° livello che consiste nella fecondazione in vitro e nel successivo trasferimento dell’embrione in utero. Il dr. Robert Edwards nel 1968 presso l’Università di Cambridge riuscì per la prima volta a fecondare un ovocita umano con uno spermatozoo. Il 25 luglio 1978, alle 23.47 presso l’ospedale di Oldham, nel Nord dell’Inghilterra, nacque, mediante T.C., la prima bambina, Louise Brown, utilizzando la tecnica FIVET. L’esito positivo dell’eccezionale evento, fu reso possibile dalla collaborazione di Edwards con il ginecologo Patrick Steptoe. Unica complicazione fu l’insorgenza di ipertensione in gravidanza alla 34a settimana che rese necessario il ricovero ospedaliero per consentire di raggiungere un’adeguata crescita fetale. L’indicazione alla FIVET fu una patologia tubarica bilaterale. La paziente ebbe una seconda gravidanza mediante FIVET ed infine, spontaneamente, un terzo bambino.
Indicazioni – La FIVET è indicata in caso di patologie tubariche, dispermie, endometriosi, senescenza ovarica precoce, e infertilità idiopatica e ripetuti fallimenti di inseminazioni intrauterine.
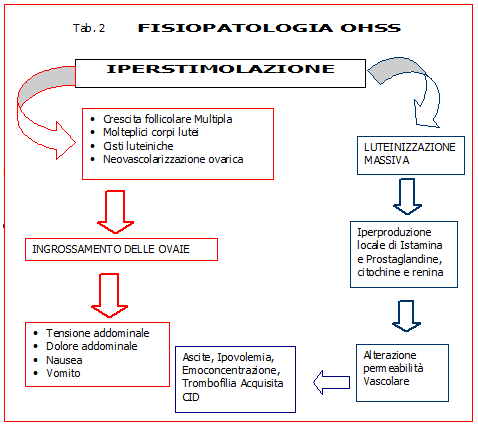
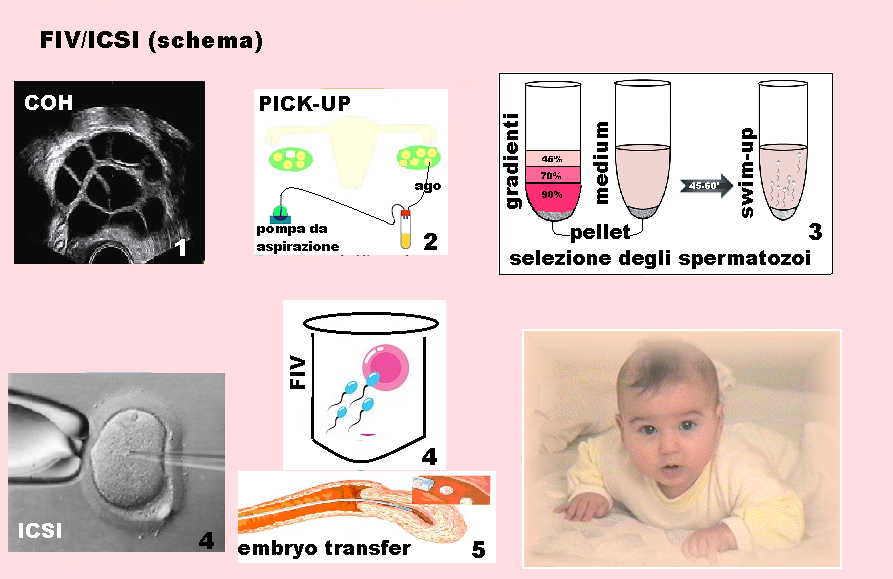
Stimolazione ovarica – Il primo step della FIVET è rappresentato dalla iperstimolazione ovarica controllata (COH) realizzata mediante la somministrazione di gonadotropine in modo da ottenere almeno 5-6 follicoli terziari per ovaio. Lo sviluppo follicolare è strettamente controllato in maniera costante attraverso il monitoraggio ormonale (estradiolo, progesterone, FSH, LH) e soprattutto ecografico. Esistono numerosi protocolli di stimolazione che prevedono la somministrazione clomifene, gonadotropine in dosi variabili personalizzate associate o meno ad agonisti e/o antagonisti, LH-added, estrogeni, inibitori dell’aromatasi (1-22).
Prelievo ovocitario (Pick-up) – Il pick-up è effettuato al 12-14° giorno del ciclo quando almeno 2 follicoli per ovaio hanno raggiunto un diametro ≥18 mm e 24-32 ore dopo iniezione di 5.000 U.I. di HCG. Il prelievo ovocitario è effettuato mediante agoaspirazione ecoguidata con sonda vaginale da 3.65 MHz. Si tratta di una procedura realizzata in sala operatoria, con paziente sedata. In caso di un numero eccessivo di follicoli, si aspirano solo quelli di diametro ≥14 mm essendo difficoltoso e inutile cercare di aspirare quelli più piccoli neanche per diminuire il rischio e le conseguenze di iperstimolazione severa (OHSS) che ricava pochi benefici da questa manovra. Il trattamento della OHSS prevede una terapia e misure preventive specifiche (23-49). 
Preparazione del liquido seminale – Normalmente si utilizza lo sperma del partner maschile della coppia, ma nel caso di azoospermia è possibile fare ricorso al liquido seminale di donatore oppure, in caso di azoospermia ostruttiva, ricorrere al prelievo chirurgico degli spermatozoi: TeFNA (Testicular Fine Needle Aspiration), PESA (Percutaneous Epididymal Sperm 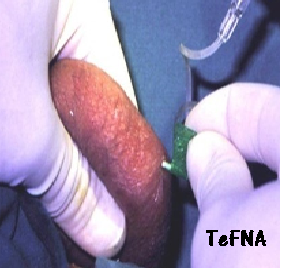 Aspiration), MESA (Microsurgical Epididymal Sperm Aspiration), TESE (Testicular Sperm Extraction), se non è possibile la ricanalizzazione microchirurgica delle vie seminali prossimali (23-30).
Aspiration), MESA (Microsurgical Epididymal Sperm Aspiration), TESE (Testicular Sperm Extraction), se non è possibile la ricanalizzazione microchirurgica delle vie seminali prossimali (23-30).
Per l’IVF standard occorrono ≥2.000.000 spz mobili/eiaculato altrimenti si deve ricorrere a procedure di microiniezione (ICSI). I risultati dipendono dalla qualità del seme e in particolare dalla morfologia e motilità più che dal numero degli spermatozoi.
Dopo mezz’ora dal prelievo, il liquido seminale è sottoposto a trattamento con metodica “swim-up” o migrazione ascendente da pellet oppure, nei casi di oligoastenospermia, utilizzando i gradienti di Percoll.
Swim-up – dopo la liquefazione (30′ circa dalla raccolta), il liquido seminale viene posto in 4 separate provette e miscelato con una quantità doppia di medium di cultura. Tutto il preparato è quindi centrifugato a 600-800 giri per 4-6 minuti. Quindi si elimina da ogni provetta il sopranatante e il pellet complessivo è riunito in una sola provetta e quindi risospeso in un terreno di coltura fresco e lasciato incubare a 37°C per 40-60 minuti.
Gradienti di Percoll – Le tecniche più diffuse su gradiente di Percoll utilizzano gradienti piccoli e discontinui con due o tre strati; è da utilizzare nei casi di oligo-astenospermia grave (< 5 milioni di spermatozoi per eiaculato). Tale gradiente utilizza tre strati da 0.3 mL di Percoll isotonico rispettivamente al 50%, 70% e al 95%. L’utilizzo, nelle fasi di lavaggio iniziale, di pentossifillina (una molecola antiossidante) determina un miglioramento sostanziale nelle percentuali di fertilizzazione alla IVF.
Gradienti di mini-Percoll sono preparati in provette coniche da centrifuga, caricate con il pellet di spermatozoi lavati e risospesi in 0.3mL di medium di coltura e quindi centrifugati a 300 giri per 30-45 minuti. La separazione in base al gradiente permette di eliminare detriti cellulari ed acellulari, batteri e di recuperare gli spermatozoi mobili,presenti nelle frazioni più concentrate del gradiente e morfologicamente normali localizzati nel sedimento. Questa metodica trova quindi indicazione nei casi di oligoastenospermia severa.
Fecondazione in vitro – Il passaggio più importante nella FIVET consiste nel procedimento di fecondazione in vitro. Una volta ottenuti separatamente gli ovuli e gli spermatozoi, ogni ovulo viene collocato su una piastra di coltura e “circondato” da un numero di spermatozoi che varia dai 100.000 ai 500.000, per un tempo che oscilla dalle 12 alle 18 ore. Nel caso siano riscontrabili problemi nel processo di fecondazione si procederà “manualmente” con la tecnica ICSI (Iniezione intracitoplasmatica) attraverso la quale si introduce con un ago uno spermatozoo vivo all’interno dell’ovulo. Gli embrioni ottenuti attraverso la procedura di fecondazione assistita vengono analizzati in laboratorio sulla base della loro morfologia e, di conseguenza, vengono scartati quelli non ritenuti idonei per l’impianto.
Embryo-transfer – Si tratta di una procedura ambulatoriale, assolutamente veloce e indolore, che non necessita di sedazione. Il transfer, normalmente, viene effettuato in arco di tempo che varia dai 2 ai 5 giorni dalla fecondazione degli ovociti. A 4 ore si forma lo zigote e a 48 ore un embrione a 2-4 cellule mentre la blastocisti so osserva dopo 4-5 giorni. La blastocisti è stadio di sviluppo embrionale di una fecondazione naturale. L’embrione viene “aspirato” con un catetere da embryo-transfer e posizionato nell’utero a 2 cm dal fondo. La paziente resta sdraiata in trendelenbur a 30° per alcune ore e quindi osserverà un periodo di riposo di 3-7 giorni.
Bibliografia:
- Forman R.G., Ross B., Frydman R., Barlow D.H. et Egan D.: Severe ovarian hyperstimulation syndrome using agonists of gonadotropin-releasing hormone for in vitro fertilization: a European series and a proposal for prevention. Fertil. Steril. vol 53, No.3, March 1990.
- Rabau E., David A., Serr DM., Mashiach S., Lunenfeld B.: Human Menopausal Gonadotropins for anovulaztion and sterility: results of 7 years of treatment. Am. J. Obstet. Gynecol. 98:92,1967.
- Schenker J.G., Weinstein D.: Ovarian Hyperstimulation Syndrome: a current survey. Fertil. Steril. 30:255,1978.
- Golan A., Ron-El R., Herman A., Soffer Y., Weinraub Z., Capsi E.: Ovarian hyperstimulation syndrome: an update review. Obstet. Gynecol. Surv., 44, 430-440, 1989
- Blackstein J., Shalev J., Saadon T. et al.: Ovarian hyperstimulation syndrome: prediction by numbers and size of preovulatory ovarian follicles. Fertil. Steril. 47,597-602, 1987
- Forman R.G., Frydman R., Egan D., Ross C., Barlow D.H.: Severe ovarian Hyperstimulation Syndrome using Agonists of gonadotropin-releasing hormone for in vitro fertilization: a European series and a proposal for prevention. Fertil. Steril., 53, 502-9, 1990.
- In vitro fertilization and assisted reproduction. Brinsden P.R. et Rainsbury P.A. Parthenon Publishing Group Ltd London 1992
- Trounson A. et Gardner D. K.: Handbook of in vitro fertilization pagg. 11-12 CRC Press, Boca Raton, Florida, USA.
- Tulandi T., Micinnes R.A., Arronet GH: Ovarian Hyperstimulation following ovulation induction with human menopausal gonadotropin. Int. J. Fertil. 29:113,1984.
- Polishuk W.Z., Schenker J. G.: Ovarian overstimulation syndrome. Fertil. Steril. 20:443, 1969.
- Hengel T., Jewelewicz R., Dyrenfurth I.: Ovarian hyperstimulation Syndrome. Am. J. Obstet. Ginecol. 112: 1050, 1972.
- Shalev J., Mashiach S., Lunenfeld B., Serr D.M., Blankstein J.: Ovarian Hyperstimulation Syndrome: prediction by number and size of preovulatory follicles (Abstr. 24). Presented at Esco VII Monte Carlo 1984. Published by European Sterility Congress, in induction on ovulation, pag 204.
- Blankstein J, Shalev J, Saadon T et al: “Ovarian hyperstimulation syndrome : prediction by number and size of preovulatory ovarian follicles“. Fertil Steril 1987;47:597-602.
- Kodama H, Fukuda J, Karube H, Matsui T, Shimizu Y, Tanaka T: “Characteristics of blood hemostatic markers in a patient with ovarian hyperstimulation syndrome who actually developed thromboembolism”. Fertil Steril 1995;64:1207-1209.
- De Stefano V, Finazzi G, Mannucci PM: “Inherited thrombophilia : pathogenesis, clinical syndromes, and management”. Blood 1996;87:3531-3544.
- Lainas T, et al: “Administration of methylprednisolone to prevent severe ovarian hyperstimulation syndrome in patients undergoing in vitro fertilization”. Fertil Steril 2002;78,3:529-533.
- Smitz J., Camus M., Devroey P., Erard P., Wisanto A., Van Steirteghem A.C.: Incidence of severe ovarian Hyperstimulation syndrome after GnRH agonist/HMG superovulation for in vitro fertilization. Human Reproduction Vol. 5 n. 8 pp 933-937,1990.
- 23) Salat-Baroux J., Tibi G., Alvarez S., Cornet D., Antoine J.M., Gomes A.: Ultrasonografic prediction of ovarian hyperstimulation after IVF. In abstract book of the VI World Congress on in vitro fertilization Alternate Assisted Reproduction ,. Jerusalem, Israel, 1989,April 2-7, p. 27.
- Golan A., Ron-El R., Herman A., Soffer Y., Weinraub Z., Capsi E.: Ovarian hyperstimulation syndrome following D-Trp-6 luteinizing hormone-releasing hormone microcapsules and menotropins for in vitro fertilization. Fertil. Steril. 50,912-916,1988.
- Friedman C.I., Schmidt G.E., Chang F.E., Kim M.H.: Severe ovarian Hyperstimulation syndrome following follicular aspiration. Am. J. Obst. Gynec. 150, 436-437, 1984.
- Belaisch-Allart J., Belaisch J., Hazout A., Testart J., Fridman R.: Selective oocyte retrieval: a new approach to ovarian hyperstimulation. Fertil. Steril. 50,654-656, 1988.
- V. Volpicelli – – V. Maisto – 0. Daino Narciso – G. Tomasillo – A. Torre – R. Zarcone: Pattern Endometriale In Cicli Di Procreazione Medica Assistita. ATTI 13° Corso di Aggiornamento su Fertilità, Sterilità e Contraccezione. Congresso Nazionale Società Italiana di Endoscopia e Laser terapia Ginecologica (SIELG). Firenze, 15-17 Maggio 1995.