Menopausa dal greco “μήν” mese e “παὒσις” fine letteralmente significa cessazione delle mestruazioni, osservata però almeno per un anno. Per perimenopausa o climaterio s’intende il periodo di vari anni prima e dell’anno successivo all’ultimo ciclo mestruale.
La menopausa, in base all’età di insorgenza, si definisce:
- Precoce: se insorge prima dei 40 anni
- Prematura: se insorge tra i 40 e 45 anni
- Tempestiva: se insorge tra i 45 e 53 anni
- Tardiva: se insorge oltre i 53 anni
In base al meccanismo di insorgenza la menopausa può definirsi:
- spontanea, in seguito al normale esaurimento ovarico legato all’età;
- iatrogena, indotta cioè dall’uso di farmaci come gli antiblastici e/o radiazioni ionizzanti o post-chirurgica (isterectomia con annessiectomia).
MENOPAUSA PRECOCE: è un’amenorrea secondaria non gravidica in età <40 anni con FSH elevato (>40 UI/ml)..In genere è dovuta ad
- esaurimento ovarico precoce detto anche POF, Premature Ovarian Failure. In questa patologia esiste un riarragiamento cromosomico a carico del cromosoma X (delezione braccio lungo X o dislocazione).
- S. dell’ovaio resistente (S. di Savage), causa di menopausa precoce, è a sua volta causata da anticorpi contro i recettori delle gonadotropine.
- Presenza del fattore V di Leiden.
- Fattori Immnunitari: frequentemente chiamati in causa nelle menopause precoci. E’ infatti frequente ritrovare insieme alla menopausa precoce altre patologie immunitarie come la tireopatia di Basedow e Hashimoto, vitiligine, Addison, Ipoparatiroidismo, Gastrite atrofica, Artrite reumatoide, M. di Crohn, Diabete tipo I etc.
MENOPAUSA TEMPESTIVA: insorge spontaneamente nelle donne tra i 45 e i 53 anni di età. L’eziologia è da attribuire alla normale senescenza ovarica legata all’età della paziente.
Senescenza ovarica – La senescenza ovarica si riconduce principalmente a riduzione del numero e della sensibilità dei follicoli ovarici. La riduzione del numero dei follicoli è progressiva (un feto di 5 mesi possiede 7 milioni di follicoli; una donna di 40 anni ne possiede appena 10.000) ed è dovuta a fattori ereditari (6) ed è influenzata dalla nulliparità ma non dal numero di gravidanze o dall’uso di contraccettivi. Il miglioramento delle condizioni di vita e soprattutto di nutrizione hanno innalzato l’età di inizio della insensibilità dei follicoli. Nel periodo perimenopausale la dilapidazione dei follicoli è formidabile sotto la spinta di elevati livelli di FSH. Inoltre numerosi sono i follicoli irregolari con teca e granulosa scarsa o addirittura mancante. Questi follicoli sono difettosi e a diminuita responsività ma possono essere fecondati e dare origine ad embrioni con malformazioni cromosomiche. In caso di necessità di stimolazione ovarica per PMA, la quantità di gonadotropine necessarie per la crescita follicolare è maggiore dopo i 40 anni per l’accresciuta insensibilità dei follicoli allo stimolo gonadotropinico. In questi follicoli si instaura una iperplasia dello stroma ovarico sotto l’azione dell’FSH prodotto in aumentate quantità dall’ipofisi per feed-back positivo da carenza di estrogeni. Le cellule steroidogenetiche si organizzano attorno ai corpi albicans in micronoduli ai quali si dà il nome di cellule di Berger o cellule LU, cellule stromali che producono androgeni; si pensa essere la controparte ovarico delle cellule interstiziali del testicolo. A livello ovarico si assiste a una diminuzione della secrezione di E2, Inversione E2/E1, arresto della produzione di progesterone, triplicata produzione ovarica di testosterone, inversione EE/AA.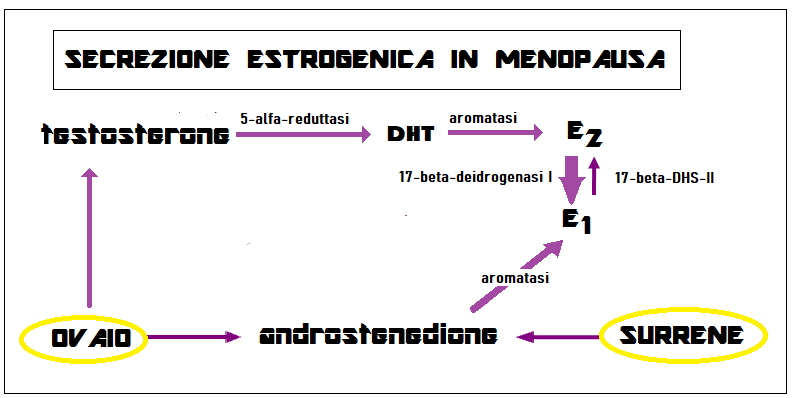
FASI DEL CLIMATERIO-MENOPAUSA
Le modificazioni funzionali a livello ovarico hanno un ruolo fondamentale per l’insorgenza di tutti i fenomeni del climaterio. Escludendo la menopausa precoce prodotta dalla S. dell’ovaio resistente (S. di Savage), l’atteggiamento ormonale della donna nel periodo del climaterio-menopausa passa, molto spesso, attraverso le seguenti fasi:
- Fase Iperestrogenica, premenopausica, nella quale l’ovaio tende a produrre una quantità di estrogeni diversa da quella abituale e soprattutto compaiono cicli anovulatori, per cui la situazione è di solito caratterizzata da un deficit della secrezione di progesterone e da iperestrogenismo assoluto o relativo.
- Fase Ipoestrogenica, menopausica, nella quale l’ovaio non realizza più la biosintesi steroidea (prima diminuisce la produzione di progesterone e poi quella degli estrogeni) e cessa il fenomeno della mestruazione; va anche scomparendo ogni inibizione sulla adenoipofisi, venendo a cessare il feed-back degli estrogeni e dell’inibina entrambi prodotti dalle cellule della granulosa;
- Fase Ipergonadotropa, post-menopausica, caratterizzata da iperproduzione di FSH prima (10 volte la norma) e poi anche di LH (3 volte rispetto ai valori normali). Gli estrogeni all’inizio sono normali poi iniziano a diminuire insieme all’LH e in post-menopausa sono rappresentati dalla produzione di estrogeni di origine surrenalica (quasi esclusivamente Estrone, E1). L’ipergonadotropinemia che si instaura dopo la menopausa rimane costante per molti anni fino alla senilità, poiché l’ipotalamo e quindi l’ipofisi sono ormai liberi da ogni controllo steroideo. L’ipergonadotropinemia conduce a massiva sollecitazione follicolare producendo la dilapidazione dei pochi follicoli sensibili rimasti.

SINTOMATOLOGIA –
Molti sintomi della perimenopausa, sebbene fastidiosi, si riducono successivamente in termini di frequenza e intensità dopo la menopausa. Tuttavia, la diminuzione dei livelli di estrogeni provoca cambiamenti che possono continuare a influire negativamente sulla salute (ad esempio aumentando il rischio di osteoporosi) e possono peggiorare se non si prendono misure per prevenirli. Possono essere interessati i principali sistemi dell’organismo:
- Apparato riproduttivo: a seguito del calo estrogenico il microambiente vaginale tende verso l’alcalinità, la mucosa si assottiglia, diventa più secca e meno elastica (vaginite atrofica). e sanguigna al minimo traumatismo. Altri organi sessuali (piccole labbra, clitoride, utero e ovaie) si rimpiccioliscono per fenomeni involutivi con diminuzione del grasso, modificazioni cutanee ed alterazioni dei peli pubici e vulvari che diventano grigi, ispidi, rari.. L’eccitazione sessuale (libido) in genere diminuisce con l’età; la maggior parte delle donne può ancora raggiungere l’orgasmo, ma per alcune è necessario più tempo; compare dispareunia. Lo striscio vaginale della post-menopausa è caratterizzato da una diminuzione delle cellule eosinofile e dell’indice cariopicnotico e dalla comparsa di cellule degli strati più bassi dell’epitelio vaginale (cellule parabasali).
- Mezzi di sospensione degli organi pelvici: la diminuzione della quantità e della qualità del collagene (rapporto collagene tipo III/collagene tipo I) incide profondamente sulla relaxatio pelvica e quindi sul prolasso genitale. Il collagene è particolarmente rappresentato nella matrice del tessuto connettivo e quindi dei legamenti e dei sistemi di sospensione. Occorrerebbe sempre effettuare una terapia HRT pre- e post-operatoria nella chirurgia della relaxatio pelvica.
- Mammelle – Le mammelle risentono piuttosto precocemente della carenza di estrogeni, diminuiscono di volume e il loro supporto legamentoso si allenta, per cui si fanno cadenti. Al momento della menopausa questo quadro endocrino cambia rapidamente: il ruolo del progesterone diventa minore e la fonte di estradiolo, che prima era rappresentata principalmente dalla secrezione ovarica diretta, si sposta in periferia dove la produzione indiretta degli estrogeni é rappresentata principalmente dalla secrezione di E1, proormone androgeno.
- Vie urinarie: Il rivestimento dell’uretra si assottiglia e l’organo si accorcia. Queste trasformazioni facilitano l’ingresso e attecchimento di microrganismi e lo sviluppo di infezioni delle vie urinarie. Dopo la menopausa può insorgere urge incontinence e stress incontinence. Sindrome genito-urinaria menopausale è un termine più accurato utilizzato per descrivere i sintomi suesposti causati dalla menopausa a carico della vagina e delle vie urinarie.

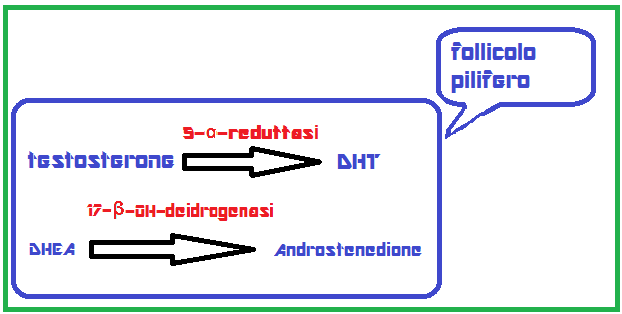
- Cute: La diminuzione della concentrazione sierica degli estrogeni e l’invecchiamento stesso causano una diminuzione della quantità di collagene ed elastina.. Pertanto, la cute diventa più sottile, secca, anelastica, rugosa e più soggetta alle lesioni per traumi anche minimi. Altro grave problema legato alla diminuzione degli EE in climaterio è l’alopecia androgenetica, molto spesso sottovalutata dai medici e anche dalle stesse pazienti. Il tricogramma in condizioni di normalità prevede un rapporto di capelli in fase Anagen del 90%, in fase Telogen del 9% e in fase Catagen dell’1%. In climaterio la percentuale dei capelli in fase Anagen tende a diminuire. La terapia con EE fa aumentare la SHBG e fa diminuire l’alopecia androgenetica (EE 0,02 mg/die dal 1° al 25° giorno + MAP 10 mg/die dal 16° al 25°). La diminuzione degli EE si collega ad una marcata attività di alcune funzioni enzimatiche del bulbo pilifero per cui il Testosterone si trasforma in DHT ad opera della 5-a-reduttasi ed il DHEA si trasforma in Androstendione ad opera della 17-β-OH-deidrogenasi.
- Apparato osseo: La riduzione degli estrogeni causa spesso la diminuzione della densità ossea e, quindi, l’osteoporosi. L’osteoporosi della menopausa è caratterizzata da una rarefazione ossea, per demineralizzazione conseguente ad iposecrezione di estrogeni. Gli estrogeni si oppongono al riassorbimento osseo determinato dal paratormone. La deficienza degli estrogeni sensibilizza forse al paratormone o deprime la somatotropina, inducendo un difetto nel trasporto del calcio a livello intestinale o renale e di conseguenza un riassorbimento dell’osso. Si calcola che in media le donne nei primi 5 anni di menopausa possono perdere il 15% della massa ossea. Le ossa più colpite sono le vertebre, il bacino, il femore e il polso. In post-menopausa la densità ossea diminuisce con la stessa velocità degli uomini (circa 1-3% ogni anno). La diminuzione del tono oppioide produce inoltre aumentata sensibilità nocicettiva: si osserva artropatia climaterica ovaro-priva, o artralgia climaterica, che colpisce di preferenza le articolazioni del ginocchio, del carpo e del metacarpo. Altra caratteristica dell’ipoestrogenismo è l’insorgenza o aggravamento delle lesioni artrosiche e comparsa di caratteristiche lesioni a livello delle piccole articolazioni interfalangee distali che vengono grossolanamente deformate per la presenza dai “noduli di Heberden” e talora subiscono deviazioni dal proprio asse con danni estetici e funzionali.
- Diminuita secrezione surrenalica di DHEA (Deidroepiandrosterone) La diminuzione della secrezione di DHEA surrenalico è costante dopo i 30 anni (2% l’anno) con una brusca impennata, del 50-60%, con la menopausa. Questo può spiegare una parte di sintomi frequenti in menopausa: debolezza generale, ridotta energia vitale, perdita di tono muscolare, perdita di concentrazione e di memoria.
- Alterazioni metaboliche – Dopo la menopausa, i livelli di triglicerid e colesterolo-LDL aumentano, mentre quelli del colesterolo-HDL diminuiscono o restano all’incirca invariati. Questi cambiamenti nei livelli di LDL possono spiegare in parte la maggiore frequenza dell’aterosclerosi e quindi delle coronaropatie dopo la menopausa. Occorre anche notare che in climaterio si osserva una maggiore frequenza del diabete tipo II per aumentata insulino-resistenza. Aumento di peso ed in particolare accumulo di adipe addominale e conseguente aumento di acidi grassi liberi (NEFA) i quali competono con il glicogeno per la captazione a livello epatico (effetto diabetogeno). Ne consegue un aumento della glicemia, iperinsulinemia, resistenza all’insulina, potenziamento della sintesi androgenica ovarica sia per azione diretta dell’insulina sull’ovaio che tramite una iperproduzione della IGF-I che a sua volta svolge la stessa azione dell’insulina sull’ovaio. L’esercizio fisico fatto con regolarità (4 ore settimanali) favorisce la perdita di peso e può migliorare la sensibilità all’insulina e la diminuzione della dislipidemia.

- Fenomeni neurovegetativi e vascolari – Sembrano dipendere da pulses di LH e ACTH. La sintomatologia è rappresentata dapprima da fenomeni neurovegetativi vasomotori: vampate di calore (“hot flashes”), sudorazioni, crisi di tachicardia, cardiopalmo, dolori stenocardici, modificazioni a carico della pressione arteriosa (ipertensione o ipotensione). Questi disturbi sono soprattutto presenti nella fase premenopausale. Sono il sintomo più noto e fastidioso interessando l’80% delle donne.

- Labilità emozionale e tendenza alla depressione sono fattori che possono portare all’iperfagia psichica e all’inattività fisica. L’obesità che ne deriva ha pure un effetto diabetogeno, inducendo nei tessuti periferici una resistenza all’insulina. Rientrano in questo gruppo anche alcune manifestazioni allergiche, come ad esempio sindromi asmatiche che insorgono per la prima volta in climaterio, ecc. Frequentemente insorgono facile irritabilità, instabilità emotiva, modificazioni a carico del carattere, cefalea, emicrania, dolori neuritici e atteggiamenti depressivi e psico-nevrotici. Rare sono invece le manifestazioni epilettiche transitorie della menopausa che, secondo le vedute più recenti, sarebbero di natura diencefalica e neurovegetativa.
- Aumento dell’attività tiroidea: La tiroide presenta di solito quadri di iperattività, mentre sono rare le situazioni di ipotiroidismo. Gli estrogeni stimolano la sintesi della TBG (Thyroid-binding-globulin); la diminuzione degli EE produce quindi una diminuzione della TBG ed un aumento della tiroxina libera con quadri di ipertiroidismo (vampate di calore, instabilità emotiva, tachicardia).
- Disordini della funzionalità ipotalamica: col sopraggiungere della menopausa la donna perde quell’atteggiamento ciclico, bifasico, che caratterizza l’ipotalamo femminile e si realizza, a quel livello, un orientamento funzionale di tipo maschile, cioè tonico, monofasico. C’è una ipersecrezione di Gn-RH conseguente a:
DIAGNOSTICA –
- Esame obiettivo ginecologico + pap-test + visita senologica + mammografia
- Esame obiettivo generale
- Peso e BMI (Body Mass Index): BMI <22 è un fattore favorente l’osteoporosi
- Pressione arteriosa
- ECG e visita cardiologica
- DEXA a livello del femore prossimale (triangolo di Ward a livello del collo del femore),
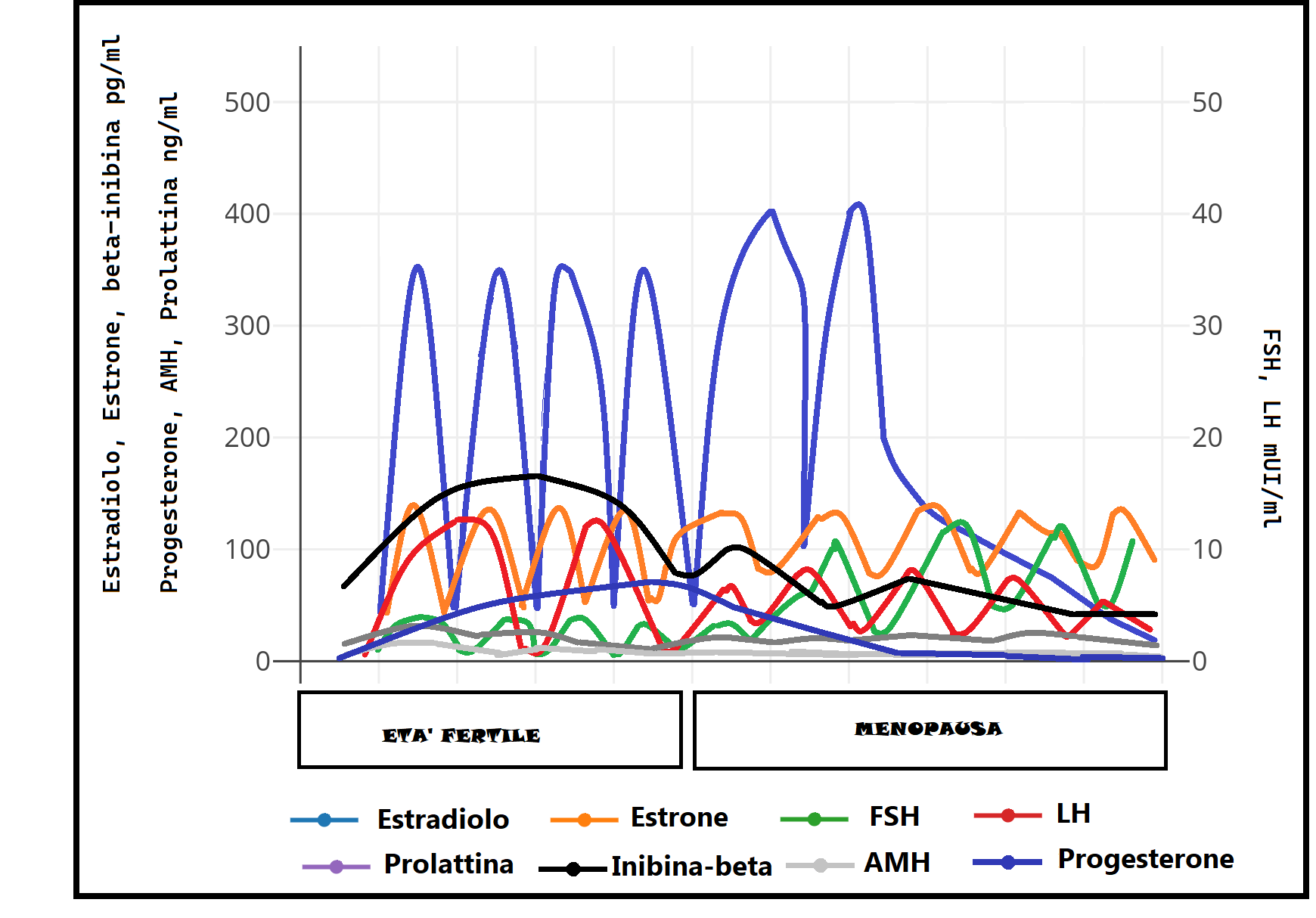
- FSH, LH, E1, E2, Progesterone, Paratormone, ß-inibina, AMH, Prolattina, quadro tiroideo. Le variazioni più evidenti sono a carico delle gonadotropine il cui valore sierico si innalza vistosamente e costantemente in menopausa rispetto ai valori dell’età fertile: l’FSH si innalza da 1-25 a 16-134 mUI/ml e l’LH che presenta variazioni cicliche di 1-105 mUI/ml in età fertile a valori di 15-62 mUI/ml in menopausa. L’estradiolo cala vistosamente in menopausa: da 15-350 pg/ml durante i normali cicli a <10 pg/ml in menopausa con un caratteristico picco pre-menopausale che giunge fino a 400 pg/ml; L’estrone invece passa da valori di 15-130 pg/ml in età fertile a 40-140 in menopausa. Il progesterone presenta valori variabili in età fertile in rapporto alla fase del ciclo con valori che oscillano da 1 a 25 ng/ml mentre in menopausa scende a valori stabili <1 ng/ml. La prolattina diminuisce anche se di poco in menopausa: 5-20 vs. 10-20 ng/ml. La secrezione di AMH e ß-inibina diminuisce in menopausa: AMH da 2-10 a <1 ng/ml; ß-inibina scende da 50-150 a <10 pg/ml.
- Emocromo, Colesterolo frazionato, trigliceridi, Calcemia,fosforemia, creatinina, calciuria, fosfaturia, idrossiprolina urinaria/24 ore
TERAPIA
- TERAPIA ORMONALE
- TERAPIA NON ORMONALE
- TERAPIA OSTEOPOROSI
References:
- Doherty JA, Cushing-Haugen KL, Saltzman BS, Voigt LF, Hill DA, Beresford SA, Chen C, Weiss NS: ”Long-term use of postmenopausal estrogen and progestin hormone therapies and the risk of endometrial cancer”. Am J Obstet Gynecol. 2007 Aug;197(2):139.e1-7.
- M. Diete: Hormone replacement therapy (HRT), breast cancer and tumor pathology. Maturitas 2010;65,3:183-189
- Writing Group for the Women’s Health Initiative Investigators. Risks and benefits of estrogen plus progestin in healthy postmenopausal women. Principal results from the Women’s Health Initiative randomized controlled trial. J Am Med Assoc. 2002;288:321–333.
- Million Women Study Collaborators. Breast cancer and hormone replacement therapy in the Million Women Study. Lancet. 2003;362:419–427
- Vickers, M.R., Martin, J., Meade, T.W. WISDOM study team. The Women’s international study of long-duration oestrogen after menopause (WISDOM): a randomised controlled trial. BMC Women’s Health. 2007;7:2.
- Turgeon, J.L., McDonnell, D.P., Martin, K.A., Wise, P.M. Hormone therapy: physiological complexity belies therapeutic simplicity. Science. 2004;304:1269–1273.
- American Institute for Cancer Research/World Cancer Research Fund. Food, nutrition and the prevention of cancer: a global perspective. Breast. American Institute of Cancer Research, Washington, DC, USA; 2002 (p. 252–287, 20009, ISBN: 1 899533 05 2).
- Skouby, S.O., Jespersen, J. Progestins in HRT: sufferance or desire?. Maturitas. 2009;62:371–375
- Brekelmans, C.T. Risk factors and risk reduction of breast and ovarian cancer. Curr Opin Obstet Gynecol. 2003;15:63–68.
- Colditz, G.A., Hankinson, S.E., Hunter, D.J. et al, The use of estrogens and progestins and the risk of breast cancer in postmenopausal women. N Engl J Med. 1995;332:1589–1593
- Lancet 2003; 362: 419-27. Breast cancer and hormone-replacement therapy in the Million Women Study.Beral V; Million Women Study Collaborators.
- N Engl J Med 2008; 359: 697-708. The effects of tibolone in older postmenopausal women. Cummings SR, et al
- Kenemans P, Speroff L; International Tibolone Consensus Group. Tibolone: clinical recommendations and practical guidelines. A report of the International Tibolone Consensus Group. Maturitas 2005;51:21-8.
- Hammar M, Christau S, Nathorst-Böös J, et al. A Double-blind randomised trial
comparing the effect of tibolone and continous combined hormone replacement
therapy in postmenopausal women with menopausal syntoms. Br J Obstet Gynecol 1998;105:904-11. - Archer DF, Hendrix S, Gallagher JC, et al. Endometrial effects of tibolone. J Clin
Endocrinol Metab 2007;92:911-8. - Lundström E, Christow A, Kersemaekers W, et al. Effects of tibolone and continuous combined hormone replacement therapy on mammographic breast density. Am J Obstet Gynecol 2002;186:717-22.
- Modelska K, Cummings S. Tibolone for postmenopausal women: systematic review of randomized trials. J Clin Endocrinol Metab 2002;87:16-23.


