L’azoospermia è la completa assenza di spermatozoi in un campione di liquido seminale. Circa il 2% delle coppie infertili e il 10% degli uomini infertili presenta questo tipo di patologia (1). L’azoospermia presenta due forme: ostruttiva o secretoria (non -ostruttiva) (1,2).
Azoospermia ostruttiva
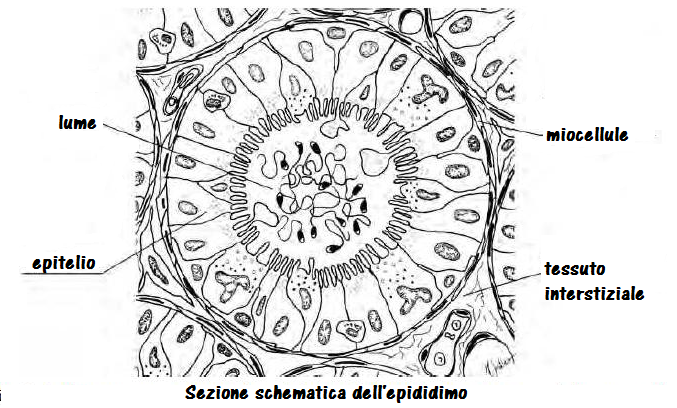
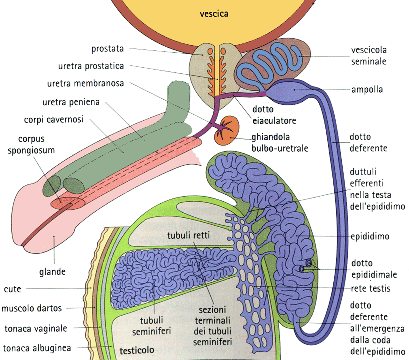
La spermatogenesi è regolare ma gli spz sono assenti nell’eiaculato, il trofismo testicolare è quasi sempre nella norma come FSH e testosterone. Il fenotipo è di tipo maschile normale. In condizioni normali il passaggio attraverso la testa ed il corpo epididimario è reso possibile dalla contrazioni peristaltiche delle cellule muscolari presenti sul tubulo. Nella coda le contrazioni della parete avvengono solo quando le cellule sono stimolate, in vista dell’eiaculazione. In caso di azoospermia ostruttiva, il passaggio è ostacolato da assenza congenita o stenosi epididimaria.
L’azoospermia ostruttiva può essere dovuta a:
- vasectomia,
- agenesia bilaterale dei vasi deferenti (CBAVD, Congenital Bilateral Absence Vas Deferens) presente nel 98% dei pazienti affetti da fibrosi cistica. E’ presente molto frequentemente (42%) una mutazione delta-F508 nel gene CFTR .
- S. di Young: sindrome caratterizzata da azoospermia ostruttiva e ed infezioni seno-bronchiali ricorrenti causate dalle secrezioni troppo dense. La funzionalità respiratoria è solo lievemente compromessa. Non vi sono mutazioni del gene CFTR
- interruzione dei vasi deferenti o dell’epididimo post- chirurgica
- TBC genitale
Azoospermia non-ostruttiva
L’azoospermia non ostruttiva (NOA, Non-Obstructive Azoospermia), o azoospermia secretoria, è dovuta a difetti nella produzione di spermatozoi per cui solo pochi tratti dei tubuli seminiferi producono spz. che però non risultano nell’eiaculato per mancanza di comunicazione con l’esterno. Tra le cause di azospermia secretoria troviamo problematiche legate a:
-
anomalie cromosomiche
-
anomalie geniche
-
deficit enzimatici steroidogenesi
-
Aplasia cellule di Sertoli
-
Degenerazione tubulare idiopatica
-
patologie immunologiche
-
malattie sistemiche
-
K testicolo
-
traumi testicolari diretti o torsione del testicolo entro i primi anni di vita
-
Alterazioni e lesioni delle tight Junction epiteliali epididimarie
-
Infezioni in epoca pre-puberale (TBC, Parotite epidemica)
-
Varicocele
-
Cisti epididimarie: rappresentano una causa frequente di azoospermia non soltanto quelle di un certo volume, ma soprattutto le forme microcistiche, più difficilmente diagnosticabili.
-
Criptorchidismo
-
Iperpiressia
-
Anorchia bilaterale
-
Iatrogena
-
Etiologia idiopatica
ANOMALIE CROMOSOMICHE E GENICHE: Le alterazioni genetiche presenti nell’azoospermico non-ostruttiva sono: microdelezione del cromosoma Y, traslocazioni robertsoniane, sindrome di Klinenfelter, S. di Steinert (18-25).
Microdelezioni del cromosoma Y: La presenza del cromosoma Y nelle cellule somatiche rappresenta una peculiarità dei maschi. Nel cromosoma Y è sta individuata sul braccio corto una regione specifica denominata “Male Specific Y (MSY)” che contiene ben 27 geni coinvolti in funzioni come la determinazione del sesso maschile (SRY, Sex-determining Region Y) mentre nel braccio lungo del cromosoma Y è situata una regione denominata AZF (Azoospermia factor) i cui geni sono implicati nella spermatogenesi. Le “microdelezioni” delle regioni AZF rappresentano la causa genetica più frequente (20%) di oligo/azoospermia (19-22).
Il gene AZFa (o AZF 1) è localizzato nella regione eucromatica del braccio lungo in Yq11.23, è lungo  792kb ed è poco distale dal centromero del cromosoma Y.
792kb ed è poco distale dal centromero del cromosoma Y.
Nei pz azoospermici con microdelezioni AZFb difficilmente si ritroveranno spermatozoi anche con le più invasive tecniche di recupero chirurgico (26).
L’AZFc: una delezione parziale e specifica dell’AZFc (chiamato gr/gr deletion). Le delezioni interessanti la AZFc non hanno alcun sull’outcome gravidico degli spz. utilizzati nella tecnica ICSI.
Per microdelezione si intende la perdita di una piccola parte del braccio lungo (ovvero tratto verticale) del cromosoma sessuale maschile “Y”. La microdelezione del cromosoma Y si reperta in meno del 10% degli azoospermici non ostruttivi. La presenza di una microdelezione del cromosoma Y invalida tutte le terapie mediche e chirurgiche attualmente note per tentare di re-indurre la spermatogenesi nei soggetti azoospermici: varicocelectomia, gonadotropine o antiestrogeni. Pertanto la presenza di microdelezione del cromosoma Y implica la necessità di fecondazione assitita mediante ICSI utilizzando solo spermatozoi “X” per evitare la trasmissione della azoospermia alla prole. La microdelezione del cromosoma Y può insorgere per una mutazione “de novo” in soggetto nato da genitori sani, oppure per un meccanismo di amplificazione (18-25).
Traslocazioni Robertsoniane
Le traslocazioni Robertsoniane si manifestano quando due cromosomi acrocentrici si fondono tra loro. Il risultante cromosoma anomalo, generalmente dicentrico, reca la maggior parte delle braccia lunghe dei due cromosomi originali con la conseguente perdita delle braccia corte. I portatori di traslocazioni bilanciate possiedono solo 45 cromosomi. Questi errori possono avere l’effetto di produrre corredi cromosomici sbilanciati, con presenza di monosomie (mancanza di un cromosoma) o trisomie(aumento di un cromosoma). Questo tipo di errori possono provocare aborti spontanei precoci o diminuita o assente fertilità. I portatori di tale anomalia in genere manifestano un fenotipo normale, ma la traslocazione può condizionare la possibilità di concepire a causa di una gametogenesi difettosa e/o di una produzione di gameti con una distribuzione di riarrangiamenti parentali non equilibrata.
Sindrome di Klinefelter
La sindrome di Klinefelter (47XXY) è dovuta alla non disgiunzione del cromosoma Y nella IIa divisione meiotica. Fenotipicamente maschi di altezza superiore alla norma (>182 cm), testicoli piccoli e duri e/o scarso sviluppo dei caratteri sessuali secondari. L’esame istologico testicolare evidenzia fibrosi dei tubuli seminiferi e ipertrofia delle cellule di Leydig. Spesso è presente ginecomastia. Hanno Q.I. ridotto di 10-15 punti. La S. di Klinefelter è la più frequente causa di infertilità maschile su base genetica. Nella forma classica (47XXY), presente nel 90% dei casi gli individui affetti sono quasi tutti azoospermici. Nel 10% dei casi si tratta di “mosaicismi” con cariotipo 46XY/47XXY, meno grave rispetto alla forma classica, in quanto nello sperma di un uomo con tale sindrome sono presenti spermatozoi e sono sensibili alla terapia con HCG e letrozolo..
S. di Steinert: alterazioni geniche del cromosoma 19 per cui la tripletta CTG che si ripete per migliaia di volte mentre nelle persone normali la moltiplicazione non supera le 36 volte. Quanto più la sequenza si ripete tanto più è grave la patologia. A livello testicolare si osserva azoospermia in conseguenza della ialinizzazione dei tubuli seminiferi, le cellule del Leydig sono iperplasiche. Il livello sierico degli androgeni è molto basso mentre quello delle gonadotropine è elevato.
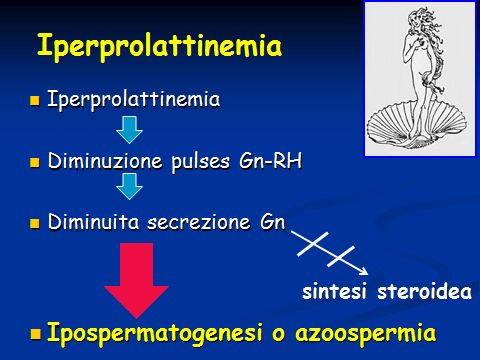
Iperprolattinemia: in genere causa una ipospermatogenesi o un’azoospermia secondaria e transitoria reversibile dopo adatta terapia con farmaci antiprolattinemici o rimozione chirurgica del prolattinoma, se presente.
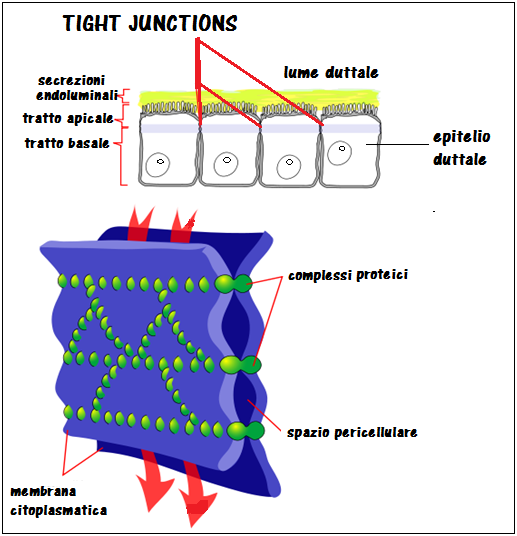
Tight Junction: le TJ dell’epitelio testicolare ed epididimario sono indispensabili per la maturazione e acquisizione della motilità da parte degli spermatozoi in quanto li difendono dalle aggressioni immunologiche e impediscono il passaggio intratubulare di acqua e soluti (barriera emato-epididimaria). Tutte le patologie infiammatorie e traumatiche delle TJ sono responsabili della mancata maturazione spermatozoaria.
Virus della parotite epidemica: RNA virus del gruppo mixovirus. Una delle complicazioni più comuni è l’orchite post-parotite che provoca sterilità; ma spesso la sterilità post-parotite si verifica anche in assenza di orchite.
INDAGINI DI LABORATORIO:
-
Spermiogramma, MAR-test, fruttosio, ac. citrico, fosfatasi acida, Zn, aminoglicosidasi, proteasi
-
Glicemia, Emoglobina glicata (HbA1c)
-
Esami culturali di liquido seminale, secreto prostatico, urine
-
USG prostatica,
-
USG testicolare,
-
Ecocolor Doppler plesso pampiniforme
-
Vescicolodeferentografia: L’approccio tradizionale di tipo chirurgico prevede che, previa anestesia locale, si esteriorizzino i dotti deferenti e si proceda poi ad un incannulamento del lume con un ago butterfly 25G corto od in alternativa si proceda ad una deferentotomia. Si inietta un mezzo di contrasto non ionico nelle vie seminali. Vengono eseguiti una serie di radiogrammi seriati che possono essere ripresi e seguiti in tempo reale su un monitor. Gradualmente si assiste alla opacizzazione del dotto deferente, delle ampolle deferenziali, delle vescicole seminali dei dotti eiaculatori e, da ultimo, si può osservare il reflusso del mezzo di contrasto nella vescica (25-27).
-
RMN addome inferiore: ha sostituito quasi completamente la vescicolo-deferentografia (25-27).
-
Biopsia testicolare
TERAPIA MEDICA:
- Antiprolattinemici
- HMG
- FSH di sintesi
CHIRURGICA
A) RICANALIZZAZIONE MICROCHIRURGICA DELLE VIE SEMINALI PROSSIMALI
La ricostruzione delle vie seminali prossimali è comunque subordinata alla pervietà del tratto distale che viene dimostrata nella fase operatoria immediatamente precedente la fase ricostruttiva, mediante incannulamento del deferente (con ago cannula o butterfly 23-25 G) ed iniettando almeno 10 ml di soluzione fisiologica e/o colorante o mediante vescicolo-deferentografia (3-5). Le tecniche attualmente più raccomandata in base ai risultati riportati dalla letteratura sono la tubulovasostomia termino-terminale (6-9) o latero-terminale (16), e quelle di invaginazione del tubulo epididimario nel lume deferenziale (10-13). I tassi di ricanalizzazione estrapolati dalle maggiori casistiche (in totale 2385 casi trattati) oscillano tra l’86% e il 93%, mentre i tassi cumulativi di gravidanza spontanea oscillano tra il 52% e l’82% (14-17).
B) RESEZIONE ENDOSCOPICA DEI DOTTI EIACULATORI (TURED) è stata proposta nel 1973 da Farley e Barnes per la risoluzione di ostruzioni dei dotti eiaculatori (DE). Da allora diversi lavori hanno documentato la sua efficacia (29-31). Il termine comprende anche le resezioni endoscopiche di cisti prostatiche ostruenti i dotti eiaculatori, anche se impropriamente, perchè in questo caso non vengono effettivamente resecati i dotti eiaculatori ma solo la parete anteriore della cisti, facendola comunicare ampiamente con l’uretra prostatica. Le indicazioni alla TURED sono appunto rappresentate dalle ostruzioni complete (azoospermia) ed incomplete della via seminale distale su base congenita o acquisita, dovute a atresie, stenosi cicatriziali o litiasiche dei DE o conseguenti alla presenza di cisti prostatiche comunicanti o non comunicanti con la via seminale. Ovviamente verranno prese in considerazione solo le problematiche relative all’impiego della TURED nei casi di azoospermia. Fino a pochi anni fa la TURED rappresentava l’unica possibilità terapeutica nei casi di ostruzione dei DE. Il successo delle tecniche chirurgiche di recupero di spermatozoi e l’introduzione di nuove tecniche disostruttive (sclerotizzazione ecoguidata di cisti prostatiche, Seminal Tract Wash-out) hanno ridimensionato il suo impiego (32-34).
C) TECNICHE CHIRURGICHE DI RECUPERO DEGLI SPERMATOZOI: in caso di azoospermia ostruttiva è possibile recuperare gli spermatozoi al 100%, mentre in caso di azoospermia secretoria le probabilità di recupero si riducono al 15-50% in relazione soprattutto al llivello sierico di FSH.
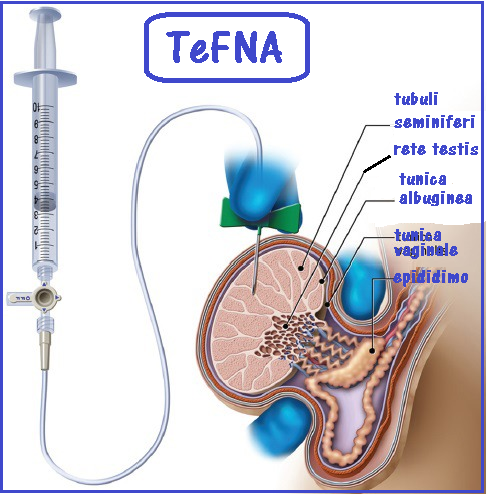
In caso di azoospermia si può ricorrere ad estrazione chirugica degli spz. mediante biopsia testicolare (TESE, Testicular Sperm Extraction) o estrazione chirurgica dall’epididimo MESA (Microsurgical Epididymal Sperm Aspiration). Meno traumatiche risultano l’estrazione percutanea di spermatozoi dal testicolo (TeFNA, Testicular Fine Needle Aspiration) o dall’epididimo: PESA (Percutaneous Epididymal Sperm Aspiration)
- La TeFNA (Testicular Fine Needle Aspiration): è di semplice esecuzione, minimamente invasiva e gravata di basse percentuali di complicanze. Viene praticata mediante aspirazione testicolare (2-15
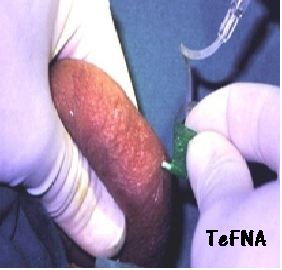 punture per ciascun testicolo) transcutanea con butterfly 21-23 G collegata ad una siringa da 20 cc contenenti Ham’s medium + 2% di albumina umana. Complicazioni rare ma possibili: ematomi ed infezioni (35-54).
punture per ciascun testicolo) transcutanea con butterfly 21-23 G collegata ad una siringa da 20 cc contenenti Ham’s medium + 2% di albumina umana. Complicazioni rare ma possibili: ematomi ed infezioni (35-54). - PESA (Percutaneous Epididymal Sperm Aspiration): introdotta nel 1995, prevede l’aspirazione degli spz, con la stessa metodica della TeFNA, dalla testa dell’epididimo bloccata fra indice e medio della mano sinistra dell’operatore. Gli spz recuperati vengono in parte esaminati dopo colorazione con Giemsa e per il resto utilizzati per ICSI o congelati. In caso di falli. mento dell’approccio percutaneo, si ricorre alle tecniche più invasive MESA e TESE. Complicazioni possibili: ematoma e danni tubulari.
- La tecnica MESA (Microsurgical Epididymal Sperm Aspiration): è stata la prima tecnica per il recupero chirurgico degli spz, introdotta da Silber nel 1987. Prevede incisione longitudinale di cute scrotale e albuginea con esposizione della testa epididimaria. Il prelievo degli spz è effettuata, mediante butterfly 21 G collegata a siringa da insulina contenente 1 ml di medium Ham’s F10 + 2% di albumina, dalla testa epididimaria dove si riscontrano gli spz. dotati di maggiore motilità. In caso di fallimento o in caso di azoospermia secretoria, si effettuerà l’aspirazione dal centro testicolare, a livello della cavità dei tubuli seminiferi.
TESE (Testicular Sperm Extraction): si pratica incidendo cute e albuginea ed effettuando 3 prelievi di tessuto testicolare da inviare ai biologi. Le incisioni testicolari vengono suturate in continuo con vycril 4/0 o prolene 6/0. In laboratorio, al M.O., i campioni tissutali vengono divisi in frammenti di 0.2-0.5 mm. Ogni frammento è stratificato in gradienti al 90%, 70% e 50% e centrifugato a 300 giri per 20 minuti. Si recupera la frazione al 90% che viene centrifugata con Ham’s F10 + albumina 2% a 1800 giri per 15 minuti. Il pellet è messo in incubazione con medium culturale fino al momento di essere utilizzato per la ICSI. No crio. Percentuali medie di recupero spz: 50% per biopsie multiple; 40% per biopsia singola. Una variante della TESE prevede l’utilizzo di un microscopio operatore 15-24x (micro-TESE), meno traumatizzante ma più indaginoso (36,37).
Le percentuali di successo riguardanti il recupero degli spz mediante le tecniche chirurgiche sono direttamente correlate con il volume testicolare asportato e il dosaggio sierico di FSH. A valori sierici di FSH <10 mUI/ml corrispondono percentuali del 45% di recupero di spz; mentre solo nel 15% dei casi si riescono a recuperare spz se i valori di FSH sono >19 mUI/ml (18). Complicazioni: perdita di tessuto testicolare, quello asportato.
Bibliografia:
- ^ Keye WR Jr, Chang RJ, Rebar RW. In: Infertilità Valutazione e trattamento. Verduci editore 1997;587-91. 6.
- Wolf-Bernhard Schill, Frank H. Comhaire, Timothy B. Hargreave, Andrologia clinica , Springer Science & Business Media, 02 mar 2011
- ^ Goldstein M. Chirurgia dell’infertilità maschile. Verduci ed. (1996). ISBN 978-88-7620-383-1
- Allan JA, Cotman AS A new method for freezing testicular biopsy sperm: three pregnancies with sperm extracted from cryopreserved sections of seminiferous tubule. Fertil Steril 1997;68:741-744
- Silber SJ. Microscopic vasoepididymostomy: specific microanastomosis to the epididymal tubule.Fertil Steril 1978, 30:565.
- Wagenknecht LV, Klosterhalfen H, Schirren C. Microsurgery in andrologic urology. I. Refertilization. J Microsurg 1980, 1:370-375.
- Berger RE. Triangulation end-to-side vasoepididymostomy. J Urol 1998, 159:1951-1953.
- Marmar JL Modified vasoepididymostomy with simultaneous double needle placement, tubulotomy and tubular invagination. : J Urol 2000, 163:483-486.
- Southwick GJ, Temple-Smith PD. Epididymal microsurgery: current techniques and new horizons. Microsurgery 1988, 9:266-277.
- Matthews GJ, Schlegel PN, Goldstein M Patency following microsurgical vasoepididymostomy and vasovasostomy: temporal consideration. J Urol 1995, 154:2070-2073.
- Jarow JP, Oates RD, Buch JP, Shaban SF, Sigman M Effect of level of anastomosis and quality of intraepididymal sperm on the outcome of end-to-side epididymovasostomy. Urology 1997, 49:590-595.
- Owen E, Kapila H. Vasectomy reversal: review of 475 microsurgical vasovasostomies. Med J Aust 1984, 40:398-400.
- Soonawala FB, Lal SS. Microsurgery in vasovasostomy. Indian J Urol 1984, 1:104-109.
- Lee HY. A 20-year experience with vasovasostomy. J Urol 1986, 136:413-415.
- Belker AM. Results of 1469 microsurgical vasectomy reversal by the vasovasostomy study group. J Urol 1991, 145:505-511.
- Friedler S et al: Testicular sperm retrieval by percutaneous fine needle sperm aspiration compared with testicular sperm extraction by open biopsy in men with non-obstructive azoospermia. Human Repod 1997;12(7):1488-1493.
- Repping S, Skaletsky H, Lange J, Silber S, Van Der Veen F, Oates R, Page D, Rozen S (2002). “Recombination between palindromes P5 and P1 on the human Y chromosome causes massive deletions and spermatogenic failure”. Am J Hum Genet 71 (4): 906–22.
- Ioulianos A, Sismani C, Fourouclas N, Patroclou T, Sergiou C, Patsalis P (2002). “A nation-based population screening for azoospermia factor deletions in Greek-Cypriot patients with severe spermatogenic failure and normal fertile controls, using a specific study and experimental design”. Int J Androl 25 (3): 153–8. doi:10.1046/j.1365-2605.2002.00340.x. PMID 12031043.
- Vogt P (2005). “AZF deletions and Y chromosomal haplogroups: history and update based on sequence”. Hum Reprod Update 11 (4): 319–36. doi:10.1093/humupd/dmi017.PMID 15890785.
- Navarro-Costa P, Gonçalves J, Plancha CE (March 2010). “The AZFc region of the Y chromosome: at the crossroads between genetic diversity and male infertility”. Hum Reprod Update 16 (5): 525–542. doi:10.1093/humupd/dmq005. PMC 2918367.PMID 20304777.
- Stouffs, K.; Lissens, W.; Tournaye, H.; Haentjens, P. (2010). “What about gr/gr deletions and male infertility? Systematic review and meta-analysis”. Human Reproduction Update17 (2): 197–209. doi:10.1093/humupd/dmq046. PMID 20959348. e
- Salvatore Raimondo, Andrea Di Luccio; Valerio Ventruto, La genetica nell’infertilità maschile, Napoli, Springer, 2008.
- Fernandes S., Huellen K., Goncalves J., Dukal H., Zeisler J., Rajpert De Meyts E., Skakkebaek N.E., Habermann B., Krause W., Sousa M., Barros A., Vogt P.H. (2002) High frequency of DAZ1/DAZ2 gene deletions in patients with severe oligozoospermia. Mol Hum Reprod. 8:286-98.
- Brandell RA et al: AZFb deletions predict the absence of spermatozoa with testicular sperm extraction: Human Reprod 1998;13;10:2812-2815
- Payne SR, Pryor JP, Parks CM. Vasography, its Indications and Complications. British Journal of Urology. Volume 57, Issue 2, pages 215–217, April 1985
- Kneeland JB, Auh YH, McCarron JP. Computed tomography, sonography, vesiculography, and MR imaging of a seminal vesicle cyst. J Comput Assist Tomogr. 1985 Sep-Oct;9(5):964-6. PMID 3897303
- ^ Arora SS, Breiman RS, Webb EM. CT and MRI of congenital anomalies of the seminal vesicles. AJR Am J Roentgenol. 2007 Jul;189(1):130-5.
- “Linee guida su: La azoospermia: terapia” G.M. Colpi, C. Bettocchi, G. Franco, E. Greco, A. Ortensi, L. Negri Giornale Italiano di Andrologia, 7, 79-103, 2000
- Farley S and Barnes R. Stenosis of the ejaculatory ducts treated by endoscopic resection. J Urol 1973, 109: 664-666.
- Popken G, Wetteraeuer U, Schultze-Seeman W, Deckart A, Sommerkamp H. Transurethral resection of cystic and non-cystic ejaculatory duct obstruction. Int J Androl 1998, 21:196-200.
- Vazquez-Levine MH, Dressler KP, Nagler HM. Urine contamination of seminal fluid after transurethral
- resection of the ejaculatory ducts. J Urol 1994, 152:2049-2052.
- Goluboff ET, Kaplan SA, Fish H. Seminal vesicle urinary reflux as a complication of transurethral resection of ejaculatory ducts. J Urol 1995, 153:1234-1235.
- Colpi GM. La terapia chirurgica. II Corso di aggiornamento “Il trattamento dell’infertilità maschile”
- Milano, 19 maggio 2000.
- Goluboff ET, Stifelman MD, Fish H. Ejaculatory duct obstruction in the infertile male. Urology 1995, 45:925-931.
- Lewin A1, Reubinoff B, Porat-Katz A, Weiss D, Eisenberg V, Arbel R, Bar-el H, Safran A. Testicular fine needle aspiration: the alternative method for sperm retrieval in non-obstructive azoospermia. Hum Reprod. 1999 Jul;14(7):1785-90.
- Friedler S1, Raziel A, Strassburger D, Soffer Y, Komarovsky D, Ron-El R. Testicular sperm retrieval by percutaneous fine needle sperm aspiration compared with testicular sperm extraction by open biopsy in men with non-obstructive azoospermia. Hum Reprod. 1997 Jul;12(7):1488-93.
- Chan PT, Palermo GD, Veeck LL, Rosenwaks Z, Schlegel PN. Testicular sperm extraction combined with intracytoplasmic sperm injection in the treatment of men with persistent azoospermia postchemotherapy. Cancer. 2001 Sep 15; 92(6):1632-7.
- Lee AP, Roth MY, Nya-Ngatchou JJ, Lin K, Walsh TJ, Page ST, Matsumoto AM, Bremner WJ, Amory JK, Anawalt BD1. Testicular fine-needle aspiration for the assessment of intratesticular hormone concentrations. Asian J Androl. 2016 Jan-Feb;18(1):21-4. doi: 10.4103/1008-682X.156637.
- Lorenzo Gómez MF. [Usefulness of fine needle aspiration puncture in the diagnosis of testicular neoplasms and in the study of testicular physiopathology]. Arch Esp Urol. 2000 Jul-Aug; 53(6):433-42.
- Testis Needle Aspiration of Sperm in Men With Azoospermia ClinicalTrials.gov 2015
- World Heath Organization. The epidemiology of infertility. WHO Tech. Rep. Ser. No 582 p5 1975.
- Cates W, Farley TMM, Rowe PJ. Worldwide patterns of infertility: Is Africa different’ Lancet 1985: ii. 596.
- Toren P, Oshima H. The male factor. New Engl J Med 1980; 303: 751.
- Fisch H, Lipshultz Ll. Diagnosing male factors of infertility. Arch Pathol Lab Med 1992: 116: 398
- Fisch H, Lipshultz Ll. Diagnosing male factors of infertility. Arch Pathol Lab Med 1992: 116: 398.
- Buch JP, Johansson SL. Testis biopsy in male infertility : Current status. In Lytton B (ed): Advances in Urology, Vol 5. St Louis: Mosby Year Book Inc, 1992; 209.
- Huhner M. Aspirations of the testicle in the diagnosis and prognosis of sterility. J Urol 1928; 19(1): 31
- Persson PS, Ahren C, Obrant KO. Aspiration biopsy smear of testis in azoospermia: cytology versus histological examination. Scand J Urol Nephrol 1971; 5: 22.
- Foresta C, Varotto A, Scandellari C. Assessment of testicular cytology by fine needle aspiration as a diagnostic parameter in the evaluation of the azoospermic subject. Ferti Steril 1992; 57: 858.
- Odabas 0, Ugras S, Aydin S, et al. Assessment of testicular cytology by fine needle aspiration and the imprint technique : are they reliable diagnostic modalities? Br J Urol 1997; 79: 445.
- Yadav SP, Gopal M, Chadha I, et al. Comparative evaluation of the needle aspiration cytology and biopsy of testis in diagnosis of male infertility. Journal of Indian Medical Association 1997; 95(5): 129-34.
- Gottschalk-Sabag S, Glick T, Weiss DB. Fine needle aspiration of the testis and correlation with testicular open biopsy. Acta Cytol 1993;37:67.
- SCHLEGEL, P.N.; GIRARDI, S.K.: “Clinical review: in vitro fertilization for male factor infertility”. J.Clin. Endocrinol. Metab., 82: 709, 1997.
- LANIA, C.; GRASSO, M.; DE SANTIS, L. et al:“Nuova tecnica per recupero seminale con minimo
approccio chirurgico”. Abs. XXI Congress of Italian Society of Andrology. Italian Journal of Andrology,
11-4:135, 2004.