L’insufficienza respiratoria cronica (IRC) è una condizione patologica caratterizzata dall’incapacità dei polmoni di mantenere livelli normali di gas (O² e CO²) nel sangue, in tal senso l’IRC può presentarsi come  ipossiemica semplice (Pa O2 <60 mmHg) o IRC ipossiemica-ipercapnica (Pa O2 <60 mmHg e Pa CO2 >50 mm Hg).
ipossiemica semplice (Pa O2 <60 mmHg) o IRC ipossiemica-ipercapnica (Pa O2 <60 mmHg e Pa CO2 >50 mm Hg).
Il quadro di cronicità può presentare riacutizzazioni che possono metter anche a repentaglio la vita del paziente necessitando di stretto monitoraggio, cura e riabilitazione.
Classificazione eziologica di insufficienza respiratoria cronica
- Insufficienza respiratoria ostruttiva: deriva da un’ostruzione parziale delle vie aeree che riduce il flusso di ossigeno. Tre malattie polmonari possono essere associate a questa tipologia di insufficienza respiratoria come: broncopneumopatia cronica ostruttiva (BPCO), asma ed enfisema.
- Insufficienza respiratoria restrittiva: correlata a una diminuzione della capacità polmonare, che può essere causata da danni alla pompa respiratoria (gabbia toracica e muscoli respiratori) e alterazioni del centro respiratorio nel cervello.
EZIOLOGIA –
Il più delle volte l’IRC è dovuta alla broncopneumopatia cronica ostruttiva (BPCO) associata nella maggior parte dei casi al fumo o all’esposizione professionale a sostanze inquinanti. Ma varie malattie possono anche causare carenza di ossigeno: malattie polmonari interstiziali, fibrosi cistica, asma cronico grave, malattie cardiache congenite, carcinoma polmonare avanzato, ipertensione polmonare, abuso di benzodiazepine, paralisi dei centri bulbari, la sclerosi laterale amiotrofica (SLA), la sindrome obesità-ipoventilazione (o sindrome di Pickwick), l’ipertensione polmonare, le malattie cardiache congenite o croniche ingravescenti.
SINTOMATOLOGIA
I principali segni fisici di fatica ventilatoria sono la dispnea, tachipnea, l’uso vigoroso dei muscoli ventilatori accessori, , la diminuzione del volume respiratorio, un respiro irregolare o boccheggiante, la tachicardia e il movimento paradosso dell’addome. Una certa alterazione dello stato di coscienza e la sonnolenza sono tipici e la confusione è comune.
DIAGNOSTICA STRUMENTAL E DI LABORATORIO
- L’ossimetria è la stima della quantità di ossigeno nel sangue o della saturazione di ossigeno (SpO²). Questo test può indicare se il livello di ossigeno nel sangue è troppo basso (SpO2²<88%).
- L’emogas analisi arteriosa consente di misurare con precisione le quantità di O² (o PaO²) e di anidride carbonica (o PaCO²) presenti nel sangue.
- Spirometria e test di funzionalità polmonare: valuta la capacità e i volumi polmonari al fine di rilevarne il tipo e la gravità.
- Valutazione cardiaca mediante elettrocardiogramma ed ecografia.
- Tra le indagini aggiuntive ci sono: l’imaging, la misura dei volumi polmonari e la capacità di diffusione, il test di tolleranza allo sforzo, le misure di forza dei muscoli respiratori (MIP e MEP), l’endoscopia delle vie aeree, l’ecografia toracica, l’ecocardiografia.
TERAPIA –
Broncodilatatori – I broncodilatatori sono attualmente i principali farmaci nella terapia della broncopneumopatia cronica ostruttiva. I broncodilatatori sono costituiti da
- farmaci β2-agonisti selettivi a breve durata di azione (salbutamolo, metaproterenolo, terbutalina, bambuterolo, pirbuterolo, isoetarina, bitolterolo, fenoterolo) o
- farmaci β2-agonisti selettivi a lunga durata di azione (salmeterolo, formoterolo), farmaci anticolinergici antimuscarinici (ipratropio bromuro, oxitropio bromuro, tiotropio bromuro) e
- metilxantine (teofillina).
Uno dei principali effetti terapeutici dei broncodilatatori, almeno nella broncopneumopatia cronica ostruttiva grave, consiste nel migliorare lo svuotamento dei polmoni durante la fase espiratoria.
I farmaci β2-agonisti selettivi agiscono principalmente mediante stimolazione dei recettori β2-drenergici sulle cellule della muscolatura liscia bronchiale ed, in definitiva, riduzione della interazione dei filamenti di actina e miosina con conseguente effetto broncodilatatore.
I farmaci antimuscarinici somministrati come broncodilatatori sono antagonisti non selettivi dei recettori colinergici muscarinici. Il loro effetto sull’ostruzione bronchiale è principalmente dovuto all’antagonismo di recettori muscarinici M3 su cellule muscolari lisce bronchiali con conseguente effetto broncodilatatore e di recettori muscarinici M3 su cellule delle ghiandole sottomucose con riduzione dell’attività parasimpatica colinergica basale e sotto stimolo e conseguente riduzione dell’ostruzione bronchiale. A differenza dell’atropina, i broncodilatatori antimuscarinici non hanno effetti inibitori sulla clearance mucociliare.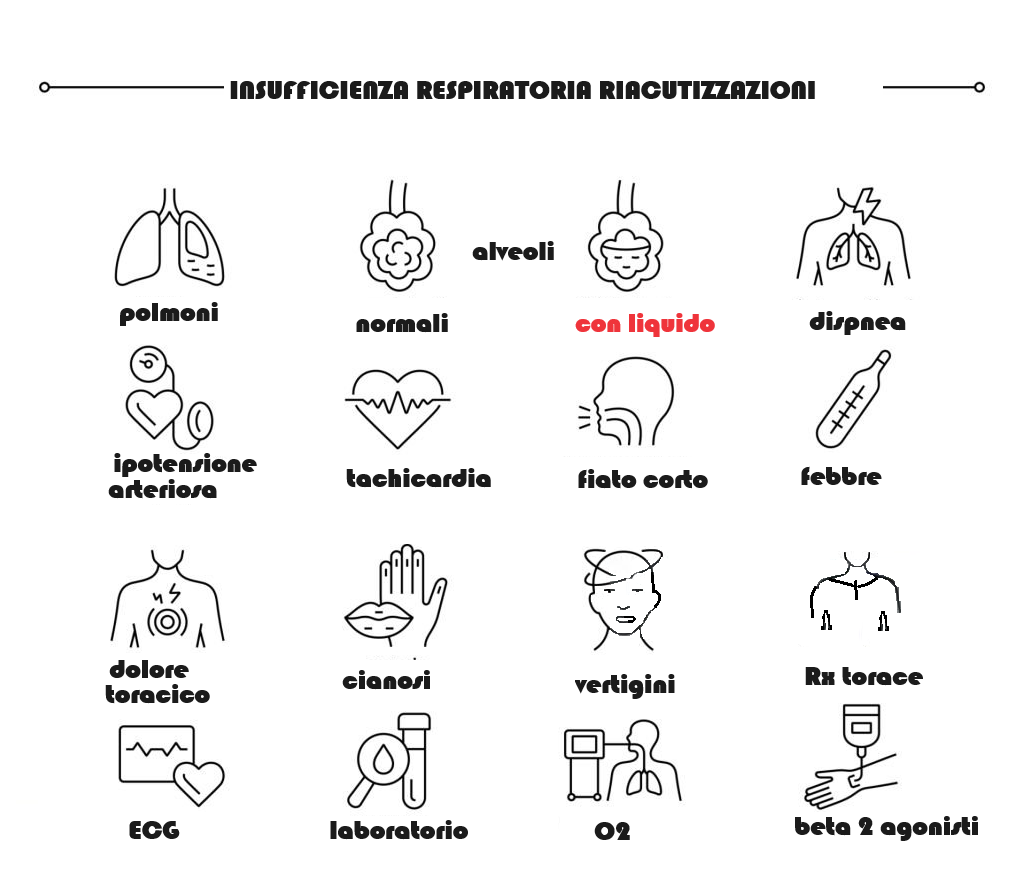
La teofillina, una metilxantina, è tra i farmaci broncodilatatori meno costosi. Essendo la sua solubilità in
acqua molto bassa, la teofillina è somministrata per via iniettiva come aminofillina, una miscela di teofillina ed etilendiammina, che è 20 volte più solubile della teofillina. L’effetto broncodilatatore della teofillina è dovuto alla inibizione relativamente non selettiva delle fosfodiesterasi dei nucleotidi ciclici e all’antagonismo competitivo dei recettori dell’adenosina. La teofillina si somministra generalmente per os in formulazioni convenzionali o, più frequentemente, a rilascio controllato o per via endovenosa (come aminofillina). La teofillina ha una insorgenza di azione farmacologica lenta e, generalmente, è indicata come terapia di mantenimento piuttosto che per risolvere rapidamente la sintomatologia.
I glucocorticoidi per via inalatoria attualmente disponibili in Italia sono costituiti da beclometasone dipropionato, budesonide, flunisolide, fluticasone propionato, triamcinolone acetonide. I glucocorticoidi non provocano rilasciamento della muscolatura liscia bronchiale e, pertanto, non hanno effetto sulla broncocostrizione acuta.
Il meccanismo dell’azione antinfiammatoria dei glucocorticoidi è dovuto, in gran parte, alla inibizione dell’espressione di geni che codificano per citochine proinfiammatorie nelle cellule infiammatorie delle vie respiratorie.
Antibiotici – Molti studi controllati su larga scala hanno dimostrato che la profilassi antibiotica o la somministrazione cronica di antibiotici non hanno alcun effetto sulla frequenza delle riacutizzazioni di broncopneumopatia cronica ostruttiva. Analogamente, la profilassi antibiotica durante il periodo invernale è inefficace. Pertanto, i dati attualmente disponibili non sostengono l’efficacia della profilassi antibiotica contro le infezioni batteriche o le riacutizzazioni di broncopneumopatia cronica ostruttiva.
Le indicazioni per la terapia domiciliare con ossigeno sono cambiate negli ultimi cinque anni ed i dati attuali indicano che nei pazienti con minore ipossia e nei pazienti con desaturzione notturna isolata con pressioni parziali dei gas maggiormente mantenute durante il giorno, la terapia domiciliare con ossigeno non è efficace. Questo è probabilmente dovuto alla lenta velocità di riduzione della emodinamica polmonare osservata in questi pazienti. Al contrario, la somministrazione di ossigeno durante l’esercizio fisico migliora la tolleranza allo sforzo diminuendo l’iperinflazione dinamica anche nei pazienti che non hanno desaturazione.
References:
- Anthonisen NR, Connett JE, Kiley JP, Altose MD, Bailey WC, Buist AS, Conway WA Jr, Enright PL, Kanner RE, O’Hara P, et al. Effects of smoking intervention and the use of an inhaled
anticholinergic bronchodilator on the rate of decline of FEV1. The Lung Health Study. JAMA 1994;272:1497-505. - Pauwels RA, Lofdahl CG, Laitinen LA, Schouten JP, Postma DS, Pride NB, Ohlsson SV. Long-term treatment with inhaled budesonide in persons with mild chronic obstructive pulmonary disease who continue smoking. European Respiratory Society Study on Chronic Obstructive Pulmonary Disease. N Engl J Med 1999;340:1948-53.
- Vestbo J, Sorensen T, Lange P, Brix A, Torre P, Viskum K. Long-term effect of inhaled budesonide in mild and moderate chronic obstructive pulmonary disease: a randomised controlled trial. Lancet 1999;353:1819-23. 568 Paolo MONTUSCHI LA TERAPIA FARMACOLOGICA DELLA BRONCOPNEUMOPATIA CRONICA OSTRUTTIVA
- Burge PS, Calverley PM, Jones PW, Spencer S, Anderson JA, Maslen TK. Randomised, double blind, placebo controlled study of fluticasone propionate in patients with moderate to severe chronic obstructive pulmonary disease: the ISOLDE trial. BMJ 2000;320:1297-303.
- Global Initiative for Chronic Obstructive Lung Disease. Global strategy for the diagnosis, management, and prevention of chronic obstructive pulmonary disease. National Institutes of
Health. National Heart, Lung, and Blood Institute; 2001. - Jorenby DE, Leischow SJ, Nides MA, Rennard SI, Johnston JA, Hughes AR, Smith SS, Muramoto ML, Daughton DM, Doan K, Fiore MC, Baker TB. A controlled trial of sustained-release bupropion, a nicotine patch, or both for smoking cessation. N Engl J Med 1999;340:685-91.
- Tashkin D, Kanner R, Bailey W, Buist S, Anderson P, Nides M, Gonzales D, Dozier G, Patel MK, Jamerson B. Smoking cessation in patients with chronic obstructive pulmonary disease: a double-blind, placebo-controlled, randomised trial. Lancet 2001;357:1571-5.
- American Thoracic Society. Pulmonary rehabilitation – 1999. Am J Respir Crit Care Med 1999;159:1666-82.
- British Thoracic Society. Pulmonary rehabilitation. Thorax 2001;56:827-34.
- Lacasse Y, Brosseau L, Milne S, Martin S, Wong E, Guyatt GH, Goldstein RS. Pulmonary rehabilitation for chronic obstructive pulmonary disease. Cochrane Database Syst Rev 2002;CD003793.
- Crockett AJ, Cranston JM, Moss JR, Alpers JH. A review of long-term oxygen therapy for chronic obstructive pulmonary disease. Respir Med 2001;95:437-43.
- Cooper JD. Clinical trials and future prospects for lung volume reduction surgery. Semin Thorac Cardiovasc Surg 2002;14:365-70.
- Fishman A, Martinez F, Naunheim K, Piantadosi S, Wise R, Ries A, Weinmann G, Wood DE. National Emphysema Treatment Trial Research Group. A randomized trial comparing lungvolume-reduction surgery with medical therapy for severe emphysema. N Engl J Med 2003;348:2059-73.
- Respiratory system. In: British National Formulary. 45. ed. London: Pharmaceutical Press; 2003. p. 131-65.
- Cuvelier A, Muir JF, Benhamou D, Weitzenblum E, Zuck P, Delacenserie R, Taytard A, Iacono P. Dry powder ipratropium bromide is as safe and effective as metered-dose inhaler formulation: a cumulative dose-response study in chronic obstructive pulmonary disease patients. Respir Care
2002;47:159-66. - Ikeda A, Nishimura K, Koyama H, Tsukino M, Hajiro T, Mishima M, Izumi T. Comparison of the bronchodilator effects of salbutamol delivered via a metered-dose inhaler with spacer, a dry-powder inhaler, and a jet nebulizer in patients with chronic obstructive pulmonary disease. Respiration 1999;66:119-23.
- Vathenen AS, Britton JR, Ebden P, Cookson JB, Wharrad HJ, Tattersfield AE. High-dose inhaled albuterol in severe chronic airflow limitation. Am Rev Respir Dis 1988;138:850-5.
- Gross NJ, Petty TL, Friedman M, Skorodin MS, Silvers GW, Donohue JF. Dose response to ipratropium as a nebulized solution in patients with chronic obstructive pulmonary disease. A three-center study. Am Rev Respir Dis 1989;139:1188-91.
- Chrystyn H, Mulley BA, Peake MD. Dose response relation to oral theophylline in severe chronic obstructive airways disease. BMJ 1988;297:1506-10.
- Belman MJ, Botnick WC, Shin JW. Inhaled bronchodilators reduce dynamic hyperinflation during exercise in patients with chronic obstructive pulmonary disease. Am J Respir Crit Care Med 1996;153:967-75.
- Hay JG, Stone P, Carter J, Church S, Eyre-Brook A, Pearson MG, Woodcock AA, Calverley PM. Bronchodilator reversibility, exercise performance and breathlessness in stable chronic obstructive pulmonary disease. Eur Respir J 1992;5:659-64.
- Berger R, Smith D. Effect of inhaled metaproterenol on exercise performance in patients with stable “fixed” airway obstruction. Am Rev Respir Dis 1988;138:624-9.
- Undem, JB, Lichenstein LM. Drugs used in the treatment of asthma. In: Hardman JG, Limbird LE, Goodman Gilman A (Ed.). The pharmacological basis of therapeutics. 10. ed. New York: McGraw-Hill; 2001. p. 733-54.
- Johnson M, Coleman RA. Mechanisms of action of β2 adrenoceptor agonists. In: Busse, WW, Holgate, ST (Ed.). Asthma and rhinitis. Cambridge: Blackwell Scientific Publications; 1995. p. 1278-95.
- Kume H, Hall IP, Washabau RJ, Takagi K, Kotlikoff MI. Betaadrenergic agonists regulate KCa channels in airway smooth muscle by cAMP-dependent and -independent mechanisms. J Clin Invest 1994;93:371-9.
- Hughes JM, Seale JP, Temple DM. Effect of fenoterol on immunological release of leukotrienes and histamine from human lung in vitro: selective antagonism by β-adrenoceptor antagonists. Eur J Pharmacol 1983;95:239-45.
- Barnes PJ. Effect of β-agonists on inflammatory cells. J Allergy Clin Immunol 1999;104:S10-7.
- Seale JP. Whither β-adrenoceptor agonists in the treatment of asthma. Prog Clin Biol Res 1988;263:367-77.
- Calverley PM. The future for tiotropium. Chest 2000;117(2 Suppl):67S-9S.
- van Schayck CP, Dompeling E, van Herwaarden CL, Folgering H, Verbeek AL, van der Hoogen HJ, van Weel C. Bronchodilator treatment in moderate asthma or chronic bronchitis: continuous or on demand? A randomised controlled study. BMJ 1991;303:1426-31.
- Barnes PJ. Theophylline: new perspectives for an old drug. Am J Respir Crit Care Med 2003;167:813-8.
- Soderling SH, Beavo JA. Regulation of cAMP and cGMP signaling: new phosphodiesterases and new functions. Curr Opin Cell Biol 2000;12:174-9.
- Torphy TJ, Undem BJ, Cieslinski LB, Luttmann MA, Reeves ML, Hay DW. Identification, characterization and functional role of phosphodiesterase isozymes in human airway smooth muscle. J Pharmacol Exp Ther 1993;265:1213-23.
- Feoktistov I, Polosa R, Holgate ST, Biaggioni I. Adenosine A2B receptors: a novel therapeutic target in asthma? Trends Pharmacol Sci 1998;19:148-53.
- The Lung Health Study Research Group II. Effect of inhaled triamcinolone on the decline in pulmonary function in chronic obstructive pulmonary disease. N Engl J Med 2000;343:1902-9.569
- Barnes PJ. Inhaled corticosteroids are not beneficial in chronic obstructive pulmonary disease. Am J Respir Crit Care Med 2000;161:342-4.
- Confalonieri M, Mainardi E, Della Porta R, Bernorio S, Gandola L, Beghe B, Spanevello A. Inhaled corticosteroids reduce neutrophilic bronchial inflammation in patients with chronic obstructive pulmonary disease. Thorax 1998;53:583-5.
- Keatings VM, Jatakanon A, Worsdell YM, Barnes PJ. Effects of inhaled and oral glucocorticoids on inflammatory indices in asthma and COPD. Am J Respir Crit Care Med 1997;155:542-8.
- Paggiaro PL, Dahle R, Bakran I, Frith L, Hollingworth K, Efthimiou J. Multicentre randomised placebo-controlled trial of inhaled fluticasone propionate in patients with chronic obstructive pulmonary disease. International COPD Study Group. Lancet 1998;351:773-80.
- MacNee W, Calverley PM. Chronic obstructive pulmonary disease. 7. Management of COPD. Thorax 2003;58:261-5.