Ultimo aggiornamento 2019-12-24 19:59:05
Le cefalosporine sono un gruppo di antibiotici beta-lattamici, battericidi, di estrazione vegetale o semisintetici, resistenti alle più comuni β-lattamasi, che agiscono con un meccanismo d’azione simile alle penicilline, bloccando cioè la sintesi della parete batterica, attivi soprattutto sui gram positivi ma anche gram negativi.
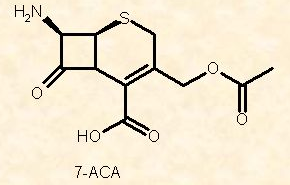 Origine delle cefalosporine – Le cefalosporine hanno origini naturali. La cefalosporina C è il capostipite di questa classe di antibiotici. Essa fu scoperta nel 1945 da Giuseppe Brotzu quando egli riuscì ad isolare, dalle acque marine inquinate, una moniliacea del genere Cephalosporium, in seguito identificata come Cephalosporium acremonium. Da questa monilia ricavò la cefalosporina C, dotata di attività antibatterica in vitro ad ampio spettro. Ma non era sufficientemente attiva per poter essere immessa in terapia come tale. Perciò furono apportate delle modifiche alla sua struttura fino a che non si riuscì ad isolare il nucleo principale: l’acido 7-amminocefalosporanico (7-ACA). Nel corso degli anni ottanta, furono apportate numerose modifiche al nucleo 7-ACA consentendo così lo sviluppo di cefalosporine più efficaci rispetto al loro precursore naturale e con uno spettro d’azione più ampio.
Origine delle cefalosporine – Le cefalosporine hanno origini naturali. La cefalosporina C è il capostipite di questa classe di antibiotici. Essa fu scoperta nel 1945 da Giuseppe Brotzu quando egli riuscì ad isolare, dalle acque marine inquinate, una moniliacea del genere Cephalosporium, in seguito identificata come Cephalosporium acremonium. Da questa monilia ricavò la cefalosporina C, dotata di attività antibatterica in vitro ad ampio spettro. Ma non era sufficientemente attiva per poter essere immessa in terapia come tale. Perciò furono apportate delle modifiche alla sua struttura fino a che non si riuscì ad isolare il nucleo principale: l’acido 7-amminocefalosporanico (7-ACA). Nel corso degli anni ottanta, furono apportate numerose modifiche al nucleo 7-ACA consentendo così lo sviluppo di cefalosporine più efficaci rispetto al loro precursore naturale e con uno spettro d’azione più ampio.
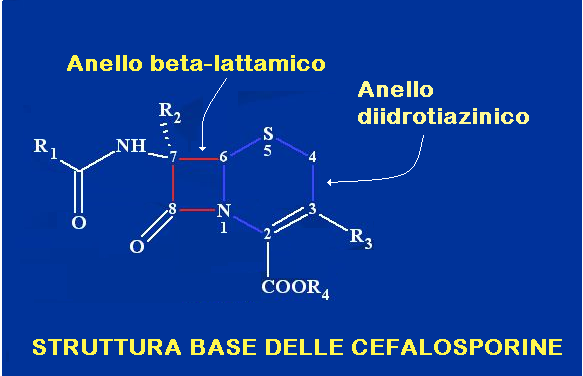
Struttura base delle cefalosporine – è simile a quella delle penicilline; è una struttura composta da due anelli: un anello β-lattamico e un anello diidrotiazinico. Il gruppo beta-lattamico inibisce la crescita dei batteri, ostacolando la sintesi del peptidoglicano, un componente fondamentale della parete batterica. L’altro componente che caratterizza le cefalosporine è il nucleo diidrotiazinico, che le differenzia dalle penicilline. Sia all’anello beta-lattamico che a quello diidrotiazinico sono legate delle catene laterali, la modifica delle quali consente di ottenere un gran numero di derivati cefemici.
Efficacia delle cefalosporine – Le cefalosporine sono molto efficaci nel trattamento di:
- Infezioni dell’apparato respiratorio superiore e inferiore;
- Infezioni della cute e dei tessuti molli;
- Infezioni ossee e articolari;
- Setticemie;
- Endocarditi di origine infettiva;
- Infezioni addominali e delle vie biliari.
Le cefalosporine penetrano facilmente nella maggior parte dei liquidi corporei e nel liquido extracellulare della maggior parte dei tessuti, compresi quello pleurico, pericardico e sinoviale e la flogosi ne aumenta la diffusione. Tuttavia,nel liquido cerebrospinale le uniche cefalosporine che raggiungono livelli elevati utili per il trattamento di meningite sono quelle di IIIa e IVa generazione:
- Cefotaxime (Zariviz®, IIa generazione)
- Ceftriaxone (Rocefin®, IIIa generazione)
- Ceftazidima (Glazidim®, IIIa generazione)
- Cefepime (Maxipime®, IVa generazione)
Tutte le cefalosporine hanno una scarsa penetrazione nel compartimento intracellulare e nell’umor vitreo.
Meccanismo d’azione
Le cefalosporine agiscono inibendo la sintesi della parete cellulare batterica, in particolare del peptidoglicano, un polimero costituito da catene parallele di carboidrati azotati, unite fra loro da legami trasversali.
Le cefalosporine si legano alla transammidasi, l’enzima implicato nella formazione dei suddetti legami trasversali. L’interazione cefalosporina-transammidasi impedisce la formazione di questi legami, generando così delle zone deboli all’interno della struttura peptidoglicanica che conducono a lisi cellulare e alla conseguente morte della cellula batterica.
Escrezione – La maggior parte delle cefalosporine viene escreta per via urinaria, pertanto le loro dosi devono essere personalizzate nei pazienti con insufficienza renale. Cefoperazone (Cefobid®) e ceftriaxone (Rocefin®), fanno eccezione perchè sono eliminate prevalentemente per via biliare.
Classificazione
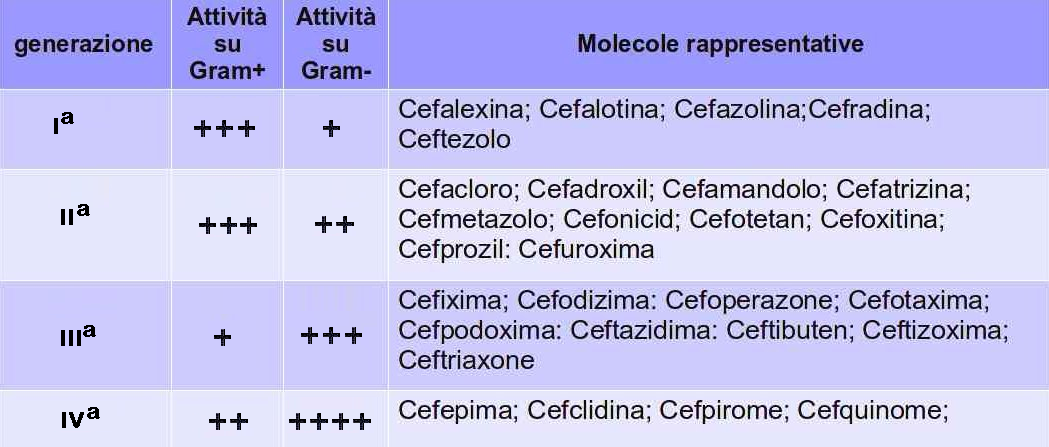
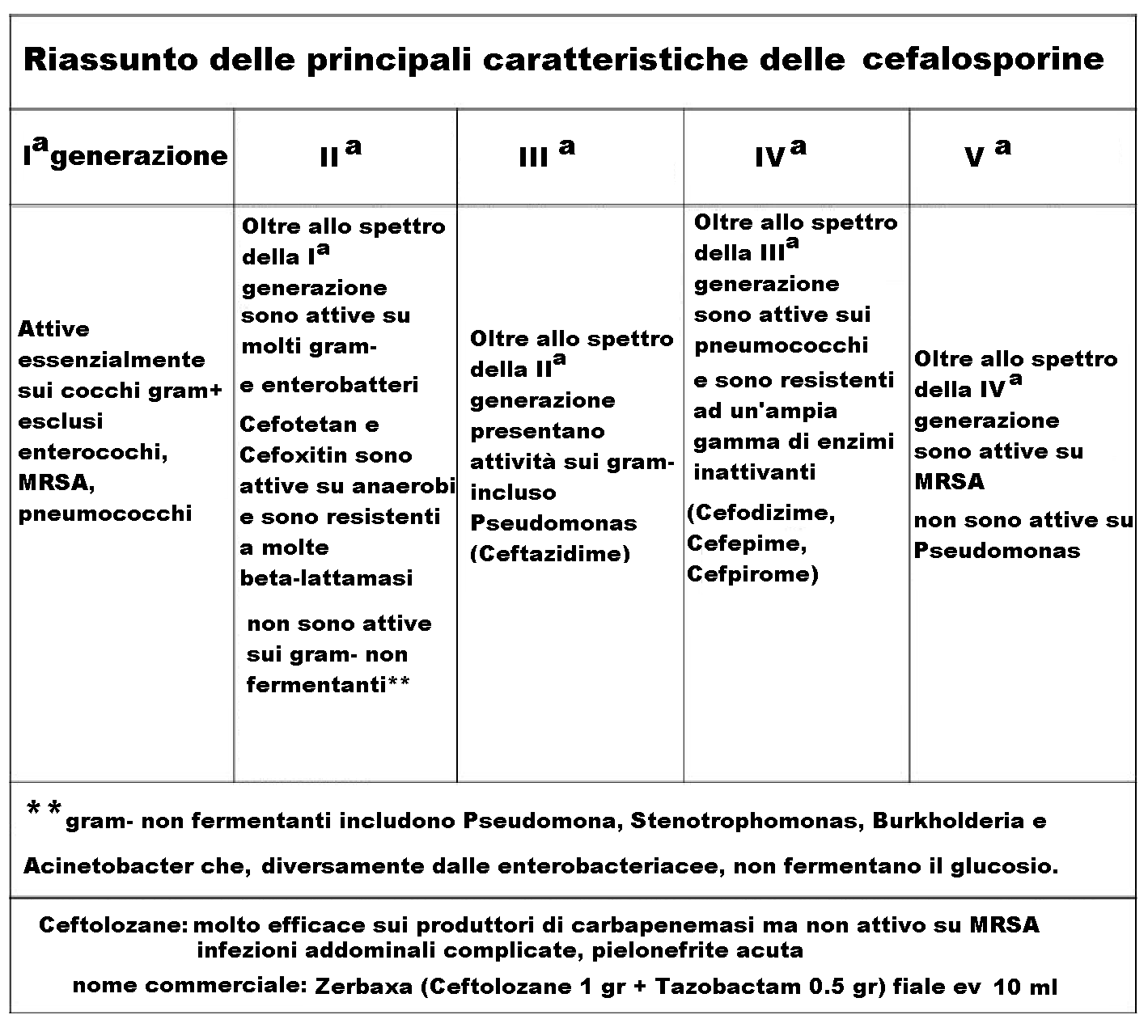
Le cefalosporine possono essere suddivise in 5 generazioni, in funzione del loro spettro d’azione.
CEFALOSPORINE DI PRIMA GENERAZIONE
Questi farmaci hanno un’eccellente attività contro Cocchi Gram-positivi e sono comunemente utilizzate in alternativa alle penicilline per le infezioni non complicate della cute e dei tessuti molli, che sono generalmente dovute a stafilococchi e streptococchi. Fanno eccezione lo streptococco pneumoniae resistente alle penicilline e lo stafilococco resistente alla meticillina.
La cefazolina parenterale (Cefamezin® fl 250, 500 mg intramuscolo, 1 gr im/ev) è utilizzata spesso per l’endocardite da S. aureus meticillino-sensibile e per la profilassi in chirurgia cardiotoracica, ortopedica, addominale e pelvica. Altre cefalosporine di prima generazione sono la cefalexina (Keforal® caps 500 mg, 1 gr, Ceporex® caps 1 gr), cefradina (Planocid® cpr 1 gr).
CEFALOSPORINE DI SECONDA GENERAZIONE
Sono efficaci contro i batteri Gram-positivi come quelle di prima generazione, ma presentano un’efficacia maggiore nei confronti dei Gram-negativi.
Fanno parte di questa categoria il cefamandolo, il cefonicid, la cefuroxima, la cefoxitina, il cafotetan, il cafaclor, il loracarbef e il cefprozil. La cefotaxima (Zariviz® fl) e la cefixima (Unixime® Cefixoral® cps 400 mg) sono i farmaci di prima scelta nella terapia dello streptococco.
CEFALOSPORINE DI TERZA GENERAZIONE
Possiedono un’efficacia ridotta nei confronti degli stafilococchi (batteri Gram-positivi), ma possiedono una maggior attività contro i Gram-negativi rispetto alle cefalosporine di prima e seconda generazione.
Appartengono a questa categoria la cefotaxima, la ceftizoxima, il ceftriaxone, la ceftazidima, il cefoperazone, la cefixima (Cefixoral® cpr 400 mg), il ceftibuten, la cefpodoxima, il cefdinir e il cefditoren. Il ceftriaxone (Rocefin®, Fidato®) è la cefalosporina di IIIa generazione dotata di più lunga emivita. Ceftazidime (Glazidim® fl 250 mg, 500 mg fl im, 1 gr, 2 gr im/infusione) è il composto più attivo su Pseudomonas aeruginosa.
CEFALOSPORINE DI QUARTA GENERAZIONE
Hanno uno spettro d’azione molto simile a quello delle cefalosporine di terza generazione, ma sono attive anche contro alcuni tipi di enterobatteri resistenti a queste ultime.
Cefepima (Maxipime® 500 mg, 1 gr), cefalosporina di IVa generazione, risulta particolarmente attivo contro lo Stafilococco aureo.
CEFALOSPORINE DI QUINTA GENERAZIONE
Ceftbriole, ancora in fase di studio, attività su MRSA (Staphylococcus aureus meticillino-resistente)
ma non su Pseudomonas aeruginosa. Approvata dalla FDA americana ma non ancora in Europa dove sono state richieste ulteriori sperimentazioni cliniche.
Effetti Collaterali
Gli effetti collaterali che compaiono più di frequente durante il trattamento con cefalosporine sono nausea lieve e temporanea, vomito e diarrea. Tali effetti sono da attribuire all’interazione del farmaco con la normale flora batterica intestinale.
Più raramente, può insorgere diarrea severa dovuta a colite pseudomembranosa. Tale effetto è da imputarsi a un’infezione da Clostridium difficile, un patogeno anaerobio opportunistico. Questo patogeno si trova normalmente nel microbiota umano e la sua crescita è tenuta sotto controllo da altri batteri facenti parte della flora batterica stessa. Tuttavia, in seguito a una terapia antibiotica – soprattutto se di lunga durata – i batteri responsabili del controllo della crescita del C. difficile possono essere distrutti; ciò permette al patogeno di prendere il sopravvento e instaurare un’infezione.
Altri effetti collaterali:
- reazioni locali: flebite, tromboflebite, dolore, indurimento e fragilità nella sede d’iniezione;
- disturbi gastrointestinali: nausea, vomito, diarrea, dolori addominali;
- disturbi dermatologici: esantema, orticaria, dermatiti;
- disturbi neurologici: cefalea, vertigini;
- anomalie ematologiche: eosinofilia, neutropenia, trombocitosi, fenomeni emorragici;
- disturbi a carico del sistema nervoso centrale: nervosismo, disturbi del sonno, confusione, sensazione di stordimento;
- anomalie nella funzionalità epatica;
- anomalie nella funzionalità renale;
Reazioni allergiche
Le cefalosporine possono scatenare reazioni allergiche: orticaria, reazioni anafilattiche, ipotensione, broncospasmo, laringospasmo. Esse compaiono meno frequentemente rispetto alle penicilline e perciò le cefalosporine possono essere somministrate anche a pazienti con una storia di reazioni allergiche lievi o ritardate alle penicilline.
Tuttavia, in pazienti che hanno avuto episodi acuti e gravi d’intolleranza alle penicilline l’uso delle cefalosporine è controindicato.
References:
- Tilli Tansey; Lois Reynolds, eds. (2000), Post Penicillin Antibiotics: From acceptance to resistance?, Wellcome Witnesses to Contemporary Medicine, History of Modern Biomedicine Research Group,
- Dash CH (1975). “Penicillin allergy and the cephalosporins”. J. Antimicrob. Chemother. 1 (3 Suppl): 107–18.
- Pegler S, Healy B (10 November 2007). “In patients allergic to penicillin, consider second and third generation cephalosporins for life threatening infections”. BMJ. 335 (7627): 991.
- Rossi S, editor. Australian Medicines Handbook 2006. Adelaide: Australian Medicines Handbook; 2006.
- Pichichero ME (2006). “Cephalosporins can be prescribed safely for penicillin-allergic patients” (PDF). The Journal of Family Practice. 55 (2): 106–12.
- Cephalosporins and other beta-lactams”. British National Formulary (56 ed.). London: BMJ Publishing Group Ltd and Royal Pharmaceutical Society Publishing. September 2008. p. 295.
- Kitson TM (1987). “The effect of cephalosporin antibiotics on alcohol metabolism: a review”. Alcohol. 4 (3): 143–148.
- Shearer MJ; Bechtold H; Andrassy K; et al. (1988). “Mechanism of cephalosporin-induced hypoprothrombinemia: relation to cephalosporin side chain, vitamin K metabolism, and vitamin K status”. Journal of Clinical Pharmacology. 28 (1): 88–95.
- Ghuyesen JM. Serine b-lactamases and penicillin-binding proteins. Annu Rev Microbiol. 1991, 45:35-67.
- Bayles KW. The bactericidal action of penicillin: New clues to an unsolved mistery. Trends Microbiol. 2000, 8:81274-81278.
- Carratalà J, Alcaide F, Fernandez-Sevilla A, et al. Bacteremia due to viridans streptococci that are highly resistano to penicillin: Increase among neutropenic patients with cancer. Clin Infect Dis. 1995, 20:1169-1173.
- Spratt BG. Resistance to antibiotics mediated by target alterations. Science 1994, 264:388-393.
- Jacoby GA. Prevalence and resistance mechanisms of common bacterial respiratory pathogens. Clin Infect Dis 1994, 18:951-957.
- Nakae T. Outer-membrane permeability of bacteria. Crit Rev microbial. 1986, 13:1-62.
- Nikaido H. Prevention of drug access to bacterial targets: Permeability barriers and active efflux. Science. 1994, 264:382-388.
- Nikaido H. Antibiotic resistance caused by gram-negative multidrug efflux pump. Clin Infect Dis. 1998, 27(suppl. I):S32-S41.
- Bush K. New b-lactamases in gram-negative bacteria Diversity and impact on the selection of antimicrobial therapy. Clin Infect Dis. 2001, 32:1085-1089.
- Davies J. Inactivation of antibiotics and the dissemination of resistance genes. Science. 1994, 264-375-382.
- Donlan RM. Biofilm formation: A clinically relevant microbiologic process. Clin Infect Dis. 2001, 33:1387-1392.
- Karchmer AW. Cephalosporins. In, Mandell, Douglas, and Bennet’s Principles and Practice of Infectious Diseases. 5th ed. (Mandell, GL, Bennet JE, and Dolin R, eds.) Churchill Livingstone, Philadelphia, 2000, pp.274-291.
- Bennet S, Wise R, Weston D, and Dent J. Pharmacokinetics and tissue penetration of ticarcillin combined with clavulanic acid. Antimicrob Agents Chemother. 1983, 23:831-834.
- Kammer RB. Host effects of b-lactam antibiotics. In, Contemporary Issues in Infectious diseases, Vol. I: New Dimensions in Antimicrobial Therapy. (Root RK, and Sande MA, eds.) Churchill Livingstone, New York, 1984, pp.101-119.
- Wade JC, Smith CR, Petty BG, et al. Cephalotin plus an aminoglycoside is more neohrotoxic than methicillin plus an aminoglycoside. Lancet. 1978, 2:604-606.
- Bank NU, Kammer RB. Hematologic complications associated with b-lactam antibiotics. Rev Infect Dis. 1983, 5:S380-S398.
- Sattler FR, Weitekamp MR, Ballard JO. Potential for bleeding with the new b-lactam antibiotics. Annu Intern Med. 1986, 105-924-931.
- Medical Letter. Choice of antibacterial drugs: Treatment guidelines. Med Lett. 2004, 2:13-26.19) Friedland IR, McCracken GH, Jr. Management of infections caused by antibiotic-resistant Streptococcus pneumoniae. New Engl J Med. 1994, 331:377-382.
- Quagliarello V, Scheld VM. Drug therapy: Treatment of bacterial meningitis. New Engl J Med. 1997, 336:708-716.
- Jones RN, Pfaller RA, Doern GV, Erwin ME, Hollis RJ. Antimicrobial activity and spectrum investigation of eight broad-spectrum b-lactam drugs: A 1997 surveillance trial in 102 medical centers in the United States. Cefepime study group. Diagn Microbiol Infect Dis. 1998, 30:215-228.
- Sullivan TJ, Wedner HJ, Schatz GS, Yecies LD, Parker CW. Skin testing to detect penicillin allergy. J Allergy Clin Immunol. 1981, 68:171-180.
- Greenberger PA. Patterns of anti-penicillin IgE antibodies in 634 penicillin allergenic patients. J Invest Med. 2001, 49:303A.
- Sogn D, Evans R III, Shepherd GM, Casale TB, Condemi G, Greenberger PA, et al. Results of the national Institute of allergy and Infectious diseases collaborative clinical trial to test the predictive value of skin testing with major and minor penicillin derivatives in hospitalized adults. Arch Intern Med. 1992, 152:1025-1032.
- Solensky R, Earl HS, Grichalla RS. Penicillin allergy: prevalence of vague history in skin test-positive patients. Ann Allergy Asthma Immunol. 2000, 85:195-199.
- Macy E, Mangat R, Bruchette RJ. Penicillin skin testing in advance of need: multiyear follow-up in 568 test result-negative subjects exposed to oral penicillins. J Allergy Clin Immunol. 2003, 111:1111-1115.
- Bittner A, Greenberger PA. Incidence of resensitization after tolerating penicillin treatment in penicillin-allergic patients. Allergy Asthma Proc. 2004, 25:161-164.
- Kelkar PS, Li JT-C. Cephalosporin allergy. N Engl J Med. 2001, 345:804-809.
- Greenberger PA. Utility of penicillin major and minor determinants for identification of allergic reactions to cephalosporins. J Allergy Clin Immunol. 2005, 115(suppl):S182.
- Romano A, Guenant-Rodriguez R-M, Viola M, Pettinato R, Gueant J-L. Cross-reactivity and tolerability of cephalosporins in patients with immediate hypersensitivity to penicillins. Ann Intern Med. 2004, 141:16-22.
- Hall WB. Problemi mucogengivali puri. Quintessenza Italia. Resch Ed., Verona, 1986.
- Pignanelli M, Calderari G, Fraschini F, Moro GF, Tassarotti B. Concentrazioni di antibiotici in alcuni tessuti mascellari: concentrazioni di eritromicina. Dental Cadmos. 1984, 3:91.
- Deffer JP et al. A randomized prospective double-blind comparison of the efficacy and safety of roxithromycin and erithromycin in acute dental infections. 17th I.C.C., Belein, 1991.
- Panattoni E, Marcucci M, Gabriele M, et al. Efficacia clinica della roxitromicina in pazienti affetti da infezioni odontogene acute. Min Stomatol. 1991, 40:273.
- Scaglione F, Demartini G, Dal Caro A, et al. Linelli di claritromicina nel cavo orale. Dental Cadmos. 1991, 59:74.