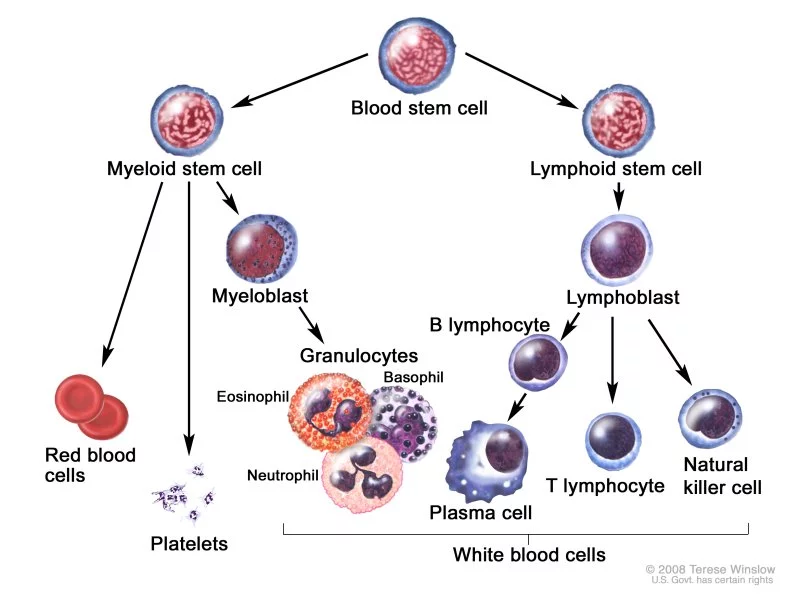
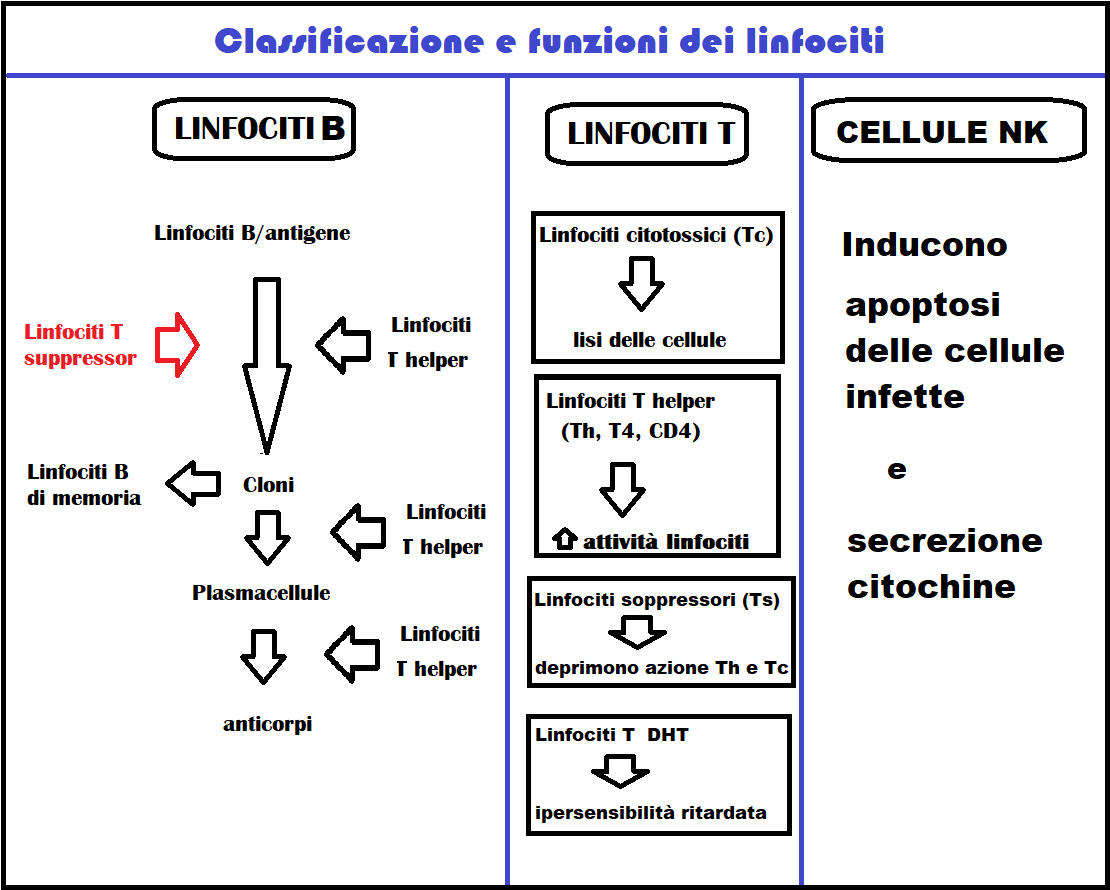
LINFOCITI – I linfociti sono un tipo di leucociti presenti nel sangue che svolgono un ruolo molto importante nel sistema dell’immunità acquisita cellulo-mediata.
Rappresentano il 5-20% dei leucociti ed in circolo sono presenti in concentrazioni di 1.5–3.5 x 109/l.
Ma la concentrazione ematica rappresenta solo il 5% dei linfociti totali che sono quasi tutti concentrati nei tessuti linfatici (midollo osseo,  milza, timo, tonsille e soprattutto linfonodi).
milza, timo, tonsille e soprattutto linfonodi).
In questi organi i linfociti hanno la possibilità di maturare (i linfociti B nel midollo osseo e i linfociti T nel timo) ed attivarsi prontamente in caso di presenza di antigeni penetrati nell’organismo. In presenza di una severa infezione, i linfociti si moltiplicano velocemente per mitosi nenerando molti cloni e determinando un aumento di volume dei linfonodi che appaiono duri e dolenti e poco mobili alla palpazione (1-5).
Esistono tre tipi di linfociti: i linfociti B, i linfociti T e le cellule Natural Killer (NK).
I linfociti B incontrando i propri antigeni danno origine per mitosi a diversi cloni; una parte della popolazione clonale si attiva in plasmacellule, che sintetizzano in gran quantità gli anticorpi specifici presenti sulla membrana del loro precursore; la rimanente quota funge da serbatoio di memoria contro future infezioni, che verranno contrastate in maniera più rapida ed efficace. La produzione dei cloni linfocitari avviene sotto lo stimolo dei linfociti T helper. Gli anticorpi prodotti dalle plasmacellule, noti anche come immunoglobuline, si legano agli antigeni segnalandoli alle cellule preposte alla loro distruzione.
Poiché l’immunità mediata dai linfociti B si giova degli anticorpi presenti nel sangue e negli altri umori dell’organismo viene chiamata immunità umorale.
Linfociti T – Per quanto detto, gli anticorpi sono efficaci soltanto contro agenti patogeni extracellulari mentre non sono efficaci contro quelli racchiusi all’interno delle cellule. Invece i lnfociti T riconoscono le cellule anomale grazie al segnale dato da specifici marcatori detti MHC (o complesso maggiore di istocompatibilità), che contengono frammenti di antigene riconosciuti come estranei dai recettori del linfocita T che in tal modo attaccano solo le cellule infette mentre risparmiano le cellule sane.
La differenza con i recettori della linea B (detti anticorpi o immunoglobuline) è che mentre questi ultimi sono in grado di legarsi direttamente agli antigeni, le cellule T si legano soltanto ad altre cellule umane che presentano frammenti di antigene, vuoi perché infettate (MHC di classe I), vuoi perché deputate alla digestione del corpo estraneo (MHC di classe II). Nel primo caso, l’intervento dei linfociti T citotossici porta alla distruzione della cellula infettata, nel secondo l’intervento dei linfociti T helper aumenta la risposta immunitaria.
La popolazione linfocitaria T è suddivisa in:
- linfociti Tc (citotossici o T killer o NK): lisano le cellule bersaglio (in particolare quelle tumorali infettate da virus portandole a morte e favoriscono l’azione dei fagocitaria dei macrofagi. Allo stesso tempo i linfociti Tc secernono varie citochine antivirali, che inducono le cellule non ancora infettate ad attuare meccanismi di difesa.
- linfociti Th (T helper, T4 o CD4): stimolano e sostengono l’azione di riconosci-mento e quella di risposta dei linfociti T e B (favorendone la
 differenziazione in plasmacellule e la produzione di anticorpi); costituiscono il bersaglio elettivo del virus dell’AIDS (HIV).
differenziazione in plasmacellule e la produzione di anticorpi); costituiscono il bersaglio elettivo del virus dell’AIDS (HIV). - linfociti Ts (T suppressor): bloccano l’attività dei linfociti T helper e citotossici;
- linfociti T DHT (T Delayed Type Hypersensitivity): sono mediatori dei fenomeni infiammatori ed in particolare della ipersensibilità ritardata.
Al contrario dei linfociti B, la cui vita media è di pochi giorni (fatta eccezione per le “cellule della memoria”), i linfociti T sopravvivono per diversi mesi o anni.
Le cellule Natural Killer o cellule NK diversi dai Linfociti T NK sono una classe di cellule citotossiche del sistema immunitario capaci di  provocare lisi e apoptosi delle cellule bersaglio che sono rappresentate da cellule tumorali e infette da virus (6-11).
provocare lisi e apoptosi delle cellule bersaglio che sono rappresentate da cellule tumorali e infette da virus (6-11).
Il meccanismo d’azione delle cellule NK viene definito “naturale” poiché, a differenza dei Linfociti Tc, non richiedono una precedente esposizione all’antigene per mediare i loro effetti antitumorali ma riconoscono il target aspecificamente e senza l’ausilio di molecole del complesso maggiore di istocompatibilità (MHC).
Le cellule NK sono citotossiche; i piccoli granuli presenti nel loro citoplasma contengono proteine speciali come la perforina e le proteasi note come granzimi.
Al rilascio in prossimità di una cellula prevista per l’uccisione, la perforina crea dei pori nella membrana cellulare della cellula bersaglio e attraverso di essi i granzimi e le molecole associate possono entrare nella cellula bersaglio inducendola all’apoptosi.
La distinzione tra apoptosi e lisi cellulare è importante in immunologia: lisare una cellula infetta da virus rilascerebbe solo i virioni, mentre l’apoptosi porta alla distruzione del virus all’interno.
Inoltre, le cellule NK secernono citochine come IFN-γ e TNF-α, che agiscono sui macrofagi e cellule dendritiche per migliorare la risposta immunitaria (12-15).
References:
- Thomas J. Kindt, Richard A. Goldsby; Barbara A. Osborne, Kuby Immunology, 6ª ed., UTET, ISBN 978-88-02-07774-1.
- Abbul K. Abbas & Andrew Lichtman, Cellular and Molecular Immunology, Saunders Copyright 2003
- Lauren Sompayrac, How the Immune System Works, 2nd edition, PhD Blackwell Publishing 2003
- Janeway, Travers, Walport & Shlomchik, Immunobiology: The Immune System In Health And Disease, Churchchill Livingstone Copyright 2005
- Vera Del Gobbo, Immunologia per le lauree sanitarie, Piccin, ISBN 978-88-299-1853-9.
- Carrega P, Ferlazzo G. Natural killer cell distribution and trafficking in human tissues. Front Immunol (2012) 3:347.
- Scoville SD, Freud AG, Caligiuri MA. Modeling human natural killer cell development in the era of innate lymphoid cells. Front Immunol (2017) 8:360.
- Sun JC, Lanier LL. NK cell development, homeostasis and function: parallels with CD8(+) T cells. Nat Rev Immunol (2011) 11:645–57.
- Langers I, Renoux VM, Thiry M, Delvenne P, Jacobs N. Natural killer cells: role in local tumor growth and metastasis. Biologics (2012) 6:73–82.
- Jiao Y, Huntington ND, Belz GT, Seillet C. Type 1 innate lymphoid cell biology: lessons learnt from natural killer cells. Front Immunol (2016) 7:426.
- Yu J, Freud AG, Caligiuri MA. Location and cellular stages of natural killer cell development. Trends Immunol (2013) 34:573–82.
- Renoux VM, Zriwil A, Peitzsch C, Michaëlsson J, Friberg D, Soneji S, et al. Identification of a human natural killer cell lineage-restricted progenitor in fetal and adult tissues. Immunity (2015) 43:394–407.
- Marcenaro E, Notarangelo LD, Orange JS, Vivier E. Editorial: NK cell subsets in health and disease: new developments. Front Immunol (2017) 8:1363
- Farag SS, Caligiuri MA. Human natural killer cell development and biology. Blood Rev (2006) 20:123–37
- Raulet DH, Vance RE. Self-tolerance of natural killer cells. Nat Rev Immunol (2006) 6:520–31.