Ultimo aggiornamento 2022-03-11 22:01:31
Introduzione – La sindrome dell’ovaio policistico è il più comune (4-12%) disturbo endocrinologico che colpisce le donne e anche il più controverso.
La metformina è stata introdotta nei protocolli terapeutici della policistosi ovarica per la sua azione sul metabolismo glicidico, ed in particolare sull’insulino-resistenza, presente nel 60-80% delle pazienti PCOS e direttamente coinvolto nell’eziopatogenesi della PCOS. Inizialmente annunciato come farmaco magico nella terapia della PCOS, attualmente, nonostante l’indicazione off-label si stia diffondendo in USA e Canada, è in corso un’analisi critica sulle condizioni permittenti e sulla reale efficacia di tale terapia (1-4).
Insulino-resistenza (IR) e PCOS – L’insensibilità all’azione dell’insulina da parte delle cellule bersaglio ai normali livelli sierici di insulina per difetto di fosforilazione recettoriale è considerato come resistenza all’insulina (IR) (5). L’IR può portare ad eccessiva produzione di insulina, esaurimento delle cellule ß ed, infine, a diabete mellito di tipo 2 (DM2). Questa definizione di IR non può essere universalmente gradita ma fornisce una comprensione semplificata di questa patologia. Altre definizioni di insulino-resistenza sono state formulate dall’Organizzazione Mondiale della Sanità (OMS) (6).
La presenza di IR induce iperproduzione compensativa di insulina dalle cellule ß pancreatiche. Quindi l’IR è caratterizzata da iperinsulinemia in presenza di glicemia normale o lievemente aumentata. Nella PCOS, l’iperglicemia e la iperinsulinemia compensativa è causa di iperandrogenemia assoluta attraverso iperproduzione ovarica di androgeni conseguente a ipersecrezione di LH (7,8) e/o iperandrogenemia relativa per la diminuita sintesi epatica della globulina legante gli ormoni androgeni (SHBG) (9-14).
L’IR non è considerato un criterio diagnostico in PCOS secondo le associazioni internazionali ESHRE/ASRM (15) tuttavia, è riconosciuta da molti AA. come una caratteristica frequentemente presente (60-70%) nella PCOS indipendentemente dalla presenza di obesità (16-19) ma con maggior frequenza nelle donne PCOS obese (20-22). Inoltre, la quantificazione clinica dell’IR non è abbastanza precisa (22,23).
La metformina è un farmaco, della famiglia delle biguanidi, introdotto in commercio per il trattamento del diabete di tipo 2 d. Il meccanismo d’azione della metformina non è ancora chiarito nei dettagli ma non sembra dipendere dall’azione delle cellule beta pancreatiche poiché non sembra agire direttamente sulla secrezione di insulina, diversamente dalle sulfaniluree.
Farmacodinamica: il meccanismo d’azione della metformina non è ancora completamente chiarito ma non stimola direttamente la produzione insulinica da parte delle cellule β pancreatiche del Langherans come invece avviene per le sulfaniluree. E, diversamente dalle sulfaniluree, non induce ipoglicemia nè aumento del peso corporeo perchè non stimola la secrezione di insulina se non indirettamente e con modalità glucosio-dipendente. Gli organi bersaglio della metformina sono principalmente: il fegato, il tessuto muscolare scheletrico, il tessuto adiposo e l’intestino.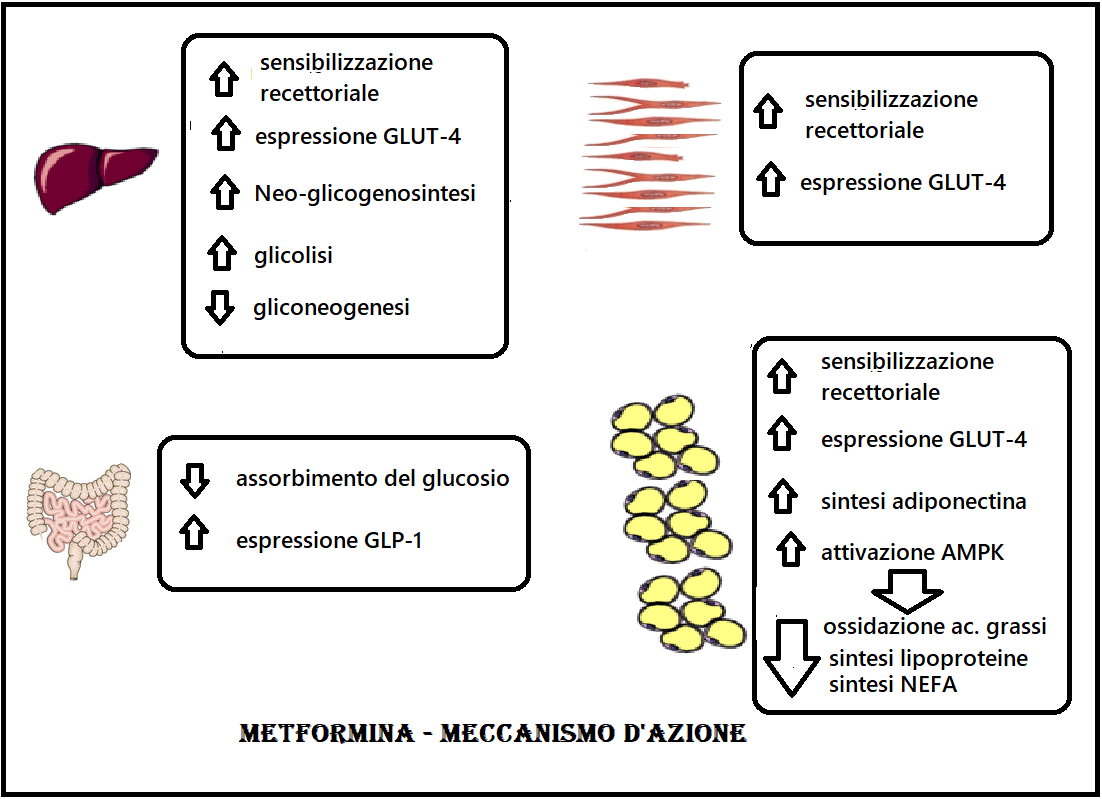
Si ritiene che la metformina agisca:
- riducendo la gliconeogenesi epatica (10-30%) mediante alterazione dei substrati del complesso della catena respiratoria mitocondriale cAMP dipendente (6);
- aumentando la metabolizzazione anaerobica del glucosio
- A livello muscolare la traslocazione dei trasportatori GLUT-4 dai siti intracellulari (vescicole) alla membrana plasmatica è favorita anche dalla contrazione, dall’aumento del flusso ematico e dai bassi livelli di glicogeno che caratterizzano l’esercizio fisico di durata. Ciò spiega come mai l’attività sportiva sia un’utilissima medicina nella prevenzione dell’insulino resistenza e nel trattamento del diabete mellito.
- stimolando l’uptake del glucosio da parte di fegato, muscoli scheletrici e tessuto adiposo aumentando la sensibilità dei recettori dell’insulina mediante inibizione della fosforilazione negli stessi recettori.
- stimolando l’espressione di GLUT4 (Insulin-regulated Glucose Transporter), proteine carrier, normalmente presenti nel citoplasma cellulare che, stimolate dalla metformina, raggiungono la superficie cellulare dove “caricano” le molecole di glucosio e le trasportano all’interno delle cellule (diffusione facilitata, che non richiede l’uso di ATP).A livello muscolare la traslocazione dei trasportatori GLUT-4 dai siti intracellulari (vescicole) alla membrana plasmatica è favorita anche dalla contrazione, dall’aumento del flusso ematico e dai bassi livelli di glicogeno che caratterizzano l’esercizio fisico di durata. Ciò spiega come mai l’attività sportiva sia un’utilissima medicina nella prevenzione dell’insulino resistenza e nel trattamento del diabete mellito tipo II (DM2).
- riducendo l’assorbimento del glucosio da parte dell’intestino (5).
- Inducendo aumentata secrezione intestinale di GLP-1 (glucagon-like peptide-1) da parte dell’ileo-colon. Questo ormone, il cui gene di espressione è lo stesso del glucagone, stimola la secrezione di insulina e inibisce la secrezione di glucagone da parte del pancreas. Il suo rilascio avviene dopo i pasti, entrando quindi in azione solamente quando la glicemia sale per effetto dei carboidrati introdotti col cibo. Per questo motivo non causa ipoglicemia. Il GLP-1 rallenta lo svuotamento gastrico, aumentando il senso di sazietà in risposta all’assunzione di cibo, e riduce l’appetito, agendo direttamente sui centri di regolazione della fame del sistema nervoso centrale (nucleo del tratto solitario dell’ipotalamo).
- Inducendo aumentata secrezione da parte del tessuto adiposo di adiponectina (“assassina dei grassi”) che a sua volta stimola l’uptake del glucodio a livello epatico e della muscolatura scheletrica.
La metformina viene assunta per os e viene assorbita a livello intestinale e nel plasma circola in forma libera. Il farmaco non viene metabolizzato ed è eliminato come tale attraverso le urine. La sua emivita è di circa 1,5-3 ore.
Attualmente la metformina viene considerata il farmaco di scelta nelle persone affette da diabete di tipo II (non insulino-dipendente). Presenta dei vantaggi interessanti specie in persone obese in quanto non induce aumento di peso e la comparsa di ipoglicemia risulta essere un fenomeno poco comune. La metformina, inoltre, può anche essere associata alle sulfaniluree, qualora quest’ultime si siano rivelate insufficienti (1-4). Dosaggio terapeutico: generalmente le terapie a base di metformina prevedono una dose iniziale di 500 mg dopo colazione. Dopo qualche giorno, se la glicemia non si è normalizzata, si può aumentare la dose di farmaco distribuendola in maniera frazionata dopo i pasti principali della giornata. Si consiglia di non superare i 3 g/die. Il frazionamento del farmaco lungo l’arco della giornata viene utilizzato al fine di limitare i fastidiosi effetti collaterali gastrointestinali che altrimenti si avrebbero a seguito d’una somministrazione unica.
Effetti collaterali: sono generalmente dose-dipendenti e di natura gastro-intestinale: nausea, vomito, anoressia, diarrea, flatulenza, tensione addominale. Si riducono con il passare del tempo, ma in caso di persistenza occorre interrompere la terapia. Inoltre l’uso cronico della metformina può limitare l’assorbimento di vitamina B12 e ac. folico per cui si consiglia di valutare i livelli ematici di tali fattori e l’emocromo al fine di valutarne la necessità di una supplementazione parenterale. Talvolta si può sviluppare uno stato di acidosi lattica che compare più frequentemente in persone con insufficienza renale, epatopatie, alcoliste e malattie cardiorespiratorie croniche. In tali pazienti e nei bambini >10 anni la somministrazione di metformina è controindicata (5-8).
Il razionale della terapia della PCOS con metformina consiste nella capacità di questo farmaco nel ridurre l’iperglicemia e i danni da quest’ultima indotta sulla funzionalità ovarica. Diversamente dalle sulfaniluree, la metformina non induce deplezione della riserva pancreatica e non induce aumento di peso come invece avviene con sulfaniluree e insulina. La metformina è efficace anche in pazienti non obese e anche in assenza di iperglicemia; invece è inefficace in assenza di iperandrogenemia (9-13). Ancor più efficace risulta l’azione della metformina se associata alla : 20 mg al giorno in combinazione con metformina 500 mg tre volte al dì. La valutazione di efficacia è effettuata osservando le variazioni dei livelli sierici di androgeni (testosterone, androstendione e deidro-epiandrostenion solfato-DHEAS), LH, FSH, rapporto LH/FSH e insulino-resistenza (IR), oltre alla regolarizzazione del ciclo mestruale, irsutismo, BMI, ovulazione spontanea (49).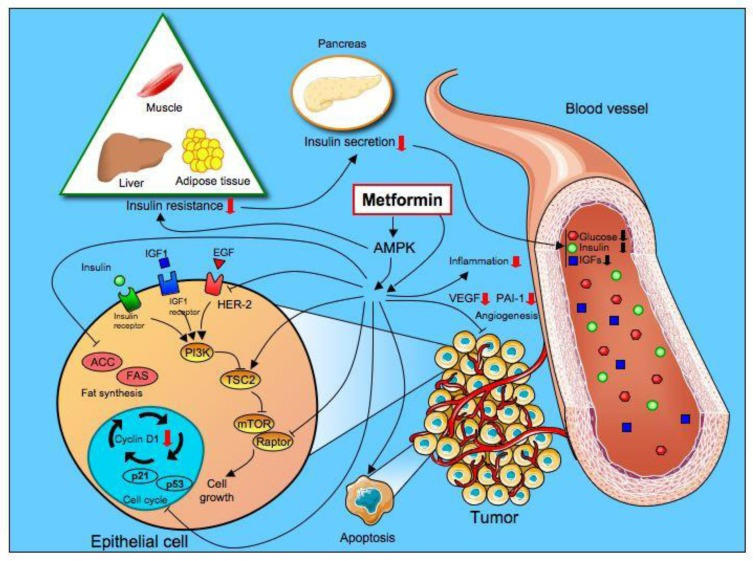
Conclusioni – L’uso di metformina è associato a una maggiore ciclicità mestruale, un’ovulazione migliorata e una riduzione dei livelli degli androgeni circolanti. I benefici metabolici sono aumentati in presenza di perdita di peso e la perdita di peso stessa può essere migliorata in presenza di metformina.
La metformina gioca il suo ruolo nel migliorare l’induzione dell’ovulazione nelle donne con PCOS attraverso una serie di azioni, tra cui la riduzione dei livelli ematici di insulina e i negativi effetti dell’iperinsulinemia sulla biosintesi steroidea e la neogluconeogenesi epatica.
Dosaggio: la terapia con metformina inizia con 500 mg al giorno ai pasti. Dopo una settimana, la dose viene aumentata a 1000 mg per un’altra settimana e poi a 1500 mg al giorno. La dose target è 1500-2500 mg/die. La risposta clinica è solitamente osservata alla dose di 1000 mg al giorno.
La combinazione di metformina e Clomifene ha significativamente migliorato l’ovulazione e l’outcome gravidico rispetto al solo CC (“smoother response”), riduce il rischio di iperstimolazione ovarica severa (OHSS) e gravidanze multiple e gli effetti negativi del clomifene sul muco cervicale e sul trofismo endometriale. Il pretrattamento con metformina migliora l’efficacia di CC nei pazienti PCOS con resistenza al CC. L’associazione di metformina con le gonadotropine nell’iperstimolazione ovarica controllata (COH) permette una riduzione delle dosi di Gn, riduzione OHSS, una più elevata percentuale di gravidanze e riduzione delle percentuali di aborti spontanei del 1° trimestre. Tuttavia, la terapia combinata non ha migliorato le probabilità di gravidanza a termine (10-25).
Gli effetti collaterali più comuni della metformina sono dolori addominali, crampi, nausea e diarrea, in alcuni casi così gravi da costringere ad interrompere la terapia (14-31).
Prima di iniziare la terapia con metformina è utile effettuare alcuni esami: dosaggio sierico di LH, FSH, estradiolo, DHEAS, testosterone, 17-OHP, prolattina, TSH, creatinina, AST, ALT, LDH e insulino-resistenza.
Bibliografia:
- Legro RS, Barnhart HX, Schlaff WD, et al. Clomiphene, metformin, or both for infertility in the polycystic ovary syndrome. N Engl J Med. 2007;356(6):551–566. [PubMed]
- Alberti K.G.M.M., Zimmet P.Z., Consultation W. (1998) Definition, diagnosis and classification of diabetes mellitus and its complications part 1: Diagnosis and classification of diabetes mellitus -Provisional report of a WHO consultation. Diabetic Med 15: 539–553 [PubMed]
- Apridonidze T., Essah P.A., Iuorno M.J., Nestler J.E. (2005) Prevalence and characteristics of the metabolic syndrome in women with polycystic ovary syndrome. J Clin Endocrinol Metab 90: 1929–1935 [PubMed]
- Arlt W., Auchus R.J., Miller W.L. (2001) Thiazolidinediones but not metformin directly inhibit the steroidogenic enzymes P450c17 and 3beta -hydroxysteroid dehydrogenase. J Biol Chem 276: 16767–16771 [PubMed]
- Le Roith D., Zick Y. (2001) Recent advances in our understanding of insulin action and insulin resistance. Diabetes Care 24: 588–597
- Alberti K.G.M.M., Zimmet P.Z., Consultation W. (1998) Definition, diagnosis and classification of diabetes mellitus and its complications part 1: Diagnosis and classification of diabetes mellitus -Provisional report of a WHO consultation. Diabetic Med 15: 539–553
- Attia G.R., Rainey W.E., Carr B.R. (2001) Metformin directly inhibits androgen production in human thecal cells. Fertil Steril 76: 517–524
- Barbieri R.L., Makris A., Randall R.W., Daniels G., Kistner R.W., Ryan K.J. (1986) Insulin stimulates androgen accumulation in incubations of ovarian stroma obtained from women with
- Nestler J.E. (2008) Metformin for the treatment of the polycystic ovary syndrome. N Engl J Med 358: 47–54
- Nestler J.E., Jakubowicz D.J. (1996) Decreases in ovarian cytochrome P450c17 alpha activity and serum free testosterone after reduction of insulin secretion in polycystic ovary syndrome. N Engl J Med 335: 617–623
- Nestler J.E., Jakubowicz D.J. (1997) Lean women with polycystic ovary syndrome respond to insulin reduction with decreases in ovarian P450c17 alpha activity and serum androgens. J Clin Endocrinol Metab 82: 4075–4079
- Nestler J.E., Powers L.P., Matt D.W., Steingold K.A., Plymate S.R., Rittmaster R.S., et al. (1991) A direct effect of hyperinsulinemia on serum sex hormone-binding globulin levels in obese women with the polycystic ovary syndrome. J Clin Endocrinol Metab 72: 83–89
- Hwu YM, Lin SY, Huang WY, Lin MH, Lee RK. Ultra-short metformin pretreatment for clomiphene citrate-resistant polycystic ovary syndrome. Int J Gynaecol Obstet. 2005;90(1):39–43. [PubMed]
- Creanga AA, Bradley HM, McCormick C, Witkop CT. Use of metformin in polycystic ovary syndrome: a meta-analysis. Obstet Gynecol. 2008;111(4):959–968.
- ESHRE/ASRM (2004) Revised 2003 consensus on diagnostic criteria and long-term health risks related to polycystic ovary syndrome (PCOS). Hum Reprod 19: 41–47
- Dunaif A., Graf M., Mandeli J., Laumas V., Dobrjansky A. (1987) Characterization of groups of hyperandrogenic women with acanthosis nigricans, impaired glucose tolerance, and/or hyperinsulinemia. J Clin Endocrinol Metab 65: 499–507
- Chang R.J., Laufer L.R., Meldrum D.R., DeFazio J., Lu J.K., Vale W.W., et al. (1983) Steroid secretion in polycystic ovarian disease after ovarian suppression by a long-acting gonadotropin-releasing hormone agonist. J Clin Endocrinol Metab 56: 897–903
- Burghen G.A., Givens J.R., Kitabchi A.E. (1980) Correlation of hyperandrogenism with hyperinsulinism in polycystic ovarian disease. J Clin Endocrinol Metab 50: 113–116
- DeUgarte C.M., Bartolucci A.A., Azziz R. (2005) Prevalence of insulin resistance in the polycystic ovary syndrome using the homeostasis model assessment. Fertil Steril 83: 1454–1460
- Holte J., Bergh T., Berne C., Wide L., Lithell H. (1995) Restored insulin sensitivity but persistently increased early insulin secretion after weight loss in obese women with polycystic ovary syndrome. J Clin Endocrinol Metab 80: 2586–2593
- Pasquali R., Casimirri F. (1993) The impact of obesity on hyperandrogenism and polycystic ovary syndrome in premenopausal women. Clin Endocrinol (Oxf) 39: 1–16
- Kiddy D.S., Hamilton-Fairley D., Bush A., Short F., Anyaoku V., Reed M.J., et al. (1992) Improvement in endocrine and ovarian function during dietary treatment of obese women with polycystic ovary syndrome. Clin Endocrinol (Oxf) 36: 105–111
- Legro R.S., Barnhart H.X., Schlaff W.D., Carr B.R., Diamond M.P., Carson S.A., et al. (2007) Clomiphene, metformin, or both for infertility in the polycystic ovary syndrome. N Engl J Med 356: 551–566
- Gennarelli G., Holte J., Berglund L., Berne C., Massobrio M., Lithell H. (2000) Prediction models for insulin resistance in the polycystic ovary syndrome. Hum Reprod 15: 2098–2102
- Moll E, Bossuyt PM, Korevaar JC, Lambalk CB, van der Veen F. Effect of clomifene citrate plus metformin and clomifene citrate plus placebo on induction of ovulation in women with newly diagnosed polycystic ovary syndrome: randomised double blind clinical trial. BMJ. 2006;332(7556):1485.[PMC free article]
- Palomba S, Orio F, Jr, Zullo F. What is the best first-step therapeutic approach in treating anovulatory infertility in patients with polycystic ovary syndrome? Questions that are still unanswered. Gynecol Endocrinol. 2007;23(5):245–247.
- Glueck CJ, Wang P, Goldenberg N, Sieve-Smith L. Pregnancy outcomes among women with polycystic ovary syndrome treated with metformin. Hum Reprod. 2002;17(11):2858–2864.
- Harborne LR, Sattar N, Norman JE, Fleming R. Metformin and weight loss in obese women with polycystic ovary syndrome: comparison of doses. J Clin Endocrinol Metab. 2005;90(8):4593–4598.
- Grundy SM. Obesity, metabolic syndrome, and coronary therosclerosis. Circulation. 2002;105(23):2696–2698.
- Sam S, Dunaif A. Polycystic ovary syndrome: syndrome XX? Trends Endocrinol Metab. 2003;14(8):365–370.
- Messinis IE. Ovulation induction: a mini review. Hum Reprod. 2005;20(10):2688–2697.
- Harborne LR, Sattar N, Norman JE, Fleming R. Metformin and weight loss in obese women with polycystic ovary syndrome: comparison of doses. J Clin Endocrinol Metab 2005; 90: 4593-
- Eisenhardt S., Schwarzmann N., Henschel V., Germeyer A., von Wolff M., Hamann A., Strowitzki T.: J Clin Endocrin Metab, First published December 13, 2005
- Nestler JE, Stovall D, Akhter N, Iuorno MJ, Jakubowicz MJ. Strategies for the use of insulin-sensitizing drugs to treat infertility in women with polycystic ovary syndrome. Fertil Steril. 2002;77:209–215.
- Dunn CJ, Peters DH. Metformin: a review of its pharmacological properties and therapeutic uses in non-insulin dependent diabetes. Drugs. 1995;49:721–749.
- Kashyap S, Wells GA, Rosenwaks Z. Insulin-sensitizing agents as primary therapy for patients with polycystic ovarian syndrome. Hum Reprod. 2004;19:2474–2483.
- Thatcher SS, Jackson EM. Pregnancy outcome in infertile patients with polycystic ovary syndrome who were treated with metformin. Fertil Steril. 2006;85:1002–1009.
- Matthews DR, Hosker JP, Rudenski AS, Naylor BA, Treacher DF, Turner RC. Homeostasis model assessment: insulin resistance and beta-cell function from fasting plasma glucose and insulin concentrations in man. Diabetologia. 1985;28:412–419.
- De Leo V, la Marca A, Ditto A, Morgante G, Cianci A. Effects of metformin on gonadotropin-induced ovulation in women with polycystic ovary syndrome. Fertil Steril. 1999;72:282–285.
- Yarali H, Yildiz BO, Demirol A, Zeyneloglu HB, Yigit N, Bukulmez O, et al. Co-administration of metformin during rFSH treatment in patients with clomiphene citrate–resistant polycystic ovarian syndrome: a prospective randomized trial. Hum Reprod. 2002;17:289–294.
- Tasdemir S, Ficicioglu C, Yalti S, Gurbuz B, Basaran T, Yildirim G. The effect of metformin treatment to ovarian response in cases with PCOS. Arch Gynecol Obstet. 2004;269:121–124.
- Glueck CJ, Phillips H, Cameron D, Sieve-Smith L, Wang P. Continuing metformin throughout pregnancy in women with polycystic ovary syndrome appears to safely reduce first-trimester spontaneous abortion: a pilot study. Fertil Steril. 2001;75:46–52.
- Jakubowicz DJ, Iuorno MJ, Jakubowicz S, Roberts KA, Nestler JE. Effects of metformin on early pregnancy loss in the polycystic ovary syndrome. J Clin Endocrinol Metab. 2002;87:524–529.
- Schachter M, Raziel A, Friedler S, Strassburger D, Bern O, Ron-El R. Insulin resistance in patients with polycystic ovary syndrome is associated with elevated plasma homocysteine. Hum Reprod. 2003;18:721–727.
- Seppala M, Riittinen L, Julkunen M, Koistinen R, Wahlstrom T, Iino K, et al. Structural studies, localization in tissue and clinical aspects of human endometrial proteins. J Reprod Fertil. 1988;36(Suppl):127–141.
- Steer CV, Tan SL, Dillon D, Mason BA, Campbell S. Vaginal color Doppler assessment of uterine artery impedance correlates with immunohistochemical markers of endometrial receptivity required for the implantation of an embryo. Fertil Steril. 1995;63:101–108.
- Boomsma C.M., Eijkemans M.J., Hughes E.G., Visser G.H., Fauser B.C., Macklon N.S. (2006) A meta-analysis of pregnancy outcomes in women with polycystic ovary syndrome. Hum Reprod Update 12: 673–683
- Costello M.F., Chapman M., Conway U. (2006) A systematic review and meta-analysis of randomized controlled trials on metformin co-administration during gonadotrophin ovulation induction or IVF in women with polycystic ovary syndrome. Hum Reprod 21: 1387–1399
- Seyam E, Hefzy E: Long-term effects of combined simvastatin and metformin treatment on the clinical abnormalities and ovulation dysfunction in single young women with polycystic ovary syndrome. Gynecol Endocrinol 2018 Dec;34(12):1073-1080.

