- in considerazione della complessità degli eventi eziopatogenetici che stanno alla base della patologia endometriosica, la terapia mira a centrare due obiettivi: interrompere l’aggravamento della patologia e soprattutto a controllare il dolore.
- La terapia medica trova indicazione nelle forme lievi e moderate, I° e II° tipo della classificazione dell’ASF-r (American Society Fertility) (1) e prima e dopo la terapia chirurgica.
- Si basa sull’utilizzo di presidi terapeutici antidolorifici tipo FANS come il dexketoprofene (Enantyum® cpr 25 mg o bustine granulare o liquido in bustine), l’ipubrofene (Nurofen® cpr 400 mg, Moment cpr 200 mg) e e il naproxene (Momendol® cpr 220 mg) e farmaci capaci di indurre (provvisoriamente) atrofizzazione del tessuto endometriale ectopico. Di più recente formazione è la Palmitoiletanolamide, PEA (Pelvilen DuoAct® microgranuli per somministrazione sublinguale e cpr).
FARMACI ANTIDOLORIFICI:
- KETOPROFENE: Enantyum cpr 25 mg, fl im 50 mg/2 ml
- IBUPROFENE: Nurofen cpr 200 mg, Moment cpr 200 mg, CibalginadueAct cpr 200 mg, MomentAct cpr 400 mg
- NAPROXENE: Momendol cpr 220 mg, Naprosyn 250 mg
FARMACI ANTIESTROGENICI
I. PROGESTINICI – Riconoscendo agli estrogeni una prevalente responsabilitò nel mantenimento della patologia (2,3), ed essendo stati evidenziati recettori per gli estrogeni e per il progesterone, la terapia si avvale soprattutto di farmaci progestino-simili in grado di indurre ipotrofia dell’endometrio ectopico. Sfortunatamente nelle pazienti endometriosiche risulta diminuito il numero e la funzionalità dei recettori del progesterone di tipo β, cioè l’isoforma interessata al 90% della capacità funzionale del progesterone (11-13).
Farmaci progestinici attualmente in commercio:
- Medrossiprogesterone acetato, MAP (Depoprovera® cpr 100, 200, 400 mg, fl 50 mg, 150 mg, Farlutal® cpr 10, 20, 250, 500, 1000 mg, fiale 1 gr, Provera G® cpr 5 mg, 10 mg);
- Nomegestrone (Lutenyl cpr 5 mg) derivato del 19-nor-progesterone
Effetti collaterali comuni della terapia con progestinici:
- Aumento del senso di fame. È l’effetto collaterale più comune. Un regime dietetico adeguato può servire a limitarne le conseguenze.
- Nausea – A volte può comparire nel corso delle prime settimane di trattamento con il MAP. La nausea scompare spesso spontaneamente, ma se persiste può essere trattata con efficacia con i farmaci antiemetici: metoclopramide (Plasil® cpr), clorpromazina (Largactil® cpr).
- Ritenzione di liquidi: gambe e caviglie si presentano edematose. Questo fenomeno scompare lentamente alla conclusione del trattamento.
- Sanguinamento vaginale. Un leggero sanguinamento vaginale (spotting) è possibile durante il trattamento con il MAP. Al termine del trattamento si potrebbe presentare un sanguinamento più abbondante, simile a una mestruazione.
- Crampi muscolari. Generalmente si presentano in forma lieve; se creano dolore persistente, può essere utile assumere un antinfiammatorio (Enantyum® cpr).
II. Noretisterone derivato progestinico, commercializzato con il nome di Primolut-Nor® cpr 10 mg, induce inibizione ipofisaria di FSH, conseguente ipoestrogenemia e atrofizzazione endometriale. Il dosaggio medio è di 5 mg/die per 10 gg/ciclo; il dosaggio può essere incrementato di 2,5 mg/die (14,15),
III. Danazolo (Danatrol cps 200 mg) blocca l’espressione del citocromo P450 aromatasi che permette la trasformazione degli androgeni in estrogeni. Inoltre blocca il release di Gn-RH ipotalamico. Commercializzato agli inizi degli anni ’70 con la specifica indicazione dell’endometriosi, è rimasto a lungo il farmaco di riferimento.
È in grado di indurre un clima ipoestrogenico- iperandrogenico altamente ostile all’endometriosi. Il dosaggio raccomandato è di 600-800 mg/die. Dosaggi inferiori sono risultati meglio tollerati ma meno efficaci
Presenta importanti effetti collaterali legati all’iperandrogenismo e all’azione sul metabolismo lipidico che ne riducono molto la tollerabilità (16-19).
IV. Letrozolo (Femara® cpr 2.5 mg): un inibitore non steroideo di seconda generazione dell’aromatasi, capace di inibire del 90-99% la sintesi degli estrogeni.
Utilizzato per il trattamento adiuvante del carcinoma mammario in fase precoce in donne in postmenopausa con stato recettoriale ormonale positivo dopo trattamento adiuvante standard con tamoxifene.
La terapia con letrozolo (Femara® cpr) è indicata, in associazione con il noretisterone (Primolut Nor® cpr 10 mg), soprattutto per alleviare la sintomatologia dolorosa nella localizzazione endometriosica nel setto retto-vaginale; ma ci sono dubbi sulla reale diminuzione delle lesioni stesse e Gli inibitori dell’aromatasi offrono la possibilità molto interessante di trattare l’endometriosi senza sopprimere la funzione ovarica poiché è stato dimostrato che inibiscono selettivamente la produzione di estrogeni nelle lesioni endometriosiche, senza influire sulla funzione ovarica.
La sintomatologia dolorosa ricompare dopo la sospensione della terapia. Inoltre sono controindicati in gravidanza, allattamento e in pazienti allergici, nefropatici ed epatopatici. Effetti collaterali: demineralizzazione ossea, hot flashes, artralgia, facile stancabilità (20-22).
IV. Dienogest – Nel 2013 è stato introdotto in commercio dalla Bayer un nuovo progestinico (8-12), il Dienogest commercializzato come Visanne® 28 cpr 2 mg. A causa dei possibili effetti teratogeni su un’eventuale gravidanza, è opportuno associare a Visanne una terapia contraccetiva ormonale. Recentemente il dienogest è anche commercializzato in associazione a etinilestradiolo (Nuvadien 28 cpr, Aglae 28 cpr Dienogest 2 mg + EE 0.03 mg) che potrebbe essere utilizzata nei casi di endometriosi di lieve e medio grado.. Il Dienogest è un farmaco androgenico ma con una attività anti-estrogenica corrispondente a circa un terzo dell’attività del ciproterone acetato. Dienogest, malgrado la sua debole affinità per i recettori del progesterone, si lega ai recettori del progesterone presenti nell’utero umano producendo un forte effetto progestinico in vivo. Dienogest non presenta attività androgena, mineralcorticoide e glucocorticoide significativo in vivo. Meccanismo d’azione: Agisce sull’endometriosi, riducendo la produzione endogena di estradiolo e inibendo così gli effetti trofici dell’estradiolo sull’endometrio sia eutopico che ectopico. Somministrato senza interruzioni, il dienogest genera un ambiente endocrino iperprogestinico e ipo-estrogenico, causando decidualizzazione iniziale seguita da atrofia del tessuto endometriale e delle lesioni endometriosiche e diminuzione del dolore in una percentuale del 50-75% dopo 6 mesi di terapia. Diversamente dagli analoghi, non sembra esserci diminuzione della densità ossea nè varazioni a carico del profilo lipidico ed epatico (23-44).
V. Il mifepristone, un antiprogestinico, può essere un’alternativa se vengono confermati incoraggianti dati preliminari sulla sua efficacia e tollerabilità.
VII. SPIRALI AL PROGESTERONE (LNG-IUD):
E’ indicata soprattutto nei casi di adenomiosi, oltre che per iperplasia semplice dell’endometrio e miomatosi uterina in cui non sono indicate soluzioni chirurgiche. È stato ipotizzato che la riduzione del dolore indotta dall’applicazione di spirali medicate al progesterone (GNL-IUS) nelle donne con endometriosi possa essere mediata da una diminuzione dell’apporto vascolare alle strutture viscerali pelviche con diminuzione della congestione pelvica. Il flusso subendometriale nelle arterie spirali è significativamente ridotto nei soggetti del gruppo GNL-IUS e in nessuno dei gruppo IUS rame. In conclusione sembra che la riduzione del sanguinamento uterino sperimentata dagli utenti di LNG-IUD può essere principalmente dovuta a un effetto progestinico locale caratterizzato da parziale blocco dell’ovulazione, marcata riduzione del flusso sanguigno dell’arterie spirali, atrofizzazione endometriale associato al normale flusso sanguigno sistemico (45,50). La quantità di sangue mestruale diminuisce drasticamente dopo tre o più mesi di utilizzo. Circa il 20% delle donne smette di avere flussi mestruali dopo un anno di utilizzo di IUD-LNG.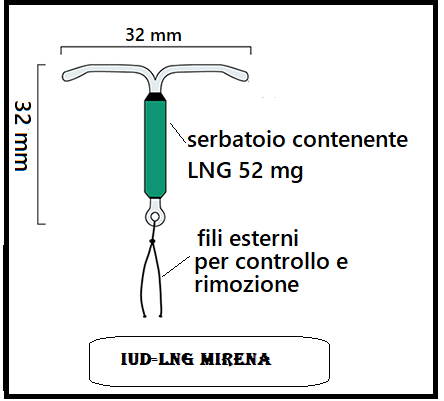
Effetti collaterali di IUD-LNG:
- di tipo metabolico (aumento ponderale, acne, seborrea, mastodinia) che testimoniano un significativo assorbimento uterino del farmaco
- ansia, disturbi dell’umore.
- lieve e a volte persistente dolore pelvico e tensione addomino-pelvica localizzata: da attribuire al microtrauma locale endocavitario per la presenza di un corpo estraneo intrauterino. Occorre rivalutare ecograficamente l’esatto posizionamento intrauterino del dispositivo e, se necessario, rimuoverlo e riapplicarlo subito o dopo una necessaria sosta.
- rischio di infezioni: il ricorso a IUD-LNG deve essere effettuato con cautela nelle donne con malattie cardiache congenite o patologie delle valvole cardiache a rischio di endocardite batterica. Queste pazienti devono essere sottoposte a profilassi antibiotica al momento dell’inserimento e della rimozione del dispositivo intrauterino.
- Nelle pazienti diabetiche che utilizzano IUD-LNG, si deve tenere sotto controllo la glicemia. Tuttavia, non è generalmente necessario modificare la terapia antidiabetica.
- Sanguinamenti irregolari possono mascherare alcuni sintomi e segni di polipi o cancro dell’endometrio ed in questi casi bisogna rimuovere lo IUD e prendere in considerazione le necessarie misure diagnostiche e terapeutiche.
- IUD-LNG non è il metodo di prima scelta né per le donne giovani nullipare, né per le donne in post-menopausa con avanzata atrofia uterina.
- Espulsione – Le contrazioni uterine durante le mestruazioni possono qualche volta spostare il dispositivo dalla sua sede o provocarne l’espulsione. I possibili sintomi sono dolore e sanguinamento anormale (AUB) (51-55).
- Perforazione uterina: quasi sempre avviene durante l’applicazione. La paziente lamenta dolore trafittivo, metrorragia anomala (AUB) e dopo poco tempo, ipertermia. L’USG permette agevolmente la diagnosi.
- GEU: Nelle utilizzatrici di IUD-LNG il rischio di una gravidanza ectopica, è basso a seguito della ridotta probabilità complessiva di gravidanza ma più elevato rispetto alla popolazione controllo.
Mirena: IUD a forma di T con serbatoio allocato nel braccio verticale dotato di serbatoio contenente 52 mg di levonorgestrel (LNG) rilasciato in dose di 20 μg/die che si riduce a circa 18 μg/24 h dopo 1 anno e a 10 μg/24 h dopo 5 anni. Scadenza: 5 anni.
Jaydess microspirale al progesterone a forma di T – Nel braccio trasversale è posto un serbatoio contenente 13.5 mg di levonorgestrel (LNG) che rilascia 20 μg/die di levonorgestrel (GNL). La sua efficacia è garantita per 3 anni.
Kyleena – serbatoio posto nel braccio verticale e contenente 19.5 mg di levonorgestrel che rilascia 20 μg/die di levonorgestrel (GNL). Scadenza: 5 anni.
VIII. Analoghi del Gn-RH long-acting (Leuprorelina: Enantone® fl im 3.75 mg e 11.25 mg) con iniezioni mensili o trimestrali per 3 mesi; Goserelin (Zoladex fl sc 3.6 mg, 10.8 mg) per iniezione sottocutanea a livello della parete addominale; Triptorelina (Decapeptyl® fl im 3.75 mg, 11.25 mg) (37). Gli analoghi bloccano l’espressione del citocromo P450 aromatasi che permette la trasformazione degli androgeni in estrogeni. Inoltre essi bloccano il release di Gn-RH ipotalamico dopo un breve periodo di flare-up (8,9). In tal modo bloccano la secrezione di estrogeni inducendo così atrofizzazione del tessuto endometriale uterino ed ectopico.
Gli analoghi possono presentare effetti collaterali da deprivazione estrogenica (menopausa iatrogena) come vampate di calore, irritabilità, depressione, insonnia, cefalee, demineralizzazione ossea. Per rimediare a questi effetti negativi è stata proposta una “add-back therapy” (38-39) cioè una contemporanea somministrazione di estrogeni . Tuttavia, nonostante l’importante e imprescindibile attività terapeutica, gli estrogeni in generale e l’estradiolo in primis, presentano un intensa attività inducente nei confronti delle cellule endometriali con iperplasia endometriale e aumentato rischio di carcinoma endometriale (56-59).
VIII. Integratori– i presidi terapeutici antistress e antiossidanti sono utilizzati come terapia complementare. La melatonina (Melatonina cpr 3, 5 mg, Melamil® gocce sublinguali) esercita un effetto inibitorio sulla secrezione di Gn-RH e delle gonadotropine. Un deficit di secrezione della melatonina o l’epifisiectomia in età pre-puberale causa l’insorgenza della pubertà precoce mentre in età adulta si accompagna ad ipergonadotropinemia. La melatonina inoltre possiede un elevato potere antiossidante; I radicali liberi sono importanti markers delle lesioni endometriosiche. Essi aggravano la patologia endometriosica attivando le citochine pro-infiammatorie (60,61).
IX. Immunomodulatori: agiscono direttamente sulla componente immunologica della malattia e dovrebbero rallentare per lungo tempo l’evoluzione della malattia. Gli studi però sono ancora controversi e troppi sono ancora gli aspetti oscuri della patogenesi dell’endometriosi per avere un target specifico.
X. Melatonina – Oltre a migliorare il sonno, la melatonina possiede proprietà anti-infiammatorie e antiossidanti, per tale motivo è efficace nel combattere l’endometriosi favorita invece dalla presenza di radicali liberi (60,61).
XI INIBITORI DELL’ANGIOGENESI –
L’angiogenesi è basata sulla crescita, la differenziazione e la migrazione delle cellule che rivestono la parete interna dei vasi sanguigni (cellule endoteliali). Questo processo è controllato da fattori di crescita specifici, detti fattori angiogenetici. Alcuni di essi, come il fattore di crescita dell’endotelio vascolare (identificato con la sigla VEGF, dall’inglese Vascular Endothelial Growth Factor), si legano ai recettori presenti normalmente sulla superficie delle cellule endoteliali. Il legame tra il fattore di crescita e il corrispondente recettore stimola la crescita cellulare favorendo la formazione e la sopravvivenza di nuovi vasi sanguigni. I fattori inibitori dell’angiogenesi anti-TNFα, inibitori delle Metalloproteasi e anti-VEGF. (ad esempio, l’angiostatina), invece, contrastano la formazione dei nuovi vasi sanguigni. Tali sostanze iniettate in circolo si legano ai recettori dei fattori angiogenetici e quindi esercitano la loro azione con meccanismo di competizione recettoriale (62-65). Attualmente i farmaci antiangiogenetici sono indicati per la terapia di mantenimento e per l’eradicazione dei residui focolai endometriosici.
Effetti collaterali degli anticorpi monoclonali anti-VEGF e recettori solubili (sVEGFr) – La neutralizzazione dei livelli fisiologici di VEGF con anticorpi monoclonali (bevacizumab) o con recettori VEGF solubili (aflibercept) può danneggiare il meccanismo della filtrazione glomerulare e conseguente proteinuria. Altri effetti collaterali importanti possono essere emorragie, trombosi e conseguente ictus cerebrali e infarto del miocardio, ipertensione arteriosa, difficoltà di cicatrizzazione delle ferite, e un disturbo cerebrale reversibile, chiamato sindrome leucoencefalopatica posteriore.
Queste pagine fanno parte del sito fertilitycenter.it in internet da marzo 2011. I testi, le tabelle, i disegni e le immagini pubblicati in queste pagine sono coperte da copyright ma a disposizione di tutti per copia e riproduzione purché venga citata la fonte con link al sito www.fertilitycenter.it. Ringrazio i lettori per la loro cortese attenzione e li prego di voler comunicare le loro osservazioni e consigli su eventuali errori o esposizioni incomplete.
Enzo Volpicelli
References:
- American College of Obstetricians and Gynecologists. (2010, reaffirmed 2018). Practice Bulletin No. 114: Management of endometriosis. Obstetrics & Gynecology, 116(1), 223–236. Retrieved February 11, 2020, from https://journals.lww.com/greenjournal/Citation/2010/07000/Practice_Bulletin_No__114__Management_of.41.aspx
- Practice Committee of the American Society for Reproductive Medicine. (2014). Treatment of pelvic pain associated with endometriosis: A committee opinion. Fertility and Sterility, 101(4), 927–935.
- Stratton, P., & Berkley, K. J. (2011). Chronic pelvic pain and endometriosis: Translational evidence of the relationship and implications. Human Reproduction Update, 17(3), 327–346. Retrieved February 11, 2020
- Hughes, E., Brown, J., Collins, J. J., Farguhar, C., Fedorkow, D. M., & Vandekerckhove, P. (2007). Ovulation suppression for endometriosis. Cochrane Database of Systematic Reviews, (3), Art. No. CD000155. Retrieved February 11, 2020,
- Olive DL, Pritts EA: Treatment of endometriosis. N Eng J Med, 2001; 345:266-275
- Hughes E, Fedorkow DM, Collins JA, Vandekerkhone P. Ovulation suppression for endometriosis (Cochrane Review). In: The Cochrane library, issue 2, 2004.
- Dunselman GA, et al. ESHRE guideline: management of women with endometriosis. Hum Reprod. 2014; 29:400-12..
- Johnson Neil P, et al. Consensus on current management of endometriosis. Human Reproduction. 2013. Vol.28, No.6 pp. 1552–1568.
- Leyland N, Casper R, Laberge P, Singh SS; SOGC. Endometriosis: diagnosis and management. J Obstet Gynaecol Can. 2010 Jul;32(7 Suppl 2):S1-32
- Kennedy S, Bergqvist A, Chapron C, et al. ESHRE guideline for the diagnosis and treatment of endometriosis. Hum Reprod. 2005;20(10):2698–2704.
- Practice Committee of the American Society for Reproductive Medicine. Endometriosis and infertility: a committee opinion. Fertil Steril. 2012 Sep;98(3):591-8.
- Harlow CR; Cahill DJ; Maile LA; Talbot WM; Mears J; Wardle PG; AD:University of Bristol, Dept of Obstetrics & Gynaecology, St Michael’s Hospital. Reduced preovulatory granulosa cell steroidogenesis in women with endometriosis. SO:J Clin Endocrinol Metab. 1996 Jan. 81(1). P 426-9.
- Rinesi L et al.:”Results of assisted reproductive technologies in patients with endometriosis”. Fertil Steril Jan 2002; 77,1:190-191.
- Buyalos RP, Agarwal SK (October 2000). “Endometriosis-associated infertility”. Current Opinion in Obstetrics & Gynecology12 (5): 377–81
- Dizerega GS, Barber DL, Hodgen GI: “Endometriosis: role of ovarian steroids in initiation, maintenance and suppression”. Fertil Steril 1980;33:649-53.
- Bulun SE, Cheng YH, Yin P, Imir G, Utsunomya H, Attar E, Innes J, Kim J: “Progesterone resistance in endometriosis: link to failure to metabolize estradiol”. Mol Cell Endocrinol 2006;248;94-103
- Gadkar-Sable S, Shah C, Rosario G, Sachdeva G, Puri C.: “Progesterone receptors: various forms and functions in reproductive tissues”. Front Biosci. 2005 Sep 1;10:2118-30.
- Muneyyirci-Delale O, Karacan M. Effect of norethindrone acetate in the treatment of symptomatic endometriosis. Int J Fertil Womens Med. 1998;43(1):24–27.
- Surrey E.S., Judd H.L.: Reduction of vasomotor symptoms and bone mineral density loss with combined norethindrone and long-acting gonadotropin-releasing hormone agonist therapy of symptomatic endometriosis: a prospective randomized trial. J Clin Endocrinol Metab 1992; 75:558-63
- V, Farquhar C, Prentice A, Singla A. Danazol for pelvic pain associated with endometriosis.Cochrane Database Syst Rev. 2007;4:
- Selak V, Farquhar C, Prentice A, Singla A. Danazol for pelvic pain associated with endometriosis. Cochrane Database Syst Rev. 2007;4:
- Biberoglu KO, Behrman SJ. Dosage aspects of danazol therapy in ednometriosis: short-term and long-term effectiveness. Am J Obstet Gynecol 1981; 139:645-54
- Moore EE, Harger JH et al. Management of pelvic endometriosis with low-dose danazol. Fertil Steril 1981; 36: 15-9.
- Attar E., Bulun S.E.: “Aromatase inhibitors: the next generation of therapeutics for endometriosis?”- Fertil Steril 2006;85:1307-18.
- Attar E, Bulun SE (May 2006). “Aromatase inhibitors: the next generation of therapeutics for endometriosis?”. Fertility and Sterility85 (5): 1307–18.
- Remorgida V, Abbamonte HL, Ragni N, Fulcheri E, Ferrero S. Letrozole and norethisterone acetate in rectovaginal endometriosis. Fertil Steril 2007;88:724-6.
- Visanne® Summary of Product Characteristics. 2010. [Accessed May 25, 2011].
- Adolf E Schindler Dienogest in long-term treatment of endometriosis Int J Womens Health. 2011; 3: 175–184.
- Harada T, Momoeda M, Taketani Y, et al. Dienogest is as effective as intranasal buserelin acetate for the relief of pain symptoms associated with endometriosis – a randomized, double-blind, multicenter, controlled trial. Fertil Steril. 2009;91(3):675–681.
- Schindler AE, Christensen B, Henkel A, Oettel M, Moore C. High-dose pilot study with the novel progestogen dienogestin patients with endometriosis. Gynecol Endocrinol. 2006;22(1):9–17.
- Kitawaki J, Kusuki I, Yamanaka K, Suganuma I. Maintenance therapy with dienogest following gonadotropin-releasing hormone agonist treatment for endometriosis-associated pelvic pain. Eur J Obstet Gynecol Reprod Biol. 2011 April 5;
-
Lippert TH, Mueck AO. The clinical importance of dienogest. In: Teichmann AT, editor. Dienogest – Preclinical and Clinical Features of a New Progestogen. Berlin, Germany: Walter de Gruyter; 1995.
-
Mueck AO. What makes dienogest a unique progestogen for the treatment of endometriosis? Gynaecol Forum. 2010;15(2):18–23.
-
Oettel M, Breitbarth H, Elger W, et al. The pharmacological profile of dienogest. Eur J Contracept Reprod Health Care. 1999;4(S1):2–13.
-
Köhler G, Faustmann TA, Gerlinger C, Seitz C, Mueck AO. A dose-ranging study to determine the efficacy and safety of 1, 2, and 4 mg of dienogest daily for endometriosis. Int J Gynaecol Obstet.2010;108(1):21–25.
-
Sasagawa S, Shimizu Y, Kami H, et al. Dienogest is a selective progesterone receptor agonist in transactivation analysis with potent oral endometrial activity due to its efficient pharmacokinetic profile.Steroids. 2008;73(2):222–231.
-
Klipping C, Duijkers I, Faustmann T, Klein SF, Schuett B. Pharmacodynamic study of four oral dosages of dienogest. Fertil Steril. 2010;94 (Suppl 1):S181.
-
Katayama H, Katayama T, Uematsu K, et al. Effect of dienogest administration on angiogenesis and hemodynamics in a rat endometrial autograft model. Hum Reprod. 2010;25(11):2851–2858.
-
Harada T, Taniguchi F. Dienogest: A new therapeutic agent for the treatment of endometriosis.Womens Health (Lond Engl) 2010;6(1):27–35.
-
Nakamura M, Katsuki Y, Shibutani Y, Oikawa T. Dienogest, a synthetic steroid, suppresses both embryonic and tumor-cell-induced angiogenesis. Eur J Pharmacol. 1999;386(1):33–40.
-
Okada H, Nakajima T, Yoshimura T, Yasuda K, Kanzaki H. The inhibitory effect of dienogest, a synthetic steroid, on the growth of human endometrial stromal cells in vitro. Mol Hum Reprod.2001;7(4):341–347.
-
Fu L, Osuga Y, Morimoto C, et al. Dienogest inhibits BrdU uptake with G0/G1 arrest in cultured endometriotic stromal cells. Fertil Steril. 2008;89 (Suppl 5):1344–1347.
-
Shimizu Y, Mita S, Takeuchi T, Notsu T, Mizuguchi K, Kyo S. Dienogest, a synthetic progestin, inhibits prostaglandin E(2) production and aromatase expression by human endometrial epithelial cells in a spheroid culture system. Steroids. 2011;76(1–2):60–67.
-
Tatsumi H, Kitawaki J, Tanaka K, Hosoda T, Honjo H. Lack of stimulatory effect of dienogest on the expression of intercellular adhesion molecule-1 and vascular cell adhesion molecule-1 by endothelial cell as compared with other synthetic progestins. Maturitas. 2002;42(4):287–294.
-
Momoeda M, Taketani Y. Randomized double-blind, multicentre, parallel-group dose–response study of dienogest in patients with endometriosis. Jpn Pharmacol Ther. 2007;35:769–783.
-
Strowitzki T, Faustmann T, Gerlinger C, Seitz C. Dienogest in the treatment of endometriosis-associated pelvic pain: A 12-week, randomized, double-blind, placebo-controlled study. Eur J Obstet Gynecol Reprod Biol. 2010;151(2):193–198.
-
Cosson M, Querleu D, Donnez J, et al. Dienogest is as effective as triptorelin in the treatment of endometriosis after laparoscopic surgery: Results of a prospective, multicenter, randomized study. Fertil Steril. 2002;77(4):684–692.
- Petraglia F, Hornung D, Seitz C, et al. Reduced pelvic pain in women with endometriosis: efficacy of long-term dienogest treatment. Arch Gynecol Obstet. 2011 June 17
- Järvelä, I, Tekay, A, Jöuppilä, P: The effect of a levonorgestrel intrauterine system on uterine artery blood flow, hormone concentrations and ovarian cyst formation in fertile women. Hum. Reprod. 13, 3379–3383 (1998)
- Pakarinen P, et al: The effect of local intrauterine levonorgestrel administration on endometrial thickness and uterine blood circulation. Human Reprod 1995;10,2390-2393.
- Fedele L et al. Use of a levonorgestrel-releasing intrauterine device in the treatment of rectovaginal endometriosis. Fertil Steril 2001;75:505-8
- Zalel, Y, Shulman, A, Lidor, A, Achiron, R, Mashiach, S, Gamzu, R: The local progestational effect of the levonorgestrel-releasing intrauterine system; a sonographic and Doppler flow study. Hum. Reprod. 17, 2878–2880 (2002).
- Jones, RL, Critchley, HO: Morphological and functional changes in human endometrium following intrauterine levonorgestrel delivery. Hum. Reprod. 15(Suppl. 3), 162–172 (2000).
- Vercellini P et al. A levonorgestrel-releasing intrauterine system for the treatment of dysmenorrea associated with endometriosis: a pilot study. Fertil Steril 1999;72:505-8
- Roopa, BA, Loganath, A, Singh, K: The effect of a levonorgestrel-releasing intrauterine system on angiogenic growth factors in the endometrium. Hum. Reprod. 18, 1809–1819 (2003).
- Dienogest in the treatment of endometriosis: systematic review. Andres Mde P, Lopes LA, Baracat EC, Podgaec S.Arch Gynecol Obstet. 2015 Sep; 292(3):523-9. Epub 2015 Mar 8
- Lockhat, FB, Emembolu, JO, Konje, JC: The evaluation of the effectiveness of an intrauterine-administered progestogen (levonorgestrel) in the symptomatic treatment of endometriosis and in the staging of the disease. Hum. Reprod. 19, 179–184 (2004).
- Lockhat, FB, Emembolu, JO, Konje, JC: The efficacy, side-effects and continuation rates in women with symptomatic endometriosis undergoing treatment with an intra-uterine administered progestogen (levonorgestrel): a 3 year follow-up. Hum. Reprod. 20, 789–793 (2005).
- Lockhat, FB, Emembolu, JE, Konje, JC: Serum and peritoneal fluid levels of levonorgestrel in women with endometriosis who were treated with an intrauterine contraceptive device containing levonorgestrel. Fertil. Steril. 83, 398–404 (2005).
- Friedman A.J., Hornstein M.D.: Gonadotropin-releasing hormone agonist plus estrogen-progestin “add-back” therapy for endometriosis-related pelvic pain. Fertil Steril 1993;60:236-41.
- Friedman A.J., Hornstein M.D.: Gonadotropin-releasing hormone agonist plus estrogen-progestin “add-back” therapy for endometriosis-related pelvic pain. Fertil Steril 1993;60:236-41.
- Edmonds D.K.: Add-back therapy in the treatment of endometriosis: the European experience. Br J Obstet Gynaecol 1996; 103 Suppl: 10-3.
- Edmonds D.K.: Add-back therapy in the treatment of endometriosis: the European experience. Br J Obstet Gynaecol 1996; 103 Suppl: 10-3.
- Guney M, Oral B, Karahan N, Mungan T: “Regression of endometrial explant in a rat model of endometriosis treated with melatonin”. Fertil Steril 2008;89:934-42
- Yildrim G., Attar R., Ozkan F., Kumbak B., Ficicioglu C. and Yesiladglar N.: “The effect of letrozole and melatonin on surgically induced endometriosis in a rat model: a preliminar study”. Fert Steril 93(6),April 2010;1787-1792.
- M L Hull et al: Antiangiogenic Agents Are Effective Inhibitors of Endometriosis – JCEM 2003; 88,6
- X Fun et al: VEGF blockade inhibits angiogenesis and reepithelialization of endometrium. The FASEB Journal 2008;22;10:3571-3580
-
Hikaru Sugimoto et al: Neutralization of Circulating Vascular Endothelial Growth Factor (VEGF) by Anti-VEGF Antibodies and Soluble VEGF Receptor 1 (sFlt-1) Induces Proteinuria. J Biol Chem 2003;278, 12605-12608.
-
N Murukesh , C Dive and GC Jayson Biomarkers of angiogenesis and their role in the development of VEGF inhibitors. Br J Cancer . 2010 Jan 5; 102(1): 8–18.
-
Starczewski A, Brodowska A, Brodowski [Pharmacotherapy for pelvic endometriosis in women]. Pol Merkur Lekarski. 2009 Mar;26(153):231-3.





1 commento
magnificent issues altogether, you just received a logo new reader.
What would you suggest about your post that you simply made a few days ago?
Any positive?