- riduzione dell’ipertono dell’LH
- riduzione dell’iperinsulinemia
- riduzione dell’iperandrogenemia.
2. Ovariostatici: estro-progestinici, Gn-RH-analoghi + E-P
3. Insulino-sensibilizzanti: metformina. Le pazienti PCOS con livelli di androgeni normali non sono insulino-resistenti e quindi non richiedono terapia con metformina. Ancor più efficace risulta l’azione della metformina se associata alla simvastatina (Liponorm® cpr 10, 20 mg): 20 mg al giorno in combinazione con metformina 500 mg tre volte al dì. La valutazione di efficacia è effettuata osservando le variazioni dei livelli sierici di androgeni (testosterone, androstendione e deidro-epiandrostenion solfato-DHEAS), LH, FSH, rapporto LH/FSH e insulino-resistenza (IR), oltre alla regolarizzazione del ciclo mestruale, irsutismo, BMI, ovulazione spontanea (69).
4. Induttori dell’ovulazione: Clomifene citrato e/o gonadotropine, Gn-RH pulsatile
6. Normalizzazione dell’indice di massa corporea (BMI) e diminuzione di peso: dieta da 1700-2000 KCal, ipolipidica, ipoglicidica, ricca di acqua, verdure e frutta di stagione; ginnastica aerobica; inositolo [2]
-
riduzione dei livelli di androgeni che già da sola è capace di ripristinare l’ovulazione.
-
riduzione di tutte le complicazioni dell’obesità in pazienti con PCOS come la ridotta tolleranza al glucosio, insulino-resistenza, iperinsulinemia, dislipidoproteinemia e il possibile sviluppo di tumori estrogeno-dipendenti.
-
Le donne PCOS presentano obesità nel 35-60% dei casi. Si tratta di obesità androgina, centrale, con accumulo di grasso nella zona delle spalle e addominale con inversione del normale rapporto vita/fianchi a favore del primo. Un notevole miglioramento si evidenzia già con BMI <30 e con calo di peso del 5%.. Le donne PCOS obese hanno però notevole difficoltà a diminuire di peso nonostante una severa dieta ipocalorica e ciò per un rallentato metabolismo di base che diminuisce ancora di più con la dieta ipocalorica (2). Tuttavia, la perdita di peso è consigliata solo per coloro che sono in sovrappeso con un BMI> 25-27 kg / m2. E’ di fondamentale importanza associare una discreta ma assolutamente costante, quotidiana attività fisica aerobica tipo camminare a passo svelto, step, salire le scale, jogging, salto con la fune, ginnastica aerobica (2,37-39).
2. Contraccettivi orali: l’associazione E-P è indicata soprattutto nelle giovani pazienti con disturbi del ciclo e con segni di iperandrogenismo molto lievi. I contraccettivi orali (CO) sono efficaci soprattutto come terapia sintomatica nel ristabilire la normalità dei cicli sperando che continuino ad essere normali anche dopo la sospensione della terapia estroprogestinica. La terapia con i soli contraccettivi è efficace anche nel trattamento dell’acne in forma lieve; la loro combinazione con gli antiandrogeni è utile per il trattamento dell’acne cistica moderatamente severa e irsutismo, così come per l’alopecia androgenica quando associata ad iperandrogenismo. La terapia con E-P in 12 mesi riduce il Ferriman-Gallway score del 50% senza indurre alterazioni del lipidogramma mentre l’associazione con CPA (Ciptroterone acetato, Androcur® cpr 50 mg) induce un lieve aumento dei trigliceridi (35). I CO infine riducono l’incidenza di tumori ovarici ed endometriali. Purtroppo l’esperienza insegna che gli E-P difficilmente producono un effetto duraturo anzi spesso la sintomatologia si ripresenta aggravata dopo la sospensione della terapia. Ciò sembra dovuto principalmente ad un incremento dell’insulino-resistenza, iperinsulinemia, ridotta tolleranza al glucosio e agli effetti negativi sul profilo lipidico. Per tali motivi la terapia con E-P può costituire non il trattamento ideale ma una necessità estemporanea, limitata a una durata non superiore ai 3 anni e va sempre associata a misure dietetiche e terapia fisica.
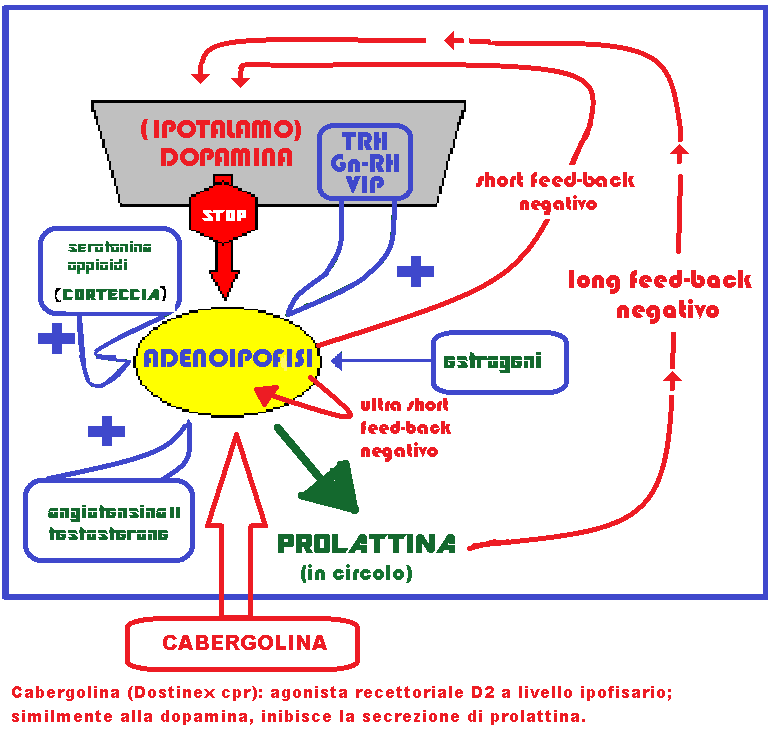
Meccanismo d’azione dei CO: soppressione della secrezione ipofisaria di gonadotropine, soprattutto dell’LH che comporta:
-
- riduzione della sintesi degli androgeni di origine ovarica: androstenedione (50% ovaio e 50% surrene) e testosterone (25% ovaio, 25% surrene e 50% dalla conversione periferica dell’androstenedione a livello di fegato, milza e tessuto adiposo).
- Stimolazione della sintesi epatica di SHBG con conseguente riduzione della quota libera di testosterone (fT, free-testosterone).
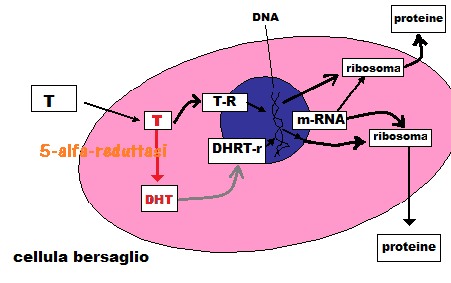
- Incremento della secrezione di IGF-BP-1 (IGF-binding proteins) e quindi allungamento dell’emivita di IGF-I, II e III (Insulin Growth Factor I, II, III) da 10 minuti a 3-4 ore. IGFs sono prodotti dal fegato sotto lo stimolo dell’ormone della crescita (GH). Agiscono stimolando l’attività dei condrociti nella sintesi della cartilagine, diminuzione della 5-α-reduttasi, che trasforma il testosterone nel più potente DHT (diidrotestosterone) e dei recettori per gli gli androgeni. IGF-I e IGF-II inoltre deprimono l’insulino-resistenza (diminuzione della sensibilità dei recettori insulinici con conseguente iperglicemia ⇒ iperinsulinemia ⇒ esaurimento delle cellule beta del pancreas ⇒ diabete II) ed esplicano un’azione insulino-simile a livello del tessuto adiposo e dei muscoli scheletrici. Il tessuto muscolare rappresenta la sede principale dell’insulino-resistenza periferica; tuttavia durante l’attività fisica questo tessuto perde la sua dipendenza dall’insulina ed il glucosio riesce ad entrare nelle cellule muscolari anche in presenza di livelli insulinemici particolarmente bassi.
Contraccettivi orali contenenti, oltre agli estrogeni, rispettivamente desogestrel (Gracial 22 cpr, Dueva 22 cpr), ciproterone acetato (Diane 21 cpr), drospirenone (Mercilon, Yasmine 21 cpr, Yasminelle 21 cpr, Drosure 21 cpr, Drospil 28 cpr, Yaz 28 cpr) hanno effetti simili; Aglae 28 cpr (etinilestradiolo 0,03 mg + Dienogest 2 mg) (25).
|
Tab. 1 – SOMMINISTRAZIONE di PCA/EE con SCHEMA SEQUENZIALE INVERSO
|
|||||||||||||||||||||||||||
|
1
|
2
|
3
|
4
|
5
|
6
|
7
|
8
|
9
|
10
|
11
|
12
|
13
|
14
|
15
|
16
|
17
|
18
|
19
|
29
|
21
|
22
|
23
|
24
|
25
|
26
|
27
|
28
|
| CPA** | CPA | CPA | CPA | CPA | CPA | CPA | CPA | CPA | CPA | ||||||||||||||||||
| ee | ee | ee | ee | ee | eeee | eeee | eeee | eeee | eeee | eeee | eeee | eeee | eeee | eeee | ee | ee | ee | ee | ee | ee | ee | ee | ee | ee | ee | ee | ee |
|
** CPA 50 mg
|
+ Etinilestradiolo AMSA cpr 10 µg
|
||||||||||||||||||||||||||
|
Tab. 2 – CPA effetti collaterali
|
|
|
|
|
|
|
|
9. Resveratrolo (Biovea® cpr 40 mg) – polifenolo naturale presente soprattutto nel polygonium (da cui normalmente è estratto) e nell’uva, dotato di numerosi effetti metabolici positivi: antiossidante, antinfiammatorio, bilancia il profilo lipidico abbassando i livelli sierici di colesterolo, diminuisce l’adiposità, favorisce la sintesi del collagene donando tono ed elasticità alla cute e riduce l’insulino-resistenza. Il resveratrolo aumenta nei muscoli scheletrici il livello di mRNA dei recettori estrogenici di tipo α, diminuiti nella PCOS (67-69)
10. Integratori vari: PCOS capsule® (D – CHIRO Inositolo (475 mg), vitamina D3 (5,8 μg), acido folico (210 μg), vitamina B6 (1,6 mg). vitamina B12 (2,88 μg), acido pantotenico (7,12 mg), biotina (58 μg) e manganese (2 mg). non in commercio in Italia
- Clomifene citrato: Nelle pazienti PCOS che desiderano la gravidanza il farmaco di prima intenzione è il clomifene citrato (Clomid® cpr 50 mg dal 5° giorno del ciclo per 5 giorni) che induce l’ovulazione nel 70-85% delle pazienti e la gravidanza interviene nel 30-35% dei casi. Queste differenze di risultati fra ovulazione e PR sono attribuite agli effetti antiestrogenici di CC, principalmente sull’endometrio e sul muco cervicale. Il trattamento con CC è economico, semplice, ha pochi effetti collaterali negativi e richiede un facile e semplice monitoraggio. E’ indicato nelle pazienti con PCOS e anovulazione con livelli normali di FSH, ma ha alcuni limiti nelle pazienti con un BMI >30 ed età avanzata. Il CC di norma induce un incremento della frequenza del rilascio pulsato di gonadotropine (LH, FSH) mentre nelle pazienti con PCOS determina un aumento dell’ampiezza del rilascio di gonadotropine (44-53).
- Il Tamoxifene è un altro agente ovulatorio per assunzione orale simile al CC come meccanismo d’azione, ma manca l’effetto antiestrogenico sulla cervice e l’endometrio. Può essere utilizzato come alternativa al CC in caso di resistenza al CC. Il TMX è commercializzato in Italia con il nome di Nolvadex® che si presenta in forma di compresse da 10 e 20 mg. Il TMX benchè agisca come antagonista estrogenico sulla mammella, agisce come agonista su altri organi estrogeni positivi, come l’endometrio. Alcuni studi hanno dimostrato che le pazienti che assumono tamoxifene in dosi elevate per un lungo periodo hanno un rischio leggermente accresciuto di sviluppare ispessimento dell’endometrio >5 mm, iperplasia endometriale con atipie, polipi endometriali, endometriosi e leiomiomi (40-43).
- Gn–RH (Gonadotropin-Releasing Hormone) pulsatile: stimola la produzione ipofisaria di gonadotropine nelle pz. PCOS con ipogonadismo ipogonadotropo (bassi livelli sierici di gonadotropine ed estrogeni). Si somministra s.c. o e.v. con microiniettore programmato per iniettare il farmaco nelle 24 ore in modo pulsatile, mimando il fisiologico ritmo di rilascio ipotalamico, ad intervalli di tempo prestabiliti: 5-10 mg/60’ in fase follicolare e ogni 90’ in fase luteale. L’induzione dell’ovulazione è ottenuta mediante HCG 5.000 UI (13-22).
- Gonadotropine di estrazione o ricombinanti: generalmente si utilizzano dopo fallimento del CC. La paziente può rispondere alla somministrazione delle gonadotropine in maniera totalmente differente: infatti, se da un lato la paziente affetta da PCOS può non avere nessuna o comunque scarsa risposta ovarica, dall’altro può avere, in qualsiasi momento del ciclo di stimolazione con gonadotropine, una risposta ovarica definita “esplosiva”. Pertanto, la PCOS può essere considerata una condizione ad alto rischio per la OHSS e per le gravidanze multigemellari. Le più recenti linee guida per l’induzione dell’ovulazione nelle donne con PCOS raccomandano: una dose iniziale di gonadotropine di 37,5-50 UI/die con successivo incremento della dose iniziale dopo 7 giorni di trattamento; incremento graduale del 50% della dose di farmaco. Durata del trattamento non superiore a sei cicli; monitoraggio stretto della risposta al fine di prevenire e ridurre le complicanze.
10. Farmaci antiobesità
- Orlistat® cpr 60 mg: 1 cprx3/die contrasta l’assorbimento intestinale dei grassi alimentari,
- Armolipid plus® cpr abbassa i livelli sierci di colesterolo e trigliceridi con un meccanismo simile alle statine. La chirurgia bariatrica è stato recentemente studiata nella PCOS e potrebbe offrire ulteriori opzioni di trattamento per il futuro.
11. Antagonisti recettoriali delle β-endorfine: naltrexone (Mysimba®: cpr a rilascio prolungato: 7,2 mg di naltrexone e 78 mg di bupropione); agiscono sulle aree cerebrali che regolano l’assunzione di cibo e l’equilibrio energetico, oltre a ridurre l’attività dei centri cerebrali che controllano la sensazione di piacere associata al consumo di cibo. Mysimba riduce iperglicemia e iperinsulinemia, regolarizza il BMI e ripristina la normalità del ciclo in donne PCOS (41).. La risposta al trattamento e la tollerabilità del medicinale devono essere monitorate periodicamente; nei pazienti che sviluppano taluni effetti indesiderati, come un aumento della pressione arteriosa, il trattamento deve essere interrotto. Il trattamento con Mysimba deve inoltre essere interrotto se i pazienti non hanno perso almeno il 5% del peso corporeo iniziale dopo 4 mesi di terapia. Ricetta RNRL – medicinali soggetti a prescrizione medica limitativa, da rinnovare volta per volta, vendibili al pubblico su prescrizione di centri ospedalieri o di specialisti.
- Prima settimana: una compressa al mattino
- Seconda settimana: una compressa al mattino e una compressa la sera
- Terza settimana: due compresse al mattino e una compressa la sera
- Dalla quarta settimana in poi: due compresse al mattino e due compresse la sera
Le catechine inibiscono la 5-α-reduttasi di tipo 1 (ma non quella di tipo 2) con conseguente inibizione della trasformazione del testosterone nel più potente diidrotestosterone (DHT).
- Biodermatin bustine: una bustina al dì oppure
- Liposkin cpr: una compressa mattina e sera
- Delicata detersione cutanea quotidiana[1]
- Scrub esfoliante: 2 volte a settimana[2]
- crema reidratante[3] dopo aver utilizzato lo scrub
- Oleoskin bagno-doccia
- Latte o crema solare specifici[4]
ARTICOLI CORRELATI

Queste pagine fanno parte del sito fertilitycenter.it in internet da marzo 2011. I testi, le tabelle, i disegni e le immagini pubblicati in queste pagine sono coperte da copyright ma a disposizione di tutti per copia e riproduzione purchè venga citata la fonte con link al sito www.fertilitycenter.it.
Ringrazio i lettori per la loro cortese attenzione e li prego di voler comunicare le loro osservazioni e consigli su eventuali errori o esposizioni incomplete.
Enzo Volpicelli
- Venturoli S, Mancini F, Ravaioli B, Colombo FM, Bagnoli A, Vianello F e Missiroli S: “Il trattamento degli iperandrogenismi dell’adolescenza e prognosi per la fertilità”. Contraccezz Fertil Sessual 2001;28,1:31-37.
- Cheryce L. Harrison, Exercise therapy in polycystic ovary syndrome: a systematic review. Human Reproduction Update, Volume 17, Issue 2, March-April 2011, Pages 171–183,
- Rotterdam ESHRE/ASRM-Sponsored PCOS Consensus Workshop Group. Revised 2003 consensus on diagnostic criteria and long-term health risks related to polycystic ovary syndrome”. Fertil Steril 2004;81:19-25.
- Sahin Y, Yirmibes U, Kelestimur F, Aygen E.: “The effects of metformin on insulin resistance, clomiphene-induced ovulation and pregnancy rates in women with polycystic ovary syndrome”. European Journal of Obstetrics & Gynecology and Reproductive Biology, Volume 113, Issue 2, Pages 214 – 220.
- Glueck CJ et al: “Continuing metformin throughout pregnancy in women with polycystic ovary syndrome appears to safely reduce first-trimester spontaneous abortion: a pilot study”. Fertil Steril 2001;75,1:46-52.
- Dunaif A: “Insulin resistance and the polycystic ovary syndrome : mechanism and implications for pathogenesis . Endocr. Rev. 1997,18:774-800.
- Fulghesu AMet al: “A new ultrasound criterion for the diagnosis of polycystic ovary syndrome: the ovarian stroma/total area ratio”. Fertil Steril 2001;76:326-331.
- Amer SA, Banu Z, Li TC, Cooke ID.: “Long-term follow-up of patients with polycystic ovary syndrome after laparoscopic ovarian drilling: endocrine and ultrasonographic outcomes”. Hum Reprod 2002 Nov;17(11):2851-7.
- Do YS et al: “Human ovaria theca cells are a source of renin”. Proc Nat Acad Sci USA;1988;85:1957-1961.
- Townsend RR, Dipette DJ, Lyeux TR, Wolfe RR: “The role of the renin-angiotensin System in insulin sensitivity in normotensive subjects”. Am J Med Sci 1993;305:67-71.
- Abraham G.E.: “Ovarian and adrenal contribution to peripheral steroids during the menstrual cycle in two hyrsute women”, Obstet, Gynecol, (N.Y.) 46, 29-33,1975.
- Paradisi R., Venturoli S., Fabbri R., Gammi L., Saviotti E., Flamigni C: “Somministrazione di glucocorticoidi in soggetti iperandrogenici con LH elevato ed LH nella norma”. Fertilità e Sterilità, Atti del VI Corso di Aggiornamento. Cofese ediz. 1982.
- Campbell RE, Gaidamaka G, Han SK, Herbison AE (June 2009). “Dendro-dendritic bundling and shared synapses between gonadotropin-releasing hormone neurons”. Proc. Natl. Acad. Sci. U.S.A. 106 (26): 10835–40.
- Brown RM (1994). An introduction to Neuroendocrinology. Cambridge, UK: Cambridge University Press. ISBN 0-521-42665-0.
- Dungan HM, Clifton DK, Steiner RA (March 2006). “Minireview: kisspeptin neurons as central processors in the regulation of gonadotropin-releasing hormone secretion”. Endocrinology 147 (3): 1154–8.
- Franceschini I, Lomet D, Cateau M, Delsol G, Tillet Y, Caraty A (July 2006). “Kisspeptin immunoreactive cells of the ovine preoptic area and arcuate nucleus co-express estrogen receptor alpha”. Neurosci. Lett. 401 (3): 225–30.
- Yang-Feng TL, Seeburg PH, Francke U (1986). “Human luteinizing hormone-releasing hormone gene (LHRH) is located on short arm of chromosome 8 (region 8p11.2—-p21)”. Somat. Cell Mol. Genet.
- TustsumiR., Webster NJ: “GnRH pulsatility, the pituitary response and reproductive dysfunction” Endocr J. 2009;56(6):729-37. Epub 2009 Jul 17.
- Santoro N, Wierman ME, Filicori M, Waldstreicher J, Crowley WF Jr. Intravenous administration of pulsatile gonadotropin-releasing hormone in hypothalamic amenorrhea: effects of dosage. J Clin Endocrinol Metab. 1986 Jan;62(1):109-16.
- Homburg R, Eshel A, Armar NA, Tucker M, Mason PW, Adams J, Kilborn J, Sutherland IA, Jacobs HS. One hundred pregnancies after treatment with pulsatile luteinising hormone releasing hormone to induce ovulation. BMJ. 1989 Mar 25;298(6676):809-12.
- Filicori M, Flamigni C, Meriggiola MC, Ferrari P, Michelacci L, Campaniello E, Valdiserri A, Cognigni G. Endocrine response determines the clinical outcome of pulsatile gonadotropin-releasing hormone ovulation induction in different ovulatory disorders. J Clin Endocrinol Metab. 1991 May;72(5):965-72.
- Filicori M, Flamigni C, Meriggiola MC, Cognigni G, Valdiserri A, Ferrari P, Campaniello E. Ovulation induction with pulsatile gonadotropin-releasing hormone: technical modalities and clinical perspectives. Fertil Steril. 1991 Jul;56(1):1-13. Review. No abstract available.
- Suzuki S, Kawasaki H, Satoh Y, et al: “Urinary chiro-inositol excretion is an index marker of insulin sensitivity in Japanese type II diabetes. Diabetes Care 1994;17:1465-1468.
-
Nestler JE, Jakubowicz DJ, Reamer P, Gunn RD, Allan G: “Ovulatori and metabolic effects of d-Chiro-Inositol in the Polycystic Ovary Sindrome”. N Engl J Med; Massachusetts Medical Society Volume 340(17),29 April 1999, pp 1314-1320.
- Comparative study of the therapeutic effects of oral contraceptive pills containing desogestrel, cyproterone acetate, and drospirenone in patients with polycystic ovary syndrome. Fertility and Sterility 2012 Jul 13
- Graham HN: Green tea composition, consumption, and polyphenol chemistry, Prev Med 1992 May;21(3):334-50
- Kaneko S et al: Molecular and Sensory Studies on the Umami Taste of Japanese Green Tea, J. Agric. Food Chem.. 2006 Apr 5;54(7):2688-94
- Khan SA et al: Influence of green tea on enzymes of carbohydrate metabolism, antioxidant defense, and plasma membrane in rat tissues, Nutrition 2007 Sep;23(9):687-95,
- Maron DJ et al: Cholesterol-lowering effect of a theaflavin-enriched green tea extract: a randomized controlled trial, Arch Intern Med 2003 Jun 23;163(12):1448-53
- Nagao T et al: Ingestion of a tea rich in catechins leads to a reduction in body fat and malondialdehyde-modified LDL in men, Am J Clin Nutr 2005 Jan;81(1):122-9
- Nagao T et al: Green tea extract high in catechins reduces body fat and cardiovascular risks in humans, Obesity (Silver Spring) 2007 Jun;15(6):1473-83
- Dulloo AG et al: Efficacy of a green tea extract rich in catechin polyphenols and caffeine in increasing 24-h energy expenditure and fat oxidation in humans, Am J Clin Nutr 1999 Dec;70(6):1040-5
- Venables MC et al: Green tea extract ingestion, fat oxidation, and glucose tolerance in healthy humans, Am J Clin Nutr 2008 Mar;87(3):778-84
- Sueoka N et al: A new function of green tea: prevention of lifestyle-related diseases, Ann N Y Acad Sci. 2001 Apr;928:274-80
- Burckhardt IC, IC, Gozal D, Dayyat E et al: Green tea catechin polyphenols attenuate behavioral and oxidative responses to intermittent hypoxia, Am J Respir Crit Care Med 2008 May 15;177(10):1135-41.
-
Patel SM, Nestler JE. Fertility in polycystic ovary syndrome. Endocrinol Metab Clin North Am. 2006;35(1):137–155. vii.
-
Moran LJ, Brinkworth G, Noakes M, Norman RJ. Effects of lifestyle modification in polycystic ovarian syndrome. Reprod Biomed Online. 2006;12(5):569–578.
-
Bruner B, Chad K, Chizen D. Effects of exercise and nutritional counseling in women with polycystic ovary syndrome. Appl Physiol Nutr Metab. 2006;31(4):384–391.
-
Reaven GM. The insulin resistance syndrome: definition and dietary approaches to treatment. Annu Rev Nutr. 2005;25:391–406.
-
Dilts PV, Jr Hopkins MP, Chang AE, Cody RL “Rapid growth of leiomyoma in patient receiving tamoxifen.” Am J Obstet Gynecol 166 (1992): 167-8
-
Timmerman D, Vergote I “Tamoxifen-induced endometrial polyp.” N Engl J Med 335 (1996): 1650
-
Jordan VC, Morrow M “Should clinicians be concerned about the carcinogenic potential of tamoxifen?” Eur J Cancer 30A (1994): 1714-21
-
Ugwumadu AH, Bower D, Ho PK “Tamoxifen induced adenomyosis and adenomyomatous endometrial polyp.” Br J Obstet Gynaecol 100 (1993): 386-8
-
Legro RS, Barnhart HX, Schlaff WD, et al. Clomiphene, metformin, or both for infertility in the polycystic ovary syndrome. N Engl J Med. 2007;356(6):551–566.
-
Hwu YM, Lin SY, Huang WY, Lin MH, Lee RK. Ultra-short metformin pretreatment for clomiphene citrate-resistant polycystic ovary syndrome. Int J Gynaecol Obstet. 2005;90(1):39–43.
-
Creanga AA, Bradley HM, McCormick C, Witkop CT. Use of metformin in polycystic ovary syndrome: a meta-analysis. Obstet Gynecol. 2008;111(4):959–968.
-
Moll E, Bossuyt PM, Korevaar JC, Lambalk CB, van der Veen F. Effect of clomifene citrate plus metformin and clomifene citrate plus placebo on induction of ovulation in women with newly diagnosed polycystic ovary syndrome: randomised double blind clinical trial. BMJ. 2006;332(7556):1485.
-
Palomba S, Orio F, Jr, Zullo F. What is the best first-step therapeutic approach in treating anovulatory infertility in patients with polycystic ovary syndrome? Questions that are still unanswered. Gynecol Endocrinol. 2007;23(5):245–247.
-
Glueck CJ, Wang P, Goldenberg N, Sieve-Smith L. Pregnancy outcomes among women with polycystic ovary syndrome treated with metformin. Hum Reprod. 2002;17(11):2858–2864.
-
Harborne LR, Sattar N, Norman JE, Fleming R. Metformin and weight loss in obese women with polycystic ovary syndrome: comparison of doses. J Clin Endocrinol Metab. 2005;90(8):4593–4598.
-
Grundy SM. Obesity, metabolic syndrome, and coronary atherosclerosis. Circulation. 2002;105(23):2696–2698.
-
Sam S, Dunaif A. Polycystic ovary syndrome: syndrome XX? Trends Endocrinol Metab. 2003;14(8):365–370.
-
Messinis IE. Ovulation induction: a mini review. Hum Reprod. 2005;20(10):2688–2697.
- Francesco Borgese, Gli elementi della tavola periodica. Rinvenimento, proprietà, usi. Prontuario chimico, fisico, geologico, Roma, CISU, 1993, ISBN 88-7975-077-1.
- R. Barbucci, A. Sabatini e P. Dapporto, Tavola periodica e proprietà degli elementi, Firenze, Edizioni V. Morelli, 1998.
- Alfredo Bonsignore e Franco Ottenga, Medicina del lavoro, ECIG, 2002, ISBN 978-88-7545-929-1.
- Falsetti L, Gambera A, Platto C, Legrenzi L. Management of hirsutism. Am J Clin Dermatol. 2000;1(2):89–99.
-
Spritzer PM, Lisboa KO, Mattiello S, Lhullier F. Spironolactone as a single agent for long-term therapy of hirsute patients. Clin Endocrinol (Oxf) 2000;52(5):587–594.
-
Lobo RA, Shoupe D, Serafini P, Brinton D, Horton R. The effects of two doses of spironolactone on serum androgens and anagen hair in hirsute women. Fertil Steril. 1985;43(2):200–205.
-
Cinar N et al., Adrenocortical steroid response to ACTH in different phenotypes of non-obese polycystic ovary syndrome, 2012 Dec 7; J Ovarian Res.
-
Choi SW, et al., Association between a single nucleotide polymorphism in MTHFR gene and polycystic ovary syndrome, 2009 Jul; Eur J Obstet Gynecol Reprod Biol.
-
Jain M et al., MTHFR C677T polymorphism is associated with hyperlipidemia in women with polycystic ovary syndrome, 2012 Jan; J Hum Reprod Sci.
-
Lim SS et al., The effect of obesity on polycystic ovary syndrome: a systematic review and meta-analysis, 2013 Feb, Obes Rev.
- Stener-Victorin E., Jedel E., Mannera ° s L. (2008) Agopuntura nella sindrome dell’ovaio policistico: Current Experimental and Clinical Evidence Journal of Neuroendocrinology 20 , 290-298
- Szkudelska K., Szkudelski T. “Resveratrol, obesity and diabetes,” European Journal of Pharmacology, vol. 635, no. 1–3, pp. 1–8, 2010
- Chen L. L., Zhang H. H., Zheng J., et al. , “Resveratrol attenuates high-fat diet-induced insulin resistance by influencing skeletal muscle lipid transport and subsarcolemmal mitochondrial beta-oxidation,” Metabolism, vol. 60, pp. 1598–1609, 2011
- Lagouge M., Argmann C., Gerhart-Hines Z., et al. , “Resveratrol improves mitochondrial function and protects against metabolic disease by activating SIRT1 and PGC-1alphaα,” Cell, vol. 127, no. 6, pp. 1109–1122, 2006
-
Seyam E, Hefzy E: Long-term effects of combined simvastatin and metformin treatment on the clinical abnormalities and ovulation dysfunction in single young women with polycystic ovary syndrome. Gynecol Endocrinol 2018 Dec;34(12):1073-1080.