Il fibrinogeno, o fattore I della coagulazione, è un polipeptide plasmatico sintetizzato dal fegato con lo scopo di favorire l’emostasi secondaria (1,2).
STRUTTURA – Il fibrinogeno è formata da tre coppie di catene polipeptidiche (α, ß, γ) unite da ponti disolfuro (3-5).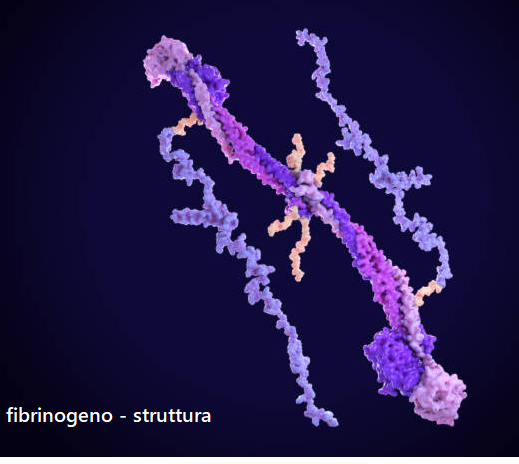
I geni preposti alla sintesi del fibrinogeno sono localizzati al terzo distale del braccio lungo del cromosoma 4, bande q23-q32.
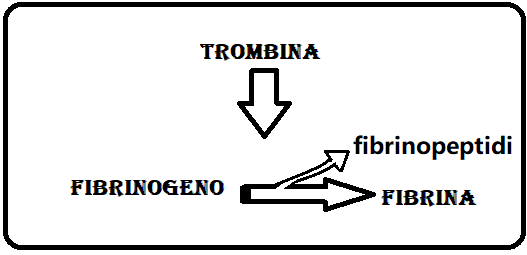
FUNZIONE – Il fibrinogeno costituisce il substrato su cui agisce la trombina, un enzima proteolitico che determina la scissione del fibrinogeno in fibrina e fibrinopeptidi di tipo A e B.
Questa reazione rappresenta la tappa finale della cascata coagulativa grazie alla quale si viene a formare un intreccio proteico formata da catene intrecciate di fibrina che inglobano piastrine e globuli rossi; si ha così la formazione di un coagulo che arresta l’emorragia. Terminata la sua funzione tampone, il coagulo si retrae e la fibrina viene degradata (fibrinolisi).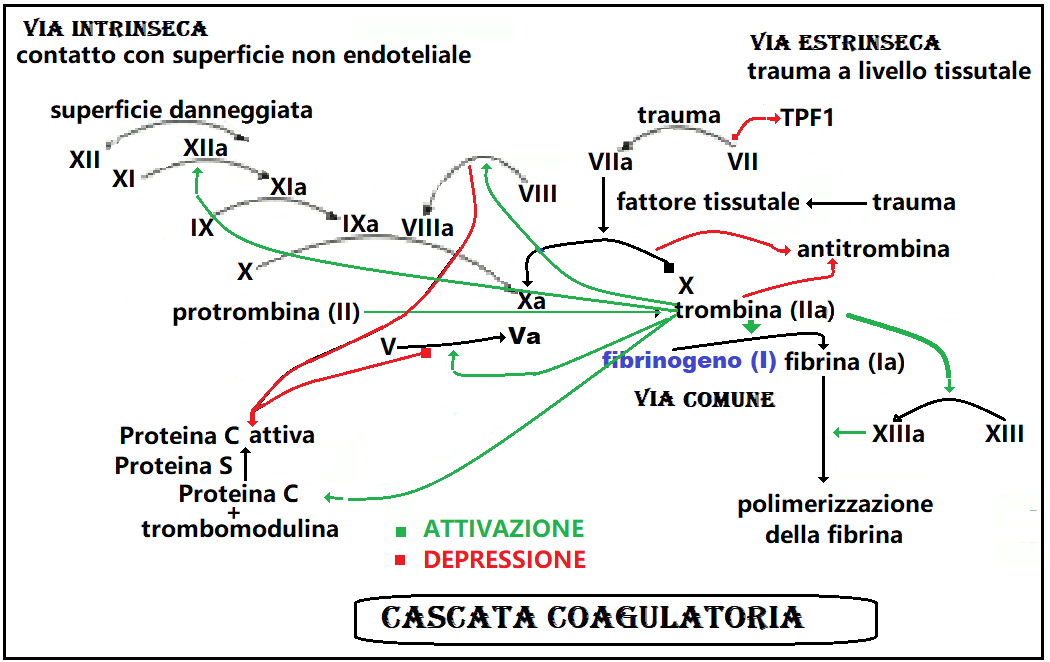
in genere è associato ad altri esami del sangue quali:
- PT (tempo di protrombina)
- APTT, tempo di tromboplastina parziale attivata
- Conta piastrinica
- D-dimero.
CONCENTRAZIONI PLASMATICHE – La concentrazione plasmatica di fibrinogeno aumenta, in parallelo alla sua velocità di sintesi, nella fase acuta di vari stimoli flogistici. I livelli di fibrinogeno nel plasma possono subire variazioni a causa di alterazioni genetiche (varianti eterozigotiche) o per variazioni di peso che determinano un più elevato rischio di trombosi venose profonde, infarto del miocardio, microangiopatie occlusive, ictus cerebrale e resistenza alla fibrinolisi (6-20).
I livelli normali di fibrinogeno si attestano tra 150 e 400 mg/dl con un valore medio che oscilla intorno ai 225 mg/dl.
References
- Kant JA, Fornace Jr AJ, Saxe D, Simon MI, McBride OW, Crabtree GR. Evolution and organization of the fibrinogen locus on chromosome 4: gene duplication accompanied by transposition and inversion. Proc Natl Acad Sci U S A 1985; 82 (8) 2344-2348
- Fornace Jr AJ, Cummings DE, Comeau CM, Kant JA, Crabtree GR. Structure of the human gamma-fibrinogen gene. Alternate mRNA splicing near the 3′ end of the gene produces gamma A and gamma B forms of gamma-fibrinogen. J Biol Chem 1984; 259 (20) 12826-12830
- M. W. Mosesson, K. R. Siebenlist and D. A. Meh (2001) The structure and biological features of fibrinogen and fibrin. Annals of the New York Academy of Sciences 936, 11- 30.
- R. F. Doolittle, Z. Yang and I. Mochalkin (2001) Crystal structure studies on fibrinogen and fibrin. Annals of the New York Academy of Sciences 936, 31-43.
- M. W. Mosesson (2005) Fibrinogen and fibrin structure and functions. Journal of Thrombosis and Haemostasis 3, 1894-1904.
- Mosesson MW, Finlayson JS, Umfleet RA. Human fibrinogen heterogeneities. 3. Identification of chain variants. J Biol Cem 1972; 247 (16) 5223-5227
- Francis CW, Marder VJ, Martin SE. Demonstration of a large molecular weight variant of the gamma chain of normal human plasma fibrinogen. J Biol Chem 1980; 255 (12) 5599-5604 Peerschke EI, Francis CW, Marder VJ. Fibrinogen binding to human blood platelets: effect of gamma chain carboxyterminal structure and length. Blood 1986; 67 (2) 385-390
- Chung DW, Chan WY, Davie EW. Characterization of a complementary deoxyribonucleic acid coding for the gamma chain of human fibrinogen. Biochemistry 1983; 22 (13) 3250-3256
- Chung DW, Davie EW. gamma and gamma’ chains of human fibrinogen are produced by alternative mRNA processing. Biochemistry 1984; 23 (18) 4232-4236
- Wolfenstein-Todel C, Mosesson MW. Human plasma fibrinogen heterogeneity: evidence for an extended carboxyl-terminal sequence in a normal gamma chain variant (gamma’). Proc Natl Acad Sci U S A 1980; 77 (9) 5069-5073
- Wolfenstein-Todel C, Mosesson MW. Carboxy-terminal amino acid sequence of a human fibrinogen gamma-chain variant (gamma’). Biochemistry 1981; 20 (21) 6146-6149
- Uitte de Willige S, de Visser MC, Houwing-Duistermaat JJ, Rosendaal FR, Vos HL, Bertina RM. Genetic variation in the fibrinogen gamma gene increases the risk for deep venous thrombosis by reducing plasma fibrinogen gamma’ levels. Blood 2005; 106 (13) 4176-4183
- Nowak-Göttl U, Weiler H, Hernandez I , et al. Fibrinogen alpha and gamma genes and factor V Leiden in children with thromboembolism: results from 2 family-based association studies. Blood 2009; 114 (9) 1947-1953
- Cheung EY, Uitte de Willige S, Vos HL , et al. Fibrinogen gamma’ in ischemic stroke: a case-control study. Stroke 2008; 39 (3) 1033-1035
- Mosesson MW, Hernandez I, Raife TJ , et al. Plasma fibrinogen gamma’ chain content in the thrombotic microangiopathy syndrome. J Thromb Haemost 2007; 5 (1) 62-69
- Siebenlist KR, Mosesson MW. Progressive cross-linking of fibrin gamma chains increases resistance to fibrinolysis. J Biol Chem 1994; 269 (45) 28414-28419
- Mannila MN, Lovely RS, Kazmierczak SC , et al. Elevated plasma fibrinogen gamma’ concentration is associated with myocardial infarction: effects of variation in fibrinogen genes and environmental factors. J Thromb Haemost 2007; 5 (4) 766-773
- de Moerloose P, Boehlen F, Neerman-Arbez M. Fibrinogen and the risk of thrombosis. Semin Thromb Hemost 2010; 36 (1) 7-17
- Pineda AO, Chen ZW, Marino F, Mathews FS, Mosesson MW, Di Cera E. Crystal structure of thrombin in complex with fibrinogen gamma’ peptide. Biophys Chem 2007; 125 (2–3) 556-559
- de Bosch NB, Mosesson MW, Ruiz-Sáez A, Echenagucia M, Rodriguez-Lemoin A. Inhibition of thrombin generation in plasma by fibrin formation (Antithrombin I). Thromb Haemost 2002; 88 (2) 253-258
- Cooper AV, Standeven KF, Ariëns RA. Fibrinogen gamma-chain splice variant gamma’ alters fibrin formation and structure. Blood 2003; 102 (2) 535-540
- Moaddel M, Falls LA, Farrell DH. The role of gamma A/gamma ‘ fibrinogen in plasma factor XIII activation. J Biol Chem 2000; 275 (45) 35656
- Kremers RM, Wagenvoord RJ, Hemker HC. The effect of fibrin(ogen) on thrombin generation and decay. Thromb Haemost 2014; 112 (3) 486-494Lorand L. Factor XIII: structure, activation, and interactions with fibrinogen and fibrin. Ann N Y Acad Sci 2001; 936: 291-311
- Allan P, Uitte de Willige S, Abou-Saleh RH, Connell SD, Ariëns RA. Evidence that fibrinogen γ’ directly interferes with protofibril growth: implications for fibrin structure and clot stiffness. J Thromb Haemost 2012; 10 (6) 1072-1080
- Greenberg CS, Shuman MA. The zymogen forms of blood coagulation factor XIII bind specifically to fibrinogen. J Biol Chem 1982; 257 (11) 6096-6101
- Mosesson MW, Finlayson JS. Biochemical and chromatographic studies of certain activities associated with human fibrinogen preparations. J Clin Invest 1963; 42: 747-755
- Siebenlist KR, Meh DA, Mosesson MW. Plasma factor XIII binds specifically to fibrinogen molecules containing gamma chains. Biochemistry 1996; 35 (32) 10448-10453
- 34 Moaddel M, Farrell DH, Daugherty MA, Fried MG. Interactions of human fibrinogens with factor XIII: roles of calcium and the gamma’ peptide. Biochemistry 2000; 39 (22) 6698-6705
- 35 Siebenlist KR, Meh DA, Mosesson MW. Protransglutaminase (factor XIII) mediated crosslinking of fibrinogen and fibrin. Thromb Haemost 2001; 86 (5) 1221-1228
- 36 Siebenlist KR, Mosesson MW, Hernandez I , et al. Studies on the basis for the properties of fibrin produced from fibrinogen-containing gamma’ chains. Blood 2005; 106 (8) 2730-2736
- 37 Gersh KC, Lord ST. An investigation of factor XIII binding to recombinant gamma’/gamma’ and gamma/gamma’ fibrinogen [abstract]. Blood 2006; 108 (11) 485a
- 38 Smith KA, Adamson PJ, Pease RJ , et al. Interactions between factor XIII and the alphaC region of fibrinogen. Blood 2011; 117 (12) 3460-3468
- 39 Lovely RS, Boshkov LK, Marzec UM, Hanson SR, Farrell DH. Fibrinogen gamma’ chain carboxy terminal peptide selectively inhibits the intrinsic coagulation pathway. Br J Haematol 2007; 139 (3) 494-503
- 40 Omarova F, Uitte De Willige S, Ariëns RA, Rosing J, Bertina RM, Castoldi E. Inhibition of thrombin-mediated factor V activation contributes to the anticoagulant activity of fibrinogen γ’. J Thromb Haemost 2013; 11 (9) 1669-1678
- 41 Segers K, Dahlbäck B, Bock PE, Tans G, Rosing J, Nicolaes GA. The role of thrombin exosites I and II in the activation of human coagulation factor V. J Biol Chem 2007; 282 (47) 33915-33924
- 42 Omarova F, Uitte de Willige S, Simioni P , et al. Fibrinogen γ’ increases the sensitivity to activated protein C in normal and factor V Leiden plasma. Blood 2014; 124 (9) 1531-1538
- 43 Vu TT, Stafford AR, Leslie BA, Kim PY, Fredenburgh JC, Weitz JI. Histidine-rich glycoprotein binds fibrin(ogen) with high affinity and competes with thrombin for binding to the gamma’-chain. J Biol Chem 2011; 286 (35) 30314-30323
- 44 Poon IK, Patel KK, Davis DS, Parish CR, Hulett MD. Histidine-rich glycoprotein: the Swiss Army knife of mammalian plasma. Blood 2011; 117 (7) 2093-2101
- 45 Leung LL. Interaction of histidine-rich glycoprotein with fibrinogen and fibrin. J Clin Invest 1986; 77 (4) 1305-1311
- Laurens N, Koolwijk P, de Maat MPM. Fibrin structure and wound healing. J Thromb Haemost 2006; 4 (5) 932-939
- 47 Cheung EYL, Weijers EM, Tuk B , et al. Specific effects of fibrinogen and the γA and γ’-chain fibrinogen variants on angiogenesis and wound healing. Tissue Eng Part A 2015; 21 (1–2) 106-114
- Hawiger J, Timmons S, Kloczewiak M, Strong DD, Doolittle RF. gamma and alpha chains of human fibrinogen possess sites reactive with human platelet receptors. Proc Natl Acad Sci U S A 1982; 79 (6) 2068-2071
- 55 Lancellotti S, Rutella S, De Filippis V, Pozzi N, Rocca B, De Cristofaro R. Fibrinogen-elongated gamma chain inhibits thrombin-induced platelet response, hindering the interaction with different receptors. J Biol Chem 2008; 283 (44) 30193-30204
- 56 Lovely RS, Rein CM, White TC , et al. gammaA/gamma’ fibrinogen inhibits thrombin-induced platelet aggregation. Thromb Haemost 2008; 100 (5) 837-846
- 57 Nagy Jr B, Simon Z, Bagoly Z, Muszbek L, Kappelmayer J. Binding of plasma factor XIII to thrombin-receptor activated human platelets. Thromb Haemost 2009; 102 (1) 83-89
- Uitte de Willige S, Standeven KF, Philippou H, Ariëns RA. The pleiotropic role of the fibrinogen gamma’ chain in hemostasis. Blood 2009; 114 (19) 3994-4001
- 63 Undas A, Ariëns RA. Fibrin clot structure and function: a role in the pathophysiology of arterial and venous thromboembolic diseases. Arterioscler Thromb Vasc Biol 2011; 31 (12) e88-e99
- 64 Riedelová-Reicheltová Z, Kotlín R, Suttnar J , et al. A novel natural mutation AαPhe98Ile in the fibrinogen coiled-coil affects fibrinogen function. Thromb Haemost 2014; 111 (1) 79-87
- 65 Park R, Doh HJ, An SS, Choi JR, Chung KH, Song KS. A novel fibrinogen variant (fibrinogen Seoul II; AalphaGln328Pro) characterized by impaired fibrin alpha-chain cross-linking. Blood 2006; 108 (6) 1919-1924
- Undas A, Podolec P, Zawilska K , et al. Altered fibrin clot structure/function in patients with cryptogenic ischemic stroke. Stroke 2009; 40 (4) 1499-1501
- 70 Undas A, Zawilska K, Ciesla-Dul M , et al. Altered fibrin clot structure/function in patients with idiopathic venous thromboembolism and in their relatives. Blood 2009; 114 (19) 4272-4278
- 71 Lovely RS, Falls LA, Al-Mondhiry HA , et al. Association of gammaA/gamma’ fibrinogen levels and coronary artery disease. Thromb Haemost 2002; 88 (1) 26-31
- 72 Kim PY, Vu TT, Leslie BA, Stafford AR, Fredenburgh JC, Weitz JI. Reduced plasminogen binding and delayed activation render γ’-fibrin more resistant to lysis than γA-fibrin. J Biol Chem 2014; 289 (40) 27494-27503
- 73 Falls LA, Farrell DH. Resistance of gammaA/gamma’ fibrin clots to fibrinolysis. J Biol Chem 1997; 272 (22) 14251-14256
- 74 Pieters M, Kotze RC, Jerling JC, Kruger A, Ariëns RA. Evidence that fibrinogen γ’ regulates plasma clot structure and lysis and relationship to cardiovascular risk factors in black Africans. Blood 2013; 121 (16) 3254-3260
- 75 Collet JP, Nagaswami C, Farrell DH, Montalescot G, Weisel JW. Influence of gamma’ fibrinogen splice variant on fibrin physical properties and fibrinolysis rate. Arterioscler Thromb Vasc Biol 2004; 24 (2) 382-386
- 76 Gersh KC, Nagaswami C, Weisel JW, Lord ST. The presence of gamma’ chain impairs fibrin polymerization. Thromb Res 2009; 124 (3) 356-363
- Farrell DH. γ’ Fibrinogen as a novel marker of thrombotic disease. Clin Chem Lab Med 2012; 50 (11) 1903-1909
- 80 van den Herik EG, Cheung EY, de Lau LM , et al. Fibrinogen γ’ levels in patients with intracerebral hemorrhage. Thromb Res 2012; 129 (6) 807-809
- 81 Lovely RS, Kazmierczak SC, Massaro JM, D’Agostino Sr RB, O’Donnell CJ, Farrell DH. Gamma’ fibrinogen: evaluation of a new assay for study of associations with cardiovascular disease. Clin Chem 2010; 56 (5) 781-788
- 82 Pieters M, Boshuizen H, de Lange Z , et al. Relationship of coagulation and fibrinolytic variables with arterial structure and function in Africans. Thromb Res 2014; 134 (1) 78-83
- 83 Lovely R, Hossain J, Ramsey JP , et al. Obesity-related increased γ’ fibrinogen concentration in children and its reduction by a physical activity-based lifestyle intervention: a randomized controlled study. J Pediatr 2013; 163 (2) 333-338
- 84 Appiah D, Schreiner PJ, MacLehose RF, Folsom AR. Association of Plasma γ’ Fibrinogen With Incident Cardiovascular Disease: The Atherosclerosis Risk in Communities (ARIC) Study. Arterioscler Thromb Vasc Biol 2015; 35 (12) 2700-2706
- 85 Cheung EY, Vos HL, Kruip MJ, den Hertog HM, Jukema JW, de Maat MP. Elevated fibrinogen gamma’ ratio is associated with cardiovascular diseases and acute phase reaction but not with clinical outcome. Blood 2009; 114 (20) 4603-4604 , author reply 4604–4605
- 86 van den Herik EG, Cheung EY, de Lau LM , et al. γ’/total fibrinogen ratio is associated with short-term outcome in ischaemic stroke. Thromb Haemost 2011; 105 (3) 430-434
- Mosesson MW, Cooley BC, Hernandez I, Diorio JP, Weiler H. Thrombosis risk modification in transgenic mice containing the human fibrinogen thrombin-binding gamma’ chain sequence. J Thromb Haemost 2009; 7 (1) 102-110
- 89 Walton BL, Getz TM, Bergmeier W, Lin FC, Uitte de Willige S, Wolberg AS. The fibrinogen γA/γ’ isoform does not promote acute arterial thrombosis in mice. J Thromb Haemost 2014; 12 (5) 680-689
- 90 Smalberg JH, Koehler E, Darwish Murad S , et al; European Network for Vascular Disorders of the Liver (EN-Vie). Fibrinogen γ’ and variation in fibrinogen gamma genes in the etiology of portal vein thrombosis. Thromb Haemost 2013; 109 (3) 558-560
- 91 Jobse A, Pieters M, Nienaber-Rousseau C, Boshuizen H, Hoekstra T, de Maat MP. The contribution of genetic and environmental factors to changes in total and γ’ fibrinogen over 5 years. Thromb Res 2015; 135 (4) 703-709
- 92 Kotzé RC, Nienaber-Rousseau C, De Lange Z, De Maat MP, Hoekstra T, Pieters M. Genetic polymorphisms influencing total and γ’ fibrinogen levels and fibrin clot properties in Africans. Br J Haematol 2015; 168 (1) 102-112
- 93 Grünbacher G, Weger W, Marx-Neuhold E , et al. The fibrinogen gamma (FGG) 10034C>T polymorphism is associated with venous thrombosis. Thromb Res 2007; 121 (1) 33-36
- 94 Uitte de Willige S, Pyle ME, Vos HL , et al. Fibrinogen gamma gene 3′-end polymorphisms and risk of venous thromboembolism in the African-American and Caucasian population. Thromb Haemost 2009; 101 (6) 1078-1084
- 95 Bahadori B, Uitz E, Dehchamani D, Pilger E, Renner W. The fibrinogen gamma 10034C>T polymorphism is not associated with Peripheral Arterial Disease. Thromb Res 2010; 126 (4) 350-352
- Mannila MN, Eriksson P, Lundman P , et al. Contribution of haplotypes across the fibrinogen gene cluster to variation in risk of myocardial infarction. Thromb Haemost 2005; 93 (3) 570-577
- 97 Uitte DE Willige S, Doggen CJ, DE Visser MC, Bertina RM, Rosendaal FR. Haplotypes of the fibrinogen gamma gene do not affect the risk of myocardial infarction. J Thromb Haemost 2006; 4 (2) 474-476
- 98 Lovely RS, Yang Q, Massaro JM , et al. Assessment of genetic determinants of the association of γ’ fibrinogen in relation to cardiovascular disease. Arterioscler Thromb Vasc Biol 2011; 31 (10) 2345-2352
- 99 Kotzé RC, Ariëns RA, de Lange Z, Pieters M. CVD risk factors are related to plasma fibrin clot properties independent of total and or γ’ fibrinogen concentration. Thromb Res 2014; 134 (5) 963-969
- 100 Nienaber-Rousseau C, de Lange Z, Pieters M. Homocysteine influences blood clot properties alone and in combination with total fibrinogen but not with fibrinogen γ’ in Africans. Blood Coagul Fibrinolysis 2015; 26 (4) 389-395
- Hill M, Dolan G. Diagnosis, clinical features and molecular assessment of the dysfibrinogenaemias. Haemophilia 2008; 14 (5) 889-897
- Bornikova L, Peyvandi F, Allen G, Bernstein J, Manco-Johnson MJ. Fibrinogen replacement therapy for congenital fibrinogen deficiency. J Thromb Haemost 2011; 9 (9) 1687-1704
- Doolittle RF, Hong S, Wilcox D. Evolution of the fibrinogen γ’ chain: implications for the binding of factor XIII, thrombin and platelets. J Thromb Haemost 2009; 7 (8) 1431-1433
- Kollman JM, Pandi L, Sawaya MR, Riley M, Doolittle RF. Crystal structure of human fibrinogen. Biochemistry 2009; 12 ;48(18): 3877-3886