Ultimo aggiornamento 2020-01-20 21:33:32
Il tampone vaginale è un esame diagnostico che viene eseguito tramite un tampone 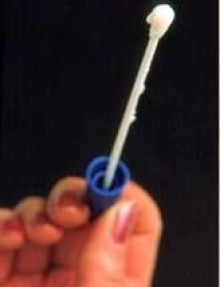 costituito da un’asta di alginato con la punta rivestita da dacron ovattato per raccogliere le secrezioni e le cellule di sfaldamento vaginale. Lo scopo è quello di verificare l’eventuale presenza di microrganismi patogeni responsabili di processi infettivi a carico della vagina oppure della cervice uterina. Il tampone vaginale viene praticato di routine alla 34-36a settimana di gestazione. Il valore predittivo negativo delle colture di SGB praticate <5 settimane prima del parto è del 95% -98%, tuttavia l’utilità clinica diminuisce quando la coltura è effettuata >5 settimane prima del parto poiché il valore predittivo negativo diminuisce con l’avvicinarsi del momento del parto (1).
costituito da un’asta di alginato con la punta rivestita da dacron ovattato per raccogliere le secrezioni e le cellule di sfaldamento vaginale. Lo scopo è quello di verificare l’eventuale presenza di microrganismi patogeni responsabili di processi infettivi a carico della vagina oppure della cervice uterina. Il tampone vaginale viene praticato di routine alla 34-36a settimana di gestazione. Il valore predittivo negativo delle colture di SGB praticate <5 settimane prima del parto è del 95% -98%, tuttavia l’utilità clinica diminuisce quando la coltura è effettuata >5 settimane prima del parto poiché il valore predittivo negativo diminuisce con l’avvicinarsi del momento del parto (1).
Ovviamente il tampone vaginale può e deve essere praticato anche in qualsiasi altro momento della gravidanza qualora il ginecologo lo ritenga necessario. Si effettuano contemporaneamente anche un tampone rettale ed urinocoltura e relativi antibiogrammi.
La paziente è posta in posizione ginecologica e la vagina debitamente illuminata. Il tampone è introdotto in vagina alla profondità di 4-5 cm. Si prelevano le secrezioni vaginali girando il tampone su stesso e contemporaneamente strisciandolo delicatamente sulle pareti vaginali. Un tampone vaginale viene strisciato delicatamente su tre vetrini per l’osservazione separata di candida, trichomonas e chlamidia. Un altro tampone vaginale viene inserito nel terreno di trasporto dove può essere conservato per 24 ore (2-4).
L’esame va effettuato a distanza di almeno 10 giorni da un’eventuale terapia antibiotica o antimicotica e astinenza dai rapporti sessuali di almeno 48 ore.
I principali agenti patogeni da ricercare con esame culturale sono Streptococco beta-emolitico di gruppo B, Stafilococco, Gardnerella vaginalis, candida.
Streptococco β-emolitico: l’infezione da Streptococco β-emolitico di gruppo B o agalactiae è quella che  desta maggiori preoccupazioni in gravidanza per le gravi conseguenze fetali e neonatali. Lo streptococco β-emolitico si trova nel piccolo intestino che funge da serbatoio primario da dove colonizza, asintomaticamente, la vagina nel 40% delle gravide. Non va confuso con lo streptococco di tipo A che è causa di faringo-tracheite. Il neonato infetto da Streptococco β-emolitico sviluppa setticemia, polmoniti e meningite con un tasso di mortalità del 15%. Il neonato è infettato dalla madre al momento del parto durante il passaggio nel canale vaginale o in utero in caso di membrane rotte. La frequenza di infezioni in bambini nati da gravide infette è di 3/1000 nati (5-8).
desta maggiori preoccupazioni in gravidanza per le gravi conseguenze fetali e neonatali. Lo streptococco β-emolitico si trova nel piccolo intestino che funge da serbatoio primario da dove colonizza, asintomaticamente, la vagina nel 40% delle gravide. Non va confuso con lo streptococco di tipo A che è causa di faringo-tracheite. Il neonato infetto da Streptococco β-emolitico sviluppa setticemia, polmoniti e meningite con un tasso di mortalità del 15%. Il neonato è infettato dalla madre al momento del parto durante il passaggio nel canale vaginale o in utero in caso di membrane rotte. La frequenza di infezioni in bambini nati da gravide infette è di 3/1000 nati (5-8).
Nel 7% dei casi i risultati dell’esame colturale dei tamponi ed urinocultura sono falsamente negativi. Se i test sono positivi, la strategia terapeutica prevede che all’inizio del travaglio la mamma venga sottoposta a una terapia antibiotica per via endovenosa ogni quattro ore, che consente di raggiungere rapidamente concentrazioni adeguate di farmaco nel sangue capaci di sterilizzare l’ambiente vaginale. Si preferiscono le penicilline, l’ampicillina e le cefalosporine di prima generazione perchè dotate di uno spettro d’azione limitato e quindi a minor rischio di sviluppare antibiotico-resistenza. È importante che la terapia venga instaurata all’inizio del travaglio e non prima altrimenti si potrebbero selezionare batteri antibiotico-resistenti. La profilassi antibiotica non viene effettuata se la donna partorisce con taglio cesareo (a meno che non ci sia stata rottura prematura delle membrane amnio-coriali). Anche se la profilassi antibiotica è stata eseguita correttamente, dopo la nascita al bambino viene effettuato un tampone oro-faringeo e otologico (9,10).
Effetti collaterali dell’antibiotico-terapia: alla maggior parte delle gravide e dei feti può essere tranquillamente somministrata la penicillina per il trattamento delle infezioni da streptococco senza effetti negativi . Tuttavia, una piccola percentuale di persone può essere allergica alla penicillina e potrebbe avere una reazione allergica grave (anafilassi) che può essere fatale. alle gravide allergiche alle penicilline e ampicillina deve essere somministrato un altro antibiotico: cefazolina, eritromicina, clindamicina o vancomicina. Altri meno gravi effetti collaterali del trattamento antibiotico comprendono diarrea e nausea e i neonati possono sviluppare infezioni da candida. Questi rischi sono però ampiamente compensati dal vantaggio di evitare una grave infezione batterica (11,12).
 Candida: oltre che dall’esame culturale in capsule di Petri, la candida può essere rivelata dall’esame a fresco su vetrino sotto microscopio ottico e l’aggiunta sullo striscio di idrossido di potassio (KOH) al 10% o colorazione del vetrino con blu di metilene. Il KOH al 10% dissolve le altre cellule e rende più evidenti le ife e le spore della candida. Candida albicans rappresenta circa l’80% dei miceti lievitiformi isolati dalla vagina, mentre Torulopsis glabrata, Candida Tropicalis, Candida Krusei, meno comunemente isolate, vengono dimostrate nei casi rimanenti.
Candida: oltre che dall’esame culturale in capsule di Petri, la candida può essere rivelata dall’esame a fresco su vetrino sotto microscopio ottico e l’aggiunta sullo striscio di idrossido di potassio (KOH) al 10% o colorazione del vetrino con blu di metilene. Il KOH al 10% dissolve le altre cellule e rende più evidenti le ife e le spore della candida. Candida albicans rappresenta circa l’80% dei miceti lievitiformi isolati dalla vagina, mentre Torulopsis glabrata, Candida Tropicalis, Candida Krusei, meno comunemente isolate, vengono dimostrate nei casi rimanenti.
La Candida albicans è spesso presente in vagina, di solito in modo asintomaticoo, perché la sua proliferazione è tenuta sotto controllo dai batteri normalmente presenti in vagina.
Trichomonas vaginalis: esame microscopico a fresco di uno striscio vaginale su vetrino; sullo striscio si pone una goccia di soluzione fisiologica e quindi si osserva al M.O.. Altrimenti si aspirano le secrezioni vaginali con pipetta Pasteur e le si riversano in una provettina contenente 3 ml di soluzione fisiologica. La provetta dovrà pervenire all’osservazione al M.O. entro 3-4 ore al massimo. Si potrà osservare il movimento ameboide del trichomonas. Il T. può provocare rottura delle membrane amniotiche e parto pretermine.
Neisseria gonorrhoee, Chlamydia Trachomatis, Micoplasmi, Human Papilloma Virus: è più indicata l’esecuzione di un tampone cervicale che va effettuato con tamponi sterili in asta sottile di alluminio tipo Amies. La punta del tampone va inserita nel canale cervicale e ruotata per alcuni secondi.
Chlamidia: Il prelievo va effettuato con appositi dispositivi e si 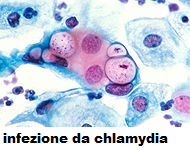 ricercano antigeni proteici di membrana dei corpi elementari direttamente nel campione, tramite anticorpi monoclonali marcati con fluoresceina (Chlamydia Direct Florescent test o metodo immunoenzimatico ELISA o chemioluminescenza). Quando il reagente viene applicato ad un campione su un vetrino da microscopio, l’anticorpo si lega a qualsiasi C. trachomatis presente. Il successivo lavaggio rimuove ogni anticorpo non legato. Quando i vetrini vengono analizzati con l’impiego di un microscopio a fluorescenza, i campioni
ricercano antigeni proteici di membrana dei corpi elementari direttamente nel campione, tramite anticorpi monoclonali marcati con fluoresceina (Chlamydia Direct Florescent test o metodo immunoenzimatico ELISA o chemioluminescenza). Quando il reagente viene applicato ad un campione su un vetrino da microscopio, l’anticorpo si lega a qualsiasi C. trachomatis presente. Il successivo lavaggio rimuove ogni anticorpo non legato. Quando i vetrini vengono analizzati con l’impiego di un microscopio a fluorescenza, i campioni 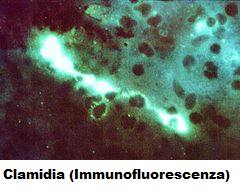 contenenti C. trachomatis appariranno come corpi elementari o reticolati verdi in contrasto con uno sfondo rosso di cellule controcolorate. Il risultato si ottiene in meno di un’ora. Ci sono poi le più moderne metodiche di biologia molecolare, fra esse la PACE (Probe Assay Chemioluminescent Enhanced) che impiega sonde genetiche per il riconoscimento dell’RNA con rilevazione chemioluminescente (13-17).
contenenti C. trachomatis appariranno come corpi elementari o reticolati verdi in contrasto con uno sfondo rosso di cellule controcolorate. Il risultato si ottiene in meno di un’ora. Ci sono poi le più moderne metodiche di biologia molecolare, fra esse la PACE (Probe Assay Chemioluminescent Enhanced) che impiega sonde genetiche per il riconoscimento dell’RNA con rilevazione chemioluminescente (13-17).
Nel 70% delle gravide l’infezione da C. è asintomatica. Purtuttavia la C. causa amniocorioniti e, se trasmessa al neonato durante il parto per via vaginale, sviluppa congiuntivite e polmonite specifica neonatale.
Gardnerella vaginalis: insieme al micoplasma è il principale responsabile della cosiddetta vaginosi batterica, sindrome polimicrobica caratterizzata da una riduzione dei lattobacilli H2O2 produttori e da una contemporanea proliferazione di microrganismi patogeni in prevalenza anaerobi.
pH vaginale: Nella stessa seduta in cui si effettua il tampone vaginale o cervicale è utile verificare il pH vaginale che in condizioni normali è decisamente acido (<4); il pH acido previene la formazione di processi infettivi. Il pH va misurato prima dell’inserimento dello speculum sulle pareti vaginali laterali utilizzando cartine indicatrici con range 3.5-5
- Yancey MK, Schuchat A, Brown LK, Ventura VL, Markenson GR. The accuracy of late antenatal screening cultures in predicting genital group B streptococcal colonization at delivery. Obstet Gynecol 1996;88):811–5.
- Barton LL, Feigin RD, Lins R. Group B beta hemolytic streptococcal meningitis in infants. J Pediatr 1973;82:719–23.
- Franciosi RA, Knostman JD, Zimmerman RA. Group B streptococcal neonatal and infant infections. J Pediatr 1973;82:707–18.
- McCracken GH, Jr. Group B streptococci: the new challenge in neonatal infections. J Pediatr 1973;82:703–6.
- Baker CJ, Barrett FF. Group B streptococcal infections in infants. The importance of the various serotypes. JAMA 1974;230:1158–60.
- Allardice JG, Baskett TF, Seshia MM, Bowman N, Malazdrewicz R. Perinatal group B streptococcal colonization and infection. Am J Obstet Gynecol1982;142:617–20.
- Boyer KM, Gotoff SP. Prevention of early-onset neonatal group B streptococcal disease with selective intrapartum chemoprophylaxis. N Engl J Med 1986;314:1665–9.
- Lim DV, Morales WJ, Walsh AF, Kazanis D. Reduction of morbidity and mortality rates for neonatal group B streptococcal disease through early diagnosis and chemoprophylaxis. J Clin Microbiol 1986;23:489–92.
- Tuppurainen N, Hallman M. Prevention of neonatal group B streptococcal disease: intrapartum detection and chemoprophylaxis of heavily colonized parturients. Obstet Gynecol 1989;73:583–7.
- Garland SM, Fliegner JR. Group B Streptococcus (GBS) and neonatal infections: the case for intrapartum chemoprophylaxis. Aust N Z J Obstet Gynaecol 1991;31:119–22.
- Matorras R, Garca-Perea A, Omeaca F, Diez-Enciso M, Madero R, Usandizaga JA. Intrapartum chemoprophylaxis of early-onset group B streptococcal disease. Eur J Obstet Gynecol Reprod Biol 1991;40:57–62.
- American College of Obstetricians and Gynecologists. ACOG committee opinion. Prevention of early-onset group B streptococcal disease in newborns. Number 173,June 1996. Committee on Obstetric Practice. American College of Obstetrics and Gynecologists. Int J Gynaecol Obstet 1996;54:197–205.
- Bush, R.M. and Everett, K.D.E. (2001). Molecular Evolution of the Chlamydiaceae. . Int. J. Syst. Evol. Microbiol. 51: 203 – 220.
- Cook, JH, and M Pezzlo (1992). Specimen receipt and accessioning. Section 1. Aerobic bacteriology, 1.2.1-4. In HD Isenberg (ed) Clinical Microbiology Procedures Handbook. American Society for microbiology, Washington DC
- Miller, J Michael (1999) A Guide To Specimen Management in Clinical Microbiology, American Society for Microbiology, Washington DC
- Miller, J Michael, and HT Holmes (1999) Specimen Collection, Transport, and Storage In PR Murray et al, (ed), Manual of Clinical Microbiology, 7th edition, American Society for Microbiology, Washington DC, pg 33-104
- Agrawal SK, Reddy BS, Bhalla P, Kaur H: “Utility of Direct Fluorescent Antibody Test for detection of Chlamydia trachomatis and its detection in male patients with non gonococcal urethritis in New Delhi”. Indian J. of Dermatology, Venereology and Leprology; 2003;69,2:144-147




1 commento
Every word in this piece of work is very clear and your passion for this topic shines. Please continue your work in this area and I hope to see more from you in the future.