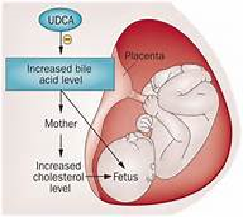
Colestasi intra-epatica gravidica (Epatogestosi o ittero gravidico)
intestinale per cui la malattia si caratterizza per l’accumulo nel plasma di sostanze che sono, in condizioni fisiologiche, escrete nella bile come gli acidi biliari, il colesterolo e la bilirubina. La produzione delle bile è una funzione secretoria del fegato. Inizia nei canalicoli biliari che sono formati dai solchi (“docce”) sullesuperfici giustapposte di due cellule epatiche prospicienti. Come rami terminali di un albero, i canalicoli si uniscono tra di loro per formare strutture sempre più grandi, a volte definiti Canali di Hering, che a loro volta si fondono per formare piccoli dotti biliari che hanno una superficie epiteliale. Questi si fondono per formare i dotti biliari più grandi, che progressivamente formano il dotto epaticodestro (che riceve la bile dal lobo destro) ed il dotto epatico sinistro (che la riceve, invece, dal lobo sinistro). I due dotti si uniscono per formare il dotto epatico comune, che riceverà poi il dotto cistico della cistifellea per formare il coledoco.Questo dotto entra nel duodeno attraverso l’ampolla del Vater.
Altra causa di colestasi è la sindrome di Aagenaes, una patologia caratterizzata da ipoplasia congenita dei vasi linfatici, che causa linfedema alle gambe e colestasi ricorrente nell’infanzia, progredendo lentamente a cirrosi epatica ed epatite a cellule giganti con fibrosi delle triadi portali (39,40). La malattia ha una trasmissione autosomica recessiva, il gene responsabile è localizzato sul cromosoma 15q ma la causa genetica è sconosciuta (41).
ICP iatrogena: farmaci capaci di indurre una colestasi intraepatico sono l’eritromicina, nitrofurantoina, estrogeni e steroidi anabolizzanti.
SINTOMATOLOGIA e DIAGNOSTICA – Il sintomo principale è costituito da un fastidioso prurito, di solito localizzato al palmo delle mani ed alla pianta dei piedi prima che si estenda su tutto il corpo, che si  associa a lesioni da grattamento. Raramente sono presenti
associa a lesioni da grattamento. Raramente sono presenti
- lieve ittero e steatorrea.
- Urine scure
- Aumento del tempo di coagulazione (in caso di carenza di vitamina K il cui assorbimento intestinale è disturbato dall’eccesso di acidi biliari)
- Facile affaticamento
- Nausea
- Diminuzione dell’appetito
- Ittero
- Xantomi cutanei
- Dolore al quadrante superiore destro
I test di funzionalità epatica risultano spesso alterati, ma la più frequente alterazione di laboratorio è l’aumento della concentrazione sierica degli acidi biliari (>10 micromol/L). Non è chiaro se esista un valore critico della concentrazione degli acidi biliari oltre il quale vi sia un effettivo aumentato rischio di complicanze materno-fetali. 40 micromol/L è considerato valore soglia. Possono essere aumentate anche le concentrazioni di aminotransferasi, bilirubina, fosfatasi alcalina e gamma- glutamil-transferasi (gamma-GT) (12-18).
L’esame ultrasonografico in caso di colestasi extra-epatica evidenzia con facilità dilatazioni 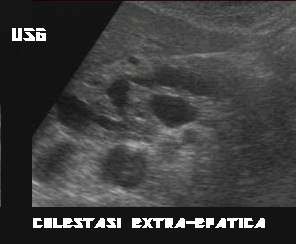 multiple dei canalicoli biliari che si presentano come aree ipo-anecogene, intraparenchimali, irregolarmente tondeggianti, a pareti sfumate, senza coni d’ombra laterali nè rinforzo della parete posteriore (24).
multiple dei canalicoli biliari che si presentano come aree ipo-anecogene, intraparenchimali, irregolarmente tondeggianti, a pareti sfumate, senza coni d’ombra laterali nè rinforzo della parete posteriore (24).
In caso di ICP invece i dotti biliari si evidenzieranno come linee sottili.
Possono ritrovarsi pure litiasi biliare o anomalie dell’albero biliare e lesioni neoplastiche.
DIAGNOSI DIFFERENZIALE:
- dermatite eczematosa: per definizione una reazione dermica infiammatoria pruriginosa e non contagiosa,
- infestazioni parassitarie come la scabbia che produce un prurito di tipo allergico-infiammatorio e cunicoli sottocutanei di tipo lineare (28-38).
Outcome in gravidanza: La colestasi intraepatica gravidica non trattata, associata a elevati livelli ematici di acidi biliari o ad ittero, si associa, nel 20-40% dei casi, ad un aumento di complicanze fetali e neonatali, tra cui distress fetale, morte fetale (nella maggior parte dei casi dopo la 34ª settimana), parto pre-termine con sindrome da distress respiratorio neonatale, ingestione di liquido amniotico tinto di meconio, insufficienza placentare (19-24).
MANAGEMENT e TERAPIA:
La terapia deve essere iniziata non appena posta diagnosi di colestasi intraepatica gravidica. I livelli di acidi biliari devono essere controllati ogni 2 settimane per guidare la terapia e il timing del parto. Inutili risultano gli antistaminici. La terapia farmacologica con Acido Ursodesossicolico (Deursil cpr 50 mg, 150 mg, 300 mg, 450 m; Deursil RR 225 mg) riduce i livelli di acidi biliari e scioglie i calcoli colesterolici. Conseguentemente il prurito diminuisce e sembra ridursi anche la morbidità e la mortalità perinatale. Effetto collaterale più comune dell’UDCA è la diarrea. La colestiramina (Questran bustine) è il farmaco di elezione per alleviare prontamente il prurito. A livello intestinale si combina con gli acidi biliari aumentando la loro eliminazione con le feci. Ma l’induzione del parto alla 36ª-37ª settimana sembra essere l’approccio migliore per ridurre il rischio di morte fetale. È indicata la somministrazione di vitamina K per ridurre il rischio di emorragie post-partum e perinatali conseguente ad un deficit da malassorbimento della stessa vitamina (20-24). Misure di carattere generale, come una dieta ipolipidica, docce fredde, abbigliamento comodo e in fibra di cotone, una maggiore assunzione di acqua.
COMPLICANZE DELLA COLESTASI INTRAEPATICA: le principali complicanze materne sono il diabete mellito di 2° tipo, patologie cardiovascolari e tiroidee, cancro epato-biliare, gestosi pre-eclamptica (25).
PREVENZIONE – Nell’immediato post-partum delle pazienti occorre controllare i livelli di acidi biliari e i test epatici e ricontrollarli ogni 3-6 mesi: se rimangono elevati sono indicati approfondimenti diagnostici. La ricorrenza di colestasi intraepatica è stata stimata pari a circa 45-70%. Alle pazienti ICP non deve essere prescritta terapia contraccettiva ormonale.
Test prenatali inclusi doppler dell’arteria ombelicale e non stress test devono essere eseguiti settimanalmente. Questi test non sono tuttavia risultati né predittivi né protettivi per la compromissione e la morte fetale.
Le pazienti a rischio di colestasi intraepatica gravidica (anamnesi positiva familiare o personale, gravidanza gemellare o multipla) devono essere strettamente monitorate durante la gravidanza circa i sintomi e segni di tale condizione specialmente nel terzo trimestre quando i livelli estrogenici sono più alti. L’esame USG seriale dovrà escludere un’eventuale dilatazione delle vie biliari.
References:
- Rapini, Ronald P.; Bolognia, Jean L.; Jorizzo, Joseph L. (2007). Dermatology: 2-Volume Set. St. Louis: Mosby. ISBN 1-4160-2999-0. CS1 maint: Multiple names: authors list (link)
- Tunzi M, Gray GR (January 2007). “Common skin conditions during pregnancy”. Am Fam Physician 75 (2): 211–8. PMID 17263216.
- Pusl T, Beuers U (2007). “Intrahepatic cholestasis of pregnancy”. Orphanet J Rare Dis 2: 26. doi:10.1186/1750-1172-2-26. PMC: 1891276. PMID 17535422.
- Lammert F, Marschall HU, Glantz A, Matern S (December 2000). “Intrahepatic cholestasis of pregnancy: molecular pathogenesis, diagnosis and management”. J. Hepatol. 33 (6): 1012–21. doi:10.1016/S0168-8278(00)80139-7. PMID 11131439. CS1 maint: Multiple names: authors list (link)
- Kreek MJ (February 1987). “Female sex steroids and cholestasis”. Semin. Liver Dis. 7 (1): 8–23. doi:10.1055/s-2008-1040559. PMID 3296217.
- Gonzalez MC, Reyes H, Arrese M, et al. (July 1989). “Intrahepatic cholestasis of pregnancy in twin pregnancies”. J. Hepatol. 9 (1): 84–90. doi:10.1016/0168-8278(89)90079-2. PMID 2768798.
- Reyes H, Sjövall J (March 2000). “Bile acids and progesterone metabolites in intrahepatic cholestasis of pregnancy”. Ann. Med. 32 (2): 94–106. doi:10.3109/07853890009011758. PMID 10766400.
- Jacquemin E, Cresteil D, Manouvrier S, Boute O, Hadchouel M (January 1999). “Heterozygous non-sense mutation of the MDR3 gene in familial intrahepatic cholestasis of pregnancy”. Lancet 353 (9148): 210–1. doi:10.1016/S0140-6736(05)77221-4.
- Stieger B, Fattinger K, Madon J, Kullak-Ublick GA, Meier PJ. (2000). “Drug- and estrogen-induced cholestasis through inhibition of the hepatocellular bile salt export pump (Bsep) of rat liver”. Gastroenterology 118 (2): 422–30. doi:10.1016/S0016-5085(00)70224-1. PMID 10648470. CS1 maint: Multiple names: authors list (link)
- Debry P, Nash EA, Neklason DW, Metherall JE (January 1997). “Role of multidrug resistance P-glycoproteins in cholesterol esterification”. J. Biol. Chem. 272 (2): 1026–31. doi:10.1074/jbc.272.2.1026. PMID 8995398. CS1 maint: Multiple names: authors list (link)
- Kauppila A, Korpela H, Mäkilä UM, Yrjänheikki E (January 1987). “Low serum selenium concentration and glutathione peroxidase activity in intrahepatic cholestasis of pregnancy”. Br Med J (Clin Res Ed) 294 (6565): 150–2. doi:10.1136/bmj.294.6565.150. PMC: 1245162. PMID 3109544. CS1 maint: Multiple names: authors list (link)
- Geenes, V.; Chappell, L.C.; Seed, P.T.; Steer, P.J.; Knight, M.; Williamson, C. (April 2014). “Association of severe intrahepatic cholestasis of pregnancy with adverse pregnancy outcomes: a prospective population-based case-control study”. Hepatology 59 (4): 1482–91.
- Brouwers L, Koster MP, Page-Christiaens GC, Kemperman H, Boon J, Evers IM, Bogte A, Oudijk MA. Intrahepatic cholestasis of pregnancy: maternal and fetal outcomes associated with elevated bile acid levels. Am J Obstet Gynecol. 2015 Jan;212(1):100.e1-7. doi: 10.1016/j.ajog.2014.07.026. Epub 2014 Jul 18.
- Dixon PH, van Mil SW, Chambers J, Strautnieks S, Thompson RJ, Lammert F, Kubitz R, Keitel V, Glantz A, Mattsson LA, Marschall HU, Molokhia M, Moore GE, Linton KJ, Williamson C. Contribution of variant alleles of ABCB11 to susceptibility to intrahepatic cholestasis of pregnancy. Gut. 2009 Apr;58(4):537-44. Epub 2008 Nov 5.
- Geenes V, Chappell LC, Seed PT, Steer PJ, Knight M, Williamson C. Association of severe intrahepatic cholestasis of pregnancy with adverse pregnancy outcomes: a prospective population-based case-control study. Hepatology. 2014 Apr;59(4):1482-91. doi: 10.1002/hep.26617. Epub 2014 Feb 26.
- Meier Y, Zodan T, Lang C, Zimmermann R, Kullak-Ublick GA, Meier PJ, Stieger B, Pauli-Magnus C. Increased susceptibility for intrahepatic cholestasis of pregnancy and contraceptive-induced cholestasis in carriers of the 1331T>C polymorphism in the bile salt export pump. World J Gastroenterol. 2008 Jan 7;14(1):38-45.
- Pauli-Magnus C, Meier PJ, Stieger B. Genetic determinants of drug-induced cholestasis and intrahepatic cholestasis of pregnancy. Semin Liver Dis. 2010 May;30(2):147-59. Epub 2010 Apr 26. Review.
- Williamson C, Geenes V. Intrahepatic cholestasis of pregnancy. Obstet Gynecol. 2014 Jul;124(1):120-33. doi: 10.1097/AOG.0000000000000346. Review.
- Williamson C1, Geenes V. Intrahepatic cholestasis of pregnancy. Obstet Gynecol. 2014 Jul;124(1):120-33. doi: 10.1097/AOG.0000000000000346.
- The pharmacological management of intrahepatic cholestasis of pregnancy. Azzaroli F, Turco L, Lisotti A, Calvanese C, Mazzella G. Curr Clin Pharmacol. 2011 Feb; 6(1):12-7.
- Correction of maternal serum bile acid profile during ursodeoxycholic acid therapy in cholestasis of pregnancy. Brites D, Rodrigues CM, Oliveira N, Cardoso M, Graça LM. J Hepatol. 1998 Jan; 28(1):91-8.
- Bile acid profiles in intrahepatic cholestasis of pregnancy: is this the solution to the enigma of intrahepatic cholestasis of pregnancy? Sinakos E, Lindor KD. Am J Gastroenterol. 2010 Mar; 105(3):596-8.
- Ursodeoxycholic acid for the treatment of intrahepatic cholestasis of pregnancy. Laifer SA, Stiller RJ, Siddiqui DS, Dunston-Boone G, Whetham JC. J Matern Fetal Med. 2001 Apr; 10(2):131-5.
- Alonso J. Rioseco et al.: Intrahepatic cholestasis of pregnancy: A retrospective case-control study of perinatal outcome. AJOG 1994 Volume 170, Issue 3, Pages 890–895
- Yael Raz et al: Severe intrahepatic cholestasis of pregnancy is a risk factor for preeclampsia in singleton and twin pregnancies. AJOG 2015 Volume 213, Issue 3, Pages 395.e1–395.e8
- Edward K Markell, John, David C.; Petri, William H, Markell and Voge’s medical parasitology nona edizione, New York – Milano, Elsevier Saunders, 2006, ISBN 0-7216-4793-6.
- Roncalli RA, The history of scabies in veterinary and human medicine from biblical to modern times, in Vet. Parasitol., vol. 25, nº 2, luglio 1987, pp. 193–8, DOI:10.1016/0304-4017(87)90104-X, PMID 3307123.
- M. Ramos-e-Silva, GC. Bonomo, Giovan Cosimo Bonomo (1663-1696): discoverer of the etiology of scabies., in Int J Dermatol, vol. 37, nº 8, agosto 1998, pp. 625-30, PMID 9732015.
- MA. Montesu, F. Cottoni; GC. Bonomo; D. Cestoni, G.C. Bonomo and D. Cestoni. Discoverers of the parasitic origin of scabies., in Am J Dermatopathol, vol. 13, nº 4, agosto 1991, pp. 425-7, PMID 1928627.
- Hebra, F. 1868. On disease of the skin including the exanthemata, vol. 2:, p. 164-252. The New Sydenham Society, London, United Kingdom. (Translated by C. H. Fagge and P. H. Pye-Smith.).
- Andrews RM, McCarthy J, Carapetis JR, Currie BJ, Skin disorders, including pyoderma, scabies, and tinea infections, in Pediatr. Clin. North Am., vol. 56, nº 6, dicembre 2009, pp. 1421–40, DOI:10.1016/j.pcl.2009.09.002, PMID 19962029.
- DPDx—Scabies, su Laboratory Identification of Parasites of Public Health Concern, CDC.
- Green MS, Epidemiology of scabies, in Epidemiol Rev, vol. 11, nº 1, 1989, pp. 126–50, PMID 2509232.
- S. Bouvresse e O. Chosidow, Scabies in healthcare settings, in Curr Opin Infect Dis, vol. 23, nº 2, aprile 2010, pp. 111–8, DOI:10.1097/QCO.0b013e328336821b, PMID 20075729.
- MI Hicks, Elston, DM, Scabies, in Dermatologic therapy, vol. 22, nº 4, 2009 Jul-Aug, pp. 279–92, DOI:10.1111/j.1529-8019.2009.01243.x, PMID 19580575.
- Giorgio Bartolozzi, Guglielmi Maurizio, Pediatria principi e pratica clinica p.762, Torino, Elsevier-Masson, 2008, ISBN 978-88-214-3033-6.
- AA. Hegazy, NM. Darwish; IA. Abdel-Hamid; SM. Hammad, Epidemiology and control of scabies in an Egyptian village., in Int J Dermatol, vol. 38, nº 4, aprile 1999, pp. 291-5, PMID 10321946.
- Christophersen J., The epidemiology of scabies in Denmark, 1900 to 1975., in Arch Dermatol., vol. 114, 1978, pp. 747-50.
- Rapini, Ronald P.; Bolognia, Jean L.; Jorizzo, Joseph L., Dermatology: 2-Volume Set, St. Louis, Mosby, 2007, ISBN 1-4160-2999-0.
- Bull LN, Roche E, Song EJ, Pedersen J, Knisely AS, van Der Hagen CB, Eiklid K, Aagenaes O, Freimer NB (2000) Mapping of the locus for cholestasis-lymphedema syndrome (Aagenaes syndrome) to a 6.6-cM interval on chromosome 15q. Am J Hum Genet. ottobre 2000; 67(4): 994-9. Epub 30 agosto 2000.
- Heiberg A, Aagenaes syndrome: lymphedema and intrahepatic cholestasis. Tidsskr Nor Laegeforen. 30 maggio 2001; 121(14): 1718-9.