Ultimo aggiornamento 12/27/2019 14:21:17
Definizione: La Vulvo-vaginite da candida (VVC) è una condizione infiammatoria causata da miceti del genere Candida.
Frequenza: la prevalenza dell’infezione varia tra il 20 e il 40%. Il 75% delle donne è soggetta ad almeno un episodio di VVC nella vita. In Italia, attualmente, rappresenta la seconda causa di infezione vaginale (20-25%), dopo la vaginosi batterica (40-45%), ma più frequente della vaginite da Trichomonas (circa 15%) e con un trend in crescita. Nel 15% delle donne si sviluppa una forma di VVC recidivante, definita come successione di almeno 4 episodi di infezione in un anno (1-3, 69-71).
E’ da rilevare come il rapporto fra infezioni da Candida albicans rispetto alle forme non-albicans era di 1:10-1:20 negli anni ‘70, mentre attualmente si sta portando su livelli pressoché paritari (1-3). Ciò sembra da attribuire alle migliorate tecniche diagnostiche e all’eccessivo uso continuato di fluconazolo e altri agenti azolici.
 Un dato epidemiologico riscontrato negli ultimi anni ha messo in evidenza come miceti un tempo rari, quali C. glabrata, C. tropicalis, C. parapsilosis, C. krusei, C. lusitaniae, Criptococcus neoformans abbiano mostrato un aumento significativo della loro prevalenza, passando dal 2-10% al 15-45%.
Un dato epidemiologico riscontrato negli ultimi anni ha messo in evidenza come miceti un tempo rari, quali C. glabrata, C. tropicalis, C. parapsilosis, C. krusei, C. lusitaniae, Criptococcus neoformans abbiano mostrato un aumento significativo della loro prevalenza, passando dal 2-10% al 15-45%.
Tali micosi non-albicans, a causa della loro maggior resistenza alle classiche terapie antimicotiche con imidazolici, rappresentano una nuova variabile nell’approccio terapeutico, soprattutto per le forme recidivanti.
Classificazione:
a) Candida albicans/candida non-albicans; la candida albicans rappresenta la specie micotica più frequente ed é presente fisiologicamente in vagina quale saprofita. Recentemente altre specie di miceti si sono sviluppati: aspergilli, blastomiceti, coccidiomiceti, paracoccidiomiceti, criptococchi, istoplasmi, mucormiceti, pseudoallescherii, sporotriceti.
b) Sintomatica/asintomatica
c) Acuta/cronica
d) Ricorrente
Fattori di rischio: è possibile identificare fattori predisponenti allo sviluppo della malattia solo in una ridotta percentuale di pazienti; la maggior parte dei casi viene quindi definito idiopatico. La Candida albicans colonizza circa il 10-50% delle donne senza dare alcun segno di sé perché vive allo stato di saprofita finché non viene “virulentata”. Sono stati individuati diversi fattori predisponenti per CVV:
- il diabete mellito e la gravidanza: la candida si sviluppa bene in ambiente acido che è quello fisiologico di vagina sana (3,5-4,5)
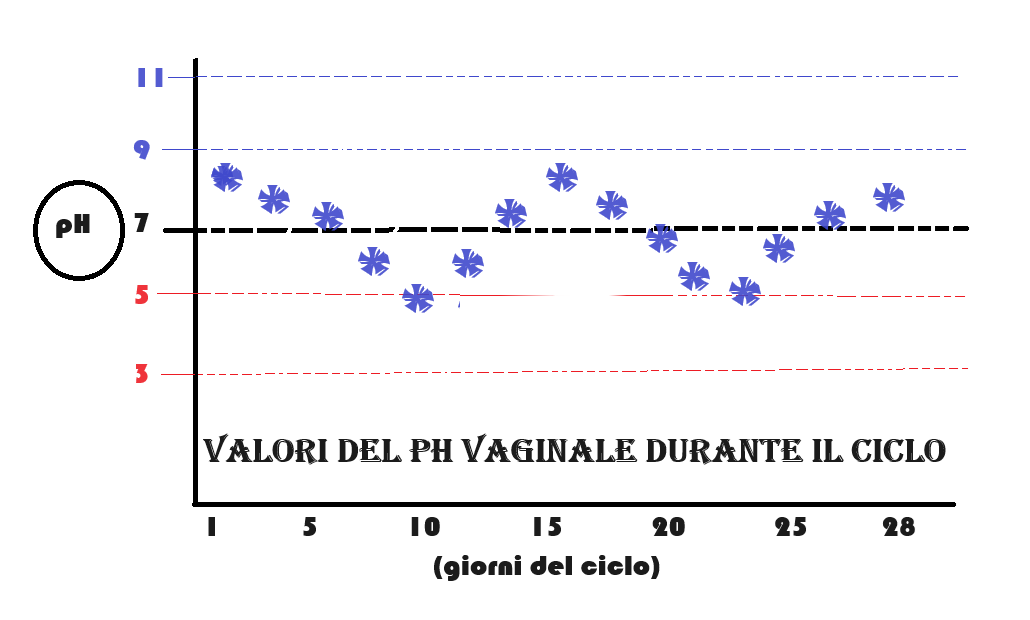
 ed ancora meglio in presenza di glicogeno similmente ai lattobacilli e contrariamente al trichomonas che si sviluppa in ambiente alcalino. Perciò la candida si trova sempre associata ai lattobacilli. L’abbondanza di glicogeno e il pH acido presenti fisiologicamente in gravidanza spiegano perchè le micosi si sviluppino frequentemente in gravidanza e nei soggetti diabetici. Le micosi sono invece molto rare in menopausa in cui il pH vaginale è basico e la disponibilità di glicogeno scarsa a causa dell’ipoestrogenismo fisiologico. Il pH vaginale aumenta con l’età, BMI elevato, rapporti sessuali senza contraccezione di barriera, atrofia vaginale, e diminuisce con l’attività fisica, l’attività professionale e la terapia ormonale sostitutiva (4-8).
ed ancora meglio in presenza di glicogeno similmente ai lattobacilli e contrariamente al trichomonas che si sviluppa in ambiente alcalino. Perciò la candida si trova sempre associata ai lattobacilli. L’abbondanza di glicogeno e il pH acido presenti fisiologicamente in gravidanza spiegano perchè le micosi si sviluppino frequentemente in gravidanza e nei soggetti diabetici. Le micosi sono invece molto rare in menopausa in cui il pH vaginale è basico e la disponibilità di glicogeno scarsa a causa dell’ipoestrogenismo fisiologico. Il pH vaginale aumenta con l’età, BMI elevato, rapporti sessuali senza contraccezione di barriera, atrofia vaginale, e diminuisce con l’attività fisica, l’attività professionale e la terapia ormonale sostitutiva (4-8). - durante il periodo mestruale e pre-mestruale: il pH vaginale diventa decisamente basico mentre nel periodo follicolare il pH è acido per ritornare decisamente basico nel periodo ovulatorio per l’abbondante muco cervicale il cui pH è 8.
- Stati di debilitazione e immunodepressione, terapia corticosteroidea
- AIDS: è stato ipotizzato che l’infezione da HIV potrebbe essere associato ad un aumento delle vaginiti da candida ed in particolare per le forme non-albicans. Ma questa teoria sono state smentite da studio di base e follow-up su donne condotto da HERS ( HIV Epidemiological Research Study), sia di base e studi di follow-up che non è riuscito a identificare un aumento del tasso di colonizzazione e vaginite causata da specie Candia albicans e non-albicans su pazienti HIV con CD4 basso (34).
- Rapporti sessuali frequenti, con diversi partners, orogenitali
- Frequenti esplorazioni vaginali e Indagini strumentali invasive: possono alterare le condizioni locali e generali della paziente favorendo lo sviluppo degli stipiti fungini.
- Infezioni nosocomiali: Poco si sa circa la possibilità di infezioni nosocomiali ma non è affatto rara e
 includono una complessa interazione di serbatoi ambientali e umani (14-19). Il ruolo dell’ambiente ospedaliero come un potenziale serbatoio di Candida è ulteriormente suggerita dai risultati di un recente studio in cui i ceppi identici di C. glabrata sono stati isolati dall’ambiente, prima ancora di infettare i pazienti ricoverati in Unità di Trapianto di Midollo Osseo (20). Sebbene ceppi infettanti possono essere coltivati da superfici ambientali, si ritiene che l’ambiente viene passivamente contaminato da organismi da pazienti (20,21). Due studi hanno coinvolto il trasporto sulle mani del personale ospedaliero come una possibile fonte di un focolaio (22,23).
includono una complessa interazione di serbatoi ambientali e umani (14-19). Il ruolo dell’ambiente ospedaliero come un potenziale serbatoio di Candida è ulteriormente suggerita dai risultati di un recente studio in cui i ceppi identici di C. glabrata sono stati isolati dall’ambiente, prima ancora di infettare i pazienti ricoverati in Unità di Trapianto di Midollo Osseo (20). Sebbene ceppi infettanti possono essere coltivati da superfici ambientali, si ritiene che l’ambiente viene passivamente contaminato da organismi da pazienti (20,21). Due studi hanno coinvolto il trasporto sulle mani del personale ospedaliero come una possibile fonte di un focolaio (22,23). - Iperestrogenismo: gli estrogeni facilitano la proliferazione della Candida perché aumentano il glicogeno vaginale, favoriscono l’adesione del micete alle cellule epiteliali della vagina, hanno un ruolo permittente sul passaggio da spora a ifa, come dimostrato dall’esplosione di infezioni da Candida dopo la pubertà; dai peggioramenti in fase middle follicolare e middle-luteale; e dalle recidive di Candida, in post-menopausa, quando si inizi la terapia ormonale sostitutiva, anche locale, in soggetti predisposti e/o che avevano avuto una candida recidivante in età fertile; tale ruolo è aumentato dal 17-beta-estradiolo e dall’etinil-estradiolo, non dall’estriolo o dal 17 alfa-estradiolo.

- Pillola contraccettiva: L’effetto dei contraccettivi orali nella RVVC è ancora discusso (26). Dispositivi contraccettivi intravaginali a rilascio graduale di ormoni vengono colonizzati in modo rilevante dalla Candida Albicans che aderisce tenacemente alla superficie del dispositivo (27).
- La RVVC è una dermatite allergico-irritativa conseguente ad una iper-reattività a piccole quote di Candida Albicans in soggetti geneticamente predisposti, per polimorfismo genico che coinvolge il sistema delle interleuchine e il conseguente svilupparsi della parallela vestibulite vulvare associata o conseguente alla Candida (1,28).
- L’ipertono dell’elevatore è uno dei fattori predisponenti più trascurati nella diagnosi ambulatoriale: non curato, diventa fattore di mantenimento della candidiasi ciclico-recidivante, aumentando nel contempo la probabilità di comorbilità con le cistiti post-coitali e la stipsi ostruttiva.
- Dismicrobismi intestinali: in caso di patologia intestinale come il m. di Crhon o colon irritabile oppure dopo l’assunzione di antibiotici a largo spettro, parte della flora saprofitica intestinale è distrutta e la produzione di biotina diminuisce, La biotina è un potente inibitore della trasformazione virulenta della candida. Quando essa manca, quest’ultima facilmente si trasforma da spora in ifa.
Fisiopatologia:
Si conosce ancora molto poco sul meccanismo che determina il passaggio dell’infezione della candida da fattore simbiotico a noxa patogena. Per infettare il tessuto ospite, il solito lievito unicellulare, rotondeggiante, come forma saprofitica di C. albicans, reagisce a stimoli ambientali e si trasforma da spora rotondeggiante in ifa, un organismo multicellulare di aspetto filamentoso, capace di penetrare nel rivestimento epiteliale grazie all’azione di tossine, enzimi proteolitici come proteasi (27,28), fosfolipasi (29-32) ed altri enzimi secreti dalla candida virulentata. Questa trasformazione si definisce commutazione fenotipica (33); Anche se spesso è definita come dimorfica, in realtà la candida albicans è di fatto polifenica, capace cioè di trasformarsi in diversi fenotipi. La commutazione è reversibile e il tipo di colonia può essere ereditato da una generazione all’altra.
La modesta virulenza della C. glabrata è dovuta soprattuttob all’assenza di commutazione fenotipica e alla minore capacità di secernere enzimi proteolitici e tossine (24,-26) .
Fattori di difesa: Il primo meccanismo di difesa dalle infezioni è costituito dall‘immunità innata che a sua volta si compone di una prima fase meccanica, di barriera costituita dall’integrità di cute e mucose, dalla presenza di cheratina e dalla secrezione di sebo, lacrime e muco che intrappolano i batteri impedendo loro di aderire alle cellule e dalla presenza di cilia che con il loro movimento spazzano via i batteri. La transferrina nel sangue compete con i batteri per il ferro.
La seconda fase dell’immunità innata e costituita dalla reazione infiammatoria, che è una reazione di difesa, prevede un’alterazione del microcircolo caratterizzata da vasodilatazione e aumento della permeabilità sinusoidale ai fluidi e, per diapedesi, dei leucociti (neutrofili, macrofagi, linfociti NK e dendriti) dal circolo ai tessuti extravascolari con lo scopo di bloccare e riparare i danni fisici (ferite, bruciature, traumi) o eliminare agenti patogeni (virus, batteri, funghi, cellule tumorali). L’infiammazione serve, dunque a diluire e confinare l’agente lesivo, ma allo stesso tempo mette in moto una serie di meccanismi che favoriscono la riparazione o la sostituzione del tessuto danneggiato. L’immunità innata è la prima risposta di difesa dell’organismo ed è pronta in poche ore a differenza dell’immunità adattativa (o acquisita o specifica) che necessita di giorni per attivarsi. Spesso l’immunità innata è sufficiente per prevenire e debellare le infezioni o traumi; comunque è indispensabile per l’attivazione dell’immunità specifica.
Le cellule dendritiche come i macrofagi sono cellule presentanti l’antigene (Antigen Presenting Cells, APC) ; cellule cioè che elaborano il materiale  antigenico e lo presentano sulla loro superficie cellulare in una forma riconoscibile dai linfociti T. Essi quindi fungono da messaggeri tra il sistema immunitario innato e quello adattativo. Le cellule dendritiche sono presenti nei tessuti che sono in contatto con l’ambiente esterno, come la pelle (dove c’è un tipo specializzato di dendrite chiamato cellula di Langerhans) e il rivestimento interno del naso, polmoni, stomaco, intestino e vagina. Possono anche essere trovati in uno stato immaturo nel sangue. Una volta attivati, migrano ai linfonodi dove interagiscono con le cellule T e le cellule B per iniziare e modellare la risposta immunitaria adattativa. In alcune fasi di sviluppo crescono proiezioni ramificati, i dendriti che danno la cellula il suo nome (δένδρον, “albero”). Simili nell’aspetto, questi dendriti sono strutture assolutamente distinte dai dendriti dei neuroni.
antigenico e lo presentano sulla loro superficie cellulare in una forma riconoscibile dai linfociti T. Essi quindi fungono da messaggeri tra il sistema immunitario innato e quello adattativo. Le cellule dendritiche sono presenti nei tessuti che sono in contatto con l’ambiente esterno, come la pelle (dove c’è un tipo specializzato di dendrite chiamato cellula di Langerhans) e il rivestimento interno del naso, polmoni, stomaco, intestino e vagina. Possono anche essere trovati in uno stato immaturo nel sangue. Una volta attivati, migrano ai linfonodi dove interagiscono con le cellule T e le cellule B per iniziare e modellare la risposta immunitaria adattativa. In alcune fasi di sviluppo crescono proiezioni ramificati, i dendriti che danno la cellula il suo nome (δένδρον, “albero”). Simili nell’aspetto, questi dendriti sono strutture assolutamente distinte dai dendriti dei neuroni.
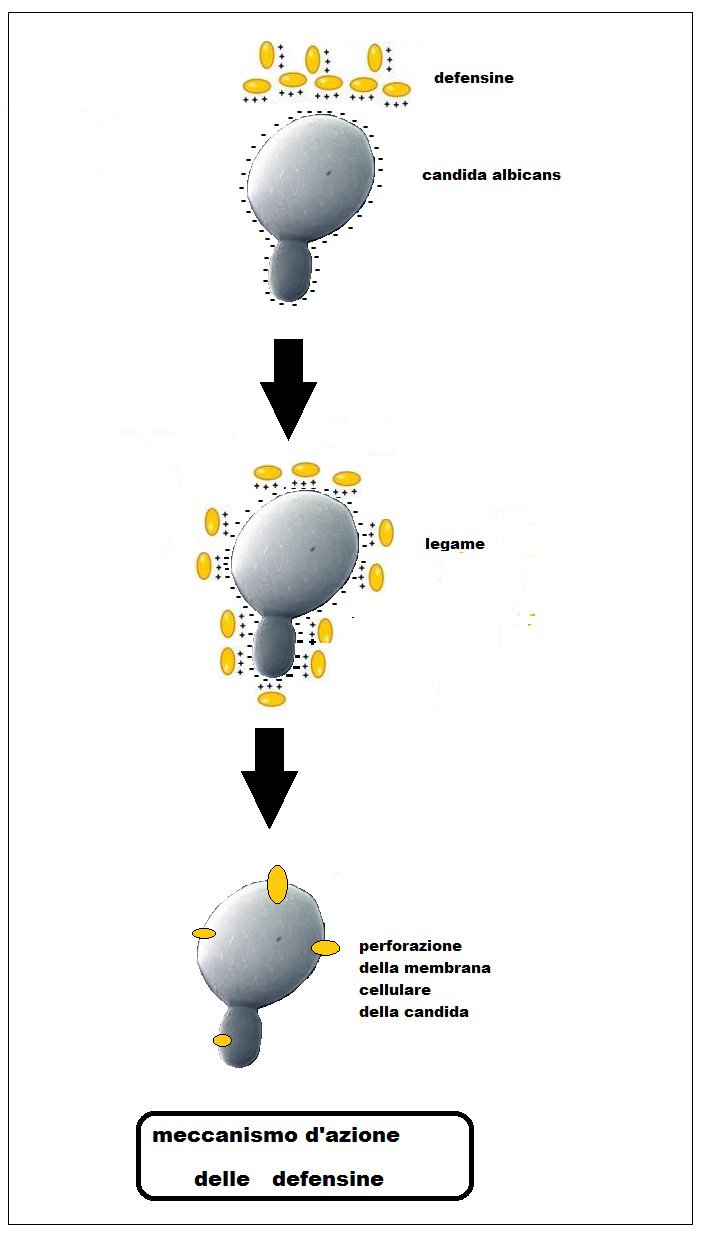
I peptidi antimicrobici sono un gruppo numeroso e diversificato di piccole molecole, contenenti dai 10 ai 50 amminoacidi, capaci di risposta immunitaria che costituisce la seconda fase dell’immunità innata. Sono definite anche AMP (antimicrobial peptides) e sono prodotti in molti tessuti e tipi di cellule. Il sistema di difesa degli AMP è stato oggetto di studio a partire dagli anni ’60, quando furono descritte per la prima volta le defensine, una famiglia di proteine antimicrobiche ubiquitarie (47). Da allora, molti altri peptidi antimicrobici, con effetti simili, sono stati scoperti, caratterizzati e isolati da un elevato numero di organismi viventi. Ad oggi più di mille peptidi sono state isolati da una serie di organismi filogeneticamente lontani tra loro (48).
La composizione amminoacidica e le caratteristiche chimico-fisiche delle defensine consentono loro di interagire con il doppio strato lipidico della membrana batterica causando perdita del potenziale elettrico della membrana e conseguente creazione di canali ionici e degradazione della cellula patogena (49-56).
La seconda linea di difesa dell’organismo è costituita dalla secrezione di proteine antimicrobiche e dalla fagocitosi. Il terzo e più importante meccanismo di difesa dell’organismo si é dimostrato l’attivazione T-linfocitaria con produzione di anticorpi specifici.
Le donne più vulnerabili alla candidiasi vaginale recidivante (CVVR) presentano alcune peculiarità genetiche alla base di alterazioni dei meccanismi difensivii:
- Polimorfismi della lectina legante il mannosio (Mannose Binding Lectin, MBL). Questa proteina lega specificamente residui di mannosio, di fucosio e di altri zuccheri, che sono presenti sulle superfici cellulari di molti patogeni. L’MBL è capace di attivare il complesso di attacco del complemento e provocare la lisi della membrana di diversi microrganismi, ed in particolare della candida, senza necessità dell’attivazione degli anticorpi. Sulla superficie cellulare dei vertebrati sono presenti altri tipi di zuccheri, ad esempio l’acido sialico. In questo modo l’MBL è in grado di discriminare il tipo di membrana di attacco e di innescare l’attivazione del complemento esclusivamente sulla superficie del patogeno. I polimorfismi del gene dell’MBL comporta un malfunzionamento della proteina che rende la donna meno capace di arginare la colonizzazione/infezione da Candida (35-46).
- Deficit del ruolo difensivo antimicrobico dell’epitelio vaginale; quest’ultimo svolge sia un meccanismo di barriera sia un’azione di riconoscimento antigenico e di secrezione di numerosi immuno-mediatori che regolano la risposta immunitaria vaginale. La specifica attività anti-Candida delle cellule vaginali è diminuita nei soggetti con CVVR.
- Deficit costitutivo degli inflammasomi di tipo NALP3, gli inflammasoniNALP3 sono complessi enzimatici formati da NALP3 + proteine adattatrici come l’ASC e altre; funzionano da recettori dello stress cellulare. Essi regolano la produzione ed il rilascio dell’interleuchina 10 (IL10); un polimorfismo del gene CIAS1 codifica un inflammasoma NALP3 alterato e induce la produzione di una IL 10 “sregolata”, con riduzione della competenza immunitaria locale.
- Elevata concentrazione locale di IgE: le Ig E sono gli anticorpi peculiari delle reazioni atopiche, nelle donne con CVVR. Questi anticorpi amplificano il processo infiammatorio, ed esasperano in particolare la sintomatologia pruriginosa
- Aumento dei linfociti Th-2, che avrebbero un’azione facilitante l’aggressione micotica
- Aumentata aggressività/virulenza del micete. Fattori di virulenza sono espressi alla superficie del fungo ed hanno un ruolo attivo nell’infezione. In particolare, enzimi della famiglia delle aspartico-proteinasi secrete (Sap, secreted aspartic proteinase) e un numero di adesine di natura proteica e/o glicoproteica hanno un ruolo chiave nell’adesione alle cellule della mucosa vaginale, prerequisito per la citotossicità successiva. La virulenza è espressa anche dalla capacità della Candida di formare ife che non solo costituiscono la forma attiva ma hanno anche la potenziale capacità di sottrarsi alle difese immunitarie (“immunoescape properties”).
Vie di trasmissione:
- Autoinfezione, specie dalla riserva intestinale: per contaminazione della cute vulvare da residui fecali o per traslocazione della Candida all’interno e attraverso le cellule della mucosa intestinale, specie in caso di infiammazioni del colon. L’intestino è una delle principali fonti di colonizzazione della Candida in vagina. In effetti, la Candida isolata da colture rettali in pazienti con CVVR si è rivelata identica a quella ritrovata in sede vaginale, suggerendo che esista una persistente riserva intestinale del micetein dagli anni 70 (63).
- Trasmissione sessuale: la colonizzazione asintomatica da Candida dei genitali maschili è quattro volte più comune nei partners sessuali di donne infette rispetto a quelle che non lo sono
- Trasmissione materno- fetale, durante il parto per via vaginale.
Sintomatologia della vaginite da candida albicans: Possono aversi frequentemente infezioni da lieviti senza alcuna sintomatologia accanto a forme violentemente sintomatiche che a loro volta possono  essere acute, croniche e recidivanti. La classica presentazione clinica di CVV acuta é costituita da prurito intenso, edema, eritema, bruciore specialmente durante la minzione, dispareunia, spesso disuria.
essere acute, croniche e recidivanti. La classica presentazione clinica di CVV acuta é costituita da prurito intenso, edema, eritema, bruciore specialmente durante la minzione, dispareunia, spesso disuria.
L’esame obiettivo ricercherà anzitutto i classici segni dell’infezione micotica
- leucorrea di aspetto biancastro, a grumi come il latte cagliato o ricotta, non maleodorante, che all’esame speculare appare sotto forma di chiazze biancastre, aderenti alla sottostante mucosa eritematosa vaginale e cervicale
- microerosioni della mucosa che facilitano l’iperattività del mastocita e il conseguente svilupparsi della parallela vestibolodinia (vestibulite vulvare o Vulvar Burning Syndrome), associata o
 conseguente alla Candida.
conseguente alla Candida. - Il pH vaginale non presenta significative alterazioni rispetto alla normalità (3.5-4.5).
- iperattività (o ipertono) dei muscoli elevatori dell’ano in risposta al dolore provocato dalle microlesioni epiteliali prodotte dalla candidiasi. La stessa iperattività del m. elevatore induce a sua volta l’iperattività dei mastociti. I mastociti (o mastcellule), sono cellule del sistema immunitario, prodotte nel midollo osseo dai precursori CD34+ e allocate nel tessuto connettivo lasso attorno ai piccoli vasi e alle terminazioni nervose. I mastociti sono direttamente interessati alla fisiopatologia del dolore. L’infiltrazione mastocitaria, è il denominatore comune in tutte le patologie pelviche caratterizzate dal dolore (sindrome della vescica dolorosa, vestibulite vulvare/vulvodinia, endometriosi, colon irritabile), che concorrono al dolore pelvico cronico. I mastociti sono attivati dal fattore flogistico ed esprimono la loro azione espellendo ll’esterno i corpuscoli lipidici ammassati nell’apparato di Golgi (degranulazione mastocitaria). Questi corpuscoli (o granuli) lipidici
 contengono eparina, istamina, NO, Nerve Growth Factor (NGF), Citochine IL-3, IL-4 e IL-5, il Granulocyte/macrophage-colony stimulating factor (GM-CSF), il Tumor necrosis factor (TNF), e ac. arachidonico. L’NGF è responsabile della proliferazione della terminazioni nervose del dolore e probabilmente dell’abbassamento della soglia del dolore. Dall’ac. arachidonico derivano prostaglandine, trombossani e leucotrieni. I leucotrieni e l’ossido nitrico possiedono un’azione vasodilatatrice. I leucotrieni e le PG esercitano un’azione contratturante sulla muscolatura liscia. L’istamina produce aumento della permeabilità vascolare con lo scopo di favorire l’afflusso di altre cellule immunitarie (eosinofili, neutrofili, monociti, linfociti T) per attaccare l’agente patogeno e l’eparina evita che il plasma trasudato dai capillari possa coagulare permettendo così alle proteine in esso contenute di svolgere la propria azione. Però, se la degranulazione di istamina è massiccia o continua, si induce una reazione esagerata con iperattivazione della commutazione fenotipica della candida superiore all’attivazione delle cellule immunitarie.
contengono eparina, istamina, NO, Nerve Growth Factor (NGF), Citochine IL-3, IL-4 e IL-5, il Granulocyte/macrophage-colony stimulating factor (GM-CSF), il Tumor necrosis factor (TNF), e ac. arachidonico. L’NGF è responsabile della proliferazione della terminazioni nervose del dolore e probabilmente dell’abbassamento della soglia del dolore. Dall’ac. arachidonico derivano prostaglandine, trombossani e leucotrieni. I leucotrieni e l’ossido nitrico possiedono un’azione vasodilatatrice. I leucotrieni e le PG esercitano un’azione contratturante sulla muscolatura liscia. L’istamina produce aumento della permeabilità vascolare con lo scopo di favorire l’afflusso di altre cellule immunitarie (eosinofili, neutrofili, monociti, linfociti T) per attaccare l’agente patogeno e l’eparina evita che il plasma trasudato dai capillari possa coagulare permettendo così alle proteine in esso contenute di svolgere la propria azione. Però, se la degranulazione di istamina è massiccia o continua, si induce una reazione esagerata con iperattivazione della commutazione fenotipica della candida superiore all’attivazione delle cellule immunitarie.
Il sospetto clinico di Candidiasi vulvo-vaginale deve essere confermato, per una diagnosi di certezza, dall’esame microscopico e/o colturale di un campione ottenuto mediante tampone vaginale.
Balanopostite é presente nel 10-30% dei partner maschili di donne positive per moniliasi vaginale.
Vaginite da candida glabrata: la candida glabrata, precedentemente denominata candida glabrata Torulopsis, e largamente ignorata fino agli anni ’90, è al 2° posto come frequenza fra le infezioni dopo la candida albicans. E’ presente soprattutto nelle pazienti diabetiche, immunodepresse e cachettiche (14-19). Diversamente dalla vaginite da C. albicans, provoca soprattutto prurito vulvo-vaginale, bruciore e scarse perdite. Come la c. albicans, predilige le zone umide del corpo (vagina, bocca, esofago, intestino) e si duplica per gemmazione. Il tampone vaginale costituisce il “gold standard” diagnostico per la identificazione della C. glabrata. Ha una sensibilità al fluconazolo nettamente ridotta rispetto alla c. albicans ma ha una buona sensibilità al terconazolo, fucitosina per via topica, anfotericina B e nistatina in combinazione con acido borico (9-13).
Candidiasi Vulvo-Vaginale ricorrente (CVVR):
Interessa circa il 5-15% delle donne in età fertile e rappresenta, nell’ambito delle infezioni vulvo-vaginali, un problema emergente e di difficile soluzione. I miceti interessati sono la C. albicans nell’80% dei casi, la C. glabrata nel 15%, C.tropicalis e krusei e parapsilosi e lusitaniae nel restante 5% dei casi. Interessa soprattutto le donne diabetiche ed immunodepresse. Necessita di una terapia lunga ed articolata basata su antimicotici, antinfiammatori e probiotici. La resistenza alla terapia si verifica a causa di:
- mutazioni nel gene ERG11, che codifica per 14α-demetilasi. Queste mutazioni impediscono al farmaco azolico di legarsi, pur consentendo il legame con il substrato naturale dell’enzima, il lanosterolo. Lo sviluppo di questo tipo di resistenza a un farmaco azolico conferisce resistenza a tutti i farmaci della classe.
- aumentata velocità di efflusso del farmaco azolico dalla cellule micotiche, grazie alla attività della superfamiglia dei grandi trasportatori.
- dismicrobismo intestinale: l’intestino rappresenta la cronica fonte di contagio (72) dove, a causa del deficit di biotina e/o della riduzione della flora saprofitica fisiologica in seguito a terapia antibiotica e/o per patologia intestinale si assiste al viraggio della candida dalla forma sporigena a fungo patogeno. I dati sperimentali ed epidemiologici però non sono univoci.
- lo sviluppo di specie non-albicans (C. tropicalis, C. glabrata, C. parapsilosis ecc.) più resistenti alle terapie imidazoliche;
- la trasmissione sessuale ripetuta da parte di partner maschili non trattati (effetto ping-pong). L’incidenza della trasmissione sessuale è però solo del 20%;
- Stimoli flogogeni cronici in cui è coinvolta l’attivazione dei mastociti. L’infiltrazione mastocitaria, è il denominatore comune in tutte le patologie pelviche caratterizzate dal dolore (sindrome della vescica dolorosa, vestibulite vulvare/vulvodinia, endometriosi, colon .irritabile), che concorrono al dolore pelvico cronico. La prolungata attivazione mastocitaria produce un’attivazione continua, prolungata e recidivante delle infezioni vaginali resistenti a tutte le terapie antibiotiche seppure mirate.
Meccanismo fisiopatologico: attualmente il meccanismo patogenetico della candidosi vaginale ricorrente viene riconosciuto in:
1) aumentata virulenza della specie candida;
2) depressione dell’attività immunitaria cellulo-mediata locale della mucosa vaginale e/o sistemica;
3) reazione di ipersensibilità locale provocata dalle PGE prodotte in eccesso dai macrofagi stimolati dagli antigeni della candida;
4) alterazione della flora batterica vaginale.
DIAGNOSI CVVR:
Viene posta con la sintomatologia, l’esame obiettivo e con la ricerca della candida in cultura in vitro.
- la sintomatologia pruriginosa è presente, seppur meno intensa rispetto alla forma acuta. Il bruciore e la dispareunia rivestono maggior importanza rispetto alle candidosi vulvovaginali acute.
- Il quadro clinico può essere rappresentato da un eritema diffuso del vestibolo vaginale, piccole labbra e solco interlabiale, con erosioni confluenti nelle piccole labbra, microvescicolazioni delimitate da un “orletto” biancastro, parzialmente desquamante, lateralmente al confine con le grandi labbra. La leucorrea, quando presente, non è particolarmente abbondante ed è acquosa o finemente densa ed omogenea.
- l’esame a fresco del vetrino sotto microscopio ottico e l’aggiunta sullo striscio di idrossido di potassio (KOH) al 10% o colorazione del vetrino con blu di metilene. Il KOH dissolve le altre cellule e rende più evidenti le la ricerca della candida mediante cultura in vitro.ife e le spore della candida. Con la colorazione di Papanicolau non si evidenzia molto la candida per cui è necessario ricorrere alla cultura in vitro di campioni di secreto vaginale ottenuti mediante tampone.
Terapia: la prevenzione e la cura della candidosi vulvovaginale ricorrente deve prevedere una strategia multimodale di lunga durata (6-12 mesi), finalizzata a correggere i fattori predisponenti, precipitanti e di mantenimento. Attualmente la CVVR è da collocare, oltre che tra le infezioni vulvo-vaginali, soprattutto tra le patologie immunoallergiche causate dalla Candida.
- Fluconazolo cpr (Diflucan® cpr 150 mg: una compressa al dì per 3 giorni; quindi una volta a settimana per 3 mesi). Associare probiotici tutti i giorni per 3 mesi (69).
- Amfotericina B : (Fungizone® fl 50 mg in soluzione elettrolitica per infusione endovena lentissima (H); Talsutin® crema vaginale (tetraciclina + amfotericina B).
- Acido borico: AB-300® capsule vaginali o AB 300 plus crema vaginale crema vaginale (Ac. borico + ß-glucano + Policarbophil); (Ac. borico + beta glucano + policarbophil); Acido borico è micostatico mentre il ß-glucano sviluppa le difese immunitarie e il policarbophil è mucoadesivo ed acidificante.
- Micostop® flac P (ac. borico + clorexidina + clotrimazolo);
- Boracid plus® schiuma vaginale (ac. Borico + ac. Benzoico).
- Micostop crema vaginale (ac. borico + clorexidina + clotrimazolo)
- Deltavagin (Betametasone 2 mg +Tirotricina 10 mg + Acido Alfa aminovalerianico (Norvalina) 100 mg): 1 ovulo ogni sera prima di coricarsi, introdotto profondamente in vagina. Iniziare il trattamento subito dopo il mestruo, ripetendo, se necessario, un ciclo dopo il successivo periodo mestruale. Nei giorni seguenti si può passare al componente ritenuto necessario.Il Betametasone è un glucocorticoide sintetico che esercita un’azione antiflogistica locale, riducendo l’essudazione antinfiammatoria e l’iperemia locale. La Tirotricina assicura un ampio spettro d’azione antibatterica. Inoltre la Tirotricina agisce bene anche in presenza di essidati o di materiale necrotico. L’acido alfa aminovalerianico, riportando verso l’acidità il pH vaginale, favorisce il ristabilimento della normale flora vaginale. In gravidanza somministrare solo in caso di effettiva necessità.
- Biotina (Diathynil® cpr 5 mg: 2 cpr/die per 6 settimane , fl im/ev 5 mg: 1-2 fl tre volte a settimana per 6 settimane): è una vitamina del gruppo B ed un potente inibitore della virulentazione della candida a livello intestinale. Durante la terapia si consiglia l’esclusione dalla dieta dell’albume d’uovo crudo, nel quale è contenuta una proteina chiamata avidina che si lega con la D(+) biotina inibendone l’assorbimento intestinale. La Biotina è denominata vitamina H nella letteratura tedesca e vitamina B7 in quella anglo-sassone. La biotina è presente nel latte e latticini, nel tuorlo d’uovo e nei frutti di mare, ma per essere disponibile occore che gli alimenti che la contengono siano ben digeriti; per tale motivo c’è carenza di biotina nei soggetti enteropatici. Il meccanismo di assorbimento intestinale è ancora poco conosciuto ma è plausibile che la sua captazione avvenga per gradiente di concentrazione grazie al sodio; ciò costituisce il rationale della terapia con bicarbonato di sodio (1 cucchiano/die disciolto in acqua. .
La biotina è prodotta in elevate quantità anche dai batteri intestinali. Il farmaco può essere impiegato durante la gravidanza e l’allattamento. La D(+) biotina costituisce il gruppo prostetico degli enzimi di carbossilazione essenziali per il metabolismo dei carboidrati, dei lipidi e delle purine della flora intestinale saprofitica.
Prebiotici e probiotici per somministrazione orale e per applicazione locale: nonostante la tendenza delle case farmaceutiche ad esagerane le qualità terapeutiche, queste sostanze sembrano abbassare il pH locale, inibire la crescita dei batteri non saprofitici per competizione nell’adesione epiteliale e mediante la produzione di antibiotici naturali e favorire la crescita della flora saprofitica fisiologica (72-78).
- Vitagyn C® ovuli e crema vaginale (vit C + lattobacilli)
- Dicoflor 60® bustine (maltodestrine, fruttosio, probiotici liofilizzati, lattobacilli rhamnosus): 1 bustina x 2/die durante i pasti, disciolta in acqua o direttamente in bocca.
- Dicoflor Elle® capsule: 2-3 cps/die lontano dai i pasti
- Diflumax flac P: a base di acqua termale salsobromoiodica, estratti di calendula, salvia, malva e olio essenziale di timo
- olii detergenti (olio di germe di grano, olio di iberico, olio di canapa, Melaleuca alternifolia) che rispettano il film lipidico cutaneo e forniscono sostanze ad azione antiossidante.
- Biancheria intima non colorata e di puro cotone
- Slip di tessuto DermaSilk®, fibroina di seta nobilitata con una protezione antimicrobica permanente (35)
Precauzioni dietetiche (per almeno 6 mesi):
- La dieta deve essere ipoglicidica, ipolipidica e ricca di verdure, legumi, carne e yogurt e distribuita in 3 pasti principali leggeri e 2 spuntini. Preferire lo yogurt greco ricco di fermenti lattici vivi.
- Diminuire o abolire il consumo di zucchero raffinato che fermentando favorisce la crescita dei miceti: anche una modesta diminuzione del consumo di zucchero apporta notevole riduzione della frequenza della CVVR
- evitare i prodotti raffinati
- preferire i prodotti bio, a chilometro zero
- evitare gli alcoolici: l’alcool fornisce elementi utili per la crescita della candida.
- evitare i latticini
- diminuire il consumo di lardo o alimenti grassi animali
- evitare i prodotti contenenti glutine
- Non bere molto durante i pasti
- Includete nella dieta, quanto più vi è possibile, zenzero, cinnamomo, aglio ed altre erbe aromatiche (ad esempio l’origano) – sono tutte fungicide e aiutano la digestione.
- Per favorire le funzioni intestinali, è utile assumere quotidianamente prodotti a base di fibre ((Benefibra® bustine).
- per le prime settimane, evitare anche la frutta troppo dolce come melone e uva.
- Eliminare i formaggi stagionati, la frutta secca e ogni cibo che sia derivato o contenga del lievito
References:
- Holland J, Young ML, Lee O, et al; Vulvovaginal carriage of yeasts other than Candida albicans. Sex Transm Infect. 2003 Jun;79(3):249-50.
- Foxman B, Muraglia R, Dietz JP, et al; Prevalence of recurrent vulvovaginal candidiasis in 5 European countries and the United States: results from an internet panel survey. J Low Genit Tract Dis. 2013 Jul;17(3):340-5. doi: 10.1097/LGT.0b013e318273e8cf.
- Lindner JG, Plantema FH, Hoogkamp-Korstanje JA; Quantitative studies of the vaginal flora of healthy women and of obstetric and gynaecological patients. J Med Microbiol. 1978 Aug;11(3):233-41.
- Nyirjesy P, Sobel JD; Genital mycotic infections in patients with diabetes. Postgrad Med. 2013 May;125(3):33-46. doi: 10.3810/pgm.2013.05.2650.
- Kelekci S, Kelekci H, Cetin M, et al; Glucose tolerance in pregnant women with vaginal candidiasis. Ann Saudi Med. 2004 Sep
- Sobel JD; Vulvovaginal candidosis. Lancet. 2007 Jun 9;369(9577):1961-71.
- Candida – female genital; NICE CKS, August 2012 (UK access only)
- Pereira Da Silva D. Martinez De Oliveira J. Negreiro F. : “Studio osservazionale del pH vaginale in donne Portoghesi sane” Minerva Ginecologica 2011 Aprile;63(2):203-1
- Dodgson AR, Pujol C, Denning DW, Soll DR, Fox AJ. Multilocus sequence typing of Candida glabrata reveals geographically enriched clades. J Clin Microbiol. 2003 Dec;41(12):5709-17.
- E. K.; Carver, B. J.; Montedonico, A. E.; Reynolds, T. B. (2009). “The inositol regulon controls viability in Candida glabrata”. Microbiology 156 (2): 452–462.
- Fidel F, Vazquez J, Sobel J. (1999). “Candida glabrata: Review of Epidemiology, Pathogenesis, and Clinical Disease with Comparison to C. albicans“. Clinical Microbiology Reviews 12 (1): 80–96.
- Paul L. Fidel, Jr., Jose A. Vazquez, and Jack D. Sobel Candida glabrata: Review of Epidemiology, Pathogenesis, and Clinical Disease with Comparison to C. albicans Clin Microbiol Rev. 1999 Jan; 12(1): 80–96.
- Barns S M, Lane D J, Sogin M L, Bibeau C, Weisburg W G. Evolutionary relationships among pathogenic Candida species and relatives. J Bacteriol. 1991;173:2250–2255
- Beck-Sague C M, Jarvis T R. Secular trends in the epidemiology of nosocomial fungal infections in the United States. J Infect Dis. 1993;167:1247–1251.
- Bodey G P. Candidiasis in cancer patients. Am J Med. 1986;77:13–19
- Bross J, Talbot G H, Maislin G, Hurwitz S, Strom B L. Risk factors for nosocomial candidemia: a case control study in adults without leukemia. Am J Med. 1989;87:614–620.
- Horn R, Wong B, Kiehn T E, Armstrong D. Fungemia in a cancer hospital: changing frequency, earlier onset, and results of therapy. Rev Infect Dis. 1985;7:646–655.
- Komshian S V, Uwaydah A K, Sobel J D. Fungemia caused by Candida species and Torulopsis glabrata in the hospitalized patient: frequency, characteristics, and evaluation of factors influencing outcome.Rev Infect Dis. 1989;11:379–390.
- Wey S B, Motomi M, Pfaller M A, Wolsen R F, Wenzel R P. Risk factors for hospital-acquired candidemia: a matched case control study. Arch Intern Med. 1989;149:2249–2253.
- Vazquez J A, Dembry L M, Sanchez V, Vazquez M A, Sobel J D, Dmuchowski C, Zervos M J. Nosocomial Candida glabrata colonization: an epidemiologic study. J Clin Microbiol. 1998;36:421–426.
- Vazquez J A, Sanchez C, Dmuchowski C, Dembry L, Sobel J D, Zervos M J. Nosocomial acquisition of Candida albicans: an epidemiologic study. J Infect Dis. 1993;168:195–201.
- Isenberg H D, Tucci V, Cintron F, Singer C, Weinstein G S, Tyras D. Single source outbreak ofCandida tropicalis complicating coronary bypass surgery. J Clin Microbiol. 1989;27:2426–2428.
- Vazquez J A, Sanchez C, Dmuchowski C, Dembry L, Sobel J D, Zervos M J. Nosocomial acquisition of Candida albicans: an epidemiologic study. J Infect Dis. 1993;168:195–201.
- DeBernardis F, Chiani P, Ciccozzi M, Pellegrini G, Ceddia T, D’Offizzi G, Quinti I, Sullivan P, Cassone A. Elevated aspartic proteinase secretion and experimental pathogenicity of Candida albicans isolates from oral cavities of subjects infected with human immunodeficiency virus. Infect Immun. 1996;64:466–471.
- Fidel P L, Jr, Cutright J L, Tait L, Sobel J D. A murine model of Candida glabrata vaginitis. J Infect Dis. 1996;173:425–431.
- Shakir B S, Martin M V, Smith C J. Relative effectiveness of various yeasts, Candida spp. andTorulopsis glabrata, for inducing palatal infection in the Wistar rat. Arch Oral Biol. 1983;28:1069–1071.
- Cassone A, DeBernardis F, Mondello F, Ceddia T, Agatensi L. Evidence for a correlation between proteinase secretion and vulvovaginal candidosis. J Infect Dis. 1987;156:777–783.
- Ross I K, DeBernardis F, Emerson G W, Cassone A, Sullivan P A. The secreted aspartate proteinase ofCandida albicans: physiology of secretion and virulence of a proteinase-deficient mutant. J Gen Microbiol.1990;136:687–694.
- Barret-Bee K, Hayes Y, Wilson R G, Ryley J F. A comparison of phospholipase activity, cellular adherence and pathogenicity of yeasts. J Gen Microbiol. 1985;131:1217–1221.
- Ibrahim A S, Mirbod F, Filler S G, Yoshiko B, Cole G, Kitajima Y, Edwards J E, Jr, Nosawa Y, Ghannoum M A. Evidence implicating phospholipase as a virulence factor of Candida albicans. Infect Immun. 1995;63:1993–1998.
- Odds F C. In Candida and candidosis. Baltimore, Md: University Park Press; 1988. Chronic mucocutaneous candidiosis; pp. 104–110.
- Sobel J D, Muller G, Buckley H R. Critical role of germ tube formation in the pathogenesis of candidal vaginitis. Infect Immun. 1984;44:576–580.
- Soll D R. High-frequency switching in Candida albicans. Clin Microbiol Rev. 1992;5:183–203.
- Schuman, P., J. D. Sobel, S. Ohmit, K. H. Mayer, A. Rompalo, A. Duerr, D. K. Smith, D. Warren, and R. S. Klein. Mucosal Candida colonization and candidiasis in women with or without at-risk for HIV infection. Clin. Infect. Dis., in press.
- Capparelli R., Iannaccone M., Palumbo D., Medaglia C., Moscariello E., Russo A., Iannelli D. (2009). Role played by human mannose-binding lectin polymorphisms in pulmonary tuberculosis. J. Infect. Dis., 199 (5): 666-72.
- Iobst S.T., Wormald M. R., Weis W. I., Dwek R. A., Drickamer K. (1994). Binding of sugar ligands to Ca(2+)-dependent animal lectins. I. Analysis 68 of mannose binding by site-directed mutagenesis and NMR. J. Biol. Chem., 269 (22): 15505-11.
- Chen C.B. e Wallis R. (2004). Two mechanisms for mannose-binding protein modulation of the activity of its associated serine proteases. J. Biol. Chem., 279 (25): 26058-65.
- Schwaeble W., Dahl M.R., Thiel S., Stover C., Jensenius J.C. (2002). The mannan-binding lectin-associated serine proteases (MASPs) and MAp19: four components of the lectin pathway activation complex encoded by two genes. Immunobiology, 205 (4-5): 455-66.
- Turner M.W. (1996). Mannose-binding lectin: the pluripotent molecule of the innate immune system. Immunology Today, 17 (11): 532-40.
- Fraser IP, Koziel H, Ezekowitz RA (1998). “The serum mannose-binding protein and the macrophage mannose receptor are pattern recognition molecules that link innate and adaptive immunity.”. Semin. Immunol. 10 (5): 363–72
- Worthley DL, Bardy PG, Mullighan CG (2005). “Mannose-binding lectin: biology and clinical implications.”. Internal medicine journal 35 (9): 548–55.
- Sheriff S, Chang CY, Ezekowitz RA (November 1994). “Human mannose-binding protein carbohydrate recognition domain trimerizes through a triple alpha-helical coiled-coil”. Nat. Struct. Biol. 1 (11): 789–94
- Guo N, Mogues T, Weremowicz S, Morton CC, Sastry KN (March 1998). “The human ortholog of rhesus mannose-binding protein-A gene is an expressed pseudogene that localizes to chromosome 10”. Mamm. Genome 9 (3): 246–9.
- Seyfarth J, Garred P, Madsen HO (2005). “The ‘involution’ of mannose-binding lectin”. Human Molecular Genetics 14 (19): 2859–69
- Jensen PH, Laursen I, Matthiesen F, Højrup P (2007). “Posttranslational modifications in human plasma MBL and human recombinant MBL”. Biochim. Biophys. Acta – Proteins & Proteomics. 1774: 335–44.
- Bradley, D. T.; Bourke, T. W.; Fairley, D. J.; Borrow, R.; Shields, M. D.; Young, I. S.; Zipfel, P. F.; Hughes, A. E. (2012). “Genetic susceptibility to invasive meningococcal disease: MBL2 structural polymorphisms revisited in a large case-control study and a systematic review”. International Journal of Immunogenetics: no. doi:10.1111/j.1744-313X.2012.01095.
- Zeya HI, Spitznagel JK. Antimicrobial specificity of leukocyte lysosomal cationic proteins. Science. 1966 Nov 25;154(752):1049-51
- Wang G, Li X, Wang Z. APD2: The updated antimicrobial peptide database and its application in peptide design. (2009) Nucleic acids Res.;37:D933– D937.
- Boman HG. Innate immunity and the normal microflora. Immunol Rev. 2000 Feb; 173:5-16. Review.
- Vizioli, J. & Salzet, M. Antimicrobial peptides from animals: focus on invertebrates. (2002) Trends Pharmacol. Sci. 23, 494–496
- Thevissen K, Osborn RW, Acland DP, Broekaert WF. Specific binding sites for an antifungal plant defensin from Dahlia (Dahlia merckii) on fungal cells are required for antifungal activity.(2000) Mol Plant Microbe Interact. Jan;13(1):54- 61.
- Levy F, Rabel D, Charlet M, Bulet P, Hoffmann JA, Ehret-Sabatier L. Peptidomic and proteomic analyses of the systemic immune response of Drosophila. Biochimie.2004 ;86(9-10):607-16.
- Papagianni M (2003) Ribosomally synthesized peptides with antimicrobial properties: biosynthesis, structure, function, and applications. Biotechnol Adv 21: 465–499.
- Tomasinsig L, Skerlavaj B, Papo N, Giabbai B, Shai Y, Zanetti M.- Mechanistic and functional studies of the interaction of a proline-rich antimicrobial peptide with mammalian cells. (2006) J Biol Chem. 6;281(1):383- 91.
- Jerala R, Porro M. Endotoxin neutralizing peptides. (2004) Curr Top Med Chem.;4(11):1173-84. Review.
- McPhee JB, Hancock RE. Function and therapeutic potential of host defence peptides. J Pept Sci. 2005 Nov;11(11):677-87. Review.
- Sweetman S, editor. Martindale: The complete drug reference. 34th ed. London: Pharmaceutical Press; 2004.
- Pfizer Australia Pty Ltd. Diflucan (Australian Approved Product Information). West Ryde (NSW): Pfizer Australia; 2004.
- Nurbhai M, Grimshaw J, Watson M, et al; Oral versus intra-vaginal imidazole and triazole anti-fungal treatment of Cochrane Database Syst Rev. 2007 Oct 17;(4):CD002845.
- Watson MC, Grimshaw JM, Bond CM, et al; Oral versus intra-vaginal imidazole and triazole Management of vulvovaginal candidiasis; British Association for Sexual Health and HIV (2007)
- Nicky Longley, Conrad Muzoora, Kabanda Taseera, James Mwesigye, Joselyne Rwebembera, Ali Chakera, Dose Response Effect of High‐Dose Fluconazole for HIV‐Associated Cryptococcal Meningitis in Southwestern Uganda in Clinical Infectious Diseases, vol. 47, nº 12, 2008, pp. 1556–1561
- FDA Alert: Diflucan (fluconazole): Drug Safety Communication – Long-term, High-dose Use During Pregnancy May Be Associated With Birth Defects, DDrugs.com, 03/08/2011.
- Bertholf ME, Stafford MJ: “Colonization of candida albicans in vagina, rectum and mouth”. J Fam Pract 1983;15:919-924.
- Sekhavat L, Tabatabaii A, Tezerjani FZ Oral fluconazole 150 mg single dose versus intra-vaginal clotrimazole treatment of acute vulvovaginal candidiasis. J Infect Public Health. 2011 Sep;4(4):195-9.
- WÃchtler B, Wilson D, Hube B. Candida albicans adhesion to and invasion and damage of vaginal epithelial cells: stage-specific inhibition by clotrimazole and bifonazole. Antimicrob Agents Chemother. 2011 Sep;55(9):4436-39
- Czaika VA, Siebenbrock J, Czekalla F, Zuberbier T, Sieber MA.: “Reactive oxygen species and the bacteriostatic and bactericidal effects of isoconazole nitrate”. Mycoses. 2013 May;56 Suppl 1:16-22. doi: 10.1111/myc.12055.
- Niwa T1, Shiraga T, Takagi A. “Effect of antifungal drugs on cytochrome P450 (CYP) 2C9, CYP2C19, and CYP3A4 activities in human liver microsomes”. Biol Pharm Bull. 2005 Sep;28(9):1805-8.
- Murayama N, Imai N, Nakane T, Shimizu M, Yamazaki H.Roles of CYP3A4 and CYP2C19 in methyl hydroxylated and N-oxidized metabolite formation from voriconazole, a new anti-fungal agent, in human liver microsomes. Biochem Pharmacol. 2007 Jun 15;73(12):2020-6. Epub 2007 Mar 19.
- F. Murina, A. Graziottin, R. Felice, G. L. Radici and S. Di Francesco The Recurrent Vulvovaginal Candidiasis: Proposal of a Personalized Therapeutic Protocol Obstet Gynecol. 2011; 2011: 806065.
- Sobel JD. Vulvovaginal candidiasis. The Lancet. 2007;369(9577):1961–1971.
- 2. Sobel JD. Candida vulvovaginitis. Seminars in Dermatology. 1996;15(1):17–28.
- Miles MR, Olsen L, Rogers A. Recurrent vaginal candidiasis. Importance of an intestinal reservoir. Journal of the American Medical Association. 1977;238(17):1836–1837.
- Reid G, Bruce AW. Urogenital infections in women: can probiotics help? Postgraduate Medical Journal.2003;79(934):428–432
- Reid G, Millsap K, Bruce AW. Implantation of Lactobacillus casei var rhamnosus into the vagina.Lancet. 1994;344:1229.
- Cadieux P, Burton J, Kang CY, et al. Lactobacillus strains and vaginal ecology. JAMA. 2002;287:1940–1941. Abstract.
- Baerheim A, Larsen E, Digranes A. Vaginal application of lactobacilli in the prophylaxis of recurrent lower urinary tract infection in women. Scand J Prim Health Care. 1994;12:239–243. Abstract.
- Kontiokari T, Sundqvist K, Nuutinen M, et al. Randomised trial of cranberry-lingonberry juice and Lactobacillus GG drink for the prevention of urinary tract infections in women. BMJ. 2001;322:1571.
- Chlebecek J, Reich I. [Fermalac Vaginal (Rougier Inc.) in the prevention of colpitis in pregnancy] Cesk Gynekol. 1993;58:237–238.
- KA. Walker, AC. Braemer; S. Hitt; RE. Jones; TR. Matthews, 1-[4-(4-Chlorophenyl)-2-(2,6-dichlorophenylthio)-n-butyl]-1H-imidazole nitrate, a new potent antifungal agent. in J Med Chem, vol. 21, nº 8, Ago 1978, pp. 840-3,
- JP. Latge, A. Beauvais; M. Montaonakil; M. Diarin; JN. Fracchia, [Action of 2 new imidazole derivatives (butoconazole and sulconazole) on Candida, Trichophyton and Aspergillus]. in Ann Dermatol Venereol, 116 Suppl 1, 1989, pp. 20-3,
- P. Bourée, C. Issoire, [In vitro evaluation of the activity of butoconazole against Trichomonas vaginalis]. in Pathol Biol (Paris), vol. 40, nº 5, Mag 1992, pp. 492-4,
- LZ. Heng, Y. Chen; TC. Tan, Treatment of recurrent vulvo-vaginal candidiasis with sustained-released butoconazole pessary in Singapore Med J, vol. 53, nº 12, Dic 2012, pp. e269-71,
- RH. Kaufman, MR. Henzl; D. Brown; DS. Horner; RH. Krauss; DR. Mehlisch; DE. Moore; RL. Prentice, Comparison of three-day butoconazole treatment with seven-day miconazole treatment for vulvovaginal candidiasis. in J Reprod Med, vol. 34, nº 7, Lug 1989, pp. 479-83,
- W. Droegemueller, DG. Adamson; D. Brown; L. Cibley; F. Fleury; ME. LePage; MR. Henzl, Three-day treatment with butoconazole nitrate for vulvovaginal candidiasis. inObstet Gynecol, vol. 64, nº 4, Ott 1984, pp. 530-4,
- D’Antuono A., Bellavista S., Gaspari V., Filippini A., Patrizi A.: “DermaSilk® briefs in recurrent vulvovaginal candidosis. An alternative option in long-lasting disease”. Minerva Ginecologica 2013; 65:697-705.
- Fischer G; Chronic vulvovaginal candidiasis: what we know and what we have yet to learn. Australas J Dermatol. 2012 Nov;53(4):247-54.
- Wächtler B, Wilson D, Hube B.: Antimicrob Agents Chemother. 2011 Sep;55(9):4436-9.





3 commenti
My spouse and I stumbled over here coming from a different website and thought I might as
well check things out. I like what I see so now i am following you.
Look forward to looking over your web page for a
second time.
Please let me know if you’re looking for
a author for your blog. You have some really good articles and
I believe I would be a good asset. If you ever want to take some
of the load off, I’d absolutely love to write some material for your
blog in exchange for a link back to mine. Please send me an e-mail if interested.
Many thanks!
Have you ever considered about adding a little bit more than just your articles?
I mean, what you say is valuable and everything. But think about if you added
some great graphics or videos to give your posts more, “pop”!
Your content is excellent but with pics and clips, this website could certainly
be one of the greatest in its niche. Awesome blog!