La riacutizzazione della broncopneumopatia cronica ostruttiva (BCO) consiste in un peggioramento grave e improvviso della sintomatologia e della funzione respiratoria, che richiedono  l’intervento medico di urgenza e/o l’ospedalizzazione.
l’intervento medico di urgenza e/o l’ospedalizzazione.
Le riacutizzazioni della BCO peggiorano le condizioni generali. Il numero di riacutizzazioni è correlato alla gravità della broncopneumopatia cronica ostruttiva. I pazienti con BCO moderata-grave hanno una o due riacutizzazioni per anno.
La gravità delle riacutizzazioni dipende dalla gravità della broncopneumopatia cronica ostruttiva di base.
Nei pazienti con broncopneumopatia cronica ostruttiva lieve, le riacutizzazioni sono associate ad aumento della dispnea con tosse ed espettorazione, insufficienza respiratoria che può essere letale e richiedere il ricovero ospedaliero, in reparto o in terapia intensiva.
CLASSIFICAZIONE: le riacutizzazioni, esse possono essere distinte in tre tipi:
– tipo I: riacutizzazioni caratterizzate da aumento della dispnea, aumento dell’espettorato e aumento della (o viraggio verso la) purulenza dell’espettorato;
– tipo II: riacutizzazioni caratterizzate da due dei sintomi suddetti;
– tipo III: riacutizzazioni caratterizzate da uno dei tre sintomi detti e, in aggiunta ulteriori disturbi del tipo tosse, sibili, bruciore di gola, rinite, aumento almeno del 20% della frequenza respiratoria o cardiaca basale.
EZIOLOGIA – Le riacutizzazioni sono spesso causate da infezioni batteriche e virali che sono presenti in circa il 50% dei casi; edema polmonare cardiogeno o non cardiogeno, polmonite, emorragia polmonare. Haemophilus influenzae e Streptococcus pneumoniae sono i più frequenti, ma anche Moraxella catarrhalis e Pseudomonas sono stati frequentemente isolati. anche Mycoplasma pneumonia e Chlamydia spp, batteri intracellulari che condividono alcune caratteristiche con i virus, sono responsabili di riacutizzazioni. In questi casi la risposta immunitaria dell’organismo assume importanza fondamentale e la giovane età di soggetti con infezione da Mycoplasma rende ragione della facile risoluzione delle riacutizzazioni. La frequenza con cui la Chlamydia è stata identificata in episodi di riacutizzazione varia dal 5 al 34%.
Il potenziale meccanismo d’azione con il quale i batteri sono causa della sintomatologia in corso di riacutizzazione riguardano l’ipersecrezione di muco, la riduzione del battito ciliare, il danno sull’epitelio bronchiale e la liberazione di citochine proinfiammatorie quali IL-6, IL-8 e TNF-α.
I virus danneggiano l’epitelio delle vie aeree, determinando perdita delle cellule ciliate, ipersecrezione di muco e trasudazione plasmatica nel lume delle vie aeree. Inoltre, le infezioni virali aumentano la reattività bronchiale, facilitando la tendenza al broncospasmo. Questo meccanismo può essere legato ad una aumentata produzione di endotelina 1 o ad un effetto diretto sui recettori muscarinici. Indagini più recenti condotte con PCR hanno indicato nei Rhinovirus gli agenti più frequentemente in causa in corso di riacutizzazione.
Altri fattori come inquinamento atmosferico da CO2, biossido d’azoto (NO2), biossido di zolfo (SO2), ozono (O3) e lo stesso abbassamento notevole della temperatura possono causare riacutizzazioni. Comunque, in circa un terzo delle riacutizzazioni di BCO non è possibile identificare una causa.
FISIOPATOLOGIA – in corso di broncopneumopatia cronica ostruttiva clinicamente stabile, si riconosce sempre un certo grado di infiammazione bronchiale o alveolare, con ipersecrezione di muco, riduzione del calibro delle vie aeree e distruzione alveolare. I mediatori chimici responsabili della flogosi, dell’ipersecrezione e del danno provengono dal maggior numero e/o dalla maggiore attivazione di cellule come i neutrofili e gli eosinofili. L’infiltrazione da parte di cellule infiammatorie della parete bronchiale è stata documentata sia in caso di broncopneumopatia cronica ostruttiva stabile, quando cellule CD8+ e neutrofili rivestono un ruolo predominante sia in corso di riacutizzazione, quando cellule CD4+ ed eosinofili prevalgono. L’edema della sottomucosa bronchiale, per quanto transitorio e potenzialmente utile per l’apporto di proteine ed enzimi nel muco bronchiale, riduce il lume bronchiale e contribuisce ad alterare la viscosità e la quantità di secrezioni ristagnanti nelle vie aeree.
Il TNF-α, aumentando l’espressione di regulated upon activation normal T cell expressed and secreted (RANTES), favorirebbe il richiamo di eosinofili. La presenza di eosinofili in elevato numero è responsabile del rilascio di mediatori quali major basic protein (MBP), ECP, matrix metalloproteinase (MMP), platelet activating factor (PAF) e rende ragione dell’efficacia dei corticosteroidi nel trattamento delle riacutizzazioni in alcuni pazienti con broncopneumopatia cronica ostruttiva.
DIAGNOSI:
- Sintomatologia
-
- Dispnea: può essere dovuta tanto a broncospasmo, variabile per entità e durata, quanto ad aumento di spessore della parete bronchiale per infiltrazione di cellule infiammatorie, edema e ristagno di muco nelle vie aeree.
- Tachipnea con frequenza >25 atti al minuto
- Aumentata espettorazione: L’ipersecrezione mucosa è verosimilmente legata sia all’ipertrofia delle ghiandole tubulo-acinose della trachea e dei bronchi, sia all’iperplasia delle cellule caliciformi dell’epitelio. La flogosi cronica delle vie aeree modifica la struttura anatomica bronchiale e le caratteristiche fisico-chimiche del muco prodotto dalle cellule muco-secernenti. L’aumentata espettorazione è solo un indice dell’aumentata quantità di muco prodotto. La purulenza dell’espettorato è legata alla presenza nel muco sia di neutrofili che di eosinofili. La degranulazione neutrofila comporta rilascio di elastasi ed altre proteine che danneggiano le strutture alveolari, riducono la clearance muco-ciliare, stimolano la produzione di muco dalle cellule muco-secernenti, favoriscono la diapedesi cellulare e l’edema interstiziale. Nell’espettorato e nel liquido di lavaggio bronco-alveolare sono inoltre aumentati il fattore chemiotattico per i neutrofili, il leucotriene LTB4, l’interleuchina-8 (IL-8) il tumor necrosis factor-α (TNF-α) e il granulocyte-macrophage colony stimulating factor (GM-CSF)-
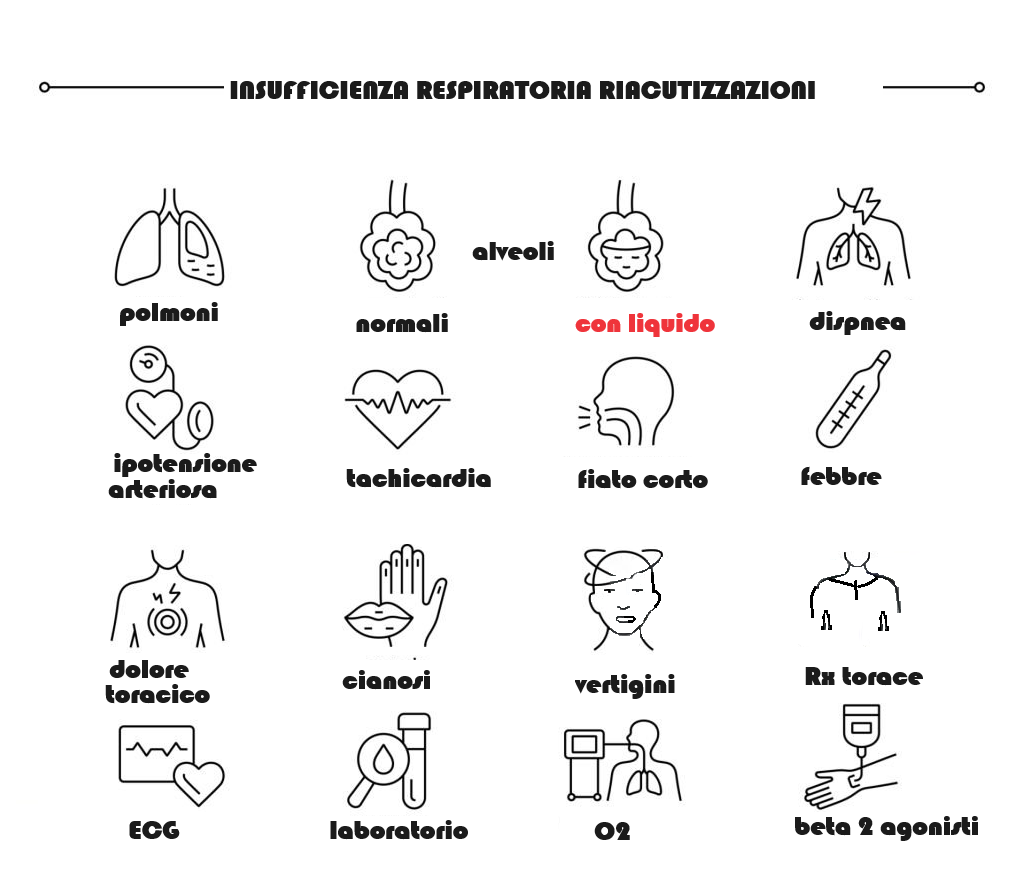
- Le riacutizzazioni più gravi si accompagnano a cefalea, cianosi, coinvolgimento dei muscoli respiratori accessori, comparsa o aumento degli edemi declivi, tachicardia superiore a 110 bpm, febbre elevata. Torpore, sonnolenza e letargia sono causati da ritenzione di diossido di carbonio
-
- Rx- torace: per valutare
-
-
- la presenza di segni di infezioni più estese (polmonite),
- iperinflazione polmonare rivelata da un diaframma appiattito (ossia, aumento dal valore normale di 45° a > 90°, dell’angolo formato da sterno e diaframma anteriore e osservato in proiezione laterale
- bolle (ossia, aree radiolucenti > 1 cm circondate da ombre sottili ed arcuate).
- ingrandimento dello spazio aereo retrosternale
- ombra cardiaca stretta
- riduzione dei vasi ilari
- trasparenza aumentata dovuta alla perdita del parenchima
- slargamento degli ili: indica arterie polmonari di grandi dimensioni che possono indicare la presenza di ipertensione polmonare
- ‘aumento del diametro trasverso dell’ombra cardiaca
-
- TAC TORACE: è utile per accertare l’estensione e la distribuzione dell’enfisema. L’allargamento del diametro dell’arteria polmonare superiore al diametro dell’aorta ascendente suggerisce l’ipertensione polmonare
-
- Emogasanalisi (EGA)
-
- PaO2 o pO2 <60 mm Hg (v.n. 80-100) pressione parziale di O2 ipossiemia – iperossiemia
- PaCO2 o pCO2 >70 mmHg (v.n. 35-45) ipocapnia – ipercapnia
- pH v.n. 7,38-7,42 acidosi – alcalosi
- O2ct <17 vol% (v.n. 17-21) contenuto totale di ossigeno
- Saturimetria: SAT O2 <93% (v.n. 93-97%) saturazione di ossigeno
- BE(B) v.n. 0 ± 2 mmol/L eccesso di basi (HCO3-): acidosi- alcalosi metabolica
- HCO3– v.n. 21-30 mEq/L concentrazione di ioni bicarbonato
- Hb v.n. 13-17 g/dl
-
ricordare che ogni volta che si sviluppa il prelievo arterioso all’emogasanalizzatore, deve essere indicato il valore della Fi02, che ci permetterà di valutare se i parametri ottenuti sono adeguati se rapportati al valore di Fi02 somministrata. La Fi02 (flusso inspiratorio di O2) indica la percentuale di 02 presente; in aria ambiente la Fi02 è al 21%. Ogni litro/min di O2 aggiunge il 3-4% di Fi02 alla concentrazione di O2, per cui: un flusso di 1Lt/min di O2 ad esempio garantisce una FiO2 al 24%, un flusso di 2 lt/min una FiO2 al 28%, etc. Le cannule nasali (chiamate comunemente occhialini) sono efficaci fino ad un’erogazione di 6 lt/min e rispettano la proporzione sopraindicata. La maschera di Venturi, invece, ha il vantaggio di poter impostare la Fi02 desiderata fino a 50%.
- alfa-1-antitripsina: diminuisce in caso di BCO
- Hb e HCT – Il valore diagnostico dell’emoglobina e dell’ematocrito nella valutazione della broncopneumopatia cronica ostruttiva è scarso ma può mostrare un’eritrocitosi (ematocrito >48%) se il paziente ha un’ipossia cronica.
- Eosinofili aumentati: predicono una buona risposta alla terapia con glucocorticoidi
- Il dosaggio degli elettroliti sierici ricopre scarsa importanza diagnostica, ma può mostrare un elevato livello di HCO3– se i pazienti presentano un’ipercapnia cronica.
- L’emogasanalisi venosa è utile per la diagnosi di ipercapnia acuta o cronica.
- ECG:
-
-
- tipicamente un basso voltaggio del QRS in tutte le derivazioni,
- I segni dell’ipertrofia ventricolare destra comprendono un’onda R o R′ di ampiezza pari o superiore all’onda S nella derivazione V1
-
-
TERAPIA FARMACOLOGICA
Innanzitutto, è necessario stabilire se la riacutizzazione di BCO può essere letale ed in questo caso è necessario ricoverare il paziente in terapia intensiva. Il rischio di letalità per riacutizzazione di BCO è associato al grado di acidosi respiratoria, presenza di patologie concomitanti e necessità di ventilazione assistita. In assenza di queste caratteristiche, il rischio di letalità è basso, anche se i pazienti con BCO di base grave richiedono comunque il ricovero ospedaliero. In questi casi infatti l’efficacia della terapia domiciliare è modesta.
La terapia ospedaliera delle riacutizzazioni di BCO si basa essenzialmente su:
- ossigenoterapia controllata – La tossicità da eccessiva somministrazione di ossigeno in pronto soccorso è ancora un problema rilevante. Nei casi di riacutizzazione di broncopneumopatia cronica ostruttiva grave (stadio III), è necessaria la ventilazione meccanica che può essere invasiva (convenzionale) o non invasiva con l’obiettivo di ridurre mortalità e morbosità e di migliorare la sintomatologia. La ventilazione non invasiva a pressione positiva costituisce un’alternativa efficace alla ventilazione meccanica convenzionale nelle unità di terapia intensiva ed è anche applicabile nei reparti con personale infermieristico specializzato.
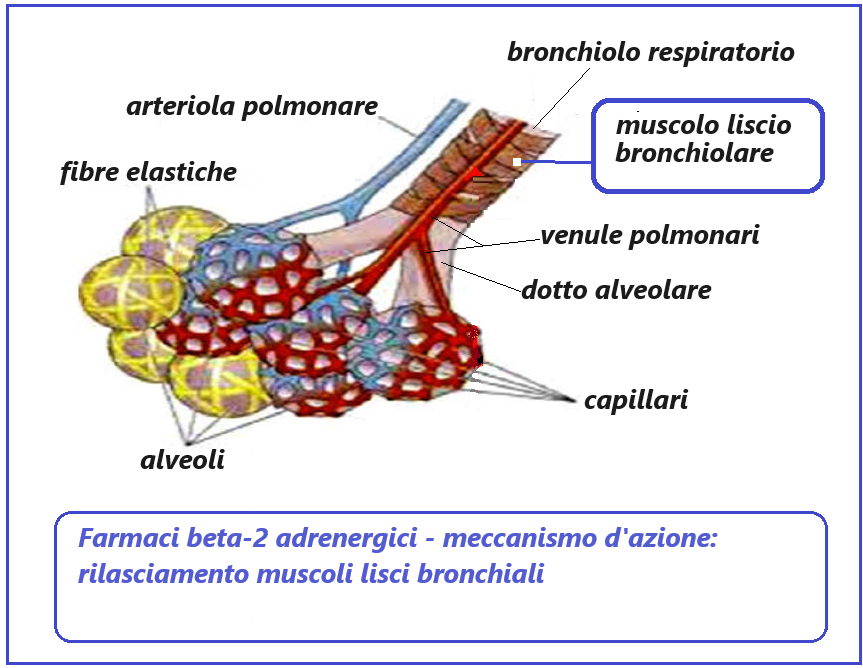
- broncodilatatori – i β2-agonisti – in corso di riacutizzazione della BCO i broncodilatatori dovrebbero essere sempre usati, eventualmente associati agli anticolinergici, o il loro dosaggio aumentato. I ß2-agonisti sono i principali broncodilatatori nella terapia della riacutizzazione di BCO. Si suddividono in:
-
- farmaci β2-agonisti selettivi a breve durata di azione (salbutamolo (Ventolin® fl ev im, gocce per aerosol), metaproterenolo, terbutalina, bambuterolo, pirbuterolo, isoetarina, bitolterolo, fenoterolo) e
- farmaci β2-agonisti selettivi a lunga durata di azione (salmeterolo (Aliflus polvere per aerosol), formoterolo),
-
- Anticolinergici – L’associazione con gli anticolinergici (ipratropio o oxitropio bromuro) consentono di dimezzare le dosi dei β2-agonisti ed è consigliata in pazienti con aritmie cardiache
- antibiotici – Gli antibiotici sono efficaci solo quando la riacutizzazione è associata ad espettorato purulento e l’aumento del volume dell’espettorato e/o la febbre indicano un’infezione batterica. La terapia antibiotica deve essere efficace su Streptococcus pneumoniae, Haemophilus influenzae e Moraxella catarrhalis, i microrganismi batterici più frequentemente implicati nelle riacutizzazioni di broncopneumopatia cronica ostruttiva. Comunque, per la scelta, dell’antibiotico è necessario basarsi sull’antibiogramma.
- Rivalutare dopo poche ore la risoluzione o miglioramento della sintomatologia
- Glucocorticoidi in caso di nessun miglioramento o risoluzione. I glucocorticoidi per os o per via endovenosa sono indicati in associazione ai broncodilatatori (e, se necessario, ad antibiotici e terapia con ossigeno) nella terapia ospedaliera delle riacutizzazioni della broncopneumopatia cronica ostruttiva. La dose ottimale di glucocorticoidi non è nota, ma alte dosi aumentano il rischio di importanti effetti collaterali. Generalmente, si somministra prednisolone (Urbason® cpr 4, 8 mg, fiale 20 mg) per os alla dose di 30-40 mg per 10-14 giorni. La terapia prolungata non aumenta l’efficacia, mentre aumenta il rischio di effetti collaterali.
- teofillina: controverso è il ruolo della teofillina nelle riacutizzazioni di BCO. Nella maggior parte dei casi la teofillina provoca un miglioramento modesto della funzionalità respiratoria, mentre alcuni studi hanno evidenziato un peggioramento degli scambi gassosi e dell’ipossia.
References:
- Rodriguez-Roisin R. Toward a consensus definition for COPD exacerbations. Chest 2000;117(5 Suppl 2):398S-401S.
- Anthonisen R, Manfreda J, Warren CPW, Hershfield ES, Harding GKM, Nelson NA. Antibiotic therapy of acute exacerbations of chronic obstructive pulmonary disease. Ann Intern Med 1987;106:196-204.
- Fernandez A, Lazaro A, Garcia A, Aragon C, Cerda E. Bronchodilators in patients with chronic obstructive pulmonary disease on mechanical ventilation. Utilization of metered-dose inhalers. Am Rev Respir Dis 1990;141:164-8.
- Davies L, Angus RM, Calverly PM. Oral corticosteroids in patients admitted to hospital with exacerbations of chronic obstructive pulmonary disease: a prospective randomised controlled trial. Lancet 1999;354:456-60.
- Saetta M, Di Stefano A, Turato G, Facchini FM, Corbino L, Mapp CE, Maestrelli P, Ciaccia A, Fabbri LM. CD8+ T Iymphocytes in the peripheral airways of smokers with chronic obstructive pulmonary disease. Am J Respir Crit Care Med 1998;157:822-6.
- Zhu J, Qiu YS, Majumdar S, Gamble E, Matin D, Turato G, Fabbri LM, Barnes N, Saetta M, Jeffery PK. Exacerbations of bronchitis: bronchial eosinophilia and gene expression for inferleukin-4, interleukin-5, and eosinophil chemoattractants. Am J Respir Crit Care Med 200l;164:109-16.
- Poole PJ, Black PN. Oral mucolytic drugs for exacerbations of chronic obstructive pulmonary disease: systematic review. BMJ 2001;322:1271-4. 8.
- Stockley RA, Bayley D, Hill SL, Hill AT, Crooks S, Campbell EJ. Assessment of airway neutrophils by sputum colour: correlation with airways infiammation. Thorax 2001;56:366-72.
- Crooks SW, Bayley DI, Hill SL, Stockley RA. Bronchial inflammation in acute bacterial exacerbations of chronic bronchitis: the role of leukotriene B4. Eur Respir J 2000;15:274-80.
- Gompertz S, O’Brien C, Bayley D, Hill SL, Stockley RA. Changes in bronchial inflammation during acute exacerbations of chronic bronchitis. Eur Respir J 2001;17:1112-9.
- Aaron S, Angel JB, Lunau M, Wright K, Fex C, Le Saux N, Dales RE. Granulocyte infiammatory markers and airway infection during acute exacerbation of chronic obstructive pulmonary disease. Am J Respir Crit Care Med 2001;163:349-55.
- Saetta M, Di Stefano A, Maestrelli P, Turato G, Ruggieri MP, Roggeri A, Calcagni P, Mapp CE, Ciaccia A, Fabbri LM. Airway eosinophilia in chronic bronchitis during exacerbations. Am J Respir Crit Care Med 1994;150:1646-52.
- Saetta M, Di Stefano A, Maestrelli P, Turato G, Mapp CE, Pieno M, Zanguochi G, Del Prete G, Fabbri LM. Airway eosinophilia and expression of interleukin-5 protein in asthma and in exacerbations of chronic bronchitis. Clin Exp Allergy 1996;26:766-74.
- Chanez P, Vignola AM, O’Shaugnessy T, Enander I, Li D, Jeffery PK, Bousquet J. Corticosteroid reversibilty in COPD is related to features of asthma. Am J Respir Crit Care Med 1997;155:1529-34.
- Sachs AP, Koeter GH, Groenier KH, van der Waaij D, Schiphuis J, Meyboom-de Jong B. Changes in symptoms, peak expiratory flow, and sputum flora during treatment with antibiotics of exacerbations in patients with chronic obstructive pulmonary disease in general practice. Thorax 1995;50:758-63.
- Saint S, Bent S, Vittinghoff E, Grady D. Antibiotics in chronic obstructive pulmonary disease exacerbations. A meta-analysis. JAMA 1995;273:957-60.
- Mogulkoc N, Karakurt S, Isalska B, Bayindir U, Celikel T, Korten V, Colpan N. Acute purulent exacerbarion of chronic obstructive pulmonary disease and Chlamydia pneumoniae infection. Am J Respir Crit Care Med 1999;160:349-53.
- Karnak D, Beng Sun S, Beder S, Kayacan O. Chlamydia pneumoniae infection and acute exacerbation of chronic obstructive pulmonary disease (COPD). Respir Med 2001;95:811-6.
- Nordenhall C, Pourazar J, Blomberg A, Levin JO, Sandstrom T, Adelroth E. Airway infiammation following exposure to diesel exhaust: a study of time kinetics using induced sputum. Eur Respir J 2000;15:1046-51.
- Devalia JL, Rusznak C, Herdman NU, Trigg CJ, Tarraf H, Davies RJ. Effect of nitrogen dioxide and sulphur dioxide on airway response of mild asthmatic patients to allergen inhalation. Lancet 1994;344:1668-71.