Ultimo aggiornamento 2023-08-22 1:13:34 PM
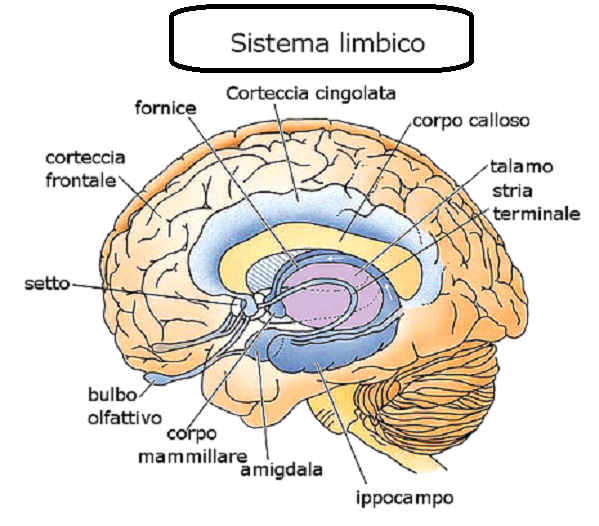
Il sistema limbico è un insieme complesso di strutture cerebrali poste su entrambi i lati del talamo, sotto l’encefalo. Comprende l’ipotalamo, l’ippocampo e l’amigdala intimamente collegati con alcune formazioni adiacenti come il cingolo, talamo, fornice, corpi mammillari e locus coeruleus. Inoltre Il sistema limbico è strettamente connesso alla corteccia prefrontale.
il sistema limbico è innervato dalla via dopaminergica meso-limbica che ne modula il grado d’attivazione. Gli oppioidi endogeni trovano un’abbondanza di recettori in queste strutture cerebrali.
Azione del sistema limbico: influenza il sistema endocrino e il sistema nervoso autonomo.
Ipotalamo: regola il sistema nervoso autonomo attraverso produzione e rilascio ormonale; regola la pressione sanguigna, la frequenza cardiaca, la fame, la sete, l’eccitazione sessuale e il ritmo sonno/veglia del ritmo circadiano.
Ippocampo: implicato nella formazione delle tracce di memoria a lungo termine 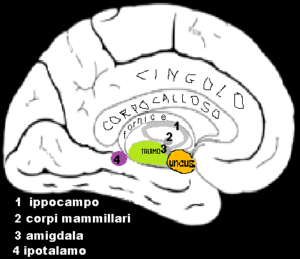 nell’orientamento spaziale tramite mappe cognitive.
nell’orientamento spaziale tramite mappe cognitive.
Amigdala: è una struttura a forma di mandorla che si trova nel lobo temporale, sotto l’uncus, all’estremità anteriore dell’ippocampo e alla punta anteriore del corno inferiore del ventricolo laterale. E’ implicata nella segnalazione alla corteccia di stimoli motivazionali associati a reazioni di paura e ricompensa e nelle reazioni emotive e nell’attrazione sessuale
Cingolo: il giro del cingolo è la parte del cervello che si trova più vicino al sistema limbico, appena sopra il corpo calloso. Fornisce un percorso dal talamo all’ippocampo, sembra essere responsabile per focalizzare l’attenzione su eventi emotivamente significativi e per associare i ricordi agli odori e al dolore. Interviene inoltre sulla frequenza cardiaca e la pressione arteriosa.
Talamo: la stazione di recezione e ritrasmissione della corteccia cerebrale.
Fornice: trasporta i segnali dall’ippocampo ai corpi mammillari, implicato nella memoria a lungo termine.
Corpi mammillari: importanti per la formazione della memoria a lungo termine.
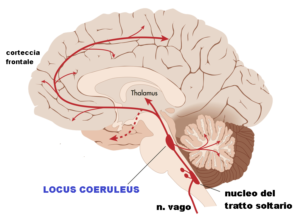 Locus coeruleus (o punto blu): è un nucleo, formato da neuroni di medie dimensioni, situato nel tronco encefalico. È anche chiamato “punto blu” per la sua colorazione tendente all’azzurro, dovuta ai granuli di melanina al suo interno che conferiscono un colore blu. Locus coeruleus è il sito principale per la sintesi della noradrenalina (o norepinefrina “NE”) nel cervello, ed è coinvolto nelle risposte a stress e panico. Ha proiezioni al sistema limbico, pur facendo parte dei nuclei laterali della formazione reticolare. Questa zona del cervello è anche strettamente collegata al sonno REM.
Locus coeruleus (o punto blu): è un nucleo, formato da neuroni di medie dimensioni, situato nel tronco encefalico. È anche chiamato “punto blu” per la sua colorazione tendente all’azzurro, dovuta ai granuli di melanina al suo interno che conferiscono un colore blu. Locus coeruleus è il sito principale per la sintesi della noradrenalina (o norepinefrina “NE”) nel cervello, ed è coinvolto nelle risposte a stress e panico. Ha proiezioni al sistema limbico, pur facendo parte dei nuclei laterali della formazione reticolare. Questa zona del cervello è anche strettamente collegata al sonno REM.
Uncus: costituisce l’estremità anteriore del giro paraippocampale. È separato dall’apice del lobo temporale da una leggera fessura chiamata incisura temporale. Sebbene superficialmente continuo con il giro dell’ippocampo, l’uncus forma morfologicamente una parte del rinencefalo.
La neuroipofisi è costituita da proiezione di assoni neuronali che si estendono dal nucleo sopraottico fino al nucleo paraventricolarie e sovraottico dell’ipotalamo. Gli assoni rilasciano per esocitosi vasopressina (ADH) e ossitocina nel parenchima neuroipofisario in prossimità dei sinusoidi dove ADH e OT penetrano per essere trasportati agli organi bersaglio. Oltre agli assoni ipotalamici la neuroipofisi è costituita da cellule gliali, i pituiciti, cellule gliali assomiglianti ad astrociti. La neuroipofisi non è considerata una ghiandola, al contrario dell’adenoipofisi, bensì una sorta di proiezione assonale dell’ipotalamo.
References: