ECOGRAFIA DEL III° TRIMESTRE
L’ecografia nel terzo trimestre di gravidanza è mirata a valutare la crescita fetale, la funzionalità placentare, le variazioni di liquido amniotico ma particolarmente lo stato di benessere fetale,Le valutazioni morfologiche essendo già state valutate nell’ecografia morfo-strutturale del II° trimestre, necessitano solo di alcune conferme (1-3).
L’obiettivo principale dell’ecografia del III° trimestre è quello di diagnosticare precocemente l’ipossia fetale, limitare la prematurità iatrogena e i parti operativi non giustificati.
L’ecografia base del III° trimestre si avvale di una sonda addominale per una scansione di tipo transaddominale bassa; la scansione transvaginale si rende necessaria in alcuni casi particolari come inserzione bassa di placenta, necessità di valutare la lunghezza del canale cervicale o “funnelling” incidenti funicolari, gestione della gravidanza protratta.
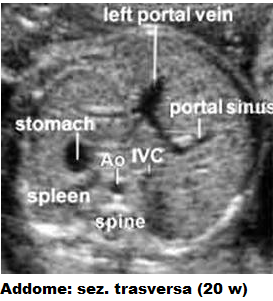 misurata in una sezione trasversale che includa il fegato, la vena porta, lo stomaco e la sezione trasversa vertebrale.
misurata in una sezione trasversale che includa il fegato, la vena porta, lo stomaco e la sezione trasversa vertebrale.
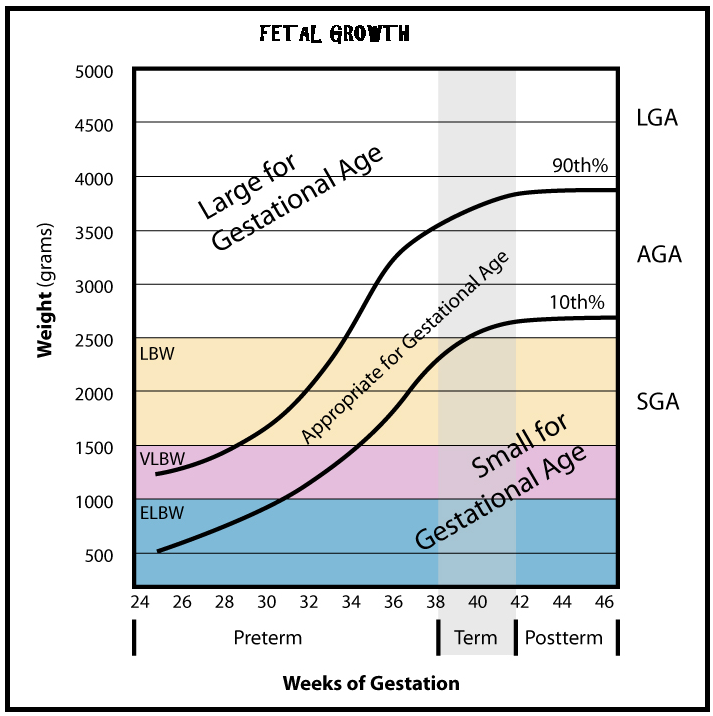
L’insufficienza placentare – è una condizione ad etiologia multifattoriale che può essere responsabile di complicazioni materne (ipertensione, proteinuria, edemi etc.) e fetali (restrizione della crescita intrauterina associata o meno a distress fetale).
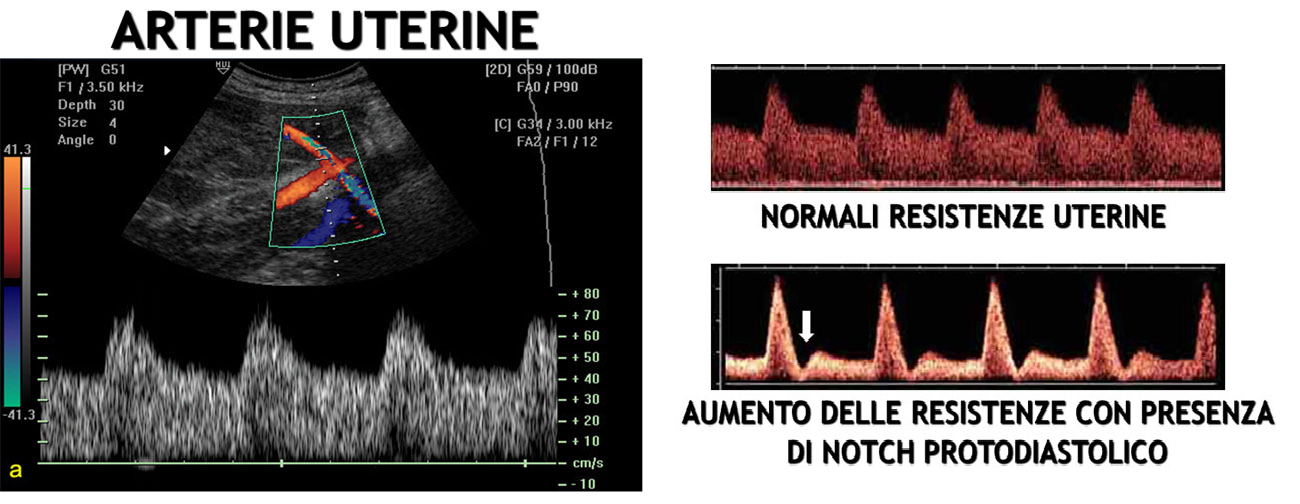
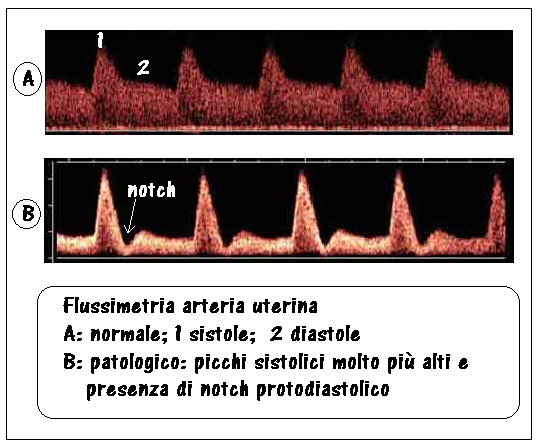
Flussimetria a. uterina – La valutazione del flusso delle aa. uterine è una parte importante della valutazione del benessere del feto e della sua crescita normale. La presenza di anormali resistenze vascolari (IR elevato o presenza di incisura protodiastolica) a livello delle arterie uterine alla fine del 1° trimestre permette di predire un elevato rischio di sviluppare nel 3° trimestre gravi patologie materne come l’ipertensione gestazionale, la pre-eclampsia e un ritardato accrescimento fetale (IUGR). Dopo la 26a settimana di gestazione lo studio delle arterie uterine ha scarso valore predittivo.
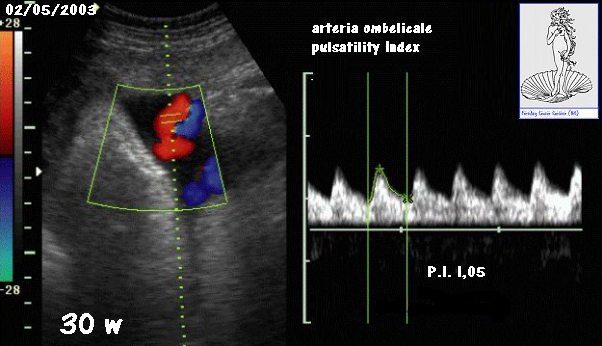
Flussimetria a. ombelicale: se è necessario studiare la funzionalità placentare l’esame interesserà l’inserzione placentare del cordone; se desideriamo eseguire un controllo della fisiopatologia circolatoria fetale (ipossia fetale e centralizzazione del circolo) preleveremo il segnale presso l’inserzione addominale fetale.
I dati derivanti da distretti iuxta-placentari risultano più stabili e riproducibili giacché la placenta va incontro a modificazioni lente, basate prevalentemente su fattori strutturali più che umorali e nervosi. Al contrario il segnale derivante da un distretto iuxta-fetale è estremamente variabile in conseguenza dei fattori umorali ed endocrini del feto stesso e delle sue condizioni emodinamiche del momento. E’ ovvio che i
valori tratti a livello fetale non possono essere utilizzati per costruire una curva e non devono essere presi nel loro valore assoluto, ma essere valutati soltanto nell’ambito di un mapping fetale allargato. Inoltre occorre considerare che a partire dalla 28-30ª settimana i valori P.I. del versante fetale divengono sensibilmente più alti rispetto al versante iuxta-placentare (20-22).
Anche per questo distretto arterioso come per ogni altro distretto flussimetrico si deve porre molta attenzione nell’eseguire la rilevazione con un angolo di insonazione favorevole e quindi preferibilmente al di sotto dei 60º. In particolare bisogna evitare di registrare il segnale durante l’attività respiratoria fetale e materna giacché in tali condizioni il profilo del’onda diventa irregolare (23-29).
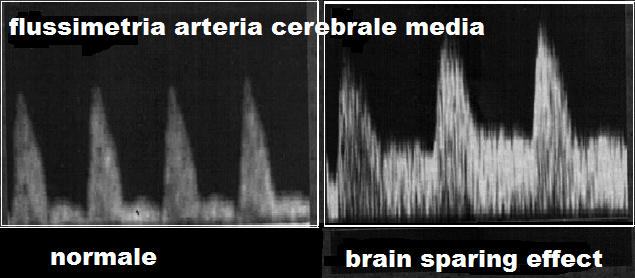
In condizioni di benessere fetale, la flussimetria dell’arteria ombelicale presenta basse resistenze (grande quantità di flusso) mentre il circolo della cerebrale media presenta alte resistenze (piccola quantità di flusso). In condizioni di ipossia invece si osserva aumento dell’indice di resistenza dell’a. ombelicale mentre l’a. cerebrale media presenta una diminuzione delle resistenze al circolo che è indice di un aumento del flusso diastolico cerebrale compensatorio, il cosiddetto Brain Sparing Effect (BSE) (18,19). La presenza di BSE impone un monitoraggio attento e continuo del benessere materno-fetale ma la capacità di compensazione permette di poter attendere la piena maturità polmonare fetale prima di espletare il parto. La perdita del BSE invece impone l’espletamento del parto anche in condizioni critiche fetali data l’incapacità del feto ad innescare o mantenere il meccanismo di compensazione. Lasciare proseguire la gravidanza in queste condizioni equivale ad esporre il feto a fondato rischio di gravissime lesioni cerebrali e a morte fetale (30-40).
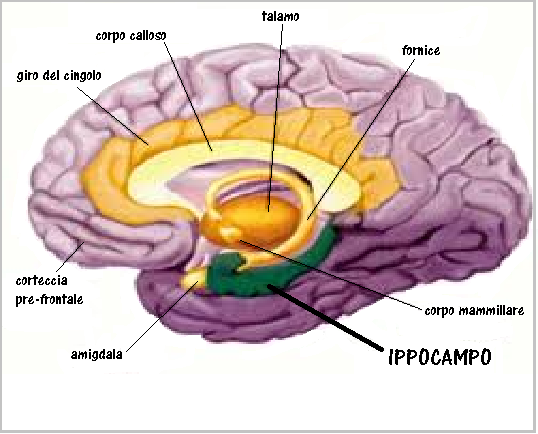
Un elevato PI ombelicale a 28-38 settimane di gravidanza è stato correlato a patologie cardiache neonatali (41) e ad uno scarso sviluppo dell’ippocampo e disturbi dell’attività cognitiva e della memoria in bambini nell’età scolare soprattutto nei feti IUGR, ma anche nei feti AGA (42-50).
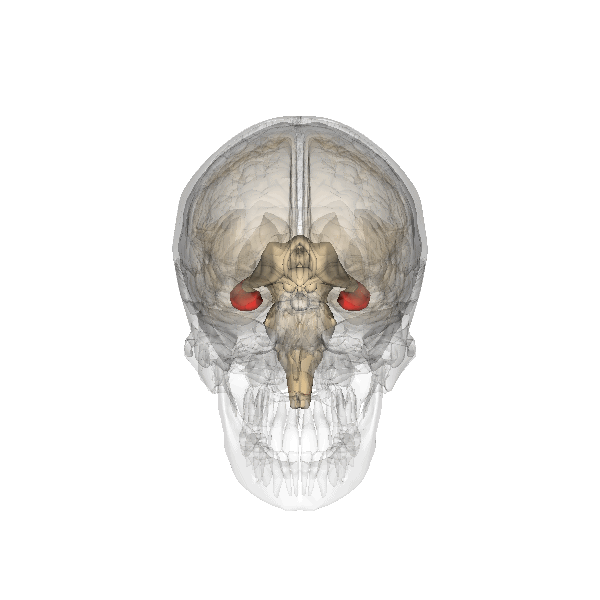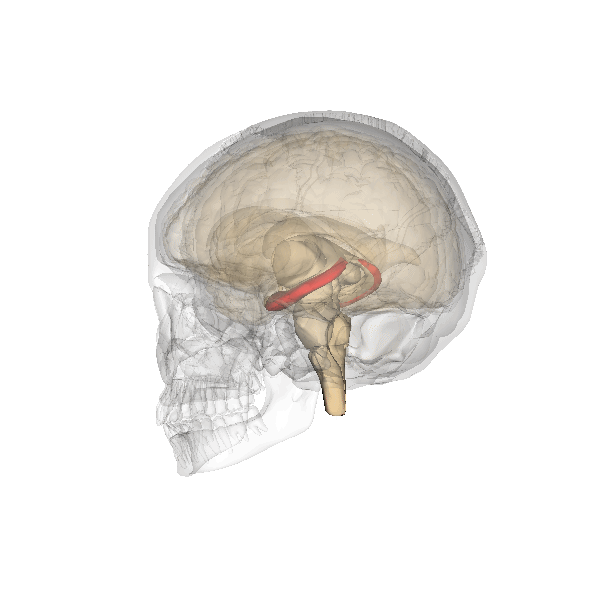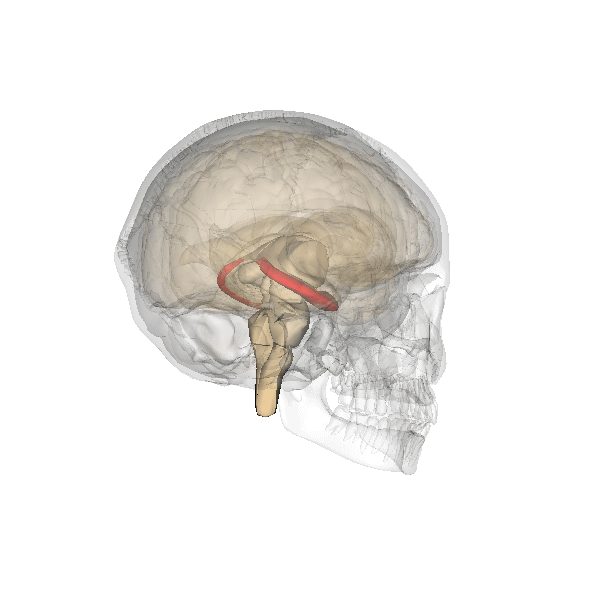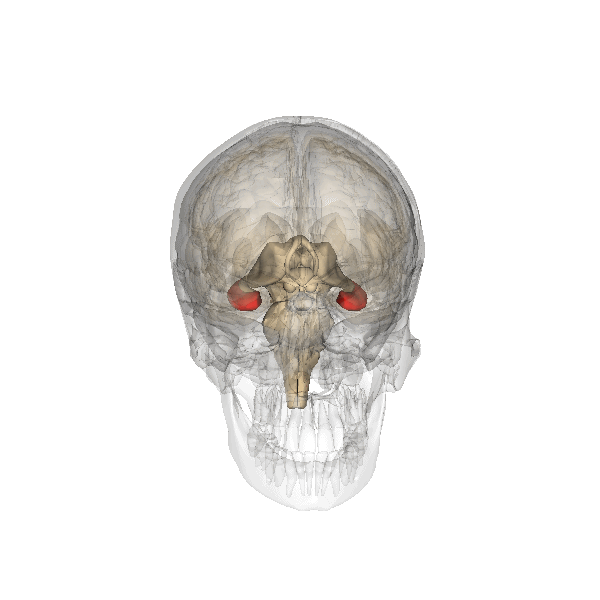
IPPOCAMPO
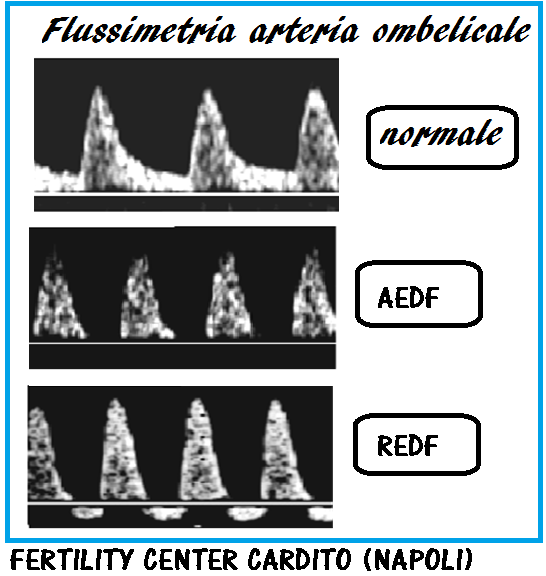
AED, REDF/BSE dell’a. ombelicale/Decelerazioni tardive – L’osservazione di flusso tele-diastolico assente (Absent end Diastolic Flow, AED) o invertito (Reversed end Diastolic Flow, REDF) nell’arteria ombelicale costituisce un fattore di rischio elevato per mortalità prenatale perchè tali alterazioni compaiono in una fase tardiva, già datata, di sofferenza fetale e dopo centralizzazione del circolo (BSE). Il tempo che intercorre tra la la comparsa di decelerazioni tardive all’esame cardiotocografico e l’osservazione di flusso diastolico assente o invertito è variabile da uno a sei giorni (37,38). La somministrazione materna di betametasone induce un ritorno del flusso telediastolico dopo 24 ore dalla somministrazione del farmaco e la positività persiste per 48 ore. Tale efficacia però non si osserva nelle gravidanze gemellari e multiple (51-55).
Classificazione della gravità: nell’ipossia fetale la forma d’onda della velocità del sangue dell’arteria ombelicale cambia in modo progressivo come segue:
- Aumento PI e RI; Riduzione S/D
- Riduzione del flusso diastolico finale
- Flusso diastolico finale assente (AEDF)
- Inversione del flusso diastolico finale (REDF) (37,38)
Il riconoscimento del rischio di insufficienza placentare non evita lo sviluppo della patologia, ma consente di individuare quelle gestanti che necessitano di un monitoraggio più attento del benessere materno e fetale.

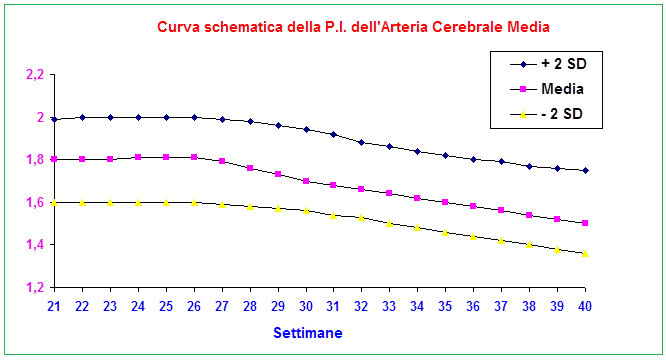
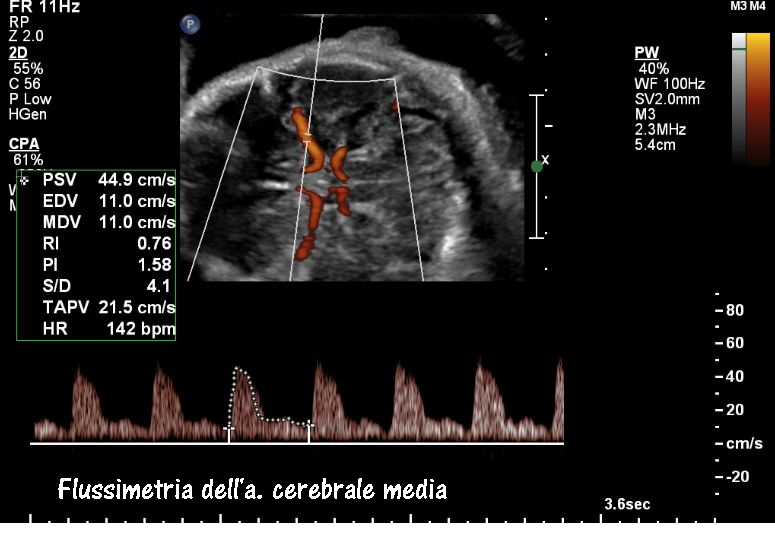
Flussimetria a. cerebrale media: lo studio della flussimetria dell’a. cerebrale media (MCA) ha acquisito enorme importanza nella valutazione del benessere fetale soprattutto in presenza di anomalie degli indici velocimetrici dell’a. ombelicale (UA). In tal caso è tassativa l’indagine flussimetrica sulla MCA ed il rapporto con la flussimetria dell’a. ombelicale. Anomalie dell’indice di pulsatilità (PI) e S/D ratio della MCA, e del rapporto MCA/UA sono significativamente correlate, rispetto ai feti con flussimetria normale, a maggior rischio di gestosi, maggiori percentuali di taglio cesareo per distress fetale (76.7% versus 62.5%,P<0.0001), basso indice di Apgar a 5 minuti dalla nascita (61.9% versus 22.4%, P<0.0001), maggior numero di IUGR (7.18% versus 1.76%,P<0.0001) (56-59).
Tecnica di scansione: Tutte le misurazioni sono state effettuate con la gravida in posizione semiseduta con la testa e il petto leggermente elevate. Per la misura dell’MCA, è stata ottenuta una scansione assiale della testa fetale a livello di peduncoli cerebrali, quindi il colore Doppler è stato utilizzato per visualizzare il poligono di Willis e il caliper è stato posizionato entro 1 cm dall’origine dell’MCA. L’angolo tra il fascio ultrasonografico e la direzione del flusso sanguigno (angolo di insonazione) da consigliare sempre deve essere <30 gradi.
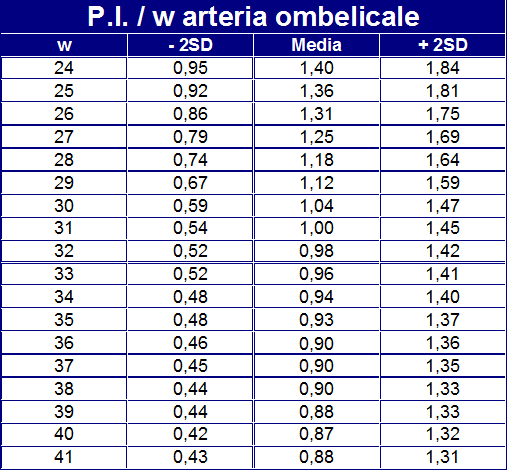
Il PI dell’a. ombelicale è considerato anormale quando è >2SD, Il PI della MCA è considerato anormale quando i valori sono <5th percentile. MCA/UA PI<1 è considerato anormale (60-62).
- in caso di ritardo di crescita il feto ridistribuisce il flusso di sangue verso quegli organi che necessitano maggiormente di ossigeno e nutrienti per svilupparsi correttamente, come il cuore il rene e soprattutto il sistema nervoso centrale. Tale processo è chiamato centralizzazione del circolo con riduzione del flusso a livello intestinale, polmonare, periferico; conservazione dellirrorazione renale e vasodilatazione dell’a. cerebrale media (brain sparing effect).
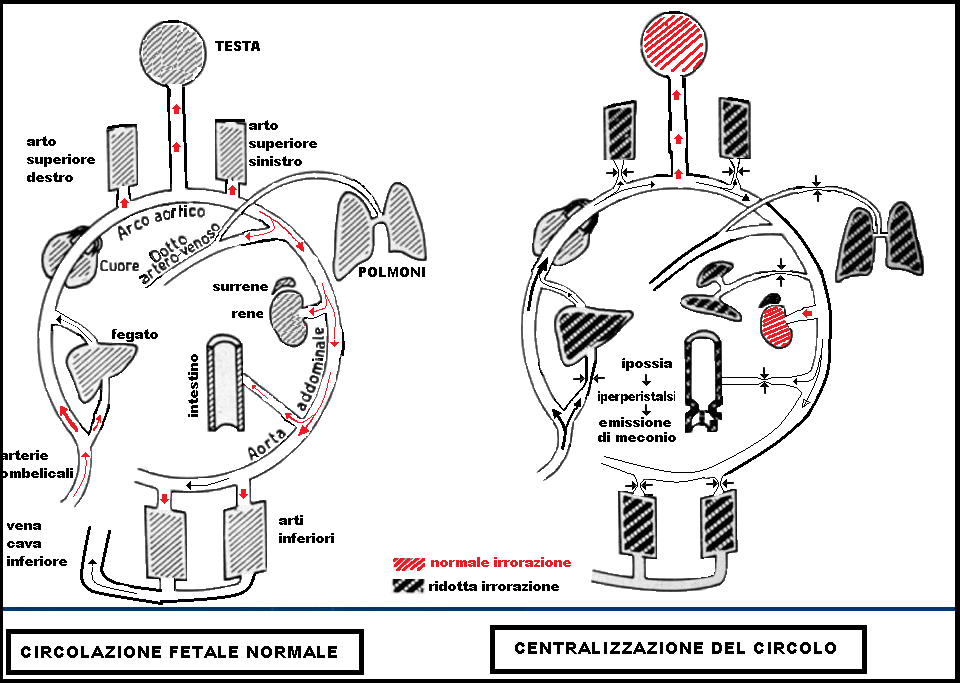
- Per questo motivo si assiste ad una dilatazione dell’arteria cerebrale media con aumento del flusso diastolico al fine di aumentare l’apporto di ossigeno e nutrienti. Da un punto di vista clinico la modificazione dell’arteria cerebrale media dimostra che il feto sta cercando di compensare il ridotto apporto di ossigeno. Tuttavia, questo dato è un segno molto tardivo della compromissione del benessere fetale ed è significativamente associato al rischio di sviluppare gravi complicazioni del SNC fetale o morte fetale (63-74).

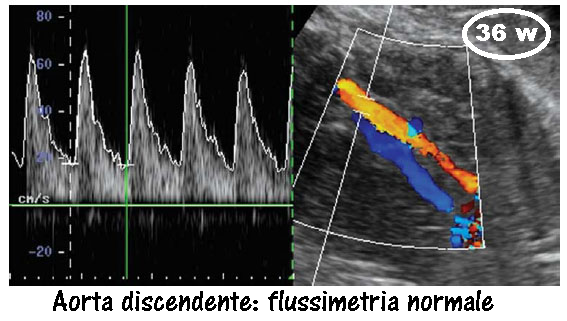
AORTA ADDOMINALE: l’aorta discendente fetale è un vaso di grande calibro, facilmente visualizzabile da ultrasuoni Doppler fin dalle prime fasi della vita fetale. Il suo indice di resistenza (RI) e l’indice di pulsatilità (PI) forniscono una buon indice per valutare l’emodinamica del sistema circolatorio fetale e il benessere fetale.
- La zona da esaminare consigliata è la porzione di aorta che va dal diaframma al carrefour delle aa. iliache.
- L’angolo di scansione deve essere inferiore ai 60º preferibilmente compreso tra i 60 ed i 45º.
- L’osservazione va compiuta durante fasi di quiete fetale e comunque in assenza di movimenti respiratori che, come noto, alterano profondamente la forma dell’onda sia a causa dell’effetto depressivo a livello toracico che per l’aritmia respiratoria che a volta si associa.
- Le donne fumatrici devono astenersi dal fumo almeno 2 ore prima dell’esame
- La visualizzazione dell’arco aortico talvolta è difficile, conseguentemente alla frequente posizione fetale dorsoanteriore e all’attenuazione ad ultrasuoni causata dalla colonna vertebrale. Per superare questa difficoltà, si cerca di stimolare il feto a cambiare posizione e si invita la madre ad assumere un decubito un decubito laterale.
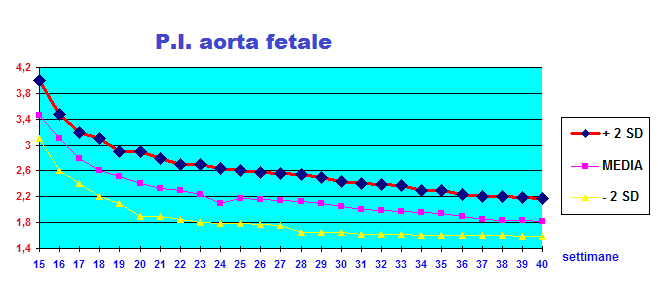
Curva e Range di normalità: Il flusso nell’aorta comincia molto precocemente e si può esplorare ecograficamente già alla 9ª-10ª settimana. In questa epoca solitamente l’onda diastolica è assente ed inizia a visualizzarsi a partire dall’inizio del IIº trimestre per poi rimanere costante per il resto della gestazione. L’indice di pulsatilità scende rapidamente durante le prime 20 settimane di gravidanze per attestarsi stabilmente sui valori di 1.8-2.0 dopo tale epoca ().
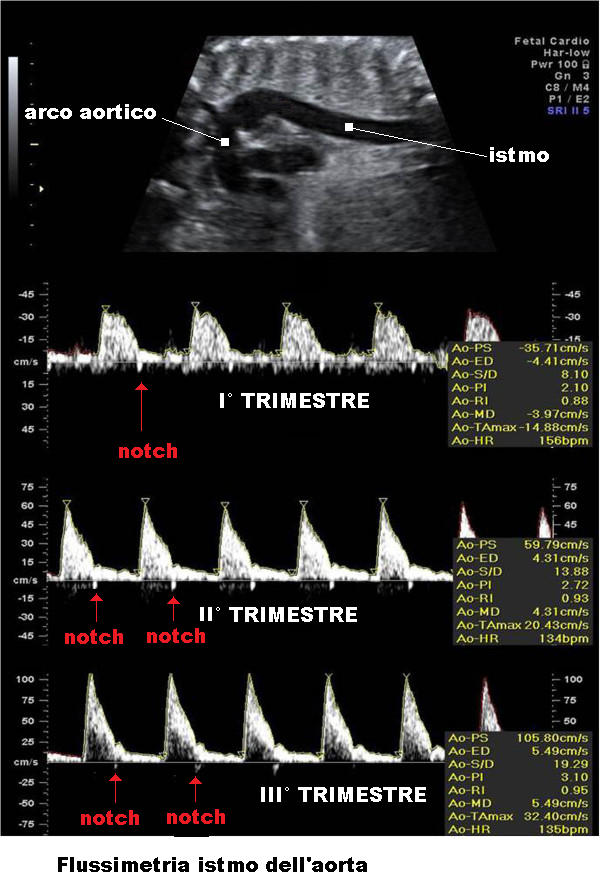
Il profilo dell’onda aortica all’esame Doppler è caratterizzato da un picco sistolico, un notch post-sistolico e un flusso diastolico terminale. La fase di accelerazione (picco sistolico) riflette la contrattilità cardiaca mentre la fase diastolica è in relazione alla resistenza vascolare periferica. Il notch post-sistolico è dato dalla chiusura della valvola aortica nella fase precoce della diastole ventricolare e corrisponde a un lieve decremento di velocità del flusso aortico.
Lo spettro flussimetrico Doppler dell’aorta è modulato da diverse variabili circolatorie come l’inotropismo cardiaco fetale, l’impedenza arteriosa del sistema vascolare periferico, l’ematocrito fetale (anemia fetale) e l’equilibrio acido-base. Durante un periodo di sofferenza ipossica il feto risponde direttamente attraverso il rilascio di epinefrina e norepinefrina indipendentemente dalla stimolazione simpatica. L’attivazione dei recettori alfa-adrenergici durante l’ipossia causa un aumento della pressione arteriosa e vasocostrizione splacnica. Anche la vasopressina plasmatica aumenta in risposta all’ipossia. Un progressivo cronico inasprisi di tali condizioni ridurrà prima il tratto diastolico prima con lieve appianamento (Flattening End Diastolic Flow, FEDF) quindi con riduzione sempre più evidente dell’onda diastolica fino a farla scomparire (Absent End Diastolic Flow, AEDF) mentre l’indice di pulsatilità aumenta. Perdurando lo stato di sofferenza, si può arrivare all’inversione del flusso telediastolico (Reversed End Diastolic Flow, REDF). I feti con RED nullo o invertito rappresentano una categoria ad altissimo rischio, con alta incidenza di IUGR asimmetrico, enterocolite necrotizzante, necrosi surrenalica e scompenso cardiocircolatorio. La prognosi clinica è sempre riservata sia quoad vitam che quoad valetitudinem. L’intervento ostetrico non deve essere differito se non in base ad una sicura motivazione di immaturità. (75-89).

Dotto venoso di Aranzio: Questa struttura, anche se poco studiata, rappresenta uno dei distretti vascolari di maggiore importanza sia per la fisiologica crescita fetale sia per il meccanismo di compenso nei casi di ipossia. Esso è localizzato alla curvatura della vena ombelicale prima che questa pieghi a destra dell’addome fetale per congiungersi con il ramo sinistro della vena porta. Il suo diametro varia con l’età gestazionale e allo stesso modo la possibilità che venga reperito in una scansione standard dell’addome fetale si riduce man mano che l’età gestazionale avanza. Oltre la 30ª settimana la struttura presenta delle notevoli variazioni di dimensioni nel corso del periodo di osservazione. In altri termini tende a rilasciarsi e a restringersi, contraendosi in seguito a stimoli di varia natura. Di certo sappiamo che esso è ben innervato, è sensibile alle variazioni di ossigeno.
La valutazione ecografica del flusso del dotto venoso può essere di ausilio in una serie di situazioni critiche fetali; le più comuni sono:
- Screening del I° trimestre per anomalie aneuploidiche
- Screening del II° trimestre per sospetto IUGR o SGA
- Patologie cardiache fetali
Di tutte le vene pre-cardiali, il ductus venosus permette l’interpretazione più accurata della funzione cardiaca fetale e dell’emodinamica del miocardio. Il dotto venoso rappresenta il primo e più importante meccanismo messo in atto dal feto in condizioni di deprivazione. Qualora incontrasse un periodo di riduzione ossigenativa durante il IIº trimestre di gravidanza il feto tenderebbe ad aprire stabilmente il dotto venoso e shuntare la circolazione epatica tendendo ridurre drasticamente il passaggio di sangue nel ramo sinistro della vena porta. Questo meccansimo è alla base del profilo disauxologico noto come IUGR asimmetrico (o sproporzionato o late flattening).
Enorme importanza di tale meccanismo è che esso avviene prima che si instauri la centralizzazione del circolo. Si può pertanto facilmente comprendere che nel periodo della riapertura del dotto ci troviamo ancora in una fase di assoluto compenso in cui abbiamo tempo per organizzare e predisporre tutto quanto riteniamo opportuno per l’ottimare svolgersi della gravidanza. (190-193). La maggiore limitazione risiede nella scarsa riproducibilità dei dati tra operatore ed operatore, apparecchiatura e momento; si è infatti già detto che il dotto venoso non è una struttura statica ma è caratterizzata da continue variazioni di calibro in diverse condizioni fisiologiche.
Tecnica
Il feto dovrebbe essere il più possibile in stato di quiete
La sonda è idealmente focalizzata in modo che il campionamento sia fatto in prossimità della confluenza della vena ombelicale nel dotto venoso
Si dovrebbe ottenere una scansione sagittale destra in cui si visualizzi la vena ombelicale, il ductus venosus e il cuore fetale
La sonda è idealmente angolata per consentire un piano medio sagittale o un piano trasversale obliquo attraverso l’addome fetale
L’immagine dovrebbe essere ingrandita il più possibile in modo da occupare l’intero schermo
Non contaminare il flusso del dotto con il flusso dalla vena cava inferiore fetale
L’angolo di insonazione dovrebbe essere di 30°
La velocità di spazzamento deve essere alta (2-3 cm / s) in modo che le forme d’onda siano diffuse permettendo una migliore valutazione dell’onda a
Su ultrasuoni Doppler il flusso nel dotto ha una forma d’onda trifasica caratteristica dove in una normale situazione fisiologica il flusso deve sempre essere nella direzione avanzata (cioè verso il cuore fetale).
Questa forma d’onda trifasica comprende:
Onda S: corrisponde alla contrazione sistolica ventricolare/rilasciamento atriale fetale ed è il picco più alto
Onda D: corrisponde alla diastole ventricolare fetale ed è il secondo picco più alto. Cresce progressivamente fino a termine di gravidanza e, in questo periodo, uguaglia e talvolta supera per durata l’onda S.
Onda A: corrisponde alla contrazione atriale fetale ed è il punto più basso dell’onda trifasica; è una breve e profonda incisura dovuta al brusco rallentamento della direzione anterograda del flusso (177-185).
La velocità media e la velocità di picco tendono a salire nel corso della gravidanza in relazione inversa a quanto accade per le dimensioni del dotto.
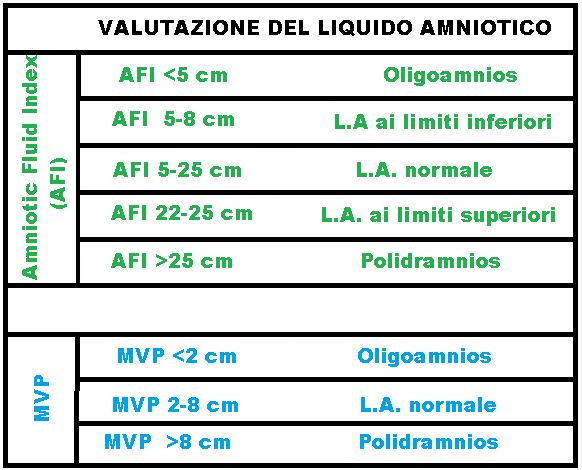
- AFI (Amniotic Fluid Index) si ottiene col metodo dei 4 quadranti (Phelan 1987): si divide la cavità amniotica in 4 quadranti tracciando una linea mediana verticale ed una linea trasversale a metà strada tra sinfisi pubica e fondo uterino; si individua la tasca di liquido più grande in ciascun quadrante, escludendo i punti dove è presente il funicolo, e si misura la massima profondità in centimetri; la somma delle quattro misurazioni rappresenta l’AFI. I valori di riferimento dell’AFI sono i seguenti: valori normali 5-25 cm. Se il valore è tra 5-8 cm. il liquido è ai limiti inferiori della norma; valori di 22-25 cm sono ai limiti superiori della norma. Al disotto dei 5 cm. si parla di oligoidramnios, al di sopra dei 25 cm. si parla di polidramnios. Si parla di anidramnios quando l’AFI presenta valori <40 mm oppure MPV <1 cm.
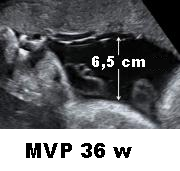
- MVP (Maximum Vertical Pocket): misurazione della massima tasca verticale nel metodo dei 4 quadranti. I valori normali di riferimento MVP sono 2-8 cm.; se MVP è <2 cm si parla di oligoidramnios; >8 si parla di polidramnios. MVP secondo alcuni AA. sembra avere maggiore specificità rispetto all’AFI che sovrastimerebbe la sofferenza fetale e indurrebbe a un maggior ricorso al taglio cesareo.
- Regola del cm
- Dispnea per lo spostamento in alto del diaframma;
- Edemi aa inferiori e vulvari per aumentata compressione venosa;
- Difficoltà alla deambulazione per accentuazione della lordosi lombare;
- Dolorabilità diffusa addominale per la sovradistensione della parete uterina.
 impedisce il normale sviluppo dei polmoni che si verifica tra la 16a e la 26a w. La riduzione di liquido amniotico, oltre a provocare ipoplasia polmonare, può portare ad alterazioni scheletriche fetali. Condizioni di oligoamnios si riscontrano nell’IUGR, nella rottura delle membrane amnio-coriali, nell’agenesia renale e in altre malformazioni fetali. La rilevazione ultrasonografica dell’oligoamnios viene considerata altamente predittiva per il ritardo di crescita intrauterino (89% di sensibilità). AFI <5 cm aumenta di 2 volte il rischio di sofferenza fetale e il ricorso a taglio cesareo mentre fa aumentare di 5 volte la percentuale di Apgar <7 a 5 minuti. Una riduzione parafisiologica del L.A. si può riscontrare nella gravidanza protratta ed in condizioni di stress materno con ridotta assunzione di liquidi. In questi casi si consiglia il riposo ed un aumentato apporto idrico (>2.5 lt) (90-103).
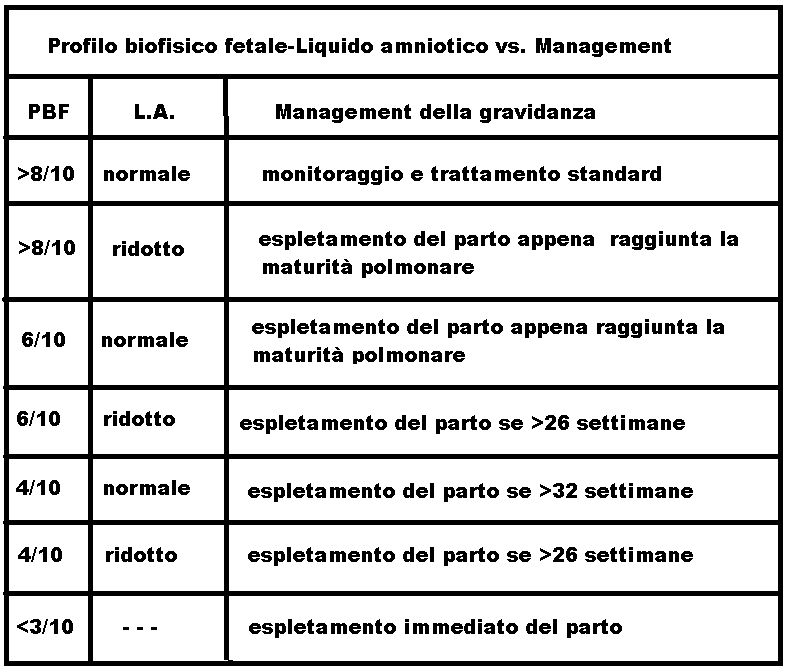
impedisce il normale sviluppo dei polmoni che si verifica tra la 16a e la 26a w. La riduzione di liquido amniotico, oltre a provocare ipoplasia polmonare, può portare ad alterazioni scheletriche fetali. Condizioni di oligoamnios si riscontrano nell’IUGR, nella rottura delle membrane amnio-coriali, nell’agenesia renale e in altre malformazioni fetali. La rilevazione ultrasonografica dell’oligoamnios viene considerata altamente predittiva per il ritardo di crescita intrauterino (89% di sensibilità). AFI <5 cm aumenta di 2 volte il rischio di sofferenza fetale e il ricorso a taglio cesareo mentre fa aumentare di 5 volte la percentuale di Apgar <7 a 5 minuti. Una riduzione parafisiologica del L.A. si può riscontrare nella gravidanza protratta ed in condizioni di stress materno con ridotta assunzione di liquidi. In questi casi si consiglia il riposo ed un aumentato apporto idrico (>2.5 lt) (90-103).Il profilo biofisico fetale permette una visione panoramica completa del benessere fetale e consente l’appropriato management della gravidanza.
Valutazione dell’anemia fetale
Il management delle gravidanze a rischio di sindrome emolitica comporta la necessità di predire l’anemia fetale al fine di procedere a una trasfusione intrauterina o, se l’epoca di gravidanza lo consente, di anticipare l’espletamento del parto.
È noto che la valutazione della velocità di picco sistolico dell’onda velocimetrica
della MCA, rilevata in prossimità della sua origine dal circolo di Willis, con un angolo il più prossimo a oo, è un buon indicatore del rischio di anemia fetale. Si considera a rischio di anemia un feto in cui il picco sistolico sia l, 5 volte la mediana per epoca di gravidanza. Il metodo presenta fino al 18% di falsi positivi, che sono più frequenti dopo la 35a settimana. Molti studi hanno dimostrato che questa metodica è utile per individuare i feti con anemia per infezione da Parvovirus B 19 o in caso di trasfusione feto-materna (127).
Bibliografia:
- Caradeux J, Martinez-Portilla RJ, Peguero A et al Diagnostic performance of third-trimester ultrasound for the prediction of late-onset fetal growth restriction: a systematic review and meta-analysis. Am J Obstet Gynecol. 2019 Jan 8
- Figueras F, Caradeux J, Crispi F, Eixarch E, Peguero A, Gratacos E. Diagnosis and surveillance of late-onset fetal growth restriction. Am J Obstet Gynecol. 2018 Feb; 218(2S):S790-S802.e1.
- Simcox LE, Myers JE, Cole TJ, Johnstone ED. Fractional fetal thigh volume in the prediction of normal and abnormal fetal growth during the third trimester of pregnancy. Am J Obstet Gynecol. 2017 Oct; 217(4):453.e1-453.e12. Epub 2017 Jun 23.
- Khalil A, Morales-Rosello J, Khan N, Nath M, Agarwal P, Bhide A, Papageorghiou A, Thilaganathan B. Is cerebroplacental ratio a marker of impaired fetal growth velocity and adverse pregnancy outcome? Am J Obstet Gynecol. 2017 Jun; 216(6):606.e1-606.e10. Epub 2017 Feb 8.
- Owen P, Ogah J, Bachmann LM, Khan KS. Prediction of intrauterine growth restriction with customised estimated fetal weight centiles. BJOG. 2003 Apr; 110(4):411-5.
- Caradeux J, Martinez-Portilla RJ, Basuki TR, Kiserud T, Figueras F. Risk of fetal death in growth-restricted fetuses with umbilical and/or ductus venosus absent or reversed end-diastolic velocities before 34 weeks of gestation: a systematic review and meta-analysis. Am J Obstet Gynecol. 2018 Feb; 218(2S):S774-S782.e21. Epub 2017 Dec 9.
- Hendrix MLE, van Kuijk SMJ, Gavilanes AWD, Kramer D, Spaanderman MEA, Al Nasiry S Reduced fetal growth velocities and the association with neonatal outcomes in appropriate-for-gestational-age neonates: a retrospective cohort study. .BMC Pregnancy Childbirth. 2019 Jan 15; 19(1):31. Epub 2019 Jan 15.
- Diagnosis and surveillance of late-onset fetal growth restriction. Am J Obstet Gynecol. 2018 Feb;218(2S):S790-S802.e1. doi: 10.1016/j.ajog.2017.12.003.
- Diagnosis and surveillance of late-onset fetal growth restriction. Am J Obstet Gynecol. 2018 Feb;218(2S):S790-S802.e1.
- Wing D.A., Fishman A., Gonzalez C., Paul R. H.: How frequently should the amniotic fluid index be performed during the course of antepartum testing! Am. J. Obstet. Gynecol.: 174:33-36,1996.
- Divon M.Y., Marx A.D., Henderson C.E.: Longitudinal measurement of amniotic flui index in post-term pregnancies and its association with fetal outcome. Am. J. Obstet. Gynecol. 172: 142-146, 1995.
- Jennifer S. Hernandez, Diane M. Twickler, Donald D. McIntire, and Jodi S. Dashe: “Hydramnios in Twin Gestations”. Obstetrics & Gynecology Oct 2012;120(4):759.
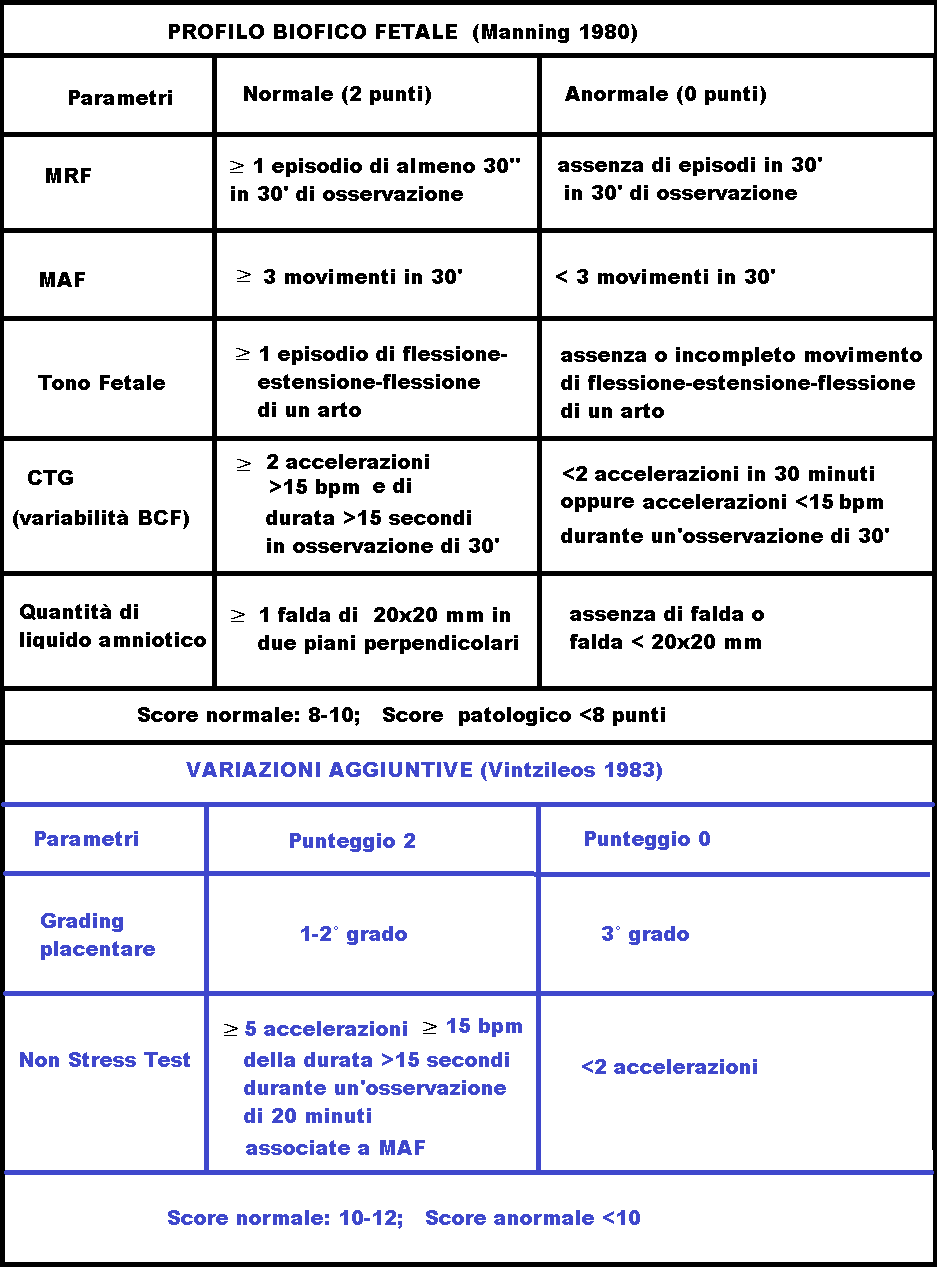
- Manning FA, Platt LD, Sipos L. Antepartum fetal evaluation: development of a fetal biophysical profile. Am J Obstet Gynecol 1980;136:787.
- Vintzileos AM, Campbell WA, Ingardia CJ, Nochimson DJ. The fetal biophysical profile and its predictive value. Obstet Gynecol. 1983 Sep; 62(3):271-8.
- Baskett TF, Gray JH, Prewett SJ, Young LM, Allen AC. Antepartum fetal assessment using a fetal biophysical profile score. Am J Obstet Gynecol. 1984 Mar 1; 148(5):630-3.
- Manning FA, Platt LD. Human fetal breathing monitoring–clinical considerations. Semin Perinatol. 1980 Oct; 4(4):311-8.
- Manning FA. Antepartum fetal testing: a critical appraisal. Curr Opin Obstet Gynecol. 2009 Aug; 21(4):348-52.
- Scherjon SA, Smolders De Haas H, Kok JH, Sondervan Ha. The brain sparing effect antenatal cerebral Doppler findings in relation to neurologic outcome in very preterm infants. Am J Ob Gyn 1993;169-175.
- Madazli R, Uludağ S, Ocak V. Doppler assessment of umbilical artery, thoracic aorta and middle cerebral artery in the management of pregnancies with growth restriction. Acta Obstet Gynecol Scand. 2001;80 (8): 702-7.
- Acharya G, Wilsgaard T, Berntsen G, Maltau J, Kiserud T. Reference ranges for serial measurements of blood velocity and pulsatility index at the intra-abdominal portion, and fetal and placental ends of the umbilical artery. Ultrasound Obstet Gynecol 2005; 26: 162 –169.
- Acharya G, Wilsgaard T, Berntsen G, Maltau J, Kiserud T.Reference ranges for serial measurements of umbilical artery Doppler indices in the second half of pregnancy. Am J Obstet Gynecol 2005; 192: 937 –944.
- Sepulveda W, Peek MJ, Hassan J, Hollingsworth J. Umbilical vein to artery ratio in fetuses with single umbilical artery. UltrasoundObstet Gynecol 1996; 8: 23 –26.
- Upton M. N. Effects of parental smoking on the respiratory health of adults. Thorax 2004; 59, 274–276
- Matijevic, R. and Kurjak, A. The assessment of placental blood vessels by three-dimensional power Doppler ultrasound. J Perinat Med. 2002; 30: 26–32
- Guimarães Filho, H.A., da Costa, L.L., Araújo Júnior, E., Nardozza, L.M., Nowak, P.M., Moron, A.F. et al.Placenta: angiogenesis and vascular assessment through three-dimensional power Doppler ultrasonography. Arch Gynecol Obstet. 2008; 277: 195–200
- Salvesen K, Lees C, Abramowicz J, Brezinka C, Ter Har G, Marsal K. ISUOG statement on the safe use of Doppler in the 11 to 13+6-week fetal ultrasound examination. Ultrasound Obstet Gynecol 2011; 37: 628.
- Khare M, Paul S, Konje J. Variation in Doppler indices along the length of the cord from the intraabdominal to the placental insertion. Acta Obstet Gynecol Scand 2006; 85: 922 –928
- Acharya G, Wilsgaard T, Berntsen G, Maltau J, Kiserud T. Reference ranges for serial measurements of blood velocity and pulsatility index at the intra-abdominal portion, and fetal and placental ends of the umbilical artery. Ultrasound Obstet Gynecol 2005; 26: 162 –169.
- Acharya G, Wilsgaard T, Berntsen G, Maltau J, Kiserud T. Reference ranges for serial measurements of umbilical artery Doppler indices in the second half of pregnancy. Am J Obstet Gynecol 2005; 192: 937 –944.
- Sepulveda W, Peek MJ, Hassan J, Hollingsworth J. Umbili-cal vein to artery ratio in fetuses with single umbilical artery. UltrasoundObstet Gynecol 1996; 8: 23 –26.
- Marsál K. Rational use of Doppler ultrasound in perinatal medicine. J Perinat Med. 1994;22 (6): 463-74.
- Gagnon R, Van den hof M. The use of fetal Doppler in obstetrics. J Obstet Gynaecol Can. 2003;25 (7): 601-14. –
- Baschat AA, Gembruch U, Reiss I et-al. Relationship between arterial and venous Doppler and perinatal outcome in fetal growth restriction. Ultrasound Obstet Gynecol. 2000;16 (5): 407-13.
- . Maulik D, Mundy D, Heitmann E et-al. Evidence-based approach to umbilical artery Doppler fetal surveillance in high-risk pregnancies: an update. Clin Obstet Gynecol. 2010;53 (4): 869-78.
- Coppens M, Loquet P, Kollen M, De Neubourg F, Buytaert P. Longitudinal evaluation of uteroplacental and umbilical blood flow changes in normal early pregnancy. Ultrasound in obstetrics & gynecology : the official journal of the International Society of Ultrasound in Obstetrics and Gynecology. 7 (2): 114-21.
- Ferrazzi E et al. Temporal sequence of abnormal Doppler changes in the pheripheral and central circulatory systems of the severely growth restricted fetus. Ultrasound Obstet Gynecol 2002;19,2:140-46.
- Giorlandino S, Vizzone A. Flussimetria ostetrica materna fetale. CIC ed. internazionali 1993.
- Ianniello B, Gambardella V, D’Ettore A, Battista L, De Falco C, Scaldarella LO, Vitelli A, Tolino A. Diagnosi e management del ritardo di crescita intrauterino (IUGR). Rivista Italiana di Med Perin. Vol 6-n. 1 gen 2004:15-18.
- Nielson JP, Alfirevic Z. Doppler Ultrasound for fetal assessment in high risk pregnancies. In the Cochrane Library, Issue 2. Oxford: Update software, 2002.
- Trudinger BJ, Giles WB, Cook CM Uteroplacental blood flow velocity-time waveforms in normal and complicated pregnancy. .Br J Obstet Gynaecol. 1985 Jan; 92(1):39-45.
- Mone F, Thompson A, Stewart M, et al . Fetal umbilical artery Doppler pulsatility index as a predictor of cardiovascular risk factors in children—a long-term follow up study. J Matern Fetal Neonatal Med 2014;27:1633–6.
- Isaacs EB, Vargha-Khadem F, Watkins KE, et al . Developmental amnesia and its relationship to degree of hippocampal atrophy. Proc Natl Acad Sci USA 2003;28:13060–3.
- Mone F et al: Fetal umbilical artery Doppler pulsatility index and childhood neurocognitive outcome at 12 years. BMJ 2016;6,6
- Levine TA, Grunau RE, McAuliffe FM, et al . Early Childhood neurodevelopment after intrauterine growth restriction: a systematic review. Pediatrics 2015;135:126–41.
- Wienerroither H, Steiner H, Tomaselli J, et al . Intrauterine blood flow and long-term intellectual, neurologic, and social development. Obstetr Gynecol 2001;97:449–53
- Geva R, Eshel R, Leitner Y, et al . Memory functions of children born with asymmetric intrauterine growth restriction. Brain Res 2006;1117:186–94.
- Hevner RF, Kinney HC . Reciprocal enthorhinal-hippocampal connections established by human fetal midgestation. J Comp Neurol 1996;372:384–94.
- D Amaral, Lavenex P, Ch 3. Hippocampal Neuroanatomy, in Andersen P, Morris R, Amaral D, Bliss T, O’Keefe J (a cura di), The Hippocampus Book, Oxford University Press, 2006,
- Battaglia C, Artini PG, Galli PA et al.Absent or reversed end diastolic flow in umbelical artery and severe intrauterine growth retardation. Acta Obstet Scand 1993;72:167-171.
- Hartung J et al. Outcome of 60 neonates who had ARED flow prenatally compared with a matched control group of appropriate-for-gestational age preterm neonates. Ultrasound Obstet Gynecol 2005;25:566-72.
-
Barkehall-Thomas A, Thompson M, Baker LS, Edwards A, Wallace EM. Betamethasone associated changes in umbilical artery flow velocity waveforms in multiple pregnancies with umbilical artery absent end diastolic flow. Aust N Z J Obstet Gynaecol. 2003 Oct;43(5):360-3.
-
Effect of maternal betamethasone on fetal and uteroplacental blood flow velocity waveforms.Thuring A, Malcus P, Maršál K.Ultrasound Obstet Gynecol. 2011 Jun; 37(6):668-72.
-
Predicting perinatal outcome through changes in umbilical artery Doppler studies after antenatal corticosteroids in the growth-restricted fetus. Robertson MC, Murila F, Tong S, Baker LS, Yu VY, Wallace EM.Obstet Gynecol. 2009 Mar; 113(3):636-40.
-
Fetal hemodynamic changes following maternal betamethasone administration in pregnancies with fetal growth restriction and absent end-diastolic flow in the umbilical artery. Nozaki AM, Francisco RP, Fonseca ES, Miyadahira S, Zugaib M.Acta Obstet Gynecol Scand. 2009; 88(3):350-4.
-
Doppler velocimetry in the evaluation of fetal hypoxia. Gudmundsson S, Dubiel M.J Perinat Med. 2001; 29(5):399-407.
-
Sterne G, Shields LE, Dubinsky TJ. Abnormal fetal cerebral and umbilical Doppler measurements in fetuses with intrauterine growth restriction predicts the severity of perinatal morbidity. J Clin Ultrasound. 2001;29:146–51.
-
Madazli R, Uludag S, Ocak V. Doppler assessment of umbilical artery, thoracic aorta and middle cerebral artery in the management of pregnancies with growth restriction. Acta Obstet Gynecol Scand. 2001;80:702–7.
-
Kassanos D, Siristatidis C, Vitoratos N, Salamalekis E, Creatsas G. The clinical significance of Doppler findings in fetal middle cerebral artery during labor. J Obstet Gynecol Reprod Biol. 2004;23:442–445.
-
Vyas S, Nicolaides KH, Bower S, Campbell S. Middle cerebral artery flow velocity waveforms in fetal hypoxaemia. Br J Obstet Gynaecol. 1990;97:797–803.
-
Williams KP, Wilson S. Maternal cerebral blood flow changes associated with eclampsia. Am J Perinatol. 1995;12:189–91.
-
Neilson JP, Alfirevic Z. Doppler ultrasound for fetal assessment in high risk pregnancies. Cochrane Database Syst Rev. 2000
-
19. Gramellini D, Folli MC, Raboni S, Vadora E, Merialdi A. Gramellini D, Folli MC, Raboni S, Vadora E, Merialdi A.. Cerebral umbilical Doppler ratio as a predictor of adverse perinatal outcome. Obstet Gynecol. 1992;79:416–420.
- Hershkovitz R, Kingdom JCP, Geary M, Rodeck CH. Fetal cerebral blood flow redistribution in late gestation: identification of compromise in small fetuses with normal umbilical artery Doppler. Ultrasound Obstet Gynecol. 2000;15:209–212.
- Arias F. Accuracy of the middle-cerebral-to-umbilical- artery resistance index ratio in the prediction of neonatal outcome in patients at high risk for fetal and neonatal complications. Am J Obstet Gynecol. 1994;171:1541–5.
- Gramellini D, Folli MC, Raboni S, Vadora E, Merialdi A. Gramellini D, Folli MC, Raboni S, Vadora E, Merialdi A.. Cerebral umbilical Doppler ratio as a predictor of adverse perinatal outcome. Obstet Gynecol. 1992;79:416–420.
- Dubiel M, Breborowicz GH, Marsal K, Gudmundsson S. Fetal adrenal and middle cerebral artery in high risk pregnancy. Ultrasound Obstet Gynecol. 2000;16:414–418.
- Hernandez-Andrade E, S cheier M, Dzerega V, Carmo A, Nicolaides KH. Fetal middle cerebral artery peak systolic velocity in the investigation of non-imune hydrops. Ultrasound Obstet Gynecol. 2004;23:442–445.
- Strigini FA, De Luca G, Lencioni G, Scida P, Giusti G, Genazzani AR. Middle cerebral artery velocimetry: different clinical relevance depending on umbilical velocimetry. Obstet Gynecol. 1997;90:953–957.
- Makhseed M, Jirous J, Ahmed MA, Viswanathan DL. Middle cerebral artery to umbilical artery resistance index ratio in the prediction of neonatal outcome. Int J Gynaecol Obstet. 2000;71:119–25.
- Williams KP, Wilson S. Maternal cerebral blood flow changes associated with eclampsia. Am J Perinatol. 1995;12:189–91
- Severi FM, Bocchi C, Visentin A, Falco P, Cobellis L, Florio P, et al. Uterine and fetal cerebral Doppler predict the outcome of third trimester small-for-gestational age fetuses with normal umbilical artery Doppler. Ultrasound Obstet Gynecol. 2002;19:225–8.
- Dubiel M, Gudmundsson S, Gunnarsson G, Marsal K. Middle cerebral artery velocimetry as a predictor of hypoxemia in fetuses with increased resistance to blood flow in the umbilical artery. Early Hum Dev. 1997;47:177–84.
- Rizzo G, Arduini D, Luciano R, Rizzo C, Tortorolo G, Romanini C, et al. Prenatal cerebral Doppler ultrasonography and neonatal neurologic outcome. J Ultrasound Med. 1989;8:237–40.
- Brar HS, Horenstein J, Medearis AL, Platt LD, Phelan JP, Paul RH. Cerebral, umbilical and uterine resistance using Doppler velocimetry in postterm pregnancy. J Ultrasound Med. 1989;8:187–91.
-
Struijk PC, Mathews VJ, Loupas T, Stewart PA, Clark EB, Steegers EA, Wladimiroff JW. Blood pressure estimation in the human fetal descending aorta. Ultrasound Obstet Gynecol. 2008;32:673–681. doi: 10.1002/uog.6137.
-
Bahlmann F, Wellek S, Reinhardt I, Krummenauer F, Merz E, Welter C. Reference values of fetal aortic flow velocity waveforms and associated intra-observer reliability in normal pregnancies. Ultrasound Obstet Gynecol. 2001;17:42–49. doi: 10.1046/j.1469-0705.2001.00306.x.
-
Fouron JC, Gosselin J, Raboisson MJ, Lamoureux J, Tison CA, Fouron C, Hudon L. The relationship between an aortic isthmus blood flow velocity index and the postnatal neurodevelopmental status of fetuses with placental circulatory insufficiency. Am J Obstet Gynecol. 2005;192:497–503. doi: 10.1016/j.ajog.2004.08.026.
-
Del Río M, Martínez JM, Figueras F, López M, Palacio M, Gómez O, Coll O, Puerto B. Reference ranges for Doppler parameters of the fetal aortic isthmus during the second half of pregnancy. Ultrasound Obstet Gynecol. 2006;28:71–76.
-
Nicolaides KH, Bilardo CM, Campbell S. Prediction of fetal anemia by measurement of the mean blood velocity in the fetal aorta. Am J Obstet Gynecol. 1990;162:209–212. doi: 10.1016/0002-9378(90)90852-X.
-
Ferrazzi E, Bellotti M, Marconi A, Flisi L, Barbera A, Pardi G. Peak velocity of the outflow tract of the aorta: correlation with acid base status and oxygenation of the growth retarded fetus. Obstet Gynecol. 1995;85:663–668. doi: 10.1016/0029-7844(95)00021-I.
-
Jouppila P, Kirkinen P. Increased vascular resistance in the descending aorta of the human fetus in hypoxia. Br J Obstet Gynaecol. 1984;91:853–856. doi: 10.1111/j.1471-0528.1984.tb03696.x.
-
Tonge HM, Wladimiroff JW, Noordam MJ, van Kooten C. Blood flow velocity waveforms in the descending fetal aorta: comparison between normal and growth-retarded pregnancies. Obstet Gynecol. 1986;67:851–855.
-
Luís Guedes-Martins, Ana Cunha, Joaquim Saraiva, Ana Rita-Gaio, Ana S Cerdeira, Filipe Macedo, and Henrique Almeida: Foetal aortic flow velocity waveforms in healthy and hypertensive pregnant women. Cardiovasc Ultrasound. 2014; 12: 1.
-
Tonge HM, Wladimiroff JW, Noordam MJ, van Kooten C. Blood flow velocity waveforms in the descending fetal aorta: comparison between normal and growth-retarded pregnancies. Obstet Gynecol. 1986 Jun;67(6):851-5.
-
Marsál K, Laurin J, Lindblad A, Lingman G. Blood flow in the fetal descending aorta. Semin Perinatol. 1987 Oct;11(4):322-34.
-
Jouppila P, Kirkinen P. Noninvasive assessment of fetal aortic blood flow in normal and abnormal pregnancies. Clin Obstet Gynecol. 1989 Dec;32(4):703-9.
- Luís Guedes-Martins, Ana Cunha, Joaquim Saraiva, Ana Rita-Gaio, Ana S Cerdeira, Filipe Macedo, and Henrique Almeida Foetal aortic flow velocity waveforms in healthy and hypertensive pregnant women. Cardiovasc Ultrasound. 2014; 12: 1.
- [Longitudinal analysis of arterial Doppler parameters in growth retarded fetuses]. Miković Z, Mandić V, Djukić M, Egić A, Filimonović D, Cerović N, Popovac M.Srp Arh Celok Lek. 2003 Jan-Feb; 131(1-2):21-5.
- O’ Brian J.M., Mercer B.M., Friedman S.A., Sibai B.M.: Amniotic fluid index in Hospitalized Hypertensive patients managed expectantly. Obstet. Gynecol., 82: 27-250, 1993.
- Tongsong T., Srisomboom J.: Amniotic fluid volume as a predictor of fetal distress in postterm pregnancy. Int. J. Gynaecol. And Obstet., 40:213-217,1993.
- Garzetti G.G., Ciavattini A., Lamarca N., de Cristofaro F.: Longitudinal measurement of amniotic fluid index in term pregnancy and its association with intrapartum fetal distress. Gynecol. Obstet. Invest.: 44: 234-238, 19997.
- Divon M.Y., Marx A.D., Henderson C.E.: Longitudinal measurement of amniotic flui index in post-term pregnancies and its association with fetal outcome. Am. J. Obstet. Gynecol. 172: 142-146, 1995.
-
Antonucci R, Zaffanello M, Puxeddu E, et al: Use of non-steroidal anti-infiammatory drugs in pregnancy: impact of the fetus and newborn. Curr Drug Metab 13(4):474-490, 2012.
-
Beall MH, van den Wijngaard JP, van Gemert MI, Ross MG: Amniotic fluid dynamics. Placenta 28(8-9):816-823,2007.
-
Bullo ML, Tschumi S, Bucher BS, et al: Pregnancy outcome following exposure to angiotensin-converting enzyme inhibitors or angiotensin receptor antagonists: a systematic review. Hypertension 60(2):444-450, 2012.
-
Chamberlain PR, Manning FA, Mprrison I, et al: Ultrasound evaluation of amniotic fluid volume , I:the relationship of marginal and decreased amniotic fluid volumes to perinatal outcomes. Am J Obstet Gynecol 150:245-249,1984.
-
Chauhan SP, Sanderson M, Hendrix NW, Magann EF, Devoe LD. Perinatal outcome and amniotic fluid index in the antepartum and intrapartum periods: A meta-analysis. Am J Obstet Gynecol. 1999 Dec;181(6):1473-8.
-
Gramellini D, Fieni S, Verrotti C, Piantelli G, Cavallotti D, Vadora E. Ultrasound evaluation of amniotic fluid volume: methods and clinical accuracy. Acta Biomed. 2004;75 Suppl 1:40-4.
-
Gumus II, Koktener A, Turhan NO. Perinatal outcomes of pregnancies with borderline amniotic fluid index. Arch Gynecol Obstet. 2007 Jul;276(1):17-9.
-
Hughes DS, Magann EF. Antenatal fetal surveillance “Assessment of the AFV”. Best Pract Res Clin Obstet Gynaecol. 2017 Jan;38:12-23.
-
Karahanoglu E, Altinboga O, Akpinar F, Gultekin IB, Ozdemirci S, Akyol A, Yalvac S. The Effect of the Amniotic Fluid Index on the Accuracy of Ultrasonographic-Estimated Fetal Weight. Ultrasound Q. 2017 Jun;33(2):148-152.
-
Magann EF, Sandlin AT. Amniotic Fluid Volume in Fetal Health and Disease. Callens. Ultrasonography in Obstetrics and Gynecology. Elsevier inc. 2017. 20; 716-732.
Queste pagine fanno parte del sito fertilitycenter.it in internet da marzo 2011. I testi, le tabelle, i disegni e le immagini pubblicati in queste pagine sono coperte da copyright ma a disposizione di tutti per copia e riproduzione purchè venga citata la fonte con link al sito www.fertilitycenter.it.
Ringrazio i lettori per la loro cortese attenzione e li prego di voler comunicare le loro osservazioni e consigli su eventuali errori o esposizioni incomplete.
Enzo Volpicelli.
L’autore, nonostante il coscienzioso e scrupoloso metodo di divulgazione adottato, non si assume alcuna responsabilità per qualsiasi atto decisionale intrapreso dal lettore sulla base di tutti i dati e le informazioni diagnostiche e terapeutiche riportate da questo testo, che NON SOSTITUISCE ASSOLUTAMENTE LA CONSULENZA MEDICA. In nessun caso quindi le informazioni presenti in questo sito sono da intendersi come sostitutive del parere del medico.
L’Autore non si assume responsabilità per danni di qualsivoglia natura che il lettore potrebbe causare a se o a terze persone derivanti da:
1) uso improprio o illegale delle informazioni riportate in questo sito
2) errori ed imprecisioni relativi al contenuto di questo sito o errate interpretazioni
3) azioni di qualsivoglia natura che l’utente può intraprendere autonomamente e disgiuntamente dalle indicazioni del medico curante.
L’Autore e curatore del sito non si assume alcuna responsabilità per le informazioni fornite da terze parti o per il contenuto di altri siti verso cui viene proposto un link.